10 липня, 2015
Хірургічне лікування пухлин загальної жовчної протоки
Рак загальної жовчної протоки (ЗЖП) уперше описали німецькі дослідники Durand і Fardel у 1840 р. Попри понад 170-річну історію діагностики та лікування раку позапечінкових жовчних проток, ці питання і зараз є актуальними та недостатньо вивченими. Резектабельність пухлин ЗЖП становить 30-80% випадків, летальність після радикальних операцій менша (1,6-7,4%), ніж після паліативних (3,8-18,4%) [1-3, 5]. Важливою проблемою є рання діагностика раку позапечінкових жовчних проток, що значною мірою впливає на операбельність і показники виживаності хворих.
На сьогодні з метою діагностики пухлин ЗЖП застосовують високоінформативні інструментальні методи дослідження: ультразвукове дослідження (УЗД), комп’ютерну томографію (КТ), магнітно-резонансну панкреатикохолангіографію (МРПХГ), ендоскопічну ретроградну панкреатикохолангіографію (ЕРПХГ), черезшкірну черезпечінкову холангіографію (ЧЧХГ), допплерографію, ангіографію, лапароскопію [6, 7]. Проте, за даними різних авторів, інформативність кожного з цих методів або у поєднанні, як і оптимальна послідовність їх застосування, є суперечливими. Спірними є питання щодо доцільності доопераційної декомпресії позапечінкових жовчних проток, а також вибору методу декомпресії залежно від рівня ураження жовчної протоки, стану хворого, рівня білірубіну та інших чинників. Анатомічні особливості гепатопанкреатодуоденальної зони; близькість печінкової артерії, ворітної вени, підшлункової залози, дванадцятипалої кишки обмежують можливості хірурга щодо виконання радикального втручання. Досить високою є частота ускладнень після панкреатодуоденальної резекції (ПДР) у вигляді гострого панкреатиту кукси підшлункової залози; неспроможності швів панкреатодигестивного анастомозу, особливо за наявності гіпербілірубінемії, печінкової недостатності, яка становить 40-70%. Ці ускладнення призводять до летальних наслідків у майже 50% випадків [2, 4]. Наведені дані свідчать про необхідність усебічного вивчення проблеми, насамперед пошуку шляхів раціонального розширення показань до радикальних операцій із приводу пухлин ЗЖП, удосконалення оперативної техніки, профілактики ускладнень, поліпшення результатів лікування.
Удосконалення потребують техніка виконання паліативних операцій із приводу пухлин позапечінкових жовчних проток, а також вибір методу їх декомпресії, від якого залежать тяжкість перебігу раннього післяопераційного періоду, тривалість та якість життя хворих.
У пропонованій статті проаналізовано дані комплексного обстеження та хірургічного лікування 166 хворих із пухлинами ЗЖП у клініці ДУ «Національний інститут хірургії і трансплантології ім. О.О. Шалімова НАМН України» за період з 2000 до 2012 р.
Матерiали i методи
У дослідженні взяли участь хворі віком від 27 до 82 років (у середньому 60±10,5 року), з них чоловіків 89 (53,6%), жінок 77 (46,4%). Для оцінювання розробленої нами тактики хірургічного лікування пухлин ЗЖП пацієнтів розподілили на 2 групи. Ретроспективно оброблено 81 історію хвороби осіб, яких лікували в період із 2000 до 2005 р. (контрольна група); а також історії хвороб 85 пацієнтів, яких було проспективно обстежено в період із 2006 до 2012 р. (основна група). Групи за віком, статтю, стадією захворювання, ступенем жовтяниці є репрезентативними. У роботі використовували Міжнародну класифікацію пухлин за системою TNM 7-го видання 2009 р.
Найчастіше у хворих спостерігали IIB, III та IV стадію (75,9%) пухлинного процесу, що зумовлено пізньою діагностикою й несвоєчасним зверненням хворих за медичною допомогою.
Гістологічний тип пухлини визначено у 86 (58,8%) хворих. Основним гістологічним типом злоякісних пухлин була аденокарцинома, діагностована у 71 (82,6%) пацієнта, у тому числі високодиференційована – у 9 (12,7%), помірно диференційована – у 31 (43,6%), низькодиференційована – у 19 (26,8%) хворих; не вдалося визначити ступінь диференціювання у 12 (16,9%) пацієнтів. Частота муцинозної та папілярної аденокарциноми становила 4,7% (по 4 випадки кожної пухлини), цистаденокарциноми і лейоміосаркоми – 1,2% (по 1 випадку).
Інструментальні методи, які були використані під час обстеження хворих на рак ЗЖП, поділяли на неінвазивні та інвазивні. З неінвазивних застосовували УЗД, КТ, МРПХГ, допплерографію, рентгенологічне дослідження; з інвазивних – фіброезофагогастродуоденоскопію, ЕРПХГ, ЧЧХГ, ангіографію та лапароскопію. Діагностичні можливості цих методів різні, у зв’язку з чим практичне значення має вирішення питання щодо доцільності вибору того чи іншого інструментального методу й послідовності їх застосування на етапах встановлення діагнозу.
На підставі аналізу результатів діагностики у контрольній групі нами створений діагностичний алгоритм виявлення пухлин ЗЖП: усім хворим потрібно проводити клініко-лабораторне обстеження та УЗД органів черевної порожнини, що є першим етапом диференційної діагностики обтураційної жовтяниці. Пацієнтам, у яких виявлено пухлину ЗЖП або є підозра про її наявність, виконують КТ. За відсутності ознак неоперабельності та нерезектабельності здійснюють радикальну операцію. Окрім того, на етапах клініко-лабораторного обстеження та УЗД визначають хворих, яким показана біліарна декомпресія з метою корекції порушень соматичного статусу, купірування проявів печінкової недостатності та холангіту.
Після успішного усунення ускладнень повторно оцінюють операбельність і резектабельність за допомогою КТ. Хворим із наявністю ускладнень призначають симптоматичне лікування. У разі виникнення діагностичних труднощів використовують додаткові неінвазивні й інвазивні методи дослідження. Так, рівень ураження та причини обструкції жовчних проток уточнюють за допомогою МРПХГ, ЕРПХГ та ЧЧХГ.
У разі виявлення (за даними КТ) інвазії судин пухлиною хворому проводять допплерографію і за необхідності ангіографію. Пацієнтам із наявністю радіологічних ознак метастазів у печінці та канцероматозом здійснюють біопсію під контролем УЗД або лапароскопічно асистовану. Якщо після оцінювання результатів усіх додаткових методів дослідження ознак неоперабельності та нерезектабельності немає, виконують радикальне втручання; якщо такі ознаки є, хворому призначають симптоматичне лікування. Проведення комплексного обстеження з використанням запропонованого алгоритму дало змогу встановити правильний діагноз у 83 (97,6%) із 85 хворих основної групи та у 71 (87,7%) із 81 – контрольної групи.
Результати i обговорення
Оперативні втручання виконано у 166 хворих, 6 пацієнтів прооперовано повторно з приводу рецидиву пухлини у строки від 12 до 18 міс. У 32 хворих за наявності високого рівня білірубіну, тривалої жовтяниці та печінкової недостатності проведено двохетапне лікування, яке включало біліарну декомпресію з використанням мініінвазивного методу (перший етап) і радикальну чи паліативну операцію (другий етап). Радикальні операції виконано у 73 (44%) хворих, паліативні – у 93 (56%).
Резекцію ЗЖП з пухлиною здійснено у 42 хворих. Показаннями до виконання резекції, на нашу думку, є наявність пухлини центральної частини ЗЖП без проростання головки підшлункової залози, дванадцятипалої кишки та метастазів у лімфатичних вузлах 13-ї та 17-ї груп, видалення яких можливе тільки під час виконання ПДР, а також відсутність інвазії пухлиною артеріальних судин або поєднання артеріальної та венозної інвазій.
Обов’язковим вважаємо дослідження дистального та проксимального країв стінки ЗЖП для виявлення злоякісних клітин (так званої чистоти зрізу) та клітковини гепатодуоденальної зв’язки з лімфатичними вузлами під час операції. За позитивного результату виконуємо резекцію проток до інтактних тканин.
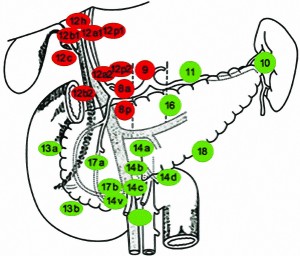
Нами розроблено стандартний обсяг лімфаденектомії під час резекції пухлини центральної частини ЗЖП, зокрема, обов’язковим вважаємо видалення 8, 9-ї та 12-ї груп лімфатичних вузлів (рис. 1).
Рис. 1. Схема обсягу лімфаденектомії під час резекції пухлин ЗЖП
Примітка: червоним кольором позначено групи лімфатичних вузлів,
які необхідно видаляти, зеленим – решту лімфатичних вузлів гепатопанкреатодуоденальної зони.
Застосування розробленого підходу дало змогу підвищити частоту виконання резекції ЗЖП із пухлиною в основній групі за рахунок здійснення втручання на ІІВ та ІІІ стадіях. Різні варіанти ПДР застосовано у 31 хворого. Показаннями до виконання ПДР слугували наявність пухлини центральної частини ЗЖП з проростанням у головку підшлункової залози, дванадцятипалу кишку та метастазами у лімфатичних вузлах 13-ї і 17-ї груп або пухлини інтрапанкреатичної частини ЗЖП, а також відсутність інвазії пухлиною артеріальних судин або поєднання артеріальної та венозної інвазії. Інвазія пухлиною ворітної вени не є протипоказанням до резекції пухлини. Резекцію ворітної вени здійснено у 6 пацієнтів.
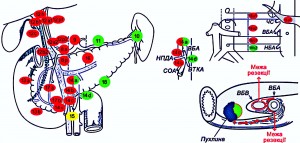
Актуальним є питання обсягу лімфодисекції за наявності пухлини ЗЖП. Для підвищення радикалізму операції без збільшення частоти післяопераційних ускладнень застосовуємо модифіковану розширену ретроперитонеальну лімфаденектомію, основною відмінністю якої у порівнянні з радикальною лімфаденектомією є збереження нервових сплетінь за ходом лівого півкола верхньої брижової артерії. За використання цієї методики стійкої діареї після операції не спостерігалося (рис. 2, 3).
Рис. 2. Схема обсягу лімфаденектомії під час модифікованої радикальної ПДР
Примітки: червоним кольором позначено групи лімфатичних вузлів, які необхідно видаляти, зеленим – решту лімфатичних вузлів гепатопанкреатодуоденальної зони: ВБА – верхня брижова артерія; ВБВ – верхня брижова вена; ВТКА – верхня тонкокишкова артерія; НБА – нижня брижова артерія; НПДА – нижня панкреатодуоденальна артерія; СОА – середня ободовокишкова артерія; ЧС – черевний стовбур.
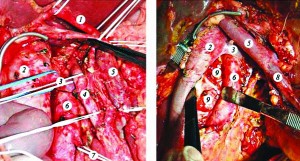
Рис. 3. Завершена модифікована розширена ретроперитонеальна лімфаденектомія і нейродисекція
Примітки: 1 – загальна печінкова артерія; 2 – нижня порожниста вена; 3 – ліва ниркова вена; 4 – верхня брижова артерія; 5 – ворітна вена; 6 – аорта; 7 – нижня брижова артерія; 8 – верхня брижова вена; 9 – інтераортокавальний простір.
Під час виконання ретроперитонеальної лімфаденектомії використовуємо модифікований транслатеральний підхід (translateral retroperitoneal approach), який забезпечує ідеальний доступ до заочеревинного простору, значно полегшує диссекцію ділянки верхніх брижових судин.
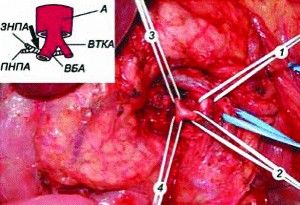
З метою зменшити тяжкість інтраопераційної крововтрати нами розроблено модифікований метод мобілізації панкреатодуоденального комплексу: насамперед ми перев’язували гастродуоденальну (шлунково-дванадцятипалокишкову) і нижню панкреатодуоденальну (підшлунково-дванадцятипалокишкову) артерії, а потім виконували всі подальші етапи мобілізації (рис. 4).
Рис. 4. ПДР із селективним перев’язуванням нижньої панкреатодуоденальної артерії
Примітки: на синьому тримачі – верхня брижова вена, на білих тримачах:
1 – верхня брижова артерія; 2 – панкреатодуоденоєюнальний стовбур;
3 – нижня панкреатодуоденальна артерія; 4 – верхня тонкокишкова артерія. На схемі: А – аорта; ВТКА – верхня тонкокишкова артерія; ВБА – верхня брижова артерія; ПНПА – передня нижня панкреатодуоденальна артерія; ЗНПА – задня нижня панкреатодуоденальна артерія.
У разі застосування цього методу об’єм інтраопераційної крововтрати становив від 80 до 200 мл, що значно менше, ніж під час виконання стандартної ПДР. Упровадження нових технологій і розроблених підходів дало змогу збільшити частоту виконання ПДР із приводу пухлин ЗЖП в основній групі за рахунок здійснення втручань на ІІВ та ІІІ стадіях. Таким чином, використання запропонованої нами хірургічної тактики уможливило достовірно збільшити частоту радикальних оперативних втручань на 23,2%. За наявності діагностованої нерезектабельної злоякісної пухлини ЗЖП лікувальна тактика спрямована на усунення проявів патологічного процесу, що, з одного боку, покращує якість життя пацієнтів завдяки зникненню симптомів захворювання, а з іншого – запобігає виникненню у хворих таких загрозливих життю станів, як печінкова недостатність, пізніше – поліорганна недостатність, спричинена біліарним блоком.
Ми використовували два види паліативних маніпуляцій – відкриті та мініінвазивні.
Окрему увагу слід приділити мініінвазивним оперативним втручанням, які застосовувалися з паліативною метою. Основну частину мініінвазивних операцій, здійснених із метою біліарної декомпресії, виконували як перший етап хірургічного лікування для підготовки хворого до відкритого оперативного втручання за наявності печінкової недостатності, холангіту і, як наслідок, високого ризику виникнення післяопераційних ускладнень.
Мініінвазивні паліативні втручання застосовували як остаточні лише за умови виявлення задавненої форми нерезектабельного раку з високою імовірністю летального наслідку (наявність канцероматозу, значної кількості віддалених метастазів, пухлинної інтоксикації, тяжкого стану хворого).
Нами проаналізовано вплив 13 факторів ризику на частоту виникнення ранніх післяопераційних ускладнень. При цьому встановлено достовірний вплив супутніх серцево-судинних захворювань на розвиток ранніх післяопераційних ускладнень; гнійного холангіту та печінкової недостатності – на летальність. Аналіз результатів дослідження дав нам можливість рекомендувати проведення передопераційної біліарної декомпресії у таких хворих (табл.).
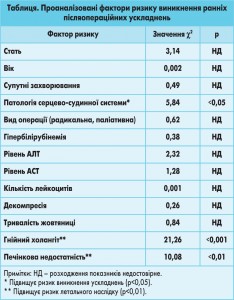 За даними статистичного дослідження, передопераційна біліарна декомпресія не впливала на частоту післяопераційних ускладнень у хворих із пухлинами ЗЖП, проте дала змогу виконати радикальні операції у 78% резектабельних, але неоперабельних хворих (c2 дорівнює 0,84; р<0,05). Попри те що нам не вдалося достовірно знизити летальність і загальну частоту післяопераційних ускладнень, в основній групі ми досягли достовірного зменшення частоти тяжких ускладнень, які потребували виконання повторних оперативних втручань (р<0,01). При порівнянні летальності в групах хворих після радикальних і паліативних операцій достовірного розходження показників не встановлено.
За даними статистичного дослідження, передопераційна біліарна декомпресія не впливала на частоту післяопераційних ускладнень у хворих із пухлинами ЗЖП, проте дала змогу виконати радикальні операції у 78% резектабельних, але неоперабельних хворих (c2 дорівнює 0,84; р<0,05). Попри те що нам не вдалося достовірно знизити летальність і загальну частоту післяопераційних ускладнень, в основній групі ми досягли достовірного зменшення частоти тяжких ускладнень, які потребували виконання повторних оперативних втручань (р<0,01). При порівнянні летальності в групах хворих після радикальних і паліативних операцій достовірного розходження показників не встановлено.
Аналізуючи результати паліативних втручань, слід зазначити, що після застосування мініінвазивних методів і накладення холедоходуоденоанастомозу всі пацієнти залишилися живі. Віддалені результати оцінювали на основі відповідей на запити онкологічних диспансерів, повторного звернення та анкетування хворих; такі дані вивчено у 64 (39%) осіб.
Показники виживаності обчислювали за процедурою Каплана-Майєра. За даними аналізу з використанням порангового критерію встановлено достовірне розходження показників виживаності хворих після радикальних і паліативних втручань (р<0,01). При порівнянні показників виживаності пацієнтів після резекції ЗЖП та ПДР достовірного розходження не було.
Встановлено достовірне розходження показників виживаності хворих залежно від стадії пухлинного процесу (р<0,01). Це дало змогу стверджувати, що основний вплив на такі показники справляють стадія захворювання і тип оперативного втручання (радикальне чи паліативне).
Після радикальних операцій показники виживаності протягом 1, 3 і 5 років становили відповідно 95, 42 і 35%, медіана виживаності – 26 міс. Після паліативних операцій протягом 1 року залишалися живими 41% оперованих, медіана виживаності – 11 міс.
Висновки
1. Застосування розробленого діагностично-лікувального алгоритму у пацієнтів із пухлинами загальної жовчної протоки допомогло встановити правильний діагноз, а також стадію захворювання до операції у 97,6% із них.
2. Використання мініінвазивних технологій декомпресії уможливило зменшення частоти післяопераційних ускладнень на 7,6%, збільшення кількості радикальних оперативних втручань на 14,7%.
3. Упровадження розробленого алгоритму лікування пухлин загальної жовчної протоки дало змогу покращити його результати та підвищити частоту виконання радикальних оперативних втручань із 32,1 до 55,3%. Факторами впливу на тривалість життя пацієнтів є стадія захворювання і радикальність виконаного оперативного втручання, що дає змогу збільшити медіану виживаності хворих з 21 до 28 міс.
Література
1. CLIP method (preoperative CT image-assessed ligation of inferior pancreaticoduodenal artery) reduces intraoperative bleeding during pancreaticoduodenectomy / M. Kawai, M. Tani, S. Ina et al. // World J. Surg. – 2008. – Vol. 32, № 1. – Р. 82-87.
2. Pancreatectomy using the no-touch isolation technique followed by extensive intraoperative peritoneal lavage to prevent cancer cell dissemination: a pilot study / M. Hirota, S. Shimada, K. Yamamoto et al. // JOP. –2005. – Vol. 6, № 2. – Р. 143-151.
3. Pancreatic and duodenal invasion in distal bile duct cancer: paradox in the tumor classification of the American Joint Committee on Cancer / T. Ebata, M. Nagino, H. Nishio et al. // World J. Surg. – 2007. – Vol. 31, № 10. – P. 13-15.
4. Pancreatoduodenectomy with or without early ligation of the inferior pancreatoduodenal artery: Comparison of intraoperative blood loss and short-term outcome / Y. Ishizaki, H. Sugo, J. Yoshimoto et al. // World J. Surg. – 2010. – Vol. 34. – P. 2939-2944.
5. Pancreatoduodenectomy with preservation of the pylorus and gastroduodenal artery / H. Nagai, J. Ohki, Y. Kondo et al. // Ann. Surg. – 1996. – Vol. 223, № 2. – P. 194-198.
6. Staging of cholangiocarcinoma: the role of endoscopy E.A.J. Rauws, J.J. Kloek, D.J. Gouma et al. // HPB. – 2008. – Vol. 10. – P. 110-112.
7. Translateral retroperitoneal approach in radical surgery for pancreatic carcinoma / T. Nagakawa, M. Kurachi, K. Konishi, I. Miyazaki // Jpn. J. Surg. – 1982. – Vol. 12, № 3. – Р. 229-233.