11 липня, 2016
Гепатиты, вызванные вирусами простого герпеса
Несмотря на широкое распространение герпетической инфекции (маркеры вируса простого герпеса 1/2 типа (HSV‑1/2) выявляются у 13-22% жителей Европы и США, в том числе у 25-64% пациентов клиник, занимающихся лечением инфекционных заболеваний, передающихся половым путем), гепатиты этой этиологии относят к редким заболеваниям [1]. Для них характерны крайне тяжелое течение, частое развитие фульминантного гепатита (ФГ) и высокий уровень летальности [2].
Традиционно под ФГ подразумевают развитие печеночной недостаточности (энцефалопатии) у больного острым гепатитом в течение 2-8 нед от появления первых признаков болезни при условии отсутствия у него хронической патологии печени в анамнезе [3]. В общей структуре причин летальных исходов от острой печеночной недостаточности (ОПН) на герпетический гепатит (ГГ) приходится ~1% случаев [4]. В 40% случаев причиной фульминантного герпетического гепатита (ФГГ) является HSV-1, в 60% – HSV-2 [5].
Еще одним аспектом, определяющим актуальность гепатитов этой этиологии, является превалирование в 3-4 раза постмортальной диагностики над прижизненной, что связано с отсутствием каких-либо патогномоничных признаков инфекции у подавляющего большинства больных [6]. В одной из серий наблюдений прижизненный диагноз ФГГ был установлен только у 23% пациентов [7]. Ключом к нему могли бы служить типичные высыпания на коже и слизистых оболочках, однако при гепатите они встречаются достаточно редко [8]. В этой связи необходимо вспомнить о том, что своевременно назначенная терапия ацикловиром потенциально могла бы оказать существенное влияние на структуру исходов ГГ, что, в свою очередь, определяет необходимость совершенствования как клинической, так и лабораторной диагностики этого заболевания [8].
HSV-1 и HSV-2 относятся к ДНК-содержащим вирусам и принадлежат к подсемейству α-herpesviridae семейства Herpesviridae. Заражение происходит при тесном контакте c имеющими клинические проявления больными или бессимптомными выделителями вируса через поврежденную кожу или слизистые оболочки ротоглотки, шейки матки и конъюнктивы [9]. После инокуляции вирус размножается в клетках эпидермиса или дермы, после чего нуклеокапсид по чувствительным или автономным нервам попадает в соответствующие ганглии [10-14]. К примеру, HSV-1 чаще персистирует в ганглиях тройничного нерва, хотя может быть обнаружен в верхних и нижних шейных ганглиях [15]. В случае генитальной инфекции HSV-2 чаще выявляется в сакральных ганглиях [16].
Реактивация инфекции с клиническими проявлениями, в том числе и диссеминированными формами, зависит от состояния иммунитета организма-хозяина. У иммунокомпрометированных пациентов диссеминированные и тяжелые формы инфекции встречаются намного чаще. Риску подвержены в первую очередь больные с нарушением Т-клеточного звена иммунитета (врожденные иммунодефициты, ВИЧ-инфекция, ятрогенная иммуносупрессия после трансплантации и пр.) [17]. У иммунокомпетентных пациентов любые события, нарушающие иммунный контроль над инфекцией, ведут к ее реактивации, что чаще всего сопровождается появлением более или менее распространенных высыпаний на слизистых и коже. Считается, что у таких пациентов причинами развития гепатита могут быть: большая инфицирующая доза возбудителя; реактивация латентной инфекции после инфицирования другим штаммом HSV с более высокой вирулентностью; наследственный дефект иммунной системы, не позволяющий развиться адекватному ответу на инфекцию [18].
Манифестация и течение HSV-инфекции зависят от места внедрения возбудителя, возраста, иммунного статуса хозяина и антигенного варианта вируса. Первый эпизод, особенно в случае первичной инфекции, возникает на фоне отсутствия или недостаточного титра антител к вирусу, часто сопровождается системными проявлениями и развитием тяжелого стоматита или фарингита, как правило, более длительным течением и вирусовыделением, возможностью развития осложнений в виде диссеминированной инфекции [19]. Напротив, рецидив чаще ассоциирован с типичными высыпаниями на слизистых оболочках и коже и характеризуется меньшей частотой генерализации процесса [20].
Клинические проявления инфекции, вызванной HSV-1 и HSV-2, схожи, но частота реактивации определяется местом инокуляции вируса и его типом (например, HSV-1 чаще рецидивирует в случае его персистенции в тройничном нерве, а не в сакральных ганглиях) [21].
Впервые ГГ был описан в 1969 г. [22]. Он является следствием гематогенной диссеминации вируса. Проявлениями последней могут быть обширные кожные высыпания в области грудной клетки, конечностей, а также развитие асептического менингита, эзофагита, пневмонита или артрита [23]. Диссеминированная инфекция может сопровождаться тромбоцитопенией и миоглобинурией [24]. Сочетание гепатита с упомянутыми состояниями может быть ключом к постановке диагноза на основе клинической симптоматики [5]. Однако на самом деле предположение о герпетической этиологии гепатита на основании клинических критериев возникает не более чем в 10-30% случаев.
У иммунокомпетентных взрослых ГГ является результатом первичного инфицирования. Случаи поражения печени вследствие реактивации инфекции у этой категории пациентов не описаны [25]. Обычно между моментом инфицирования и появлением высыпаний проходит от 3 до 7 дней.
Клиническая картина острого ГГ включает в себя высокую температуру (98%), болезненность в правом подреберье, повышение уровней конъюгированного билирубина и аминотрансфераз, а также лейкопению и тромбоцитопению (71 и 93% соответственно). Концентрации сывороточных трансаминаз иногда превышают верхнюю границу нормы в 100-1000 раз. Относительно трансаминаз уровень билирубина может быть не очень высоким (4927±4099 Ед/л и 98±102 мкмоль/л соответственно) [5]. Поскольку гепатит имеет тяжелое течение (в ряде случаев фульминантное), признаки тяжелой печеночной недостаточности также выявляются довольно часто (геморрагический синдром – 84%, энцефалопатия, кома – 80%, олигурия – 65%). Уровень летальности высокий и колеблется, по данным различных авторов, от 40 до 80% [5, 26, 27]. Высыпания, как уже упоминалось, встречаются менее чем у половины больных (44%), в основном на слизистых оболочках (27%). У 17% они имеют диссеминированный характер [5].
С целью улучшения результатов клинической диагностики пациентов всегда следует спрашивать о боли в горле, дисфагии, дизурии или выделениях из половых органов. Тем не менее, независимо от того, жалуется пациент на высыпания на коже или нет, его слизистые оболочки и кожные покровы необходимо осматривать на предмет патологических изменений; иногда существует потребность в гинекологическом осмотре (наличие везикул на шейке матки не всегда могут сопровождаться высыпаниями (везикулами) на наружных половых органах или во влагалище). Если обнаружены изменения на коже или слизистых оболочках, то окрашивание мазка, полученного путем соскоба, по Гимзе или Райту (тест Тцанка), позволяет заподозрить диагноз на основании обнаружения гигантских многоядерных клеток с характерными матово-стекловидными включениями Cowdry в ядрах.
К сожалению, реалии таковы, что у многих пациентов герпетическая этиология ФГ устанавливается на основании данных аутопсии. Так, по данным Norvell и соавт. [5], аутопсия была первоначальным методом установления диагноза у 58% больных, еще у 31% герпетическая этиология гепатита была подтверждена после биопсии печени, у 3% – при исследовании эксплантированной печени.
Гистологически при ФГГ выявляют большие участки некроза паренхимы печени. В гепатоцитах с помощью реакции гибридизации in situ может быть выявлена ДНК вируса. Иногда при микроскопии удается обнаружить тельца Cowdry типа А – эозинофильные включения, состоящие из нуклеиновых кислот и белка. После начала противовирусной терапии они могут исчезать [28]. Помимо некроза существенную роль в поражении печени может играть апоптоз [29].
Наряду с иммунодефицитом еще одним важным состоянием, предрасполагающим к диссеминации инфекции, является беременность [30, 31]. В отделениях, занимающихся трансплантацией печени, беременные составляют не менее 20-25% от общего числа больных с ФГГ [5]. Гепатит, вызванный HSV (как первого, так и второго типа) во время беременности, может быть следствием как первичной инфекции, так и ее реактивации. Беременность является особой формой иммуносупрессии, что подтверждается сниженным ответом созревающих лимфоцитов на стимуляцию фитогемагглютинином, уменьшением числа Т-клеток, а также уровня IgG с 27-й по 33-ю нед беременности, что коррелирует с гемодилюцией, характерной для этого периода. Особенно опасно инфицирование во время третьего триместра беременности, когда вирус может преодолевать плацентарный барьер, что связано с высоким риском смерти и матери, и плода [32].
По различным данным, сыпь встречается у 33-70% беременных [7, 33, 34]. Поскольку диссеминированная герпетическая инфекция редко предполагается как причина гепатита у иммунокомпетентных лиц при отсутствии высыпаний на слизистых оболочках и коже, у беременных следует исключить альтернативные причины поражения печени: острую жировую дистрофию печени, HELLP-синдром, а также подкапсульное (реже в паренхиму) кровоизлияние вследствие тяжелой преэклампсии. Не следует сбрасывать со счетов возможность гепатита, вызванного другими вирусами, или воздействием экзогенных субстанций, таких как наркотики [35].
Гепатит при врожденной HSV-инфекции также является следствием ее диссеминации. Он встречается примерно у 25% новорожденных, инфицированных HSV, или с частотой 1 установленный случай на 2-5 тыс. новорожденных в год [36]. ГГ рассматривают как наиболее частую инфекционную причину ОПН у новорожденных [37]. Помимо поражения печени отмечаются нарушения со стороны других органов и систем: центральной нервной системы (ЦНС), легких, надпочечников, кожи, глаз, слизистой оболочки ротовой полости. У 60-80% женщин, дети которых рождаются с HSV-инфекцией, не удается выявить признаков генитального герпеса или указаний на него в анамнезе, а также наличия сексуального партнера(ов) с данной инфекцией [38]. Показатели материнской смертности и новорожденных по причине ГГ могут достигать 39% [39].
В отличие от иммунокомпетентных лиц у пациентов с иммуносупрессией всегда следует рассматривать вероятность герпетической этиологии гепатита. В этом случае заболевание является, как правило, следствием реактивации латентной инфекции [40]. Типичные для этих больных обширные поражения кожи и слизистых оболочек упрощают диагностику патологии. У пациентов, имеющих антитела к HSV и получающих иммуносупрессивную терапию после трансплантации солидных органов или костного мозга, с высоким постоянством вирус обнаруживается в слюне в течение первых 2-3 нед лечения, хотя диссеминированные формы инфекции встречаются у меньшей части больных [41]. Интересно, что в случае трансплантации костного мозга от HSV-серонегативных доноров HSV-серопозитивные реципиенты подвергаются более высокому риску рецидива, у них с большей вероятностью могут появиться штаммы HSV, устойчивые к ацикловиру, по сравнению с пациентами, которым пересаживают костный мозг от HSV-серопозитивных доноров [5]. Сообщалось о летальных исходах вследствие ГГ, развившегося у пациентов с неопластическими заболеваниями, в результате лечения кортикостероидами [43].
Несмотря на высокую летальность, ГГ является потенциально курабельным заболеванием, т. к. ацикловир и валацикловир проявляют высокую терапевтическую активность как in vitro, так и in vivo. Теоретически возможность серологической диагностики, выявления вируса с помощью полимеразной цепной реакции (ПЦР) по данным биопсии печени может улучшить своевременную диагностику и выживаемость. Основанием для лабораторного обследования на HSV-инфекцию может быть тяжелое течение заболевания с развитием ФГ или без него при отрицательных результатах анализа на маркеры гепатитов А-Е.
Выявить антитела к HSV-1 и HSV-2 в сыворотке HSV-инфицированных лиц легко, но их нельзя использовать для диагностики острой инфекции. Наличие сывороточных антител – IgM, а также увеличение титра антител IgG в 4 раза не указывают на первичную инфекцию, так как они могут появляться при реактивации. Тем не менее серологические методы считаются достоверными для выявления лиц, находящихся в ремиссии или являющихся носителями HSV [44]. Антитела IgG к HSV-1 и HSV-2, которые различаются по антигенным свойствам, могут быть обнаружены в сыворотке; скрининг на HSV-2 рекомендуется в отдельных группах риска [45]. Вестерн-блот может быть полезен для дифференциации инфекции, вызванной HSV-1, от таковой, спровоцированной HSV-2, с чувствительностью и специфичностью >98% [46].
Обнаружение ДНК HSV методом ПЦР обладает высокой специфичностью (99%) и чувствительностью (≥90%), особенно когда вирусная нагрузка составляет >500 копий/мм3 [47]. Наибольшей же значимостью обладает выявление вируса в пораженных тканях (гепатоцитах). Для этого используют различные методы, в частности выявление вирусных антигенов при помощи меченных флуоресцеином антител, ДНК вируса при помощи ПЦР [26]. Всегда следует проводить культивирование, поскольку оно обеспечивает выделение вируса, который может быть типирован. Для этого подходят кровь, соскобы кожи, содержимое везикул.
Цитопатический эффект, как правило, наблюдается спустя 24-48 ч после заражения культуры вирусом. Тем не менее противовирусную терапию не следует откладывать в ожидании подтверждения диагноза вирусологическим методом [41].
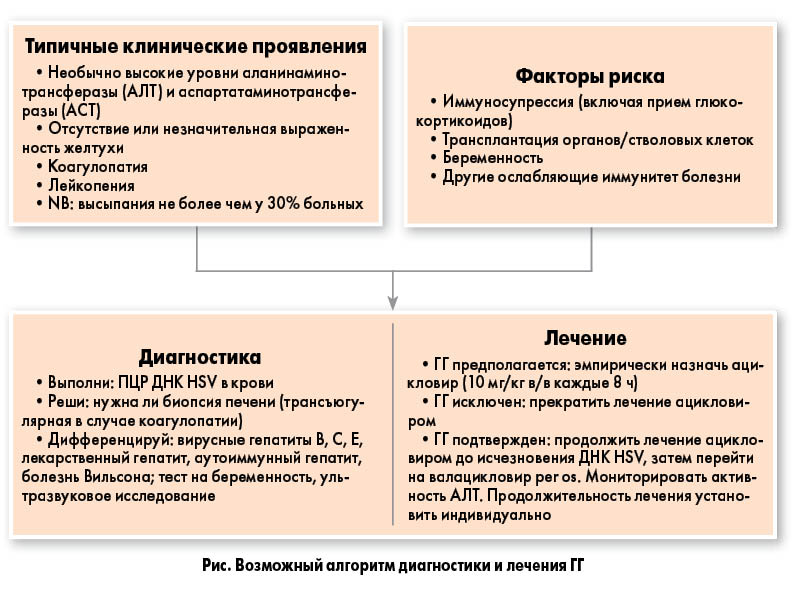
Один из предложенных алгоритмов действий при подозрении на ГГ представлен на рисунке.
Без адекватной противовирусной терапии и трансплантации печени прогноз при ГГ, как правило, неблагоприятный. Лечение ацикловиром может существенным образом повлиять на выживаемость пациентов, которая у пролеченных больных выше, чем у не получавших терапию ацикловиром (88 vs 51% в одной серии наблюдений) или тех, у кого лечение было начато позже [5].
Пока не ясно, как долго и в каких дозах должен назначаться ацикловир при лечении гепатита. При большинстве форм герпетической инфекции рекомендуемая продолжительность парентерального введения ацикловира составляет 5-7 дней. Исключение составляет энцефалит, при котором лечение должно длиться не менее 14-21 дня вследствие высокого риска развития рецидива в случае меньшей продолжительности терапии [48]. Rimawi и соавт. сообщают об успешной терапии 2 пациентов с ГГ, продолжавшейся 7 дней. Нормализация активности трансаминаз была подтверждена результатами исследования спустя месяц после начала заболевания [49].
Haag и соавт. сообщают об успешном лечении ацикловиром (10,5 мг/кг каждые 8 ч) ГГ у больной с иммунодефицитом (болезнь Крона) [50]. После 14 дней лечения (клиническое улучшение отмечено на 7-й день) пациентка была переведена на терапию валацикловиром (1000 мг 2 р/день), которая также продолжалась 2 недели с последующим постепенным снижением дозы препарата (500 мг 2 р/день).
В случае ФГ некоторые авторы допускают возможность эмпирической противовирусной терапии в ожидании результатов лабораторного обследования. У больных с иммуносупрессией, поражением костей, обширными ожогами о герпетической природе гепатита необходимо думать в первую очередь. У пациентов с иммунодефицитом, особенно после индукционной химиотерапии или трансплантации, профилактический прием ацикловира снижает вероятность развития клинических симптомов герпетической инфекции. Сопоставимую эффективность имеют фамцикловир и валацикловир [35].
Прием ацикловира per os связывают с развитием почечной недостаточности у лиц пожилого возраста [51]. Риск нефротоксичности может быть уменьшен за счет медленной инфузии препарата и обеспечения адекватной гидратации. Внутривенное введение ацикловира иногда сопровождается нарушениями со стороны ЦНС (возбуждение, галлюцинации, дезориентация, тремор и миоклонии). Теоретически (поскольку ацикловир проникает через плаценту и накапливается в амниотической жидкости) существует вероятность нефротоксического воздействия препарата на плод. Тем не менее пока в клинической практике таких случаев не зафиксировано [52].
При лечении ацикловиром может возникать резистентность. К факторам, увеличивающим риск ее появления, относят предыдущее лечение ацикловиром, ВИЧ-инфекцию, реакцию «трансплантат против хозяина». Резистентность чаще всего обусловлена мутациями в гене тимидинкиназы вируса. В общей популяции у иммунокомпетентных пациентов устойчивость HSV была выявлена в 0,28-0,33% случаев [53]. Более высокие показатели наблюдались у больных с иммуносупрессией (6-7,6%), у реципиентов трансплантата костного мозга (7,0-15,4%) [5] и у ВИЧ-инфицированных (4,2-7,1%) [54].
Преодолеть резистентность к препарату можно с помощью альтернативных схем лечения. В этом случае средством выбора является фоскарнет [55]. В случае устойчивости как к ацикловиру, так и к фоскарнету возможно применение цидофовира – нуклеотидного аналога, активного в отношении широкого спектра ДНК-содержащих вирусов, в том числе HSV [56].
Профилактический прием противовирусных препаратов может снизить частоту осложнений, связанных с реактивацией HSV-инфекции у больных с иммуносупрессией. Так, в одном из исследований было показано, что прием ганцикловира снижал частоту клинически манифестных форм герпетической инфекции после трансплантации печени до 3,5 vs 23,5% у реципиентов, получавших плацебо [57].
Трансплантация печени в случае ФГ является методом выбора. Использование прогностических маркеров может быть полезным в разграничении больных, нуждающихся в трансплантации печени, и пациентов, у которых возможно спонтанное выздоровление [58]. Необходимо учесть, что у пациентов с иммуносупрессией трансплантация печени и последующая иммуносупрессия могут осложнить течение инфекции в посттрансплантационном периоде. У пациентов с криптогенным гепатитом, этиология которого была установлена при исследовании эксплантированной печени, лечение ацикловиром в посттрансплантационном периоде было успешным [59]. К сожалению, времени на принятие решения о необходимости лечения ацикловиром не так много, т. к. период от момента начала заболевания до развития ФГ, требующего трансплантации, очень короток.
Таким образом, ГГ является редким заболеванием, а его своевременная диагностика чрезвычайно важна с учетом риска развития ФГ. Лечение ацикловиром может существенно улучшить прогноз заболевания, снизить частоту летальных исходов и уменьшить потребность в трансплантации печени.