6 липня, 2023
Хондросаркома, плеоморфна саркома, хордома, гігантоклітинна пухлина кісток
Клінічна настанова, заснована на доказах
Склад мультидисциплінарної робочої групи з опрацювання клінічної настанови:
Машкевич Олександра Григорівна – директор Департаменту медичних послуг, голова робочої групи
Дєдков Анатолій Григорович – завідувач науково-дослідного відділення онкологічної ортопедії Національного інституту раку, заступник голови робочої групи з клінічних питань
Верьовкіна Наталія Олегівна – науковий співробітник відділення хіміотерапії солідних пухлин Національного інституту раку
Кошик Олена Олександрівна – керівник патологоанатомічного відділення медичної лабораторії CSD товариства з обмеженою відповідальністю «Сі. Ес. Ді. Лаб» (за згодою)
Остафійчук Василь Васильович – лікар-онколог відділення онкоортопедії, пухлин шкіри та м’яких тканин Національного інституту раку
Сікачьов Сергій Сергійович – лікар-хірург-онколог відділення пухлин печінки, підшлункової залози та онковаскулярної хірургії Національного інституту раку
Шакірова Станіслава Василівна – представник громадської організації «Афіна. Жінки проти раку» (за згодою)
Методичний супровід та інформаційне забезпечення:
Гуленко Оксана Іванівна – начальник відділу стандартизації медичної допомоги Державного підприємства «Державний експертний центр Міністерства охорони здоров’я України», заступник голови робочої групи з методологічного супроводу
Державний експертний центр Міністерства охорони здоров’я України є членом Guidelines International Network (Міжнародна мережа настанов).
Рецензенти:
Захаричев Валерій Дмитрович – професор кафедри онкології Національного університету охорони здоров’я ім. П.Л. Шупиіка, д.мед.н., професор;
Вирва Олег Євгенович – головний лікар, керівник відділу кісткової онкології Державної установи «Інститут патології хребта та великіх суглобів ім. І.І. Ситенка НАМН України», д.мед.н., професор
Перегляд адаптованої клінічної настанови заплановано на 2028 рік.
Список скорочень
ВООЗ – Всесвітня організація охорони здоров’я
ГКП – гігантоклітинна пухлина
ДС – диспансерне спостреження
ДХС – дедиференційована хондросаркома
КН – клінічна настанова
КТ – комп’ютерна томографія
ЛР – локальний рецидив
МДК – мультидисциплінарна команда
МОЗ – Мінітерство охорони здоров’я
МХС – мезенхімальна хондросаркома
МРТ – магнітнорезонансна томографія
ПЕТ–КТ – [18F]2-фтор‑2-дезокси-d-глюкозо-позитронно-емісійна томографія – комп’ютерна томографія
ППК – первинна пухлина кістки
ПТ – променева терапія
ПС – плеоморфна саркома (веретеноподібна високого ступеня злоякісності)
ХС – хондросаркома
ХТ – хіміотерапія
Передмова мультидисциплінарної робочої групи
Дана клінічна настанова (КН) розроблена відповідно до Методики розробки та впровадження медичних стандартів медичної допомоги на засадах доказової медицини, затвердженої наказом МОЗ України від 28.09.2012 № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», зареєстрованим у Міністерстві юстиції України 29.11.2012 за № 2001/22313 (зі змінами). КН адаптована для системи охорони здоров’я України та розроблена на основі нової редакції клінічної настанови Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up, 2021. Окремі розділи доповнені рекомендаціями методологічного посібника Linee guida siot la diagnosi ed il trattamento del hondrosarcoma, 2011 Національної системи клінічних настанов Італії (www.snlg.it).
Рекомендації кваліфікуються на рівні доказовості I-V, сила рекомендацій – від А до Е. Однак у цьому документі, через складність або неможливість проведення рандомізованих контрольованих досліджень, допоміжна література повністю створена з ретроспективних досліджень «випадок – контроль» та обсерваційних досліджень, зокрема зі спеціалізованих установ, які систематично документують та архівують випадки лікування. Цей документ був направлений на розгляд експертної групи на національному рівні (Італія), щоб оцінити якість, клінічне значення та застосовність рекомендацій. Зовнішні аудитори є представниками Національних референтних центрів діагностики та лікування пухлин кістково-м’язової системи, а також фахівцями в методології клінічних досліджень GLOBE. Дана КН не повинна розцінюватись як стандарт медичного лікування. Це рекомендаційний документ, що базується на узагальненому стратегічному баченні щодо сучасного розвитку галузі з організації медичної допомоги при первинних новоутвореннях кісток, окрім остеосаркоми та саркоми Юїнга. КН призначена для практикуючих лікарів, які надають медичну допомогу, науковців, організаторів охорони здоров’я, інших зацікавлених у підвищенні якості медичної допомоги.
Рівні доказовості та оцінки рекомендацій
|
Рівні доказів |
|
|
І |
Докази принаймні одного великого рандомізованого контрольованого дослідження з хорошою методологічною якістю (низький потенціал упередженості) або метааналізу добре проведених рандомізованих досліджень без неоднорідності |
|
II |
Невеликі рандомізовані дослідження або великі рандомізовані дослідження з підозрою на упередженість (нижча методологічна якість) або метааналіз таких досліджень чи досліджень із продемонстрованою неоднорідністю |
|
III |
Перспективні когортні дослідження |
|
IV |
Ретроспективні когортні дослідження або дослідження «випадок – контроль» |
|
V |
Дослідження без контрольної групи, звіти про випадки, думки експертів |
|
Рекомендаційні оцінки |
|
|
А |
Наполегливо рекомендовані вагомі докази ефективності з істотною клінічною користю |
|
B |
Загалом рекомендовані сильні або помірні докази ефективності, але з обмеженою клінічною користю |
|
C |
Недостатні докази ефективності чи користі не переважають ризик або недоліки (несприятливі події, витрати…), необов’язково |
|
D |
Помірні докази неефективності або несприятливого результату, як правило, не рекомендовані |
|
E |
Переконливі докази неефективності або несприятливого результату ніколи не рекомендовані |
Загальні положення
Захворюваність та епідеміологія
Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2021.
Хондросаркома є найчастішою формою саркоми в дорослому віці (частота: <0,2/100 000/рік), із середнім віком на момент встановлення діагнозу від 30 до 60 років і без переважання статі [1]. Дедиференційована хондросаркома (ДХС), мезенхімальна хондросаркома (MХC) і світлоклітинна хондросаркома є надзвичайно рідкісними підтипами хондросаркоми із частотою <0,1/100 000/рік. Позаскелетна міксоїдна хондросаркома, спочатку вважалася хрящовою неоплазмою, не демонструє диференціювання хряща і класифікується як мезенхімальна пухлина невизначеної диференціації. Це охоплено клінічними настановами щодо сарком м’яких тканин Європейського товариства медичної онкології, Європейської довідкової мережі для рідкісних солідних новоутворень, Європейської довідкової мережі для синдромів ризику генетичних пухлин (ESMO-EURACAN-GENTURIS) [9].
Звичайні хордоми зустрічаються навіть рідше, ніж інші типи кісткових пухлин, із частотою приблизно 0,08/100 000/рік і середнім віком на момент встановлення діагнозу 60 років. Спостерігається незначне переважання у чоловіків. Дедиференційовані та малодиференційовані хордоми є надзвичайно рідкісними підтипами [1, 10].
Гігантоклітинна пухлина кістки (ГКП) є локально агресивною, рідко метастазує і становить 5% первинних пухлин кістки із частотою ~1/1 000 000/рік [1].
ГКП рідко метастазує і зазвичай вражає кінці довгих кісток, але також виникає в осьовому скелеті, особливо із крижів або тіл хребців.
Веретеноподібні/плеоморфні саркоми кістки високого ступеня злоякісності (ПС) є гетерогенною групою первинних злоякісних пухлин кісток, які не відповідають гістологічним критеріям остеосаркоми, хондросаркоми або саркоми Юїнга [11]. Недиференційовані плеоморфні саркоми кістки є діагнозом виключення, оскільки вони не мають ідентифікованої лінії диференціювання. Необхідно провести експертний огляд патології, щоб виключити інші рідкісні вищезгадані типи сарком.
Діагностика
Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2021.
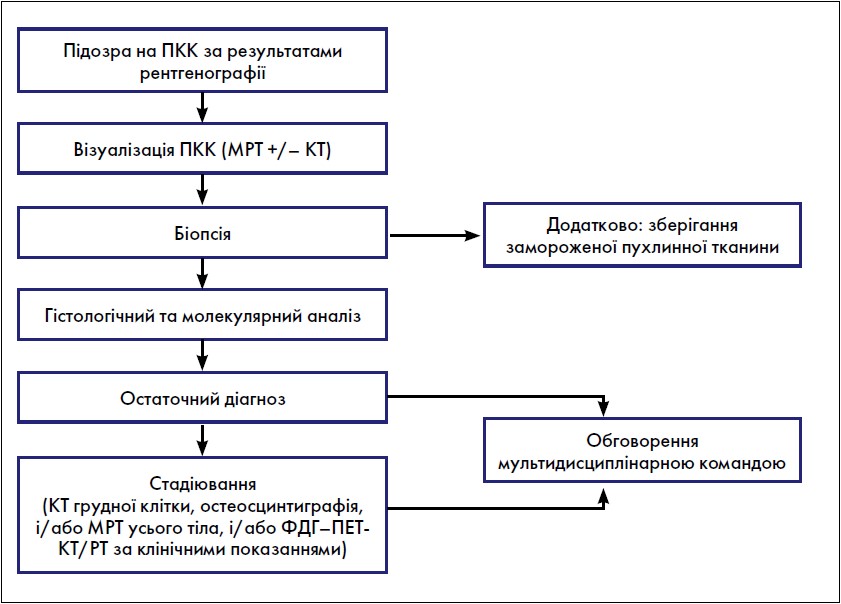
Загальна діагностична стратегія при всіх кісткових пухлинних ураженнях показана на рисунку. Наявність стійкого і часто прогресуючого немеханічного болю в кістках, переважно в нічний час, має спонукати до рентгенологічної оцінки. Набряк і функціональні порушення можуть бути присутні, якщо пухлина поширилася через кортикальний шар і розтягнула окістя, але часто це більш пізні ознаки. Диференціальні діагнози включають остеомієліт, доброякісні пухлини та метастази в кістки, усі з яких перевищують кількість первинних сарком. Діагноз може залежати від віку пацієнта. У пацієнтів молодше 5 років деструктивне ураження кісток може бути інтерпретовано переважно або як метастатична нейробластома, або як гістіоцитоз із клітин Лангерганса. У пацієнтів віком ≥5 років ймовірність первинної саркоми є вищою. Після 40 років найчастіше діагностують метастази в кістки та мієлому.
Рис. Загальна діагностична стратегія при первинній пухлині кістки
Біопсію за підозри на первинну пухлину кістки (ППК) повинна виконувати або хірургічна бригада, яка буде проводити остаточну резекцію пухлини, або спеціальний інтервенційний радіолог після обговорення з хірургом [12]. У тих пацієнтів, чий патологічний діагноз був отриманий за межами референтної мережі, патологоанатомічний огляд у референтному центрі саркоми є обов’язковим. У більшості пацієнтів біопсія стрижневою (товстою) голкою, зроблена під контролем візуалізації, є відповідною альтернативою відкритій біопсії. Забруднення навколишніх тканин має бути зведено до мінімуму, і завжди має бути забезпечено достатній багаторазовий відбір зразків репрезентативних ділянок. За потреби слід провести відкриту біопсію за допомогою поздовжнього розрізу. При агресивних і злоякісних ПК біопсійний тракт і канали, через які розміщено дренаж, мають вважатися потенційно забрудненими, а згодом їх слід видалити разом із резекційним зразком, щоб звести до мінімуму ризик локального рецидиву (ЛР). Тому біопсійні шляхи мають бути чітко позначені, щоб гарантувати, що місце розташування було розпізнане під час остаточної процедури. У разі ураження хребта слід уникати ламінектомії або декомпресії, за винятком випадків, коли це необхідно для зняття компресії спинного мозку, а взяття зразків тканини необхідно проводити при будь-якій підозрі на ПК. Гістологічні зразки мають бути інтерпретовані досвідченим патологом кісткових пухлин у співпраці з рентгенологом та обговорені в мультидисциплінарній команді (MДК).
Зі збільшенням можливостей точної молекулярної діагностики зразки слід швидко надавати для патологоанатомічної оцінки [13]. Збір свіжої швидко замороженої тканини заохочується, щоб подолати пошкодження нуклеїнових кислот у результаті декальцифікації та забезпечити подальшу молекулярну оцінку.
Характер кісткового зразка, отриманого для звіту про патологію, має бути зафіксований (голкова біопсія, кюретаж або висічення). Зазвичай необхідно декальцинувати біопсію пухлини кістки. ЕДТА є кращим порівняно з методами на основі кислоти; в останньому випадку взяття зразків замороженої тканини є важливим для молекулярної діагностики. Тип пухлини має бути діагностований відповідно до останньої версії класифікації пухлин м’яких тканин і кісток ВООЗ (2020) [4]. Важливо зазначити, що для ПК гістіотип визначається разом зі ступенем злоякісності, за невеликою кількістю винятків [4]. Результати допоміжних досліджень (наприклад, імуногістохімія або молекулярні оцінки) мають бути досліджені, коли це необхідно. Приклади включають виявлення транслокації у круглоклітинній саркомі та МХС, мутації ізоцитратдегідрогенази (IDH1 та IDH2) у звичайній хондросаркомі та ампліфікацію MDM2 при паростальній та інтрамедулярній остеосаркомі низького ступеня злоякісності.
Під час резекції первинної пухлини для хірургічних зразків слід реєструвати розмір пухлини в резекованій кістці (принаймні максимальний діаметр, але краще – тривимірне вимірювання, у мм). У звіті про патологію слід описувати ступінь локального поширення пухлини, включаючи ураження специфічних анатомічних відділів м’яких тканин і кісток. Слід зафіксувати, чи є краї резекції чистими (R0), мікро- (R1) чи макроскопічно забрудненими (R2). У разі негативних країв слід виміряти відстань (у мм) пухлини від найближчого краю резекції, а також до найближчого краю остеотомії. Повний, репрезентативний зріз пухлини, як правило, через її найбільший вимір по поздовжній осі відповідно до рентгенологічних зображень, має бути закладений для мікроскопії у вигляді сітки. Це особливо актуально після неоад’ювантної хіміотерапії (ХТ) для оцінки відповіді.
Коментар робочої групи. Основним критерієм встановлення діагнозу пацієнту є гістологічне дослідження інформативного біопсійного матеріалу у референтних лабораторіях, що спеціалізуються на саркомах. Лікар-патологоанатом, який проводить морфологічне дослідження матеріалу, повинен мати достатній досвід у галузі пухлин кісток та відповідне матеріально-технічне обладнання. В Україні існує лише декілька лабораторій, які відповідають цим вимогам.
Рекомендації
- Початкове обстеження за підозри на ППК має проводитися в референс-центрі сарком і включати історію хвороби, фізикальне обстеження, рентгенологічне дослідження та біопсію (IV, B).
- Патологоанатомічний діагноз має бути поставлений експертом-патологом, який займається патологією кісток відповідно до класифікації ВООЗ 2020 року, і, за необхідності, має підкріплюватися допоміжними дослідженнями (IV, A).
- Для післяопераційних зразків слід описати розмір пухлини та місцевий ступінь поширення, локалізацію, стан хірургічних країв та відсоток патологічної відповіді на передопераційну ХТ (V, B).
Стадіювання та фактори ризику
Використовується кілька систем стадійного визначення КС, при цьому об’єднуюча система не прийнята за стандарт [18-20]. Пухлинне навантаження* і наявність метастазів, які можна виявити, є двома основними факторами, які враховуються при клінічній стадії цих захворювань. Для оцінки ступеня віддаленого метастазування необхідно провести загальне дослідження, включаючи сцинтиграфію кісток і спеціальну КТ грудної клітки. МРТ усього тіла та [18F]2-фтор‑2-дезокси-d-глюкоза (FDG)-позитронно-емісійна томографія (ПЕТ-КТ або ПЕТ-МРТ) все частіше використовуються для визначення стадії метастазів у кістку та кістковий мозок (включаючи skip-метастази). З підозрілих місць можна взяти додаткову біопсію відповідно до візуалізації.
Немає специфічних лабораторних тестів для діагностики ППК (окрім остеосаркоми, для якої характерні підвищені рівні лужної фосфатази й лактатдегідрогенази). Прогностичні ознаки базуються на клінічному перебігу; патологічний перелом може призвести до поширення пухлинних клітин у навколишні тканини і збільшити ризик рецидиву.
Рекомендації
Для оцінки ступеня віддаленого метастазування слід проводити загальну оцінку захворювання, включаючи КТ грудної клітки, сцинтиграфію кісток, і/або ПЕТ-MРТ, і/або ПЕТ-КТ, якщо є клінічні показання (III, B).
Коментар робочої групи. У вітчизняній онкологічній практиці використовують попередню міжнародну класифікацію TNM 6-го перегляду (TNM 6th edition) (табл. 1).
|
Таблиця 1. Міжнародна TNM класифікація первинних злоякісних пухлин кісток 6-го перегляду |
||||
|
Стадія |
Tumor (T) |
Limph Node (N) |
Metastases (M) |
Grade (G) |
|
IA |
T1 |
N0 |
M0 |
G1 або G2 |
|
IB |
T2 |
N0 |
M0 |
G1 або G2 |
|
IIA |
T1 |
N0 |
M0 |
G3 або G4 |
|
IIB |
T2 |
N0 |
M0 |
G3 або G4 |
|
III |
T3 |
N0 |
M0 |
Будь-яке G |
|
ІV |
Будь-яке Т |
N0 |
М1 |
Будь-яке G |
|
Джерело: American Joint Committee on Cancer. Bone. In: Greene F.L., Page D.L., Fleming I.D. et al., eds. AJCC cancer staging manual. New York, NY: Springer-Verlag, 2002:213-21. |
||||
Хондросаркома
Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2021.
Найпоширенішими первинними ділянками є довгі кістки, особливо нижня кінцівка, а потім таз і ребра [1, 73].
Більшість звичайних (класичних) хондросарком (ХС) є локально агресивними низького ступеня злоякісності, неметастазуючими пухлинами (атипова хрящова пухлина/хондросаркома GI), ніж хондросаркома високого степеня злоякісності (G2,3). Назва «атипова хрящова пухлина» в даний час використовується для пухлин, що виникають у довгих і трубчастих кістках кінцівок, тоді як пухлини осьового скелета (у плоских кістках, включаючи таз, лопатку та основу черепа) слід називати хондросаркомою I ступеня [4]. Більшість звичайних хондросарком як низького, так і високого ступеня злоякісності є первинними і беруть початок у мозковій частині кістки (центральна ХС), хоча деякі можуть виникати вторинно всередині енхондроми (вторинна центральна ХС) або на поверхні кістки від ковпачка вже існуючої остеохондроми (вторинна периферична ХС). Більшість ХС є поодинокими (солітарними), але вони можуть виникати у вигляді множинних уражень у пацієнтів із синдромом множинних остеохондром та енхондроматозом (екзостозна хвороба та хвороба Ольє). Рідко (у 2% випадків) ХС може виникнути з окістя на поверхні кістки (періостальна ХС). Звичайні хондросаркоми іноді можуть дедиференціюватися в дуже агресивну саркому високого ступеня злоякісності з поганим прогнозом – так звані дедиференційовані ХС [4]. Більш рідкісні підтипи ХС включають мезенхімальну і світлоклітинну ХС [4, 74].
Діагноз ХС базується на морфологічному дослідженні. Приблизно 50% центральних ХС несуть мутації IDH1 або IDH2; однак молекулярний аналіз не потрібен рутинно [75]. MХС відзначається наявністю високоспецифічного злиття генів між HEY1 і NCOA2 [76].
Особливості клінічного перебігу та діагностики варіантів хондросаркоми
Linee guida siot la diagnosi ed il trattamento del hondrosarcoma, 2011.
Хондросаркома (ХС) є злоякісною пухлиною мезенхімального походження, клітини якої виробляють хондроїдний матрикс без остеоїду.
Класифікація ХС включає наступні різновиди:
- центральна;
- периферична;
- періостальна;
- світлоклітинна;
- мезенхімальна;
- дедиференційована.
Центральна хондросаркома
Центральна ХC бере початок в інтрамедулярній ділянці кістки і може бути визначена як первинна або вторинна. Первинна центральна ХС виникає в одному сегменті раніше здорової кістки. Вторинна – виникає на місці вже існуючого доброякісного ураження хрящового генезу (енхондрома; хвороба Ольє; синдром Маффуччі).
За рівнем захворюваності в дорослого населення займає друге місце серед первинних злоякісних новоутворень кісток після остеосаркоми, зустрічається переважно в осіб чоловічої статі й є типовою для похилого віку. Рідше виникає у людей до 30 років і вкрай рідко – до статевого дозрівання. За локалізацією в більшості випадків вражає тазовий пояс (проксимальний відділ стегнової кістки і тазові кістки), а також плечовий (проксимальний відділ плечової кістки і лопатка). Рідше – дистальний відділ стегна і проксимальний відділ великогомілкової кістки. Вкрай рідко виникає в кістках кисті та стопи [1-5].
Основним симптомом є біль, який не вщухає у спокої і загострюється вночі. ХС, як правило, повільно зростає. Утворення часто стає відчутним і проявляється через тривалий час від появи симптомів, особливо в кістках із глибоким заляганням у м’які тканини, таких як тазовий пояс. Больова симптоматика традиційно вважається важливим фактором диференціальної діагностики між доброякісним ушкодженням хряща та ХС низького ступеня злоякісності, але деякі автори повідомляють про погану специфічність больового симптому при спостереженні больових енхондром і безсимптомного перебігу ХС І ступеня злоякісності [6].
Інструментальні дослідження необхідно починати з рентгенографії відповідного сегмента. Рентгенографічні ознаки ураження хряща скелета можуть варіюватися від картини, схожої на доброякісну енхондрому, до картини вираженого агресивного і деструктивного характеру, яка може призвести до патологічного перелому. Рентгенологічна картина типова для центральної ХС – це остеоліз із кальцифікацією типу «попкорн» та «кільцевою» осифікацією, що характерно для високого та середнього ступеня диференціації. При ХС високого ступеня злоякісності така картина є нерегулярною. Тобто при більш агресивних формах ХС ураження може бути суто остеолітичним із незначною кальцифікацією або без неї. Кортикальний шар може бути неушкодженим або «роз’їденим» лише на ендостеальній стороні інтрамедулярного каналу (фестоноподібний край) при новоутвореннях низького ступеня злоякісності. Або бути потовщеним, набряклим чи перерваним у разі ХС високого ступеня злоякісності. Поверхня кортикального шару може продемонструвати нерегулярну періостальну реакцію на хронічне подразнення з боку новоутворених тканин.
Комп’ютерна томографія (КТ) дозволяє з більшою точністю оцінити появу коркових змін, їх взаємозв’язок із новоутвореною хрящовою тканиною і можливою ерозією ендоста (фестон). КТ абсолютно необхідна для оцінки кальцифікації та атипових осифікацій при пухлинах хрящової природи [1-3, 6, 7].
На МРТ пухлинні хрящові маси показують низький сигнал у режимах T1 і високий – у режимах T2, а ділянки кальцифікації та окостеніння мають низький сигнал як у режимі T1, так і в T2. МРТ має важливе значення для оцінки ступеня ураження в навколишніх м’яких тканинах, й особливо важливе – поширення вздовж медулярного каналу та наявність skip-метастазів. Контрастування при МРТ дає просочення контрасту в навколишні фіброваскулярні перегородки, де часточки новоутвореного атипового хряща виявляються при аналізі швидкості поглинання гадолінію із часом, через що виявилося, що динамічна МРТ корисна в диференціальній діагностиці між доброякісними і злоякісними ураженнями хряща. Зокрема, раннє поглинання гадолінію з експоненційною кривою вказує на злоякісне ураження, натомість як відстрочене поглинання з прогресуючою кривою – на доброякісне [8]. Сигнальні характеристики МРТ можуть вказувати на ступінь злоякісності ХС. Показовим є наявність утворення в м’яких тканинах при ХС високого ступеня злоякісності. Центральні ділянки ХС із високою інтенсивністю сигналу в режимах Т1 можуть свідчити про високий ступінь злоякісності й, відповідно, наявність геморагічних кістозних змін. При центральній ХС низький сигнал у послідовностях Т1 із невеликими «плямами» високого рівня сигналу у вогнищі ураження може свідчити про низьку злоякісність ХС, оскільки контраст затримується у часточках жиру жовтого кісткового мозку [9].
Сцинтиграфія кісток демонструє інтенсивне накопичення радіофармпрепарату при пухлинах хрящової природи, але не допомагає диференціювати доброякісні пухлини від злоякісних (інтенсивне накопичення спостерігається і при доброякісних хондромах) [10, 11].
За останні роки зросла роль ПЕТ-КТ у диференціальній діагностиці між доброякісними і злоякісними хрящовими ураженнями кісток скелета. Рівень стандартного значення поглинання (SUV) корелює зі ступенем злоякісності пухлини, порогове значення якого повідомляє про різницю між доброякісністю та злоякісністю (SUV коливається від 2 до 4) [11, 12]. Крім того, рівень SUV є прогностичним фактором і корелює з перебігом захворювання. Граничним значенням є рівень 4. Якщо рівень SUV >4 – прогноз гірший у відсотковому співвідношенні одужання та виживаності [13].
Критерії, які відрізняють центральну ХC від доброякісної енхондроми, включають наступні [1-3, 6-9, 12, 24, 29]:
- розміри >5 см;
- зростання із часом при послідовних обстеженнях;
- ендостальна ерозія кортикального шару (фестончатисть);
- періостальна реакція;
- потовщення кортикального шару;
- набряк кортикального шару;
- витончення кортикального шару;
- кортикальне переривання;
- остеоліз із розмитими межами;
- нерегулярні й розмиті звапнення та окостеніння;
- поширення на м’які тканини;
- динамічна МРТ (раннє поглинання з експоненційною кривою);
- ПЕТ-КТ (SUV >2) (ІІІ, В).
Іноді центральна ХС виникає на вже існуючій енхондромі (вторинна центральна ХС), і в цьому випадку чітко виражені кальцифікати поступово заміщаються остеолізом і стають розмитими й нерегулярними. Біопсія в таких випадках має на меті підтвердити, що наявне ураження хряща, але не дозволяє з певністю відрізнити доброякісність від злоякісності та визначити гістологічний ступінь останньої. У центральних ХС може спостерігатися прогресуюча злоякісність, зважаючи на те що в самій пухлині може бути представлено ділянки різних гістологічних класів, включаючи ділянку вже існуючої доброякісної енхондроми. Крім того, можуть бути наявні ділянки новоутвореної хрящової тканини за типом хондробластичної остеосаркоми. Гістологічна діагностика хрящових пухлин обов’язково має завжди проводитися разом із точною оцінкою клінічних та рентгенологічних даних. Остаточний діагноз можна встановити лише шляхом гістологічного аналізу всієї пухлини після хірургічного видалення [1-3, 14-16] (ІІІ, В).
Біопсію можна не виконувати при центральних ураженнях кісток кінцівок із неагресивним рентгенологічним виглядом [14-16], а саме:
- цілісність кори;
- легка ендостальна ерозія кори;
- відсутність періостальної реакції;
- відсутність потовщення, витончення, набряку й/або переривання кори;
- відсутність розповсюдження на м’які тканини.
Залежно від встановлення «неагресивного рентгенологічного вигляду» хрящової центральної пухлини довгих кісток кінцівок рекомендовано [1-3, 8, 12]:
- клінічне спостереження у разі:
- відсутність больових симптомів;
- розміри <5 см;
- розміри стабільні у часі при послідовних дослідженнях;
- мала динаміка накопичення контрасту під час процедури МРТ (відкладене поглинання із прогресивною кривою);
- ПЕТ-КТ негативний (SUV <2);
- внутрішньовогнищеве хірургічне висічення (кюретаж) ± місцеві допоміжні засоби у разі [1-3, 8, 12]:
- біль;
- розміри >5 см;
- збільшення розмірів із часом при послідовних дослідженнях;
- позитивна динамічна МРТ (раннє сприйняття з експоненційною кривою);
- ПЕТ-КТ (SUV >2).
У цих випадках біопсію можна не виконувати, а вогнище видалити. Гістологічний діагноз буде встановлено на основі аналізу всієї екскохлеованої тканини [14-16].
Біопсію слід проводити при центральних хрящових ураженнях кісток кінцівок з агресивним рентгенологічним виглядом [1-3, 6, 7, 9, 24, 29]:
- інтенсивна ендостальна ерозія кори;
- періостальна реакція;
- потовщення, витончення, набряк та/або порушення цілісності кори;
- поширення на м’які тканини;
- остеоліз із розмитими межами.
Необхідно завжди проводити біопсію за підозри на ураження хрящового генезу у плоских кістках тазового та плечового поясів [1-3, 14-16]. У цих випадках біопсію слід провести в ділянці, яка має більш остеолітичні та агресивні рентгенографічні ознаки, але остаточний гістологічний діагноз і ступінь злоякісності ураження будуть визначені шляхом аналізу всього матеріалу пухлини після хірургічного видалення (ІІІ, В).
Лікування
Лікування центральної ХС є хірургічним, що зумовлено низькою чутливістю пухлини до хіміо- й променевої терапії [17].
Вибір виду оперативного лікування залежить від трьох факторів: ступеня злоякісності; розміру ушкодження за даними інструментальних досліджень; місця ураження.
Центральну ХС I ступеня довгих кісток кінцівок із «неагресивним рентгенологічним виглядом» можна лікувати за допомогою кюретажу (внутрішньовогнищева резекція) і заповнення порожнини кістковим цементом або кістковим трансплантатом [17-31]. Коли сегмент кістки надмірно послаблений кюретажем – проводити профілактичний підсилювальний остеосинтез.
При внутрішньовогнищевому хірургічному лікуванні центральної ХС І ступеня, щоб зменшити ризик локального рецидиву, для стерилізації стінок порожнини можна використовувати місцеві допоміжні речовини, наприклад фенол та етиловий спирт, або кріотерапію рідким азотом, або зонди, що містять газ аргон. Згідно з дослідженнями, проведеними на хірургічному або аутопсійному матеріалі, фенол не мав цитотоксичної дії на хрящову тканину, й автори вивели постулат, що він захищає хондроїдний матрикс [32]. Навпаки, за даними останніх досліджень, фенол та етанол продемонстрували цитотоксичну дію на клітини ХC in vitro в мінімальних концентраціях – 1,5 і 42,5% відповідно [33]. Кріотерапію рідким азотом або газоподібним аргоном можна використовувати як місцевий допоміжний засіб при внутрішньовогнищевому хірургічному лікуванні центральної ХС І ступеня. Ступінь некрозу кістки, індукованого кріотерапією (7-12 мм), більший, ніж некрозу, спричиненого іншими місцевими ад’ювантами (фенол 1-2 мм). Щоб зменшити ризик патологічного перелому, у разі кріотерапії доцільно завжди виконувати профілактичний остеосинтез [23, 26, 30, 31, 34].
Центральну ХС I ступеня злоякісності довгих кісток кінцівок із «агресивним рентгенологічним виглядом» необхідно лікувати з використанням широких радикальних резекцій для отримання чистих країв [3, 17, 24, 27-29] (III, B).
Центральну ХС I ступеня плоских кісток тазового та плечового поясів також необхідно лікувати за допомогою хірургічної резекції з отриманням широких або радикальних країв [35-40] (III, B).
Центральну ХС ІІ і ІІІ ступеня злоякісності необхідно лікувати за допомогою хірургічної резекції, з отриманням широких або радикальних країв [1-3, 17, 41-46]. У клінічних ситуаціях, коли під час зберігаючих кінцівку втручаннях отримати широкі краї неможливо, виконуються ампутації. Коли при ампутації технічно неможливо отримати великі або радикальні краї резекції, можна розглядати променеву терапію як паліативне лікування [3, 17].
Променева терапія
При ХС із низьким і високим ступенем злоякісності, коли планується ампутація для оримання широких країв, перед хірургічним втручанням можна спробувати лікування променевою терапією [3, 17]. Традиційно ХС вважається нечутливою до опромінення пухлиною. Останні дослідження показали, що відсутність експресії білка p16 (INK4a) (протеїн, що регулює клітинний цикл) сприяє стійкості клітин ХС до радіації [47]. У спробі підвищити радіочутливість були випробувані радіосенсибілізуючі речовини, такі як разоксан [48]. Разоксан уводили в дозі 125 мг двічі на добу починаючи за 5 днів до початку опромінення, при цьому середня доза опромінення становила 60 Гр. Результати дослідження були обнадійливими, але воно було обмежене відсутністю контрольної групи.
Останніми роками зарекомендувала себе протонна ПТ, що забезпечила відмінний локальний контроль і довготривалу виживаність при ХС низького ступеня злоякісності основи черепа, але висока вартість й обмежена технологічна доступність робить цю терапію досить складною для застосування при лікуванні ХС [49, 50]. Добре показала себе і вуглецево-іонна променева терапія для короткострокового місцевого контролю у хворих на ХС [51].
Хіміотерапія не була ефективною при лікуванні центральної ХС, й її роль залишається невизначеною. Проспективних рандомізованих досліджень не проводилося, тому оцінити будь-які переваги неможливо [3, 17, 41-46].
Прогноз при центральній ХС пов’язаний із гістологічним ступенем злоякісності, анатомічним розташуванням та розміром ураження. Локалізація ХС в осьовому скелеті та тазовому поясі має гірший прогноз, ніж на інших ділянках [35-40].
Негативними прогностичними факторами для місцевого контролю є наступні ознаки [41-46]:
- позитивні або неадекватні хірургічні краї;
- об’єм пухлини.
Негативними прогностичними факторами для виживаності є [41-46, 52]:
- гістологічний ступінь злоякісності;
- високі показники проліферації клітин (MIB‑1, ДНК індекс);
- наявність клітинної анеуплоїдії;
- тазове розташування;
- локальний рецидив.
Виявлено, що місцевий рецидив є прогностичним негативним фактором як у низько-, так й у високозлоякісних ХС. Примітно, що локальний рецидив спостерігається у 14-25% випадків, і це має бути інтерпретовано як більш агресивний фенотип ХС, ніж вважався раніше [53, 54].
Місцевий рецидив необхідно видалити хірургічним шляхом із широкими або радикальними краями, коли це технічно можливо. Широкі або радикальні хірургічні краї можуть бути отримані за допомогою або операції, що зберігає кінцівку, або ампутації кінцівки [17, 53, 54].
Післяопераційна ПТ може бути показана, коли краї резекціїї є позитивними (при крайових або внутрішньовогнищевих резекціях) після хірургічного видалення. У випадку місцевого рецидиву, який не можна видалити ані за допомогою хірургічного втручання, що зберігає кінцівку, ані за допомогою ампутації, ПТ може розглядатися як паліативне лікування [3, 17].
Легеневі метастази центральної ХС видаляються хірургічним шляхом, якщо це технічно можливо [3, 17, 41-46]. Як варіант, пацієнту може бути запропоновано взяти участь в експериментальному лікуванні [3, 17].
Спостереження
Клініко-інструментальний контроль після хірургічного втручання у хворих на ХС малого ступеня злоякісності проводиться кожні 6 міс протягом перших 5 років і один раз на рік до 10 років спостереження. Плановим обстеженням є контроль прооперованого сегмента (рентгенографія, КТ або МРТ) та інструментальне дослідження органів грудної клітки (рентгенографія у двох проекціях або КТ).
Пацієнти з високозлоякісними ХС мають перевірятися кожні 3 міс протягом перших 3 років, кожні 6 міс – на 4-5-й роки і щорічно – до 10-го року, із клінічним оглядом, інструментальним контролем місця втручання, який визначається на основі типу втручання та реконструкції (рентгенографія або КТ чи МРТ), та інструментальним обстеженням грудної клітки (рентгенографія у двох проекціях або КТ) (табл. 1) [3, 17, 24, 29, 46] (ІІ, В).
Периферична хондросаркома
Периферична ХС виникає на поверхні кістки, зазвичай на місці наявного екзостоза або остеохондроми. Периферична ХС зустрічається рідше, ніж центральна, і виникає частіше у чоловіків. Віковий діапазон піку захворюваності – від 20 до 50 років, рідко – до 20 років і винятково – до статевого дозрівання. Переважні місця локалізації – кістки таза, лопатка, проксимальній відділ стегнової кістки, проксимальний відділ плечової кістки та коліно (дистальний відділ стегнової та проксимальний відділ великогомілкової кістки). Основним симптомом є поява здуття або збільшення в розмірі із часом у дорослому віці наявного екзостоза. Злоякісна трансформація солітарного екзостоза зустрічається рідко порівняно зі злоякісними перетвореннями спадкових множинних екзостозів (10-20% випадків екзостозної хвороби). Розростання екзостоза у зрілому віці завжди змушує думати про розвиток периферичної ХС, особливо в ділянці таза та лопатки. Біль, як правило, незначний або відсутній і не може вважатися ознакою злоякісного переродження [1-3, 55]. Інструментальні дослідження часто демонструють об’ємні новоутворення за типом «цвітної капусти» з явними ознаками периферичної ХС, що виникають на поверхні доброякісного екзостоза.
Стандартні рентгенограми та КТ можуть показати руйнацію кортикального шару в основі новоутворення, який виглядав цілим, що є типовим для доброякісного екзостозу. В інших випадках розвиток периферичної ХС на основі екзостозу виявляється змінами кісткового сегмента, з якого походить екзостоз. Зони кальцифікації та осифікації хрящових часточок на периферії новоутворення виглядають розмитими та нерегулярними, а в деяких випадках можуть відзначатися міксоїдні ділянки. МРТ має вирішальне значення для оцінки розміру пухлини біля її основи в сегменті кістки, а також наявності skip-метастазів та розповсюдження в навколишні м’які тканини. Також МРТ дозволяє точно оцінити товщину хрящової «шапки», що присутня на поверхні екзостозу. Хрящовий ковпачок розміром більше 1-2 см над наявним екзостозним ураженням або задокументоване збільшення його розмірів у пацієнтів зі скелетною зрілістю повинні викликати підозру злоякісної трансформації остеохондроми [1-3, 8, 55]. Динамічна МРТ [8, 9] і ПЕТ-КТ із 18F-фтордезоксиглюкозою (FDG) можна використовувати для диференціації доброякісного екзостозу від периферичної ХC (див. «Центральна хондросаркома») [12]. Остеосцинтиграфія кісток демонструє гіперпоглинання при периферичній ХC, але не дозволяє відрізнити її від доброякісного ураження (слабке накопичення радіофармпрепарату є і при екзостозах) [10].
Клініко-інструментальними критеріями злоякісної трансформації екзостоза є [1-3, 8, 55]:
- зростання в розмірах у дорослому віці;
- локалізація: осьовий скелет; тазовий і плечовий пояси; проксимальніше коліна; проксимальніше ліктя;
- хрящова «шапка» >2 см;
- нечіткі краї в бік навколишніх м’яких тканин;
- зони кальцифікації та окостеніння розмиті й нечіткі.
При гістологічному дослідженні периферична ХС загалом має гістологічний ступінь злоякісності нижче, ніж центральна ХС. Більше двох третин периферичних ХС мають І ступінь злоякісності, менше третини – ІІ ступінь, а ІІІ ступінь є винятковою знахідкою. Гістологічна картина зазвичай демонструє добре диференційовану гіалінову хрящову тканину, а ділянки міксоїдної перебудови зустрічаються рідко і спорадично. Як і для центральної ХС, гістологічний ступінь злоякісності периферичної ХС можна визначити лише шляхом повного аналізу пухлини після хірургічного видалення. Збільшення ступеня злоякісності в межах однієї пухлини або при рецидивах може спостерігатися рідше порівняно з центральною ХC [1-3, 14-16, 55]. За наявності типових клініко-інструментальних критеріїв периферичної ХС біопсія виконується для підтвердження діагнозу перед хірургічним втручанням [1-3, 55]. У деяких випадках при ознаках початкової злоякісної трансформації існуючого екзостоза на ніжці біопсія може не виконуватися і можна приступати до хірургічного видалення з обов’яковим гістологічним аналізом видаленого матеріалу [1, 3].
Хірургічне лікування – резекція з широкими або радикальними краями – є засобом вибору для периферичної ХС [1-3, 17, 40, 55]. У випадках коли клінічні та інструментальні ознаки вказують на початкову злоякісну трансформацію хрящової «шапки» екзостоза, можна провести резекцію основи ніжки утворення з широкими краями зі збереженням безперервності кісткового сегмента. У більшості випадків злоякісна тканина поширюється на значну частину екзостоза і його основу, циркулярно оточуючи кістковий сегмент. У цих випадках, зрозуміло, необхідна резекція сегмента [1-3, 17, 55]. Є ділянки, де важко отримати адекватні хірургічні краї резекції: хребці, кістки тазового і плечового пояса. На периферії ураження, на рівні хрящової шапки, важливо отримати запас здорової тканини за можливості (м’язова тканина; апоневроз; підшкірна жирова клітковина; поверхнева фасція; шкіра) [1-3, 17, 40, 55]. В інших випадках хірургічний край може бути локально крайовим, коли пухлина стикається з важливими анатомічними структурами, які потрібно зберегти (тверда мозкова оболонка; судинні структури; нервові структури; внутрішні органи). Враховуючи те, що значна частина периферичних ХС мають низький ступінь злоякісності, такі краї резекціїї можуть бути прийнятними [1-3, 17, 40, 55]. З іншого боку, слід уникати хірургічного пошкодження псевдокапсули на поверхні хряща до видалення пухлини, оскільки ризик локального рецидиву буде високим [1-3, 17, 40, 55]. У деяких випадках периферичної ХС місце розташування пухлини, розміри та її співвідношення з важливими анатомічними структурами роблять зберігаючу операцію неможливою. У таких випадках показана ампутація кінцівки для отримання адекватних хірургічних країв [1-3, 17, 40, 55].
Після резекції з неадекватними хірургічними краями можна розглядати застосування післяопераційної променевої терапії [3, 17]. У випадках коли неможливо отримати достатні краї резекції навіть при ампутації, може бути показана ПТ із паліативною метою (див. «Центральна хондросаркома») [3, 17, 47-51].
У даний час хіміотерапія не відіграє жодної ролі в лікуванні периферичної ХС [3, 17, 41-46, 55].
Місцеві рецидиви периферичної ХС є частими і повинні лікуватися хірургічним методом за тими ж критеріями, що й описані для первинної пухлини [1, 3, 17, 53-55]. Велику увагу необхідно приділяти місцевим рецидивам при локалізації в осьовому скелеті та кістках тазового пояса. Зокрема, при таких локалізаціях рецидиви периферичної ХС можуть бути нерезектабельними, і пацієнт може померти саме через локальний рецидив, а не від метастатичної дисемінації [1, 53-55].
Метастази в легенях рідше зустрічаються при периферичних ХС порівняно з центральними, і підлягають хірургічному висіченню, якщо це можливо [3, 17, 41-46, 55].
Найбільш значущим прогностичним фактором виживаності при периферичних ХС є гістологічний ступінь злоякісності. Іншими негативними прогностичними факторами, які мають значення для місцевого контролю та виживаності, є анатомічна ділянка (осьовий скелет і тазовий пояс) та розміри пухлини [41-46, 52, 55].
Рідкісні форми хондросаркоми
Крім «класичних» форм (центральних і периферичних) ХС може виникати в деяких рідкісних варіантах: періостальна; світлоклітинна; мезенхімальна; дедиференційована (центральна і периферична).
При цих формах методом вибору лікування завжди залишається резекція із широкими краями, але в деяких випадках (дедиференційована та мезенхімальна ХС) використовується системна терапія.
Періостальна хондросаркома (ПХС)
Це рідкісне новоутворення хряща у молодих дорослих, дещо частіше – у чоловіків, що локалізується в метадіафізах, як правило, дистального відділу стегнової кістки (задня частина), проксимального відділу великогомілкової або проксимального відділу плечової кістки.
Рентгенологічно це виглядає як радіопрозоре ураження (іноді з кальцифікаціями), яке походить із зовнішньої поверхні кортикального шару і просувається в м’які частини. Методом вибору в лікуванні є резекція з широкими краями. Прогноз більш сприятливий, ніж при центральній ХС, і корелює із гістологічним ступенем злоякісності [1, 56].
Світлоклітинна хондросаркома (СХС)
Рідкісне новоутворення хряща низького ступеня злоякісності, частіше зустрічається у чоловіків, типове для ІІ-VІ десятиліття життя. Зазвичай виникає в епіфізах довгих кісток (стегнової та проксимальної частини плечової кістки) або у плоских кістках. Важливий точний гістологічний диференціальний діагноз із хондробластомою. Резекція із широкими краями є лікуванням вибору. Локальні рецидиви та метастази зустрічаються зрідка [1-3, 57-59].
Мезенхімальна хондросаркома (МХС)
Це рідкісне новоутворення високого ступеня злоякісності з мезенхімальних клітин, локально диференційованих у хрящ. Виникає на II-IV десятиліттях життя зазвичай у кістках тулуба, стегновій кістці або в м’яких тканинах. Рентгенологічно це літичне агресивне ураження з вогнищевими кальцифікаціями. Лікуванням вибору є резекція із широкими полями. ХТ і ПТ показали обнадійливі результати, і сучасна тенденція полягає в лікуванні мезенхімальних ХС за протоколами, що використовуються для саркоми Юїнга [17, 60, 61].
Трабектедин може бути варіантом лікування мезенхімальної ХС [V, C] [85].
(Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up, 2021).
Коментар робочої групи. Станом на 01.02.2023 в Україні лікарський засіб трабектедин не зареєстрований.
Дедиференційована хондросаркома (ДХС) (центральна або периферична)
Нехрящова саркома високого ступеня злоякісності, яка походить від ХС (центральної або периферичної) або енхондроми. Приблизно 15% центральних і 5% периферичних хондросарком містять ділянки дедиференціації. Характерна для віку, дещо старшого, ніж «класичні» хондросаркоми (50-80 років), виникає в 95% випадків у стегновій кістці, тазу, проксимальному відділі плечової кістки та лопатці. Часто пацієнти вже давно мають типові симптоми ХС – біль, що раптово і швидко посилюється, інтенсивний набряк м’яких частин й іноді патологічний перелом при центральному варанті. Рентгенологічно констатується двофазне ураження: типове зображення енхондроми або ХС низького ступеня, на якому розвивається літичне агресивне ураження [1-3, 62].
Лікування – хірургічне й обов’язково зразу агресивне: резекція з широкими полями, а в деяких випадках (особливо якщо є патологічний перелом) необхідно вдатися до ампутації [17, 62-67]. Алгоритм лікування різних підтипів ХС представлено у табл. 2.
|
Таблиця 2. Алгоритм лікування хондросаркоми |
||||
|
Підтип |
Первинне лікування |
Спостереження |
Рецидив |
Лікування рецидиву |
|
GI |
Внутрішньовогнищева резекція + місцевий ад’ювант, широка резекція* при резектабельності або ПТ, якщо нерезектабельна | Кожні 6 міс протягом5 років, 1 раз на рік – до 10 років (РГ або ТГ/МРТ зони ураження і КТ грудної клітки) |
Локальний |
Широка резекція у разі резектабельностіКрай +: ПТКрай –: спостереженняПри нерезектабельності: ПТ |
|
GII-III або ПХС, СХС |
Широка резекція* при резектабельності. ПТ, якщо нерезектабельна | Кожні 3 міс протягом 3 років, кожні 6 міс протягом 5 років та 1 разна рік – до 10 років (РГ або ТГ/МРТ зони ураження і КТ грудної клітки – 1 раз на рік до 10 років |
Локальний |
Широка резекція у разі резектабельностіКрай +: ПТКрай –: спостереженняПри нерезектабельності: ПТ |
|
|
|
|
Метастази |
Хірургічне видалення |
|
Дедиференційована ХС: широка резекція*, ХТ за протоколом остеосаркоми. |
||||
|
Мезенхімальна ХС: широка резекція*, ХТ за протоколом саркоми Юїнга. |
||||
|
* Широка резекція має гарантувати краї, вільні від пухлини, враховуючи можливість ампутації кінцівки. |
||||
ХТ при ДХС має обмежену користь, причому відповіді спостерігаються у пацієнтів, які отримують комбіновану терапію на основі антрациклінів. Повідомлялося про активність гемцитабіну та доцетакселу [84]. Дані про пазопаніб детально наведено в додатковій таблиці S2, доступній на https://doi.org/10.1016/j. annonc.2021.08.1995.86. Є попередні дані про активність імунотерапії та інгібіторів мутантного IDH1 (івосиденібу). Перспективні випробування тривають. (Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up, 2021)
Коментар робочої групи. Станом на 01.02.2023 в Україні лікарський засіб івосиденіб не зареєстрований.
Рекомендації
Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up, 2021)
- Атипові хрящові пухлини можна лікувати за допомогою кюретажу з місцевим додатковим впливом фенолу, рідкого азоту кісткового цементу (або без такого [IV, B].
- Хондросаркоми високого ступеня і всі хондросаркоми таза або осьового скелета підлягають хірургічному висіченню із широкими полями (IV, B).
- ПТ можна розглядати при неоперабельному захворюванні (первинному або рецидивуючому), після неповної операції та при полегшенні симптомів (IV, B).
- У даний час високі дози ПT рекомендовані при хондросаркомах основи черепа (III, B).
- Локалізовані МХС зазвичай лікують неоад’ювантним/ад’ювантним ХТ, що поєднує антрациклін та алкілуючі агенти (IV, C).
- Неоад’ювантний/ад’ювантний ХТ також можна розглядати для локалізованої ДХС (V, C).
Xордома
У грудні 2013 року, на запрошення д-рів Казалі та Стаккіотті, 40 експертів з хордоми, які представляють різні дисципліни з обох боків Атлантики, зібралися в Мілані на конференції Європейського товариства медичної онкології, щоб розпочати ці амбітні зусилля з кодифікації найефективніших, заснованих на доказах методів лікування хордоми. Фінансування цієї зустрічі надав Chordoma Foundation.
«Хордома – дуже рідкісна пухлина, але за останні 10 років було досягнуто значного прогресу в розумінні біології цього захворювання і, як наслідок, були представлені нові терапевтичні можливості, – зазначив Стаккіотті. – Проте це захворювання залишається складним для лікування й потребує мультидисциплінарного підходу із скоординованим залученням кількох спеціалістів. Ми бачимо велику непослідовність у тому, як лікують пацієнтів із хордомою, що призводить до неоптимальних результатів для багатьох пацієнтів. Тому було очевидно, що потрібен глобальний консенсус щодо лікування цієї пухлини».
Учасники зустрічі погодилися з необхідністю використання міждисциплінарного підходу до хордоми та створення міжнародної спільноти експертів і пацієнтів, щоб ділитися своїми різноманітними точками зору. Протягом 2014 року група розробила та відредагувала рекомендації щодо лікування й підготувала їх для публікації в одному із провідних у світі рецензованих медичних журналів. Настанова «Побудова глобального консенсусного підходу до хордоми: позиція спільноти лікарів і пацієнтів» опублікована у журналі The Lancet Oncology (2015).
Клінічні рекомендації пропонують безпрецедентний рівень деталізації для хордоми, звертаючись до таких факторів, як:
- розташування пухлини (основа черепа, хребет або крижі);
- момент часу (щойно діагностований, рецидивний тощо);
- методи лікування (хірургія, променева та системна терапія).
«До цього часу медичні експерти ніколи не досягали єдиної думки щодо того, як слід лікувати хордому, – сказав виконавчий директор Chordoma Foundation Джош Соммер, який представив точку зору пацієнта та був співавтором статті. – Це важливе досягнення, оскільки воно дасть можливість пацієнтам і сім’ям у всьому світі приймати мудрі рішення щодо лікування, а також надасть лікарям дорожню карту для найбільш ефективного догляду за пацієнтами із хордомою».
Публікація цих рекомендацій щодо лікування знаменує собою значний крок вперед у зусиллях Chordoma Foundation покращити життя пацієнтів шляхом співпраці з медичною спільнотою для поліпшення діагностики та лікування цього рідкісного виду раку. Стаккіотті зазначив, що ця стаття – лише початок: «Потрібно зробити ще більше для вирішення відкритих питань, особливо щодо рецидивів захворювань і для покращення рівня доказів, що підтверджують кожну рекомендацію. Ми сподіваємося, що найближчим часом ми зможемо знову зустрітися, щоб досягнути консенсусу щодо цих додаткових тем».
Щоб отримати доступ до консенсусного документа, який опубліковано у The Lancet Oncology, надішліть електронного листа на support@chordoma.org. Оскільки ця стаття була написана для аудиторії лікарів, Фонд планує перевести звіт в освітній формат, більш придатний для непрофесійної аудиторії.
Bone sarcomas: ESMO-PaedCan-EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up, 2021.
Загальні відомості
Хордома виникає із стійких нотохордальних елементів у хребті (крижова кістка – 50%, рухливий хребет – 20%), в основі черепа – 30%. Позаскелетні випадки вкрай рідкісні. Середній вік діагностування становить 60 років, але ознаки ураження хордомою основи черепа характерні для більш молодої популяції, включаючи дітей та підлітків. Більш ніж у 40% пацієнтів із хордомою розвиваються метастази, як правило, наприкінці природного анамнезу і переважно після локального рецидиву (ЛР).
Звичайна хордома відзначається ядерною експресією Brachyury (білка, що кодується геном Т, ембріональний транскрипційний фактор), і цей показник рекомендований для її діагностичної оцінки (V, B) [4]. Дедиференційовані хордоми становлять <5% випадків і проявляються більш агресивно, ніж звичайні. При високозлоякісному дедиференційованому компоненті часто спостерігається втрата експресії Brachyury. Погано диференційована хордома є високозлоякісним, надзвичайно рідкісним підтипом, який зазвичай вражає дітей та підлітків, відзначається експресією Brachyury та втратою INI1 експресії (зазвичай пов’язаним із делеціями у SMARCB1) [4]. Хордому слід диференціювати від доброякісних пухлин нотохорди, доброякісних уражень із специфічними рентгенологічними ознаками, які вважаються попередниками хордоми. Якщо рентгенологічний вигляд характерний для доброякісних нотохордальних пухлин, біопсія не рекомендована, за умови що ураження не змінюється в динаміці. Для хордоми рекомендована передопераційна товстоголкова або трепан-біопсія, а біопсійний канал має бути включений у хірургічну резекцію. Для хордоми основи черепа передопераційна біопсія не рекомендована, якщо або пухлини неможливо досягти легко й безпечно, або існує високий ризик висівання пухлинних клітин (V, C) [87]. Початкова стадія має включати зображення первинної ділянки, МРТ осьового відділу хребта, КТ грудної, черевної порожнин та таза.
Лікування
Резекція еn bloc (R0) є рекомендованим лікуванням первинного локалізованого захворювання, якщо це можливо й наслідки прийнятні для пацієнта (IV, B).
Для крижової хордоми операцію слід запропонувати як перший вибір у разі уражень, що виникають на рівні 4-го крижового хребця і нижче. Хірургічне втручання завжди слід обговорювати в контексті інших альтернатив у пацієнтів із пухлинами, що виникають вище 3-го крижового хребця (спинномозкового нерва), враховуючи неврологічні наслідки, пов’язані із хірургічною резекцією (IV, B).
Для хордом основи черепа та верхнього відділу шийного тракту резекція R0 (із негативними краями) може бути виконана дуже рідко, тому резекція R1 (мікроскопічно позитивні краї) має бути метою операції (V, B). Ад’ювантну ПT завжди слід розглядати при хордомах основи черепа та шийного відділу хребта, а також при крижовій хордомі та хордомі рухомої частини хребта із краями резекції R1.
Якщо резекція en bloc R0 неможлива, пацієнт неоперабельний або хірургічні наслідки неприйнятні для пацієнта, альтернативою є ПT (без видалення) (V, C). Через відносну радіаційну стійкість хордом необхідні високі дози (не менше 74 Гр). Терапія важкими частинками дозволяє підвищувати дозу з покращенням локального контролю та виживаності, і її слід розглядати як лікування вибору (II, B) [88, 89]. Фотонне опромінення може бути запропоноване, коли оптимальна доза для вогнища ураження не буде критичною для органів ризику (V, B). ПТ можна проводити після операції або перед операцією з післяопераційним посиленням.
При ЛР хордоми показники виживаності надзвичайно низькі, а локальний контроль рідко досягається. У випадку ЛР лікування може включати хірургічне втручання, і/ або ПТ, і/або радіочастотну абляцію, і/або кріотерапію, і/або системне лікування (баланс між захворюваністю, якістю життя та очікуваним контролем за прогресуванням хвороби) [90].
Для олігометастатичного захворювання в окремих випадках можна розглянути хірургічне втручання, РЧА, кріотерапію або стереотаксичну ПT. ХТ неактивна і, як правило, не рекомендована (V, D). При звичайній хордомі є попередні дані про активність інгібіторів рецепторів епідермального фактора росту, і ці агенти зараз вивчаються у клінічних дослідженнях. Інгібітори EZH2 (Enhancer of zeste homolog 2) продемонстрували попередню активність у INI1-негативній, погано диференційованій хордомі.
Рекомедації
- Для підтвердження діагнозу настійно рекомендована оцінка ядерної експресії Brachyury у звичайній хордомі (V, B).
- Хірургічне втручання пропонується, якщо хордома виникає із S4 і нижче, або обговорюється в контексті інших альтернатив лікування при пухлинах, що виникають вище S3 [IV, B].
- Резекція R1 або R2 із додаванням високодозової ПT є методом вибору для лікування хордом основи черепа та верхніх відділів шийного тракту (V, B).
- Показаннями для остаточної ПТ є захворювання, при яких резекція R0 або R1 не може бути досягнута за висновком експертного центру (неоперабельні пацієнти та пацієнти, які відмовляються від резекції із причин неврологічних післяопераційних порушень) (III, B).
- У разі рецидиву лікування включає хірургічне втручання, і/або ПT, і/або системну (таргетну) терапію (III, B).
Гігантоклітинна пухлина кістки
Загальні відомості
Локальний рецидив при гігантоклітинній пухлині кістки (ГКП) зустрічається із частотою до 50% випадків, при цьому поширення на м’які тканини є найбільш впливовим прогностичним фактором. До 5% ГКП метастазують у легені, часто зберігаючи класичну морфологію, тоді як трансформація у злоякісне новоутворення високого ступеня може відбуватися в 1-3% пацієнтів. Первинна злоякісна ГКП зустрічається надзвичайно рідко.
Як звичайні, так і злоякісні ГКП відзначаються мутацією в гені H3F3A, виявлення якої може допомогти в диференціальній діагностиці, особливо з остеосаркомою, збагаченою гігантськими клітинами [91]. Демонстрація ядерної експресії мутантного білка G34W H3F3A за допомогою імуногістохімії забезпечує оптимальну діагностику.
Коментар робочої групи. ГКП не відноситься до злоякісних новоутворень кісток, але має агресивний місцевий перебіг. Робоча група рекомендує класифікувати ГКП за радіологічними крітеріями, запропонованими Campanachi.
Рентгенологічне стадіювання ГКП за Campanachi:
Стадія 1 – Межа між пухлиною та здоровою кісткою має чіткі межі. Кортикальний шар не уражений.
Стадія 2 – Поширене літичне вогнище. Кортикальний шар стоншений, можливе його здуття без порушення цілісності.
Стадія 3 – Вогнище без чітких меж із розривом кортикального шару та формуванням м’якотканинного компоненту.
Лікування
Варіанти лікування включають внутрішньовогнищевий кюретаж із допоміжною терапією або без неї та висічення en bloc (IV, A), що є балансуванням між ризиком ЛР та довгостроковим функціональним результатом. Вони були оцінені в кількох проспективних дослідженнях [92, 93].
Деносумаб – людське моноклональне антитіло до активатора рецептора ядерного фактора каппа B (RANK)-ліганду (RANK-L), який, як відомо, надмірно експресується у ГКП, є стандартним лікуванням при неоперабельних або метастатичних ГКП (III, A) [93-95]. Його використання у передопераційних умовах у випадках, які потенційно піддаються резекції з високою вірогідністю, обговорюється і має бути зарезервовано для складних випадків (II, C) [96]. Існує все більше доказів того, що якщо деносумаб використовується перед операцією (вискоблювання – кюретаж), то хірургічне втручання найкраще проводити через кілька місяців після першого введення, хоча найбільш прийнятна тривалість передопераційного лікування ще не встановлена (V, C) [93, 94]. Оптимальний графік та тривалість лікування деносумабом у метастатичних або хірургічно невиліковних ГКП також не визначено, а можливі довгострокові побічні ефекти досі здебільшого невідомі. Попередні дані свідчать про те, що переривання терапії деносумабом може супроводжуватися прогресуванням захворювання. Необхідно контролювати потенційні побічні ефекти: остеонекроз щелепи та атипові переломи. Остеонекроз щелепи є нечастим, але тяжким й обмежуючим лікування побічним ефектом деносумабу. Можна розглянути можливість повторного лікування деносумабом у пацієнтів із прогресуючою ГКП після ліквідації цього ускладнення (IV, C) [97]. Системне лікування метастатичної ГКП, рефрактерного до деносумабу, має відповідати протоколу остеосаркоми.
Рекомендації
- Варіанти лікування ГКП включають висічення en bloc (IV, A) та внутрішньовогнищевий кюретаж із ад’ювантною терапією або без неї у ретельно відібраних випадках (IV, C).
- Деносумаб є стандартним методом лікування неоперабельної або метастатичної ГКП (III, A).
- Використання деносумабу в передопераційних умовах при ГКП, які потенційно можуть бути резектабельними з високою вірогідністю, обговорюється і має бути індивідуалізованим та зарезервованим для складних випадків після міждисциплінарного обговорення (II, C).
Веретеноподібні/плеоморфні саркоми кістки високого ступеня злоякісності
Лікування
Стратегія лікування та спостереження веретеноподібної/плеоморфної саркоми кістки високого ступеня злоякісності (ПС) імітує таку остеосаркоми, із ХТ і повною резекцією en bloc, включаючи будь-який компонент м’яких тканин (IV, B) [98, 99].
ПT можна розглядати при неоперабельних ураженнях.
Спостереження
Подальше спостереження за первинними пухлинами кісток високого ступеня злоякісності має включати фізичне обстеження, зображення поперечного зрізу та звичайну рентгенограму (МРТ або КТ) первинної ділянки разом із рентгенографією/КТ грудної клітки. Суворі рекомендації не можуть бути надані за відсутності будь-яких офіційних перспективних досліджень й у контексті розбіжності думок в експертній групі. Рекомендована політика подальшого спостереження може включати оцінку після завершення ХТ, приблизно кожні 2-3 міс протягом перших 2 років, кожні 6 міс протягом 3-5 років, кожні 6-12 міс для 5-10 років і потім кожні 0,5-1-2 роки відповідно до місцевої практики та інших факторів. КТ грудної клітки, якщо вона використовується замість рентгенографії грудної клітки, слід проводити за допомогою низьких доз радіаційних методів, особливо у пацієнтів молодого віку.
У разі пухлин кісток низького ступеня злоякісності частота повторних відвідувань може бути нижчою (наприклад, протягом 6 міс у перші 2 роки, потім – щорічно). Пізні метастази, а також ЛР та функціональні порушення можуть виникати через 10 років після встановлення діагнозу, і не існує загальновизнаної точки зупинки спостереження за пухлиною.
Важливо оцінити довгострокові токсичні ефекти ХТ, хірургічного втручання та ПТ для вилікуваних пацієнтів, враховуючи частоту пізніх ускладнень, особливо у тих, яких лікують як дітей, підлітків та молодих дорослих, залежно від протоколу, і подальше спостереження має здійснюватися в поєднанні із клінікою виживаності, якщо вона доступна.
Вторинний рак може виникати у тих осіб, які пов’язані з опроміненням або незалежно від нього. Вторинний лейкоз, особливо гострий мієлоїдний, рідко може спостерігатися після ХТ уже через 2-5 років після лікування. Пацієнти із синдромами схильності до раку потребують спеціалізованого диспансерного спостереження разом із генетичною експертизою.
Рекомендації
- Подальше спостереження за ППК високого ступеня злоякісності може включати фізикальне обстеження, візуалізацію первинної ділянки (МРТ або КТ) разом із рентгенографією/КТ грудної клітки (IV, B).
- Наступне спостереження, що рекомендоване, може передбачати інтервали приблизно кожні 3 міс протягом перших 2 років; кожні 6 міс – протягом 3-5 років; кожні 6-12 міс – протягом 5-10 років, а потім кожні 0,5-1-2 роки (V, B).
- При ППК низького ступеня злоякісності (місцевоагресивних доброякісних пухлин) частота повторних відвідувань може бути нижчою (наприклад, 6 міс протягом 2 років, потім – щорічно) (V, B).
- Слід оцінювати довгострокові токсичні ефекти ХТ, хірургічного втручання та ПТ, а також продовжувати моніторинг віддалених ефектів протягом більш ніж 10 років після лікування, залежно від протоколу (V, B).
Література
Bone sarcomas: ESMO-EURACAN-GENTURIS-ERN PaedCan Clinical Practice Guideline for diagnosis, treatment and follow-up2021
- Gatta G., Capocaccia R., Botta L. et al. Burden and centralised treatment in Europe of rare tumours: results of RARECAREnet-a population-based study. Lancet Oncol. 2017;18(8):1022-1039.
- De Pinieux G., Karanian M., Le Loarer F. et al. Nationwide incidence of sarcomas and connective tissue tumors of intermediate malignancy over four years using an expert pathology review network. PLoS One. 2021;16(2): e0246958.
- Fuchs B., Pritchard D.J. Etiology of osteosarcoma. Clin Orthop Relat Res. 2002;397:40-52.
- WHO Classification of Tumours Editorial Board. Soft Tissue and Bone Tumours. 5th ed. Lyon: IARC Publications; 2020.
- Diaz-Perez J.A., Nielsen G.P., Antonescu C. et al. EWSR1/FUS-NFATc2 rearranged round cell sarcoma: clinicopathological series of 4 cases and literature review. Hum Pathol. 2019;90:45-53.
- Antonescu C.R., Owosho A.A., Zhang L. et al. Sarcomas with CICrearrangements are a distinct pathologic entity with aggressive outcome: a clinicopathologic and molecular study of 115 cases. Am J Surg Pathol. 2017;41(7):941-949.
- Kao Y.C., Owosho A.A., Sung Y.S. et al. BCOR-CCNB3 fusion positive sarcomas: a clinicopathologic and molecular analysis of 36 cases with comparison to morphologic spectrum and clinical behavior of other round cell sarcomas. Am J Surg Pathol. 2018;42(5):604-615.
- Kao Y.C., Sung Y.S., Zhang L. et al. Recurrent BCOR internal tandem duplication and YWHAE-NUTM2B fusions in soft tissue undifferentiated round cell sarcoma of infancy: overlapping genetic features with clear cell sarcoma of kidney. Am J Surg Pathol. 2016;40(8):1009-1020.
- Gronchi A., Miah A.B., Dei Tos A.P. et al. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021;32(11):1348-1365.
- Frezza AM, Botta L, Trama A, et al. Chordoma: update on disease, epidemiology, biology and medical therapies. Curr Opin Oncol. 2019;31(2):114-120.
- Sbaraglia M., Righi A., Gambarotti M. et al. Soft tissue tumors rarely presenting primary in bone; diagnostic pitfalls. Surg Pathol Clin. 2017;10(3):705-730.
- Blay J.Y., Soibinet P., Penel N. et al. Improved survival using specialized multidisciplinary board in sarcoma patients. Ann Oncol. 2017;28(11): 2852-2859.
- Bovee J.A.F., Baumhoer D., Bloem J.L. et al. Primary tumour in bone histopathology reporting guide biopsy specimens. International Collaboration on Cancer Reporting; Sydney, Australia. 2021. Available at http://www.iccr-cancer.org/datasets/published-datasets/soft-tissuebone. Accessed September 14, 2021.
- Picci P., Bacci G., Campanacci M. et al. Histologic evaluation of necrosis in osteosarcoma induced by chemotherapy. Regional mapping of viable and nonviable tumor. Cancer. 1985;56(7):1515-1521.
- Albergo J.I., Gaston C.L., Laitinen M. et al. Ewing’s sarcoma: only patients with 100% of necrosis after chemotherapy should be classified as having a good response. Bone Joint J. 2016;98-B(8):1138-1144.
- Akerman M. Tumour necrosis and prognosis in Ewing’s sarcoma. Acta Orthop Scand Suppl. 1997;273:130-132.
- Righi A., Pacheco M., Palmerini E. et al. Histological response to neoadjuvant chemotherapy in localized Ewing sarcoma of the bone: a retrospective analysis of available scoring tools. Eur J Surg Oncol. 2021;47(7):1778-1783.
- Enneking W.F., Spanier S.S., Goodman M.A. A system for the surgical staging of musculoskeletal sarcoma. Clin Orthop Relat Res. 1980;153:106-120.
- American Joint Committee on Cancer. AJCC Cancer Staging Manual. 8th ed. New York: American Joint Committee on Cancer; 2017.
- Brierley J.D., Gospodarowicz M.K., Wittekind C., eds. TNM Classification of Malignant Tumours. 8th ed. Oxford: John Wiley & Sons; 2016.
- Ruengwanichayakun P., Gambarotti M., Frisoni T. et al. Parosteal osteosarcoma: a monocentric retrospective analysis of 195 patients. Hum Pathol. 2019;91:11-18.
- Duhamel L.A., Ye H., Halai D. et al. Frequency of Mouse Double Minute 2 (MDM2) and Mouse Double Minute 4 (MDM4) amplification in parosteal and conventional osteosarcoma subtypes. Histopathology. 2012;60(2):357-359.
- Smeland S., Bielack S.S., Whelan J. et al. Survival and prognosis with osteosarcoma: outcomes in more than 2000 patients in the EURAMOS‑1 (European and American Osteosarcoma Study) cohort. Eur J Cancer. 2019;109:36-50.
- Marina N.M., Smeland S., Bielack S.S. et al. Comparison of MAPIE versus MAP in patients with a poor response to preoperative chemotherapy for newly diagnosed high-grade osteosarcoma (EURAMOS‑1): an open-label, international, randomised controlled trial. Lancet Oncol. 2016;17(10):1396-1408.
- Whelan J.S., Bielack S.S., Marina N. et al. EURAMOS‑1, an international randomised study for osteosarcoma: results from pre-randomisation treatment. Ann Oncol. 2015;26(2):407-414.
- Ferrari S., Smeland S., Mercuri M. et al. Neoadjuvant chemotherapy with high-dose Ifosfamide, high-dose methotrexate, cisplatin, and doxorubicin for patients with localized osteosarcoma of the extremity: a joint study by the Italian and Scandinavian Sarcoma Groups. J Clin Oncol. 2005;23(34):8845-8852.
- Bajpai J., Chandrasekharan A., Talreja V. et al. Outcomes in non-metastatic treatment naive extremity osteosarcoma patients treated with a novel non-high dosemethotrexate-based, dose-dense combination chemotherapy regimen ‘OGS‑12’. Eur J Cancer. 2017;85:49-58.
- Piperno-Neumann S., Ray-Coquard I., Occean B.V. et al. Results of APIAI based regimen in osteosarcoma adult patients included in the French OS2006/Sarcome‑09 study. Int J Cancer. 2020;146(2):413-423.
- Ferrari S., Bielack S.S., Smeland S. et al. EURO-B.O.S.S.: a European study on chemotherapy in bone-sarcoma patients aged over 40: outcome in primary high-grade osteosarcoma. Tumori. 2018;104(1): 30-36.
- Bielack S.S., Smeland S., Whelan J.S. et al. Methotrexate, doxorubicin, and cisplatin (MAP) plus maintenance pegylated interferon Alfa‑2b versus MAP alone in patients with resectable high-grade osteosarcoma and good histologic response to preoperative MAP: first results of the EURAMOS‑1 good response randomized controlled trial. J Clin Oncol. 2015;33(20):2279-2287.
....
66. Grimer R.J., Gosheger G., Taminiau A. et al. Dedifferentiated chondrosarcoma: prognostic factors and outcome from a European group. Eur J Cancer 2007;43:2060-5.
67. Staals E.L., Bacchini P,. Mercuri M. et al. Dedifferentiated chondrosarcomas arising in preexisting osteochondromas. J Bone Joint Surg Am 2007;89:987-93.
Текст скорочено й адаптовано до формату Медичної газети «Здоров’я України».
Повна версія документа: https://www.dec.gov.ua/wp-content/uploads/2023/04/2023_kn_hondrosarkoma.pdf.