28 грудня, 2023
Рак шлунка
Стандарт медичної допомоги
Рак шлунка (РШ) – поширене агресивне злоякісне новоутворення, яке характеризується швидким інвазивним ростом, пізньою маніфестацією клінічних проявів і високою схильністю до рецидивів. Лікарі загальної практики – сімейної медицини, лікарі інших спеціальностей мають бути обізнані щодо основних факторів ризику та початкових клінічних проявів РШ з метою його раннього виявлення та направлення пацієнта до закладу охорони здоров’я (ЗОЗ), що надає відповідні послуги. Пацієнти з РШ мають бути впевнені, що усі спеціалісти охорони здоров’я, які беруть участь у їх лікуванні, комунікують і взаємодіють між собою і з ними.
Розділ І. Організація надання медичної допомоги
Положення стандарту медичної допомоги. Медична допомога пацієнтам із РШ надається у ЗОЗ або їхніх підрозділах, що забезпечують спеціалізованою медичною допомогою пацієнтів з онкологічними захворюваннями.
Медична допомога пацієнтам з РШ потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою (МДК) фахівців, яка спеціалізується на злоякісних новоутвореннях шлунка. Лікарі різних спеціальностей мають бути обізнані щодо основних факторів ризику та клінічних проявів онкологічних захворювань з метою їх раннього виявлення та направлення пацієнта до ЗОЗ, що надає спеціалізовану медичну допомогу пацієнтам з онкологічними захворюваннями.
Обґрунтування. Рання діагностика та невідкладний початок лікування пацієнтів з РШ сприяє запобіганню інвалідизації та передчасної смерті.
Ефективні системи комунікації, які відповідають конкретним потребам окремих осіб, є найважливішими для забезпечення своєчасної діагностики, направлення та лікування пацієнтів.
Відсутні доказові дані щодо специфічної профілактики РШ.
Управління терапевтичним процесом МДК вважається найкращою практикою лікування, а також невід’ємною складовою скоординованої допомоги пацієнтам з онкологічними захворюваннями.
Критерії якості медичної допомоги
Обов’язкові
- Наявні локально узгоджені письмові документи, що координують та інтегрують спеціалізовану медичну допомогу, для забезпечення своєчасного направлення, діагностики та лікування пацієнтів з РШ.
- Існує задокументований індивідуальний план лікування, узгоджений з пацієнтом і доступний МДК, що містить інформацію про діагноз пацієнта, лікування та подальше його ведення відповідно до цього стандарту. Всі результати досліджень, консультувань, рекомендації, висновки тощо належним чином фіксуються у медичній документації.
- Пацієнти і (за згодою) члени сім'ї/особи, які здійснюють догляд, забезпечуються у доступній формі інформацією щодо їхнього стану, плану лікування і подальшого спостереження, навчання навичкам, необхідним для поліпшення результатів медичної допомоги, контактами для отримання додаткової інформації та консультації.
- До складу МДК мають бути включені фахівці: онколог, хірург-онколог, лікар з променевої терапії, лікар з ультразвукової діагностики, радіолог, рентгенолог, патологоанатом, лаборант.
- МДК переглядає план лікування пацієнта з РШ після завершення певного етапу лікування або, за необхідності, зміни тактики лікування.
Бажані
За необхідності до складу МДК можуть бути залучені психолог, дієтолог, фахівці з паліативної допомоги та інші.
Розділ ІІ. Діагностика РШ
Положення стандарту медичної допомоги. Діагноз РШ встановлюється у ЗОЗ, що надає допомогу пацієнтам з онкологічними захворюваннями, на підставі клінічних, рентгенологічних (обов’язкове виконання комп’ютерної томографії), ендоскопічних і хірургічних даних з обов’язковим гістологічним висновком за матеріалами морфологічного дослідження біоптату пухлинного утворення.
Діагноз також може бути уточнений шляхом проведення біопсії вторинних метастатичних вогнищ та цитологічного дослідження змивів з очеревини. За результатами проведених обстежень з метою визначення стратегії лікування та вибору методу(-ів) терапії пухлинний процес стадіюють за класифікацією TNM 8-ї редакції (2018 р.).
Пацієнтам, яким встановлено діагноз РШ, можуть призначатись додаткові дослідження з метою уточнення деяких аспектів лікування, проведення передопераційної підготовки пацієнта та визначення прогнозу захворювання.
Обґрунтування. Клінічна картина РШ на ранніх стадіях часто є безсимптомною. Захворювання переважно діагностується на пізніх стадіях, нерідко – випадково під час ендоскопічного або рентгенологічного обстеження.
Диференціальна діагностика може включати такі патологічні стани, як лімфома шлунка, нейроендокринна пухлина шлунка або гастроінтестинальна стромальна пухлина, а також доброякісні пухлини та непухлинні захворювання шлунка.
У разі раннього РШ необхідне проведення ендоскопічного ультразвукового дослідження (Ендо-УЗД) з метою остаточного стадіювання, оскільки отримані дані впливають на передопераційне лікування пацієнта з РШ.
Діагностика РШ передбачає проведення ендоскопічного дослідження, що супроводжується біопсією з патогістологічним висновком, і це дозволяє підтвердити діагноз та встановити ступінь диференціації пухлини для визначення прогностичних факторів і прийняття терапевтичних рішень.
Комп’ютерна томографія (КТ) є основним методом візуалізації та діагностики поширення хвороби. КТ не є діагностичним методом для встановлення карциноматозу.
Магнітно-резонансна томографія (МРТ) проводиться у разі підозри на локальне поширення пухлини або віддалені метастатичні вогнища.
Діагностична лапароскопія проводиться з метою виключення канцероматозу, визначення перитонеального канцер-індексу та взяття матеріалу з черевної порожнини для цитологічного та гістологічного дослідження, а також визначення місцевого поширення пухлини, її резектабельності, наявності віддалених метастазів. На відміну від КТ є референтним методом діагностики перитонеального карциноматозу. Бажані відео- та фотофіксація з метою реконсультації дослідження.
Критерії якості медичної допомоги
Обов’язкові
- Діагностичні заходи для встановлення діагнозу РШ включають збір анамнезу, фізикальне обстеження з метою виявлення клінічних ознак, що дозволяють запідозрити наявність злоякісного новоутворення, інструментальні та лабораторні дослідження (клінічний аналіз крові, біохімічний аналіз крові та коагулограма).
- Діагностична та передопераційна візуалізація РШ здійснюється за допомогою ендоскопічного дослідження з біопсією.
- Діагностична та передопераційна візуалізація РШ здійснюється за допомогою КТ органів грудної, черевної порожнин та малого таза з внутрішньовенним контрастуванням, зі збереженням матеріалу на зовнішніх носіях.
- Для морфологічної діагностики РШ проводиться аналіз зразків тканин належної якості, отриманих шляхом біопсії, в акредитованій патогістологічній лабораторії.
- Діагностична лапароскопія перед початком лікування пацієнтів з РШ, які є кандидатами на радикальне лікування, має проводитися з метою стадіювання процесу та визначення резектабельності пухлини.
- Необхідно провести цитологічну або гістологічну верифікацію вторинних метастатичних вогнищ.
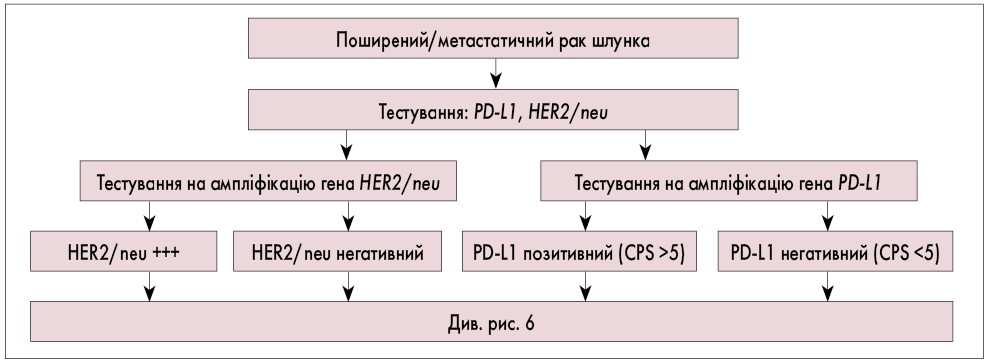
- Для пацієнтів з місцево-поширеним/метастатичним нерезектабельним РШ обов’язкове виконання імуногістохімічного (ІГХ) дослідження з метою виявлення ампліфікації гена HER2/neu.
- Для місцево-поширеного та метастатичного РШ проводиться ІГХ-дослідження для оцінки виявлення експресії PD-L1 та ферментів репарації помилок комплементарності ДНК (MMR) або мікросателітної нестабільності (MSI).
Бажані
- За клінічними показаннями діагностична та передопераційна візуалізація РШ здійснюється за допомогою МРТ.
- За клінічними показаннями діагностична та передопераційна візуалізація РШ здійснюється за допомогою позитронно-емісійної томографії (ПЕТ).
- Для пацієнтів віком <37 років показане тестування на інактивуючу мутацію гена CDH1; у разі позитивного результату показане тестування родичів пацієнта. При виявлені рекомендоване хірургічне лікування в об’ємі гастректомії.
- Діагностична візуалізація з метою остаточного стадіювання РШ на ранній стадії здійснюється за допомогою Ендо-УЗД.
- Особам, у яких виявлено солітарні доброякісні новоутворення шлунка, рекомендоване їх ендоскопічне видалення з метою запобігання малігнізації.
- Особам із множинними доброякісними новоутвореннями шлунка (поліпоз шлунка) рекомендоване хірургічне лікування в об’ємі, що адекватно відповідає об’єму ураження, з метою запобігання малігнізації новоутворень.
- Відео-, фотофіксація ендоскопічної діагностики або лікування, діагностичної лапароскопії або радикального хірургічного втручання.
Розділ ІІІ. Лікування РШ
Положення стандарту медичної допомоги. Спеціальне лікування РШ полягає у застосуванні хірургічних, хіміотерапевтичних та променевих методів у різних комбінаціях, в тому числі гіпертермічної внутрішньочеревної хіміотерапії (HIPEC), таргетної та імунотерапії, а також паліативного та симптоматичного лікування. Вибір стратегії лікування РШ визначає МДК після оцінки таких факторів: диференціація пухлини, стадія захворювання, розташування пухлини, сукупність прогностичних факторів, резекційність перитонеальних метастазів (з метою досягнення повної циторедукції), вік і загальний стан пацієнта, його фізична та психологічна готовність до хірургічного лікування.
Обґрунтування. Основні прогностичні фактори РШ визначаються гістологічними даними (при аденокарциномі високого ступеня диференціації (high grade, G1) прогноз кращий, ніж при аденокарциномі низького ступеня диференціації (low-grade, G2-G3) та дискогезивній карциномі), а також наявністю ураження лімфатичних вузлів. При цьому комбіноване лікування (поліхіміотерапія у комбінації з хірургічним лікуванням) забезпечує найдовшу виживаність для пацієнтів з РШ.
Критерії якості медичної допомоги
Обов’язкові
- МДК за результатами діагностичних досліджень визначає індивідуальний план лікування пацієнта, який згодом може коригуватися залежно від клінічної ситуації; всі висновки документуються належним чином.
- Члени МДК забезпечують дотримання плану лікування відповідно до фаху: лікар-ендоскопіст визначає локальний рівень поширення процесу та, за потреби, виконує повторну біопсію новоутворення; лікар з променевої терапії визначає рівень поширення процесу та виключає наявність вогнищ вторинного ураження; лікар-онколог встановлює необхідність і визначає схему проведення передопераційної поліхіміотерапії; лікар-хірург-онколог встановлює необхідність проведення та об’єм хірургічного лікування; лікар-патологоанатом верифікує наявність злоякісного новоутворення за результатами біопсії первинного/вторинного вогнища, встановлює поширення процесу за результатами післяопераційного патоморфологічного дослідження; лікар з променевої терапії визначає необхідність проведення променевої терапії на доопераційному та післяопераційному етапах.
- Вибір стратегії та плану лікування здійснюється відповідно до алгоритмів, наведених на рисунках 1-9.
- Лімфодисекцію D2 слід виконувати планово у ЗОЗ, що надають медичну допомогу пацієнтам з онкологічними захворюваннями, мають відповідне матеріально-технічне та кадрове забезпечення, досвід проведення подібних хірургічних втручань.
- Матеріал для післяопераційного патогістологічного дослідження має містити дослідження щонайменше 16 лімфатичних вузлів.
- Субтотальна гастректомія може бути виконана у разі можливості досягнути макроскопічного проксимального краю резекції ≥3 см. Для низькодиференційованих (G3, дискогезивних) новоутворень і новоутворень з дифузно-інфільтруючим типом росту необхідний макроскопічний проксимальний край резекції ≥5 см з обов’язковим виконанням мінімального об’єму лімфодисекції D1.
- При резектабельній пухлині та наявності пухлинного стенозу пацієнту показане хірургічне лікування з метою відновлення проходження їжі в об’ємі стентування або накладання обхідного гастроентероанастомозу з подальшою неоад’ювантною терапією. Перевага надається стентуванню або гастроентеростомії, при неможливості виконання – єюностомії.
- При нерезектабельній пухлині та наявності пухлинного стенозу пацієнту показане хірургічне лікування з метою відновлення проходження їжі в об’ємі стентування або накладання обхідного гастроентероанастомозу з подальшою паліативною терапією; перевага надається стентуванню або гастроентеростомії, при неможливості виконання – єюностомії.
- Для проведення трьохкомпонентної хіміотерапії необхідна імплантація підшкірної центральної венозної порт-системи.
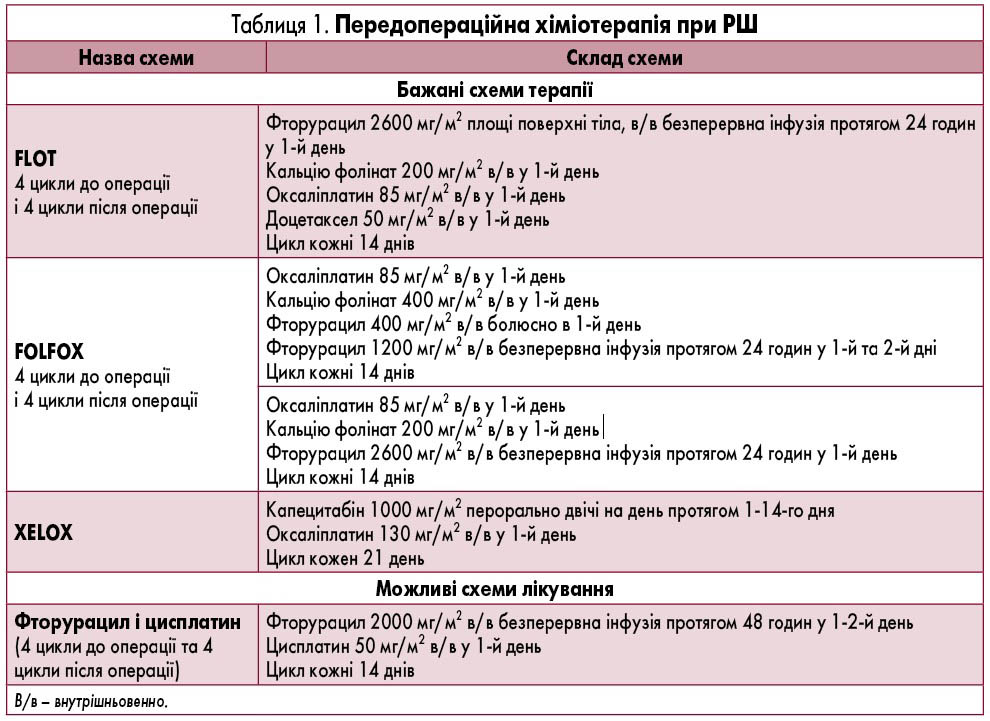
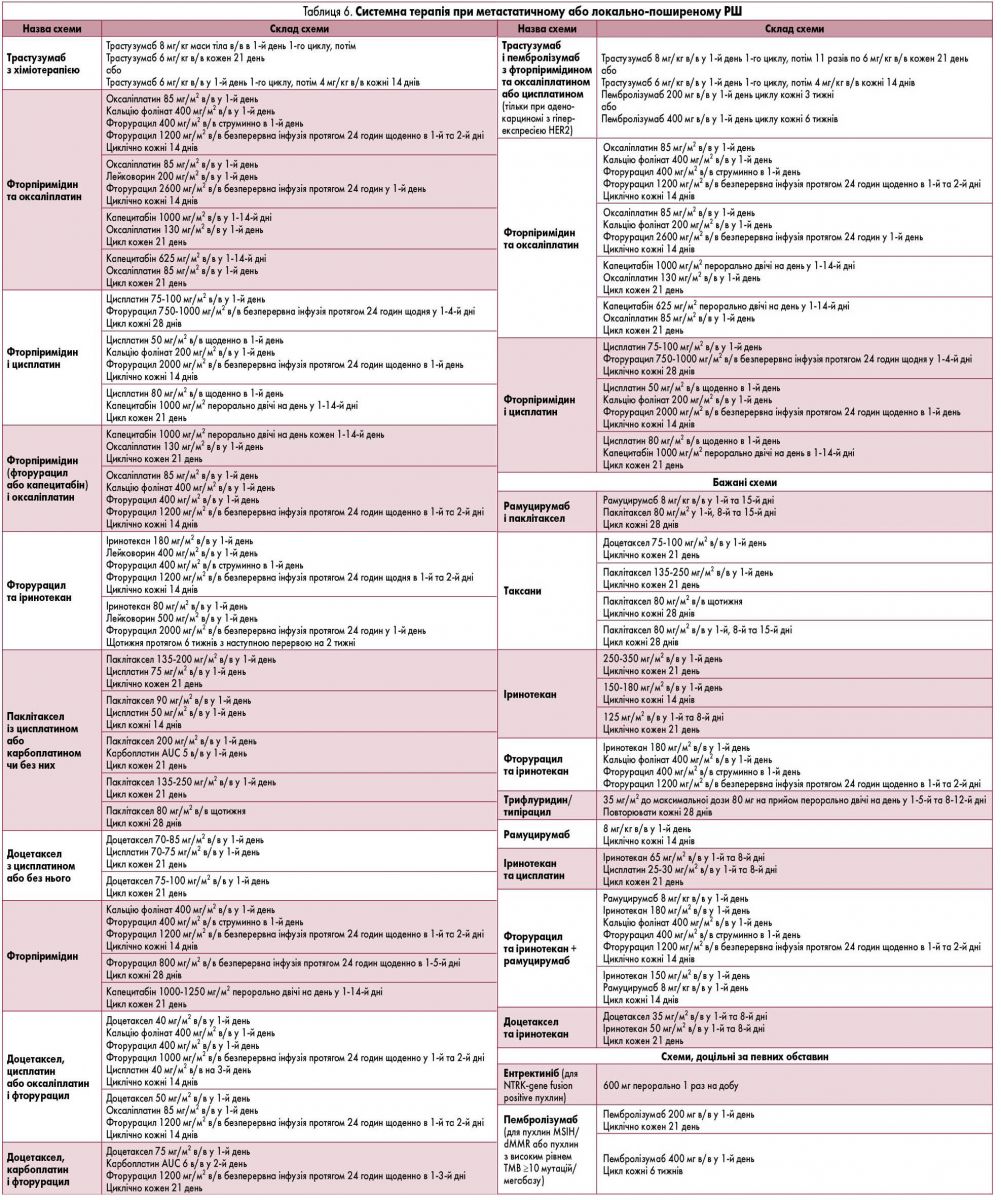
- Для пацієнтів з місцево-поширеним/метастатичним РШ, що потенційно здатні отримувати трьохкомпонентні схеми хіміотерапії з низьким ризиком ускладнень і летальності, асоційованої з хіміопрепаратами, призначається перша лінія паліативної хіміотерапії за схемою FLOT. Склад і режими хіміотерапії наведені у таблицях 1-6.
- Лікування пацієнтів з місцево-поширеним/метастатичним нерезектабельним РШ у першій лінії здійснюється за двокомпонентною схемою з трастузумабом при наявності ампліфікації гена HER2/neu.
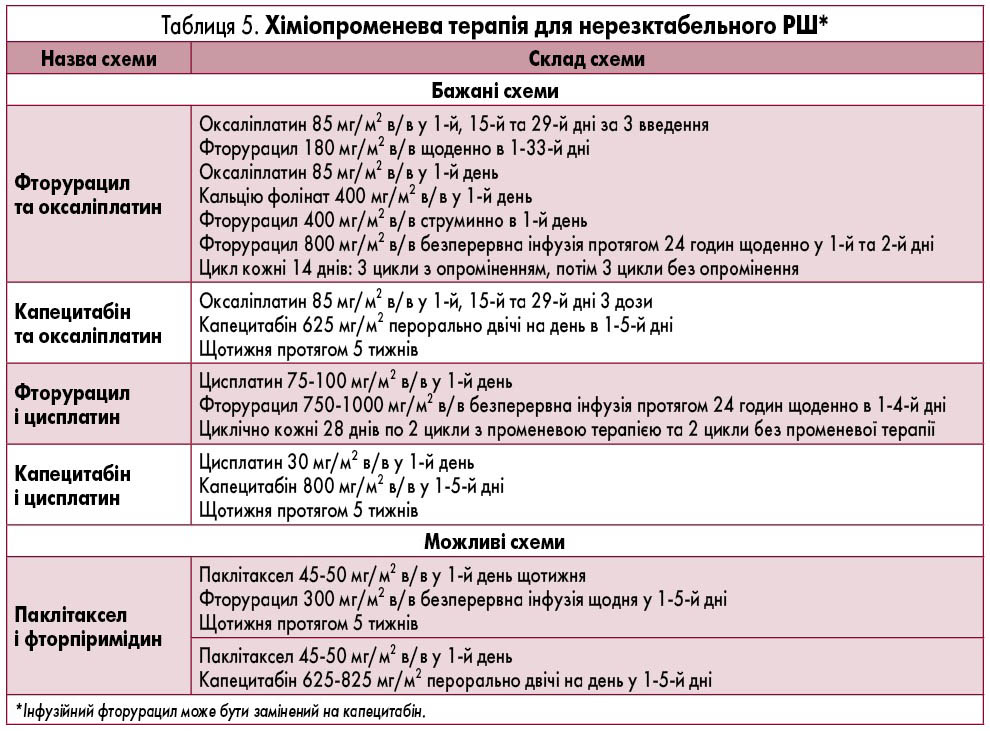
- Для пацієнтів з поширеним/метастатичним РШ після проходження другої лінії хіміотерапії за рішенням МДК призначається третя лінія паліативної хіміотерапії залежно від способу прийому препаратів: якщо можлива пероральна терапія – трифлуридин/типірацил, якщо пероральна терапія неможлива – таксани або іринотекан.
- Якщо загальний статус пацієнта відповідає ≥3 балам за ECOG, пацієнту призначається симптоматична терапія, спрямована на лікування загрозливих для життя станів: ендоскопічна коагуляція при кровотечі, гастроентеростомія або стентування при обструкції, контроль больового синдрому та лікування емезису антиеметичними лікарськими засобами.
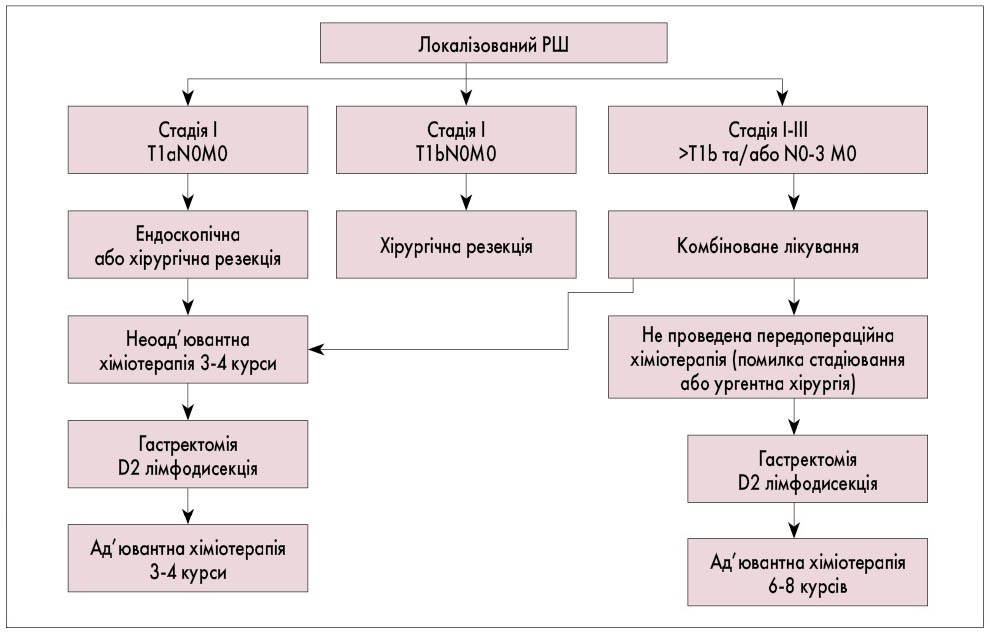 Рис. 1. Алгоритм лікування локалізованого та локально-поширеного РШ
Рис. 1. Алгоритм лікування локалізованого та локально-поширеного РШ
Примітка
- Ендоскопічна резекція показана, якщо є відповідність усім наведеним критеріям:
а) новоутворення обмежене слизовою оболонкою;
б) диференціація новоутворення відповідає ступеню high-grade (G1);
в) розмір новоутворення <2 см;
г) тип росту не відповідає виразковому або виразково-інфільтруючому.
2. Лімфодисекція для Т1 пухлин може бути обмежена до перигастральних лімфатичних вузлів і включати локальні N2 лімфатичні вузли (D1+ лімфодисекція з варіаціями груп лімфатичних вузлів залежно від локалізації новоутворення).
3. При задовільному статусі рекомендований вибір хіміотерапевтичної схеми, що включає фторпіримідин, препарати платини, кальцію фолінат і доцетаксел (FLOT). Рекомендована тривалість лікування: 4 курси перед- та післяопераційно з двотижневими перервами.
4. Якщо статус пацієнта >1 бала за ECOG або наявні тяжкі супутні захворювання, можлива зміна схеми хіміотерапії на XELOX або FOLFOX.
5. Субтотальна гастректомія може бути виконана, коли є можливість досягнути макроскопічного проксимального краю резекції ≥3 см. Для низькодиференційованих (G3, дискогезивних) новоутворень і новоутворень з дифузно-інфільтруючим типом росту необхідний макроскопічний проксимальний край резекції ≥5 см.
6. Для пацієнтів з пухлинами >T1b, які отримали хірургічне лікування без призначення неоад’ювантної хіміотерапії, показане проведення ад’ювантної хіміотерапії.
Рис. 2. Алгоритм тестування 1 при поширеному та метастатичному РШ
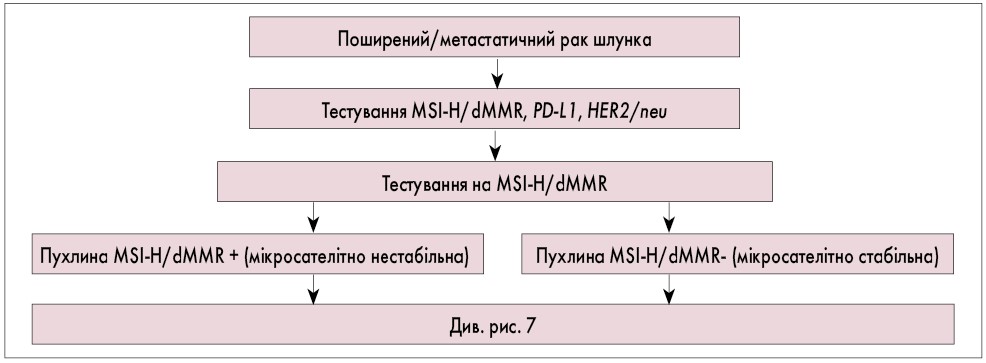 Рис. 3. Алгоритм тестування 2 при поширеному та метастатичному РШ
Рис. 3. Алгоритм тестування 2 при поширеному та метастатичному РШ
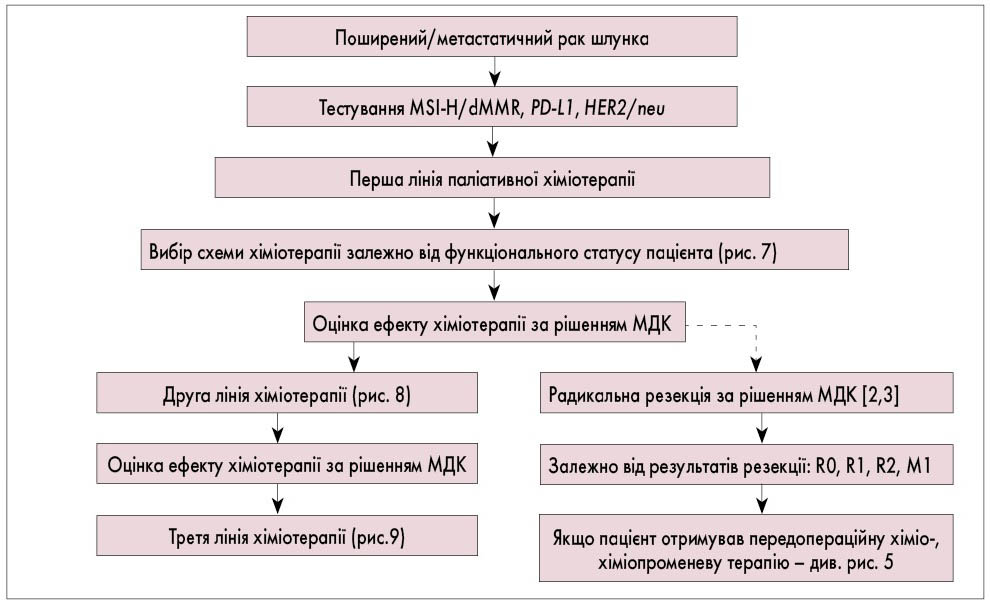 Рис. 4. Алгоритм вибору ХТ при поширеному та метастатичному РШ
Рис. 4. Алгоритм вибору ХТ при поширеному та метастатичному РШ
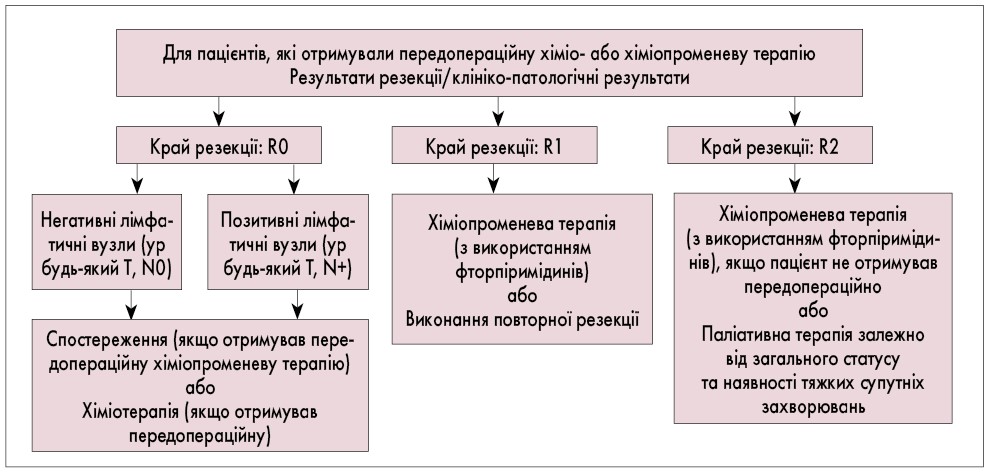 Рис. 5. Алгоритм ад'ювантної терапії 1 залежно від клініко-патологічних результатів
Рис. 5. Алгоритм ад'ювантної терапії 1 залежно від клініко-патологічних результатів
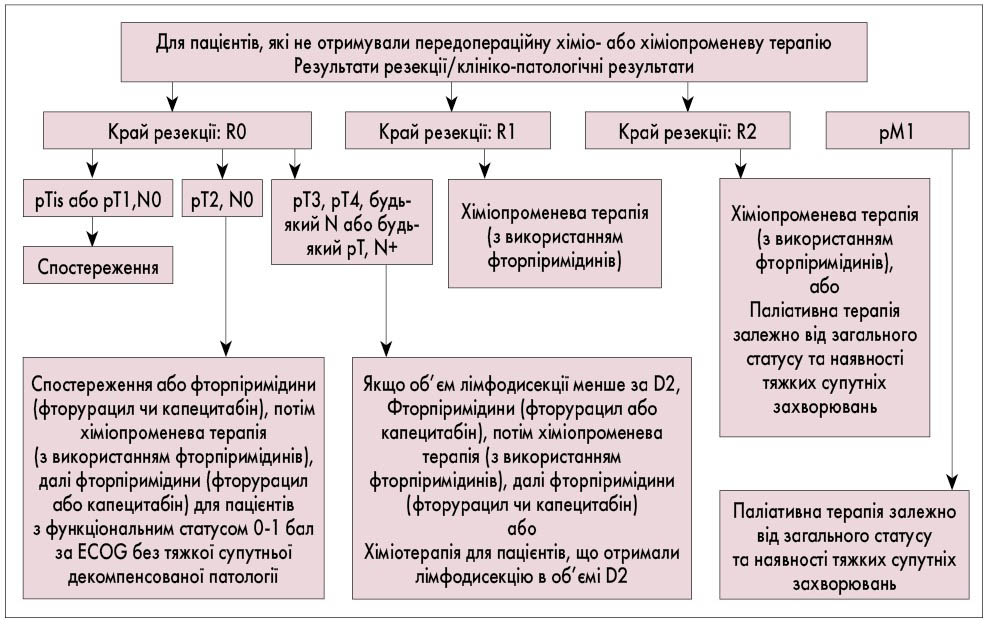 Рис. 6. Алгоритм ад’ювантної терапії 2 залежно від клініко-патологічних результатів
Рис. 6. Алгоритм ад’ювантної терапії 2 залежно від клініко-патологічних результатів
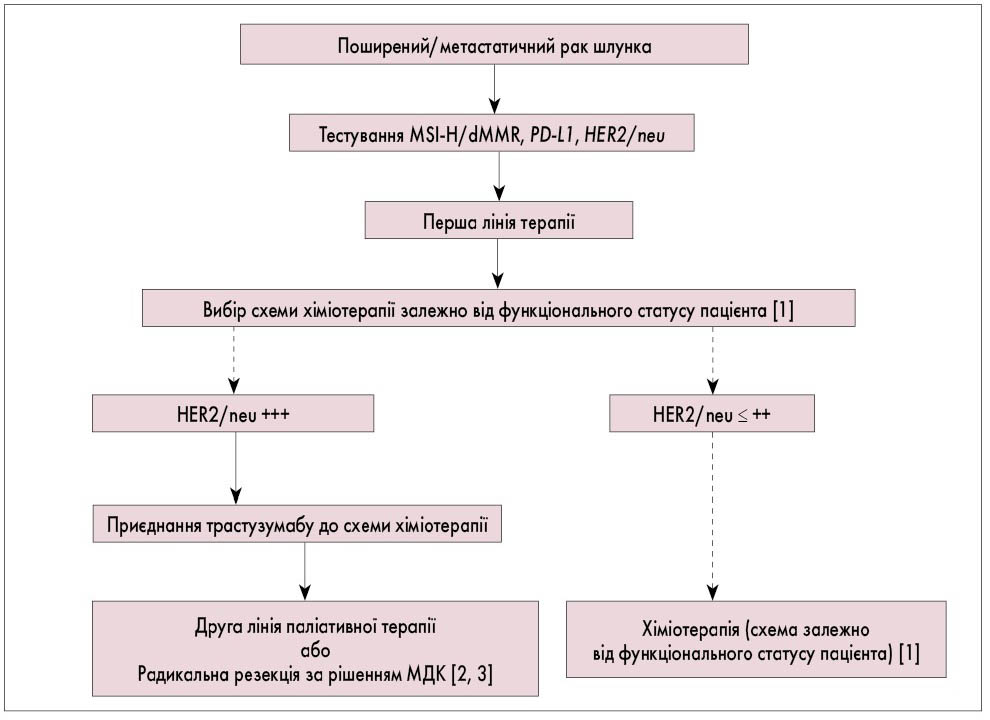 Рис. 7. Алгоритм першої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
Рис. 7. Алгоритм першої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
Примітка
- Залежно від функціонального статусу пацієнта за ECOG можуть бути призначені такі схеми хіміотерапії:
- 0 балів за ECOG: FLOT – у пацієнтів, які потенційно здатні отримувати трьохкомпонентні схеми хіміотерапії з низьким ризиком ускладнень і летальності, асоційованої з хіміопрепаратами;
- 1-2 бали за ECOG: двокомпонентні схеми хіміотерапії;
- ≥3 балів за ECOG – пацієнту призначається найкраща підтримуюча терапія (best supportive care) або таргетна терапія.
2. Оперативне втручання при метастатичному раку шлунка може бути виконане за життєвими показаннями: кровотеча, перфорація.
3. Радикальне лікування, що передбачає резекцію вогнищ вторинного ураження, може бути виконано у разі олігометастатичного захворювання за рішенням МДК у ЗОЗ, що надають спеціалізовану медичну допомогу пацієнтам з онкологічними захворюваннями.
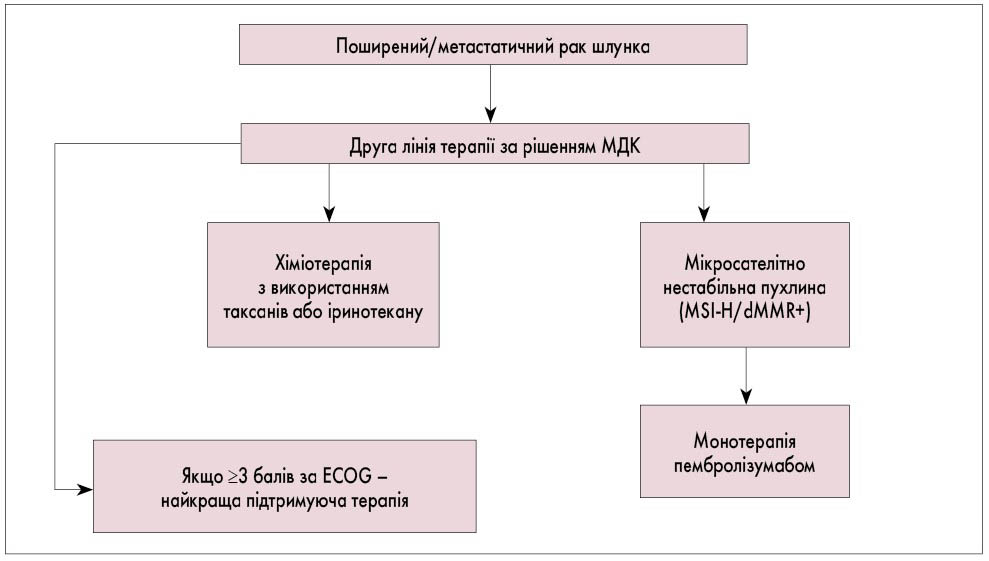 Рис. 8. Алгоритм другої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
Рис. 8. Алгоритм другої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
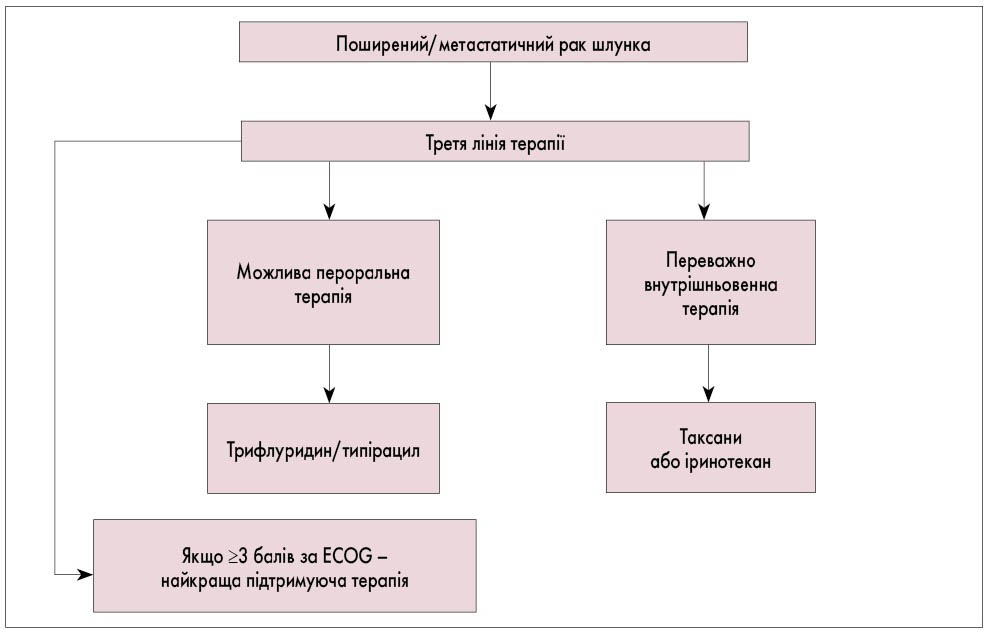 Рис. 9. Алгоритм третьої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
Рис. 9. Алгоритм третьої лінії паліативної хіміотерапії при поширеному та метастатичному РШ
Бажані
- Ендоскопічна або хірургічна резекція без передопераційної хіміотерапії може бути проведена фахівцем, який має відповідний досвід і кваліфікацію.
- Для пацієнтів з T4b бажане проведення мультивісцеральних резекцій за рішенням МДК.
- У пацієнтів, які не отримали лімфодисекцію D2 в повному об’ємі, необхідна консультація у ЗОЗ, що надають медичну допомогу пацієнтам з онкологічними захворюваннями, із висновком МДК щодо подальшої тактики лікування.
- Пацієнтам, які за оцінкою функціонального статусу та з наявністю тяжкої декомпенсованої патології не можуть отримувати триплетну хіміотерапію, рекомендоване використання комбінацій фторпіримідинів з цисплатином або оксаліплатином.
- При пухлинах І-ІІ стадії бажаним методом хірургічного втручання є лапароскопічний.
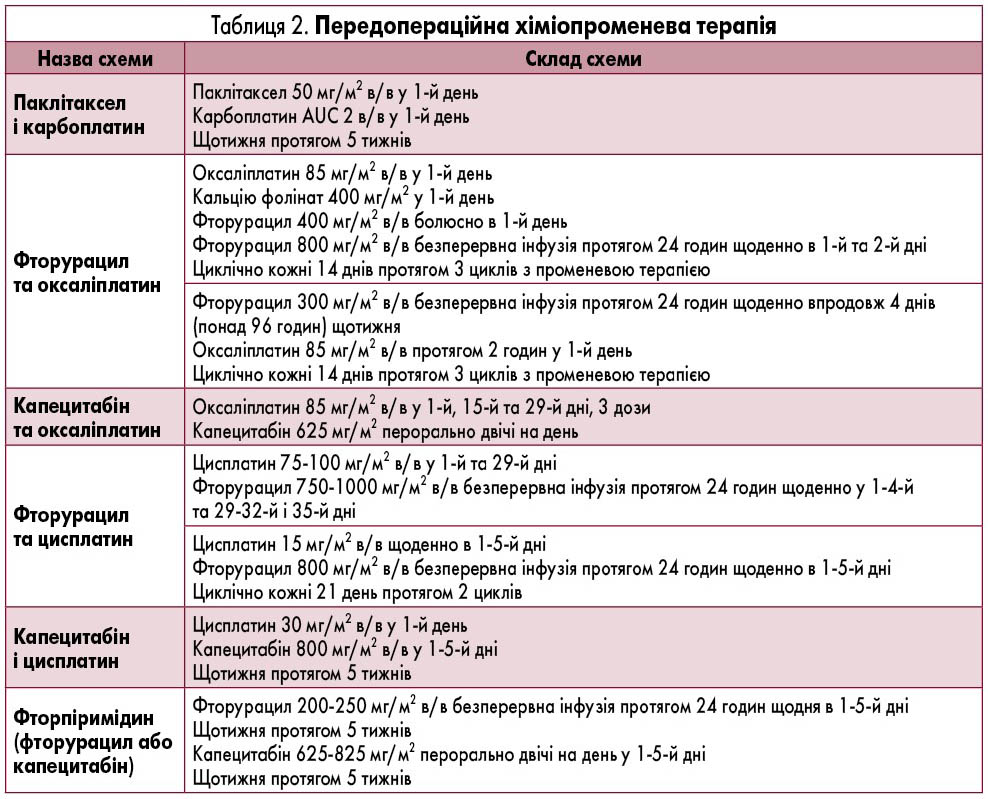
- Пацієнтам, яким обрана променева терапія як неоад’ювантна схема лікування, сумарна вогнищева доза становить 50,4 Гр, разова доза – 1,8 Гр (загалом 25-28 сеансів).
- Для пацієнтів з результатом резекції R1 ад’ювантна хіміотерапія або променева терапія може бути призначена індивідуально, за рішенням МДК.
- Пацієнтам з поширеним/метастатичним нерезектабельним РШ, у яких за результатами дослідження виявлено MSI/dMMR-, може бути призначена монотерапія пембролізумабом як друга лінія паліативного лікування.
Перша лінія хіміотерапії
Особливості вибору схеми ХТ: оксаліплатину зазвичай надають перевагу над цисплатином через меншу токсичність.
Бажані cхеми:
1) позитивна аденокарцинома з гіперекспресією HER2:
- фторпіримідини (фторурацил або капецитабін), оксаліплатин і трастузумаб;
- фторпіримідини (фторурацил або капецитабін), цисплатин і трастузумаб;
2) гіперекспресія HER2 негативна:
- фторпіримідини (фторурацил або капецитабін) і оксаліплатин;
- фторпіримідини (фторурацил або капецитабін) і цисплатин.
Інші рекомендовані схеми:
- позитивна аденокарцинома з гіперекспресією HER2:
- фторпіримідини (фторурацил або капецитабін), цисплатин, трастузумаб і пембролізумаб;
- фторпіримідин (фторурацил або капецитабін), оксаліплатин, трастузумаб і пембролізумаб;
- фторурацил та іринотекан;
- паклітаксел з цисплатином або карбоплатином чи без них;
- доцетаксел з цисплатином або без нього;
- фторпіримідини (фторурацил або капецитабін);
- доцетаксел, цисплатин або оксаліплатин і фторурацил;
- доцетаксел, карбоплатин і фторурацил.
Розділ IV. Подальше спостереження
Положення стандарту медичної допомоги. Через високий ризик виникнення рецидиву та/або іншої пухлини пацієнти з РШ після спеціального лікування мають перебувати під спостереженням лікаря загальної практики – сімейного лікаря з плановими оглядами в ЗОЗ, що надає спеціалізовану медичну допомогу пацієнтам з онкологічними захворюваннями. Лікар загальної практики – сімейний лікар веде необхідну медичну документацію та сприяє виконанню пацієнтом рекомендацій фахівців, у тому числі виконанню плану спостереження.
Обґрунтування. Цілями програми подальшого спостереження після лікування пацієнтів є виявлення потенційно резекційних рецидивів і безперервна оцінка наслідків, пов’язаних із раннім і тривалим лікуванням.
За досвідом провідних центрів, які спеціалізуються на лікуванні РШ, режим подальшого спостереження може включати фізикальний огляд, (мультиспіральну) КТ органів грудної клітки, черевної порожнини, малого таза, ендоскопію, загальний аналіз крові, біохімічний аналіз крові, коагулограму, визначення рівня заліза, вітаміну В12 та фолієвої кислоти в сироватці крові, загальний аналіз сечі.
Критерії якості медичної допомоги
Обов’язкові
- Пацієнти з РШ після проведення спеціального лікування перебувають під спостереженням у лікаря загальної практики – сімейного лікаря та онколога впродовж 5 років.
- Пацієнтами з РШ після проведення комбінованого радикального лікування планове обстеження здійснюється через кожні 3-4 місяці протягом першого року, потім кожні 6 місяців впродовж 3 років, а далі 1 раз на рік.
- План спостереження пацієнтів з РШ після проведення комбінованого радикального лікування включає:
- опитування та фізикальний огляд;
- КТ грудної клітки/черевної порожнини/таза з в/в контрастуванням;
- загальний аналіз крові; визначення сироваткового рівня заліза;
- визначення рівня вітаміну В12 у сироватці крові;
- визначення рівня фолієвої кислоти у сироватці крові.
Індикатори якості медичної допомоги
- Наявність у ЗОЗ, що надає спеціалізовану медичну допомогу, клінічного маршруту пацієнта з РШ.
- Частка пацієнтів, для яких отримано інформацію щодо медичного стану впродовж звітного періоду.
- Частка випадків РШ, виявлених упродовж звітного періоду, для яких діагноз підтверджено морфологічно.
- Виживаність пацієнтів з РШ.
Паспорти індикаторів якості медичної допомоги
Наявність у ЗОЗ, що надає спеціалізовану медичну допомогу, клінічного маршруту пацієнта з РШ.
Зв’язок індикатора із затвердженими настановами, стандартами та протоколами медичної допомоги. Індикатор ґрунтується на положеннях Стандарту медичної допомоги «Рак шлунка». Дані надсилаються лікарями, які надають первинну медичну допомогу на території обслуговування, до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій. Дані подаються лікарями-онкологами до онкологічного закладу, розташованого на території обслуговування.
Виживаність пацієнтів з раком шлунка. Показник відносної виживаності має розраховуватися за допомогою уніфікованого програмного забезпечення Національним канцер-реєстром України, в якому реалізована відповідна методологія. Доцільне обчислення показника 1-, 2-, 3-, 4-, 5-річної відносної виживаності залежно від статі та стадії захворювання.
Неприпустимі прямі порівняння показника відносної виживаності з аналогічними показниками, обчисленими за іншою методологією (1-річна летальність; частка хворих, які не прожили року з моменту встановлення діагнозу; частка хворих, що перебувають на онкологічному обліку 5 років і більше, тощо). На валідність показника відносної виживаності впливає повнота даних щодо життєвого стану пацієнтів, які перебувають на онкологічному обліку. У разі значної (більше 5%) кількості випадків, цензурованих через відсутність достовірної інформації про життєвий стан хворих, можлива систематична помилка при порівняннях.
Міжрегіональні порівняння показника відносної виживаності мають проводитися з урахуванням статистичної похибки. Слід зважати на загалом недостатню кількість пацієнтів для проведення щорічних міжрегіональних порівнянь.
Дані відносної виживаності пацієнтів з РШ, встановлені в 2016-2020 роках, наведені в Бюлетені Національного канцер-реєстру України № 23 «Рак в Україні, 2020-2021. Захворюваність, смертність, показники діяльності онкологічної служби» (інтернет-посилання на сайті Національного канцер-реєстру).
Цільовий (бажаний) рівень значення індикатора на етапі запровадження стандарту медичної допомоги не визначається для запобігання викривленню реальної ситуації внаслідок адміністративного тиску.
Дата оновлення стандарту – 2028 рік.
Текст подається у скороченні.
Текст адаптовано та уніфіковано відповідно до стандартів Тематичного випуску Медичної газети «Здоров’я України».
Повний текст за посиланням: https://www.dec.gov.ua/wp-content/uploads/2023/12/smd_rsh_2052_05122023.pdf.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (70) 2023 р.