2 травня, 2024
Призначення та ефективність вітаміну D при ендокринних захворюваннях: автоімунна патологія щитоподібної залози (хвороба Грейвса і Хашимото), цукровий діабет та ожиріння
Нещодавні дослідження показали, що прогноз за різних поширених захворювань, ендокринних, автоімунних розладів і навіть прогресування раку пов’язані з концентрацією вітаміну D у плазмі. Завдяки експресії гена 1α-гідроксилази (CYP27B1) клітини імунної системи (В-, Т- та антигенпрезентувальні клітини) здатні продукувати активний метаболіт кальциферол – речовину з імуномодулювальними властивостями. Рецептори до вітаміну D (vitamin D receptor, VDR) експресують на поверхні імунних клітин. Доведено зв’язок між поліморфізмом генів VDR або CYP27B1 і патогенезом автоімунних ендокринних захворювань. Метою огляду є вивчення впливу вітаміну D, наслідків його дефіциту та корисної ролі добавок із ним при деяких ендокринних розладах, які часто спостерігають у клінічній практиці.
Вітамін D відіграє важливу роль у регуляції гомеостазу кальцію і фосфору та підтриманні стану кісток. Дослідження на тваринах і серед людей доводять, що вітамін D бере участь у патогенезі різних ендокринних розладів, таких, зокрема, як первинний гіперпаратиреоз, цукровий діабет (ЦД) 1 і 2 типів, автоімунний тиреоїдит, патологія надниркових залоз і синдром полікістозних яєчників. Високий інтерес до вітаміну D серед дослідників і клініцистів зумовлений численними публікаціями, які ілюструють плейотропні ефекти сполуки і високу поширеність його гіповітамінозу.
Вітамін D пригнічує синтез деяких прозапальних цитокінів, таких як інтерлейкін (IL)-1, IL‑6, IL‑8, IL‑12 і фактор некрозу пухлини-α (TNF-α). Завдяки зниженню експресії білків II класу головного комплексу гістосумісності, ко-стимулювальних елементів та IL‑12 адекватні рівні вітаміну D пригнічують диференціювання і дозрівання дендритних клітин. Інший аспект полягає у впливі вітаміну D на активність регуляторних Т-клітин, що призводить до зниження залежного від Т-клітин імунного ефекту при автоімунних захворюваннях.
Зокрема, у генетично сприйнятливих осіб Т- і В-клітини реагують на антигени щитоподібної залози (ЩЗ), що може спровокувати розвиток гіпертиреозу. Сироваткові рівні 1,25(OH)2-вітаміну D3 <20 нг/мл корелюють із підвищеним синтезом тиреоїдних автоантитіл, таких як антитіла до тиреопероксидази (АТПО) і тиреоглобуліну (АТТГ).
Вітамін D відіграє важливу роль у разі порушень обміну речовин. Є докази поліпшення метаболічного профілю осіб, які отримують добавки вітаміну D, особливо за рахунок позитивних змін ліпідних фракцій, зниження рівня глікованого гемоглобіну (HbA1c) разом зі значним зниженням індексу інсулінорезистентності (HOMA-IR) у хворих на ЦД 2 типу.
Механізм, за допомогою якого відбувається зниження метаболічного ризику, повністю не з’ясований. VDR і ферменти, що метаболізують вітамін D, були виявлені в різних типах клітин, у тому числі в β-клітинах підшлункової залози та інсуліночутливих ефекторах, таких як адипоцити. Вітамін D депонується в адипоцитах – клітинах, які є значущим джерелом адипокінів і цитокінів, що зумовлюють системне запалення. Добре відомий той факт, що ожиріння, особливо вісцеральне, є одним з основних чинників ризику ЦД 2 типу.
Вплив на здоров’я і добова потреба вітаміну D
Вітамін D впливає на транскрипцію деяких генів за допомогою геномних і негеномних механізмів. Ця дія опосередковується VDR, який є ядерним рецептором, що діє як ліганд-активований фактор транскрипції. Після утворення активної форми вітаміну D 1,25(OH)2-вітамін D3 зв’язується з VDR, утворюючи гетеродимерну молекулу шляхом взаємодії з ретиноїдним рецептором (RXR). Ця складна молекула далі переміщується до ядра. Там відбувається зв’язування цього комплексу з елементами, що реагують на вітамін D (vitamin D-responsive elements, VDRE) у промоторній ділянці генів. Ремоделюванню хроматину сприяють корегуляторні елементи, які спричинюють зміни епігенетичних гістонів, а також рекрутинг локальної РНК-полімерази II. Ці ефекти ґрунтуються на зв’язку між 1,25(OH)2-вітаміном D3-VDR-RXR і VDRE. Ці процеси впливають на експресію деяких генів, у тому числі тих, що відповідають за проліферацію та диференціювання клітин, імуномодулювальну відповідь та ангіогенез.
Негеномна дія вітаміну D полягає в активації значної кількості сигнальних молекул, які націлені на фактори транскрипції і залучають VDRE до активації генів, що реагують на вітамін D. Синтез вторинних месенджерів (таких як циклічний АМФ, Ca2+, жирні кислоти та 3-фосфоінозитид) також сприяє вищезазначеному процесу.
Рівень вітаміну D можна контролювати шляхом визначення концентрації його циркулюючого метаболіту 25(OH)-вітаміну D. Ця речовина відображає надходження вітаміну D з їжею та завдяки синтезу в шкірі, має тривалий період напіввиведення (10-19 днів), тому її можна використовувати як надійний діагностичний маркер. Можна вимірювати сироваткові концентрації 25(OH)-вітаміну D і 1,25(OH)2-вітаміну D3. Перший чітко відображає метаболічний статус вітаміну D, а останній не дає цінної інформації і його рівень часто може бути нормальним або підвищеним унаслідок вторинного гіперпаратиреозу, який виникає через дефіцит вітаміну D. Попередні рекомендації визначали дефіцит вітаміну D як концентрацію 25(OH)-вітаміну D у сироватці крові <50 нмоль/л (20 нг/мл). При недостатності ці значення становили 50-75 нмоль/л (20-30 нг/мл). Однак сьогодні безпечними з точки зору здоров’я кісток вважають рівні 50-125 нмоль/л (20-50 нг/мл). Критерії дефіциту та недостатності знизилися до значень <30 нмоль/л (12 нг/мл) і 30-50 нмоль/л (12-20 нг/мл) відповідно.
Профілактика дефіциту вітаміну D зазвичай досягається добовими дозами 600-800 МО, рекомендованими кількома товариствами дієтологів в Європі та США.
Роль і ефективність призначення вітаміну D при автоімунній патології ЩЗ
Значення вітаміну D при хворобі Хашимото
Гіпертиреоз є результатом взаємодії генетичної сприйнятливості і факторів довкілля, але точний його механізм залишається невідомим.
Це захворювання було пов’язане з появою папілярної карциноми ЩЗ і нейрозапалення, яке зумовлює емоційні зміни, незважаючи на нормальну функцію ЩЗ. Захворюваність на гіпертиреоз останнім часом зростає, а перебіг патології зазвичай безсимптомний. Лише на пізніх стадіях у пацієнтів можуть спостерігатися порушення функції ЩЗ, інші супутні захворювання та навіть злоякісні пухлини, що спричинює психологічний стрес і є значущим економічним тягарем.
Хвороба Хашимото (ХХ) – це автоімунне захворювання ЩЗ, яке гістологічно проявляється як хронічний лімфоцитарний тиреоїдит. Його етіологія невідома, а важливим патогенетичним механізмом є дисбаланс Th1/Th2, а також підвищена активність клітин Th1.
Імунна відповідь при ХХ може пригнічуватися вітаміном D, який у цьому випадку діє як імуносупресивний засіб.
Біологічні ефекти активного вітаміну D є наслідками дії важливих сигнальних молекул, активованих взаємодією між вітаміном D і рецепторами. 1,25(OH)2-вітамін D3 зв’язується з VDR на клітинах-мішенях, утворюючи гетеродимерну молекулу, що забезпечує білково-залежний транспорт.
Вітамін D є важливим елементом для дозрівання макрофагів, сприяє диференціації моноцитів у макрофаги, посилює фагоцитоз, хемотаксис і протипухлинну дію мононуклеарних макрофагів (рис. 1). Вітамін D може інгібувати експресію TLR2 і TLR4 (Toll-подібні рецептори, Toll-like receptors) на поверхні моноцитів, що передбачає пригнічення ідентифікації молекулярних структур, пов’язаних із патогеном. Унаслідок цього знижується імунна реакція та синтез прозапальних цитокінів, що запобігає надмірній імунній відповіді. Загальним результатом є зменшення ступеня запалення.
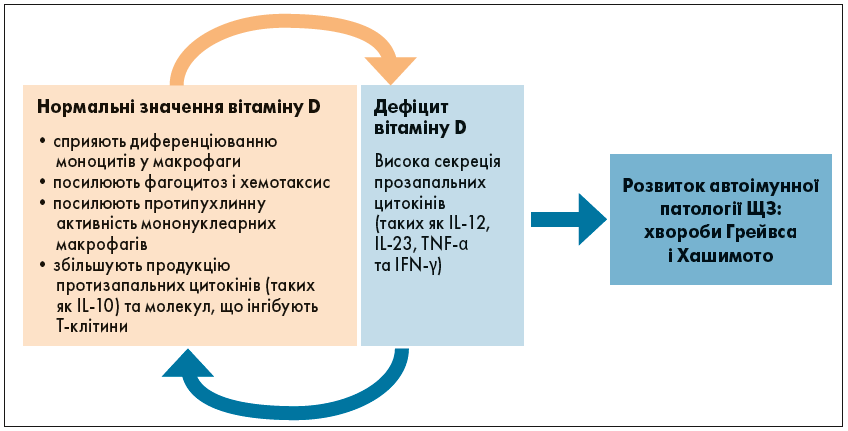 Рис. 1. Вплив вітаміну D на автоімунну патологію ЩЗ
Рис. 1. Вплив вітаміну D на автоімунну патологію ЩЗ
Вплив 1,25(OH)2-вітаміну D3 на дендритні клітини досліджували з різних аспектів. Один полягає в інгібуванні p38 мітоген-активованої протеїнкінази і ядерного фактора kB, що впливає на синтез інтерлейкінів у дендритних клітинах. Інший – у збільшенні кількості протизапальних цитокінів (таких як IL‑10) і молекул, що інгібують Т-клітини. Крім того, через зниження синтезу прозапальних цитокінів, таких як IL‑12, IL‑23, TNF-α та IFN-γ, порушується диференціювання Т-хелперних лімфоцитів.
У дослідженнях, де пацієнти з ХХ мали нижчі рівні вітаміну D порівняно з контрольною групою, у підгрупі еутиреозу після прийому вітаміну D значно знизилися титри антитиреоїдних антитіл. У тій самій підгрупі поліпшився рівень ліпопротеїнів високої щільності. Важливим є те, що дефіцит вітаміну D є поширеним явищем у пацієнтів із ХХ, отже, його лікування може бути корисним для сповільнення прогресування гіпотиреозу, а також зниження ризику серцево-судинних захворювань.
У дослідженні за участю пацієнтів з автоімунними та неавтоімунними захворюваннями ЩЗ та здорових людей дефіцит вітаміну D був більш значущим у пацієнтів з автоімунною патологією проти контрольної групи, і те саме було вірно при порівнянні пацієнтів із ХХ і без автоімунної патології. Низькі рівні вітаміну D також були пов’язані з виявленням антитиреоїдних антитіл і порушенням функції ЩЗ, що припускає участь вітаміну D у патогенезі автоімунної патології та підкреслює необхідність його призначення.
Є зворотний зв’язок між рівнями 25(OH)-вітаміну D у сироватці крові та синтезом АТПО у пацієнтів із гіпертиреозом і нормальною функцією ЩЗ. Пацієнти з дефіцитом вітаміну D мали значно вищі рівні АТПО, ніж пацієнти без дефіциту. У пацієнтів, які отримували вітамін D3 (1200-4000 МО/добу) протягом 4 міс, спостерігали значне зниження сироваткових рівнів АТПО.
Пацієнти з нещодавно діагностованим автоімунним захворюванням ЩЗ з найнижчим квартилем 25(OH)-вітаміну D мали найвищий рівень АТПО. Тримісячне спостереження показало суттєве зниження рівня АТПО у пацієнтів, які отримували добавки вітаміну D3 протягом 8 тиж (60 000 МО/тиж).
У дослідженні пацієнтів із ХХ було розділено на 2 групи. Одна група отримувала 50 000 МО вітаміну D щотижня впродовж 3 міс, інша – плацебо. У результаті в першій групі було виявлено суттєве зниження рівнів АТТГ і ТТГ після лікування, але без істотних відмінностей у рівнях АTПO між двома групами. Так само несуттєво змінилися рівні тиреоїдних гормонів. Таким чином, добавки вітаміну D були корисними для зниження активності захворювання.
У метааналізі, який охопив 25 досліджень (2695 хворих і 2263 учасники контрольних груп), було показано, що пацієнти з ХХ мали нижчі рівні 25(OH)-вітаміну D у сироватці крові порівняно з контролем. Крім того, в осіб із дефіцитом вітаміну D ризик ХХ був у 3,21 раза вищим як у дорослих, так і в дітей.
Нижчі рівні вітаміну D корелюють з автоімунними захворюваннями ЩЗ, ХХ і гіпотиреозом, що узагальнено на рисунку 2.
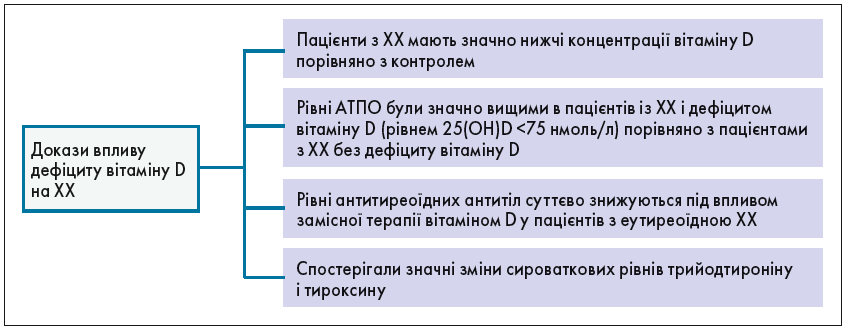 Рис. 2. Вплив дефіциту вітаміну D на хворобу Хашимото
Рис. 2. Вплив дефіциту вітаміну D на хворобу Хашимото
Значення дефіциту вітаміну D при хворобі Грейвса
Хвороба Грейвса (ХГ) є ще одним відносно частим автоімунним розладом ЩЗ, пов’язаним із синтезом антитіл до рецепторів ТТГ (АТрТТГ), що спричиняє гіпертиреоз. Його патогенезу сприяють численні генетичні та екологічні чинники, а нещодавно було показано, що певну роль відіграє і вітамін D, оскільки його концентрація в сироватці має тенденцію до зниження та пов’язана з об’ємом ЩЗ у пацієнтів із щойно виявленою ХГ.
Дані літератури виявили низку поліморфізмів, пов’язаних із геном вітаміну D, зокрема VDR і білок, що зв’язує вітамін D, і ці поліморфізми були пов’язані з ХГ.
Було продемонстровано, що в мишей BALB/c дефіцит вітаміну D модулює гіпертиреоз при ХГ через імунізацію рецептора до тиреотропіну. Він також інгібує CXCL10 у клітинах ЩЗ людини, хемокін Th1, який віді
рає вирішальну роль у патогенезі ХГ. Крім того, вітамін D пригнічує запальні реакції, залучені в етіологію ХГ і метаболічного синдрому.
У хворих на ХГ, які не перебувають у ремісії, сироваткова концентрація вітаміну D значно нижча порівняно з пацієнтами в ремісії.
У дорослих із ХГ та гіповітамінозом D виявлено тісний зв’язок між рівнем вітаміну D, об’ємом ЩЗ і ступенем екзофтальму. Додаткове до метимазолу призначення вітаміну D3 у дозі 200 000 МО щомісяця впродовж 3 міс сприяло зменшенню об’єму ЩЗ та зменшувало ступінь екзофтальму.
Хворі на ХГ були більш схильні до дефіциту вітаміну D порівняно з контролем. Таким чином, було доведено, що низький рівень вітаміну D підвищує ризик ХГ. Поширеність дефіциту вітаміну D при ХГ становить 65,4% порівняно з контрольною групою (32,4%). Була виявлена значуща кореляція між рівнями вітаміну D, рівнями кальцію і концентраціями паратиреоїдного гормону. Крім того, значною є кореляція між об’ємом ЩЗ і рівнями 25(OH)-вітаміну D, але цього не спостерігають для рівнів АТрТТГ і функції ЩЗ. Висновки цих досліджень подано на рисунку 3.
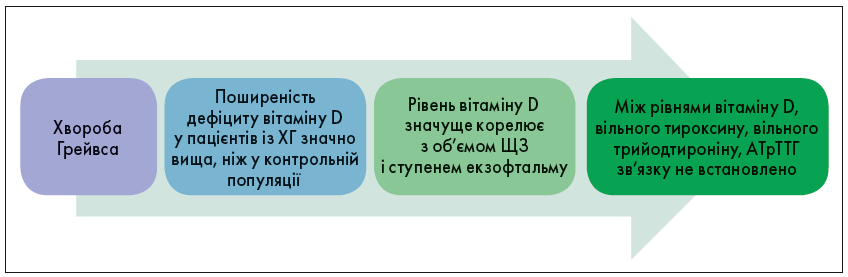 Рис. 3. Вплив дефіциту вітаміну D на хворобу Грейвса
Рис. 3. Вплив дефіциту вітаміну D на хворобу Грейвса
Дефіцит вітаміну D і вплив його призначення при ЦД 2 типу
1,25(OH)2-холекальциферол значною мірою впливає на секрецію інсуліну шляхом збільшення припливу кальцію до β-клітин підшлункової залози. Цей приплив іонів є останнім процесом у каскаді секреції інсуліну як відповідь на високий рівень цукру в крові. Кінцевим результатом є екзоцитоз інсуліну з везикул.
Вітамін D регулює дію інсуліну в тканинах як безпосередньо, за рахунок впливу на рецептори інсуліну, так і опосередковано, через стимуляцію рецепторів пероксисом. Вони діють як ядерні фактори транскрипції та відіграють важливу роль у контролі метаболізму жирних кислот як в адипоцитах, так і в міоцитах.
Хронічне запалення і порушення функції мітохондрій спричинює резистентність до інсуліну. Вітамін D знижує утворення прозапальних і стимулює синтез протизапальних цитокінів. Дефіцит вітаміну D зазвичай пов’язаний із прозапальними станами.
Вітамін D може підвищувати чутливість периферичних клітин до інсуліну за допомогою кількох механізмів. Очевидно, що 1,25(OH)2-вітамін D3 асоціюється з підвищеною чутливістю до інсуліну шляхом стимуляції експресії рецептора інсуліну після зв’язування з VDRE в промоторі гена рецептора інсуліну людини.
Іншим непрямим механізмом є регуляція гомеостазу кальцію. Він модулює внутрішньоклітинні шляхи в тканинах, що реагують на інсулін, і має дуже вузький діапазон оптимальної функції. Як наслідок, незначних змін рівня вітаміну D може бути достатньо для погіршення трансдукції сигналу інсуліну, що, своєю чергою, знижує активність транспортера глюкози.
Вітамін D, кальцитріол, діє як посередник у поліпшенні чутливості до інсуліну. Добавки вітаміну D значно поліпшують показник HOMA-IR. Прийом вітаміну D сприяє також поліпшенню показників HbA1c, резистентності до інсуліну порівняно зі значеннями, зареєстрованими в групі плацебо в пацієнтів із ЦД 2 типу. Це свідчить про те, що вітамін D може бути додатковою терапевтичною мішенню при ЦД.
Виявлено суттєве зниження ризику маніфестації ЦД 2 типу завдяки прийому вітаміну D, особливо в осіб без ожиріння, без такого ефекту в осіб з ожирінням. Прийом вітаміну D пов’язаний із поверненням предіабету до нормоглікемії, що було продемонстровано у 116 з 548 (21,2%) учасників групи втручання та в 75 із 532 (14,1%) – контрольної групи. Дослідники спостерігали значне зниження ризику виникнення ЦД 2 типу на тлі прийому добавок вітаміну D і часте повернення предіабету до нормоглікемії в осіб із предіабетом. Успіх профілактики ЦД 2 типу в пацієнтів з ожирінням може бути меншим.
Дефіцит вітаміну D при ожирінні та вплив його призначення на зниження ваги
Є припущення, що при дефіциті вітаміну D підвищується рівень паратгормону, який сприяє ліпогенезу внаслідок збільшення надходження кальцію в адипоцити. Інше пояснення передбачає пригнічення адипогенезу активною формою вітаміну D через VDR. У присутності активної форми вітаміну D VDR пригнічують диференціацію преадипоцитів унаслідок інгібування фактора транскрипції, що стимулює адипоцити.
Нижчі рівні вітаміну D можуть зумовити диференціювання преадипоцитів в адипоцити, що призводить до збільшення ваги й ожиріння. Було виявлено слабку, але статистично значущу зворотну кореляцію між рівнями вітаміну D та індексом маси тіла (ІМТ).
З іншого боку, ожиріння може призвести до зниження рівня вітаміну D, а не навпаки. Збільшення ІМТ на 1 кг/м2 було пов’язане зі зниженням рівня 25(OH)-вітаміну D на 1,15%.
Незважаючи на те що дефіцит вітаміну D є більш поширеним у пацієнтів із надмірною вагою та ожирінням, призначення різних схем вітаміну D не впливає на ІМТ.
Епідеміологічні дослідження та систематичні огляди свідчать, що зниження рівня вітаміну D є поширеним явищем у дорослих з ожирінням, але точний його механізм залишається невідомим. Є це причиною чи наслідком, ще належить визначити. Очікують, що механізми, які зв’язують низькі рівні 25(OH)-вітаміну D з ожирінням, у майбутньому стануть зрозуміліші завдяки триваючим молекулярним дослідженням гена CYP2R1, VDR, адипогенезу та адиполізу.
Висновки
Дефіцит вітаміну D часто спостерігають на тлі ендокринних розладів. При ХХ низький рівень вітаміну D пов’язаний із вищим титром АТПО та об’ємом ЩЗ, а в деяких дослідженнях прийом добавок асоційований зі зменшенням рівнів антитіл. При ХГ об’єм ЩЗ та ступінь екзофтальму корелює з рівнями вітаміну D. У пацієнтів із ЦД 2 типу добавки вітаміну D дещо поліпшують індекс HOMA-IR і рівень HbA1c. Лікування вітаміном D при ЦД значуще впливає на рівень HbA1c, оскільки зменшуює інсулінорезистентність за рахунок кращої відповіді рецепторів до інсуліну в пацієнтів із ЦД 2 типу, а отже, вітамін D можна використовувати як додатковий терапевтичний засіб в осіб із ЦД 2 типу та ожирінням. Метааналіз проілюстрував зниження поширеності ЦД 2 типу та збільшення частоти нормалізації високих значень глікемії, які вважають предіабетом, у пацієнтів із предіабетом, які отримували добавки вітаміну D. Згідно з даними літератури, показники ожиріння під впливом добавок вітаміну D не зменшуються.
З огляду на представлену ґрунтовну доказову базу щодо ефективності добавок вітаміну D та їх користі, зокрема у високих дозах при найпоширеніших ендокринних захворюваннях, визначення концентрації вітаміну D в сироватці крові та корекція його дефіциту має впроваджуватись як додаток до стандартної терапії.
Galusca D, Popoviciu MS, Babes EE, et al. Vitamin D Implications and Effect of Supplementation in Endocrine Disorders: Autoimmune Thyroid Disorders (Hashimoto’s Disease and Grave’s Disease), Diabetes Mellitus and Obesity. Medicina. 2022;58(2):194. doi: 10.3390/medicina 58020194.
Підготувала к.мед.н. Світлана Опімах
Довідка ЗУ
На фармацевтичному ринку України представлений продукт холекальциферолу (вітаміну D3) – ВІТАГАМА® D3, компанії «Вьорваг Фарма» (Німеччина). Дієтична добавка доступна в двох дозуваннях – 2000 або 5600 МО (International Unit – IU) вітаміну D3 (холекальциферолу), що дає можливість обрати потрібну дозу і режим прийому залежно від індивідуальних потреб і клінічної ситуації. Так, ВІТАГАМА® D3 2000 рекомендована до застосування у формі таблетки 1 раз на добу. Відтепер доступне нове зручне дозування ВІТАГАМА® D3 5600, яке містить 5600 IU вітаміну D3 (холекальциферол) і яке рекомендоване до застосування 1 раз на тиждень, що є зручним для пацієнта та підвищує комплаєнс під час лікування. ВІТАГАМА® D3 від компанії «Вьорваг Фарма» – це німецька якість, перевірена часом.
Тематичний номер «Діабетологія. Тиреоїдологія. Метаболічні розлади» № 1 (65) 2024 р.


