20 вересня, 2024
Позалікарняна зупинка серця: коли слід проводити коронарну ангіографію?
Позалікарняна зупинка серця (ПЛЗС) залишається основною причиною глобальної смертності. Хворі, які вижили, обтяжені довгостроковими неврологічними та серцево-судинними ускладненнями. Обґрунтованість та оптимальний час проведення коронарної ангіографії (КАГ) є важливими, але не повністю визначеними компонентами лікування ПЛЗС. Представляємо до вашої уваги адаптований переклад статті W. Wanha et al. «Out-of-hospital cardiac arrest: Do we have to perform coronary angiography?», опублікованої в Cardiology Journal (2023; 30 (6): 1026‑1037). Метою авторів було обговорення клінічних стратегій лікування ПЛЗС, включно зі стратифікацією інвазивних процедур та обґрунтуванням необхідності проведення КАГ, особливо для хворих у критичному стані.
Рекомендації щодо проведення КАГ у хворих, госпіталізованих після ПЛЗС, обмежені чіткими критеріями. До них відносяться пацієнти, у яких на електрокардіографії (ЕКГ) реєструється порушення ритму, кардіогенний шок або інфаркт міокарда (ІМ) з елевацією сегмента ST (STEMI) після відновлення спонтанного кровообігу (ВСК) (табл. 1) (Lawton et al., 2022; Zeppenfeld et al., 2022).
|
Таблиця 1. Рекомендації щодо проведення КАГ у хворих із ЗС |
||
|
Рекомендації |
КАГ |
Клас, рівень |
|
Рекомендації ESC (2017) |
Первинна стратегія ЧКВ рекомендована хворим із реанімованою ЗС та ознаками STEMI на ЕКГ |
І, В |
|
У разі відсутності елевації сегмента ST на постреанімаційній ЕКГ, але з високою підозрою на ішемію міокарда, що триває, слід провести невідкладну КАГ протягом 2 год після виключення некоронарних причин. При прийнятті рішення щодо виконання невідкладної КАГ необхідно брати до уваги фактори, пов’язані з негативними неврологічними наслідками |
IIa, C |
|
|
Рекомендації AHA/ACC/HRS (2017) щодо ведення пацієнтів із шлуночковими аритміями та профілактики раптової серцевої смерті (Al-Khatib et al., 2018) |
Хворим, які одужали після раптової ЗС нез’ясованої етіології, рекомендоване проведення комп’ютерної томографії або інвазивної КАГ для підтвердження наявності чи відсутності ішемічної хвороби серця та прийняття рішень щодо реваскуляризації міокарда |
І, C-EO |
|
Швидке виявлення та лікування хворих із ПЛЗС, пов’язаною із ГКС, веде до поліпшення виживання та кращого функціонального відновлення |
NA |
|
|
ГКС як причину ЗС не можна передбачити за клінічними даними та результатами ЕКГ. |
I, B-NR |
|
|
Рекомендації ESC (2020) |
Лікування хворих із реанімованою ЗС та супутнім NSTEMI має бути індивідуальним відповідно до їхнього гемодинамічного та неврологічного статусу. У пацієнтів, які перенесли коматозний стан, слід негайно провести ЕКГ для подальшої диференціальної діагностики |
NA |
|
Серед гемодинамічно стабільних хворих на NSTEMI, успішно реанімованих після ПЛЗС, слід розглядати проведення відстроченої КАГ |
IIa, B |
|
|
Рекомендації ACC/AHA/SCAI (2021) щодо реваскуляризації коронарної артерії |
Особам із фібриляцією шлуночків, поліморфною шлуночковою тахікардією або реанімованою ЗС рекомендоване проведення реваскуляризації (з аортокоронарним шунтуванням або черезшкірним коронарним втручанням) для поліпшення виживаності |
I, B-NR |
|
Рекомендації ERC та ESICM (2021): ведення хворих після реанімації (Nolan et al., 2021) |
У хворих із ВСК після ПЛЗС та NSTEMI на ЕКГ слід розглянути термінове проведення катетеризації серця, якщо існує висока ймовірність ГКС (наприклад, особи із гемодинамічною та/або електричною нестабільністю) |
NA |
|
Рекомендації ESC (2022) щодо ведення хворих із шлуночковими аритміями та профілактики раптової серцевої смерті (Zeppenfeld et al., 2022) |
Електронестабільним хворим після раптової ЗС із підозрою на ішемію міокарда, що триває, показане проведення КАГ |
І, С |
|
Невідкладну КАГ рекомендовано пацієнтам зі STEMI |
І |
|
|
Примітки: Класи (сила) рекомендацій: клас I – сильна рекомендація (користь >>> ризик); клас IIa – помірна рекомендація (користь >> ризик); клас IIb – слабка рекомендація (користь > ризик); клас III – слабка рекомендація відсутність користі (користь = ризик); клас III – сильна рекомендація, наявний ризик (ризик > користь). Рівні доказовості: рівень А – високий рівень доказовості, дані ґрунтуються на ˃1 РКД, метааналізі високоякісних РКД, одному або кількох РКД, підтверджених високоякісними дослідженнями реєстру; рівень BR (рандомізовані) – докази середньої якості, дані ґрунтуються на ≥1 РКД, метааналізі РКД середньої якості; NA – дані відсутні, ACC – Американський коледж кардіологів, AHA – Американська асоціація серця, ESC – Європейське товариство кардіологів, ERC – Європейська рада реанімації, ESICM – Європейське товариство інтенсивної терапії, HRS – Товариство серцевого ритму, SCAI – Товариство серцево-судинної ангіографії та інтервенцій, РКД – рандомізоване клінічне дослідження. |
||
У більшості випадків раптова зупинка серця (ЗС) виникає в осіб без основного гострого коронарного ураження та може бути спричинена ритмами, які не викликають розряду. Такі хворі не мають чітких показань до проведення КАГ (Wilson et al., 2017; Hauw-Berlemont et al., 2022). В оновлених рекомендаціях описане постреанімаційне ведення пацієнтів із виконанням невідкладної КАГ (ERC, 2021; ESICM, 2021). До таких станів відносять STEMI, а також ІМ без елевації сегмента ST (NSTEMI) на ЕКГ, але за високої ймовірності гострого коронарного синдрому (ГКС) (Nolan et al., 2021).
У європейській настанові з лікування ГКС в осіб з ІМ без стійкої елевації сегмента ST рекомендовано розглядати відстрочену КАГ (ESC, 2020). Своєю чергою гемодинамічно стабільним пацієнтам із NSTEMI, які були успішно реанімовані після ПЛЗС, слід негайно проводити КАГ (Collet et al., 2021). Сьогодні тривають дослідження, зосереджені на детальних клінічних умовах ПЛЗС, щоб глибше визначити можливі переваги раннього інвазивного підходу.
Етіологія ПЛЗС
Лікування ПЛЗС залежить від оперативності та якості заходів, вжитих протягом періоду після ЗС. Раптова ЗС характеризується відносно низькою поширеністю у популяції. Це ускладнює розробку точного індивідуального інструменту прогнозування ризику. Особливо важко його спрогнозувати у хворих без попередніх симптомів. Вони залишаються у групі ризику раптової ЗС як їх першої серцевої події (Myerburg et al., 2017; Nadolny et al., 2020).
Ішемічна хвороба серця (ІХС) є основною причиною раптової ЗС, а її поширеність зростає з віком, чому сприяє атеросклероз. Значно підвищують ризик ЗС кардіоміопатії, пов’язані з фіброзом міокарда та гіпертрофією лівого шлуночка (Hookana et al., 2011). Серед осіб молодого віку частішими є генетичні структурні розлади, серцево-судинні каналопатії, міокардити та вроджені вади серця (Mozaffarian et al., 2016).
Пацієнти зі STEMI
ПЛЗС може виникнути в будь якому віці, тому необхідно проводити диференційну діагностику відразу після стабілізації стану хворого. Це дозволяє досягти або підтримувати статус ВСК і поліпшити прогноз пацієнта. Одночасне виконання різних діагностичних досліджень допомагає комплексно оцінити стан хворого та визначити пріоритети лікування.
Одним із найшвидших, загальнодоступних та економічно ефективних інструментів є ЕКГ. Його використовують вже на початковому етапі ведення хворого до досягнення ВСК. ЕКГ має додаткове значення в контексті високої позитивної прогностичної цінності елевації сегмента ST для гострих коронарних уражень (Jabbari et al., 2015; Zanuttini et al., 2013).
У міжнародних настановах протягом десятиліть надавалися строгі рекомендації щодо своєчасного ведення осіб зі STEMI на ЕКГ після ВСК. Невідкладна (≤2 год) КАГ із первинним ЧКВ була стратегією вибору в цій популяції (Ibanez et al., 2018). Як наслідок, впродовж 12 років (із 2000 по 2012 рр.) КАГ та ЧКВ частіше виконувалися після ВСК хворим зі STEMI та шлуночковою тахікардією (53,7 vs 87,2%) або фібриляцією шлуночків (29,7 vs 77,3%). Крім того, виживаність пацієнтів до виписки також поліпшилася (59,2 vs 74,3%) протягом цього періоду (Hochman et al., 1999; Patel et al., 2016).
Хворі на NSTEMI
Потенційна користь чи ризик невідкладної КАГ у хворих на NSTEMI все ще є предметом дискусій. Особливо важливим є питання правильного відбору кандидатів для ранньої стратегії КАГ. Переваги КАГ в осіб із ПЛЗС спостерігалися лише у групі пацієнтів зі значним стенозом коронарної артерії, яким проводили черезшкірне коронарне втручання (ЧКВ) для усунення стійкої ішемії (Jobs et al., 2017). Таким чином, можна припустити, що потенційна користь від невідкладної КАГ у хворих після ВСК значно залежить від наявності стенозу коронарних артерій.
Результати клінічних спостережень і реєстру свідчать про поліпшення виживаності при ранній КАГ (Welsford et al., 2018; Simiera et al., 2022). Своєю чергою у рандомізованих клінічних дослідженнях (РКД) не було показано такої користі при порівнянні невідкладної з відстроченою КАГ (Hauw-Berlemont et al., 2022; Desch et al., 2021). Це було підтверджено нещодавнім метааналізом даних, отриманих у хворих із ПЛЗС та NSTEMI, який продемонстрував відсутність різниці між ранньою та відстроченою КАГ із точки зору таких показників, як (Verma et al., 2020):
- рівень смертності;
- неврологічний статус;
- частота ЧКВ протягом 30 днів.
Обструктивний коронарний атеросклероз і гострі тромботичні оклюзії в популяції після ПЛЗС не є рідкістю, але можуть відрізнятися між різними підгрупами. У реєстрі PROСАТ поширеність гострої ІХС становила 58%, тоді як у РКД TOMAHAWK частота ураження коронарних судин була 40% (Dumas et al., 2010; Desch et al., 2021). В останньому опублікованому РКД EMERGE клінічно значиму ІХС було виявлено лише у 49,7% хворих (Hauw-Berlemont et al., 2022). Найбільша кількість ІХС після ПЛЗС (до 65%) спостерігалася у дослідженні COACT (Lemkes et al., 2019). Згідно з результатами інших випробувань за участю хворих із ЗС та NSTEMI, яким було проведено КАГ, повідомлялося про близько 25% гострих оклюзій і майже 60% значних обструктивних уражень (Rab et al., 2015).
Серед осіб з ІХС та NSTEMI після ПЛЗС значно поширені супутні захворювання, зокрема внутрішньочерепна кровотеча (Champigneulle et al., 2018; Hirlekar et al., 2018). Це підтверджує ймовірність несерцевих причин ЗС у цій популяції хворих. Окрім того, зміни на ЕКГ, що виникають внаслідок травми головного мозку, можуть імітувати ішемію міокарда (як-от поширені гігантські інверсії зубця Т, подовження інтервалу QT, брадикардія, депресія сегмента ST, збільшення амплітуди зубця U) (Gregory et al., 2012).
Таким чином, перед прийняттям остаточного рішення щодо виконання КАГ слід оцінити несприятливі супутні стани. Особливо варто звернути увагу на ті, що можуть вплинути на виживання осіб з ускладненою ПЛЗС, бажано після консультації міждисциплінарної групи. У цій популяції пацієнтів результати зумовлені неврологічними ускладненнями або поліорганною недостатністю, що призводить до 10-кратного підвищення рівня смертності порівняно із хворими на NSTEMI (Peberdy et al., 2013). З огляду на численні особливості, що вказують на мультиорганну та незворотну ішемію, користь від відновлення коронарної перфузії може бути помірною та клінічно незначущою.
Було проведено низку досліджень, присвячених вирішенню протиріч стосовно потенційної ролі КАГ та втручань у хворих на NSTEMI (Hauw-Berlemont et al., 2022; Desch et al., 2021). У випробуванні COACT не було виявлено суттєвої різниці у клінічних результатах після 1-річного спостереження за пацієнтами із ПЛЗС та шоковим ритмом при NSTEMI, у яких застосовували обидві стратегії. Ці результати свідчать про те, що КАГ можна відкласти до неврологічного відновлення (Desch et al., 2021). Дані дослідження TOMAHAWK вказують на відсутність користі від ранньої КАГ для таких клінічних результатів, як виживання, кровотеча, інсульт або ниркова недостатність. На додаток, науковці відзначили незначне збільшення сукупного результату смерті та тяжкого неврологічного дефіциту в групі, яким проводили невідкладну КАГ (Welsford et al., 2018). Ще в одному РКД стратегія екстреної КАГ була не ліпшою, ніж стратегія відстроченої КАГ щодо 180-денної виживаності та неврологічних ускладнень (Hauw-Berlemont et al., 2022).
Невідкладна КАГ може бути виправданою для певної категорії хворих із ПЛЗС:
- без значних супутніх захворювань;
- за гемодинамічної нестабільності;
- за невизначеної причини ЗС на момент госпіталізації, але у пацієнтів, що, ймовірно, прийдуть до тями.
При прийнятті рішення щодо проведення невідкладної КАГ після ВСК слід також враховувати питання, пов’язані з негативними неврологічними наслідками. Очевидна перевага негайної КАГ за інших умов все ще є предметом дискусій. КАГ асоційована як із потенційними ризиками, так і перевагами, що можуть або поліпшити стан хворого, або призвести до більших ускладнень. Це залежатиме від основної причини ПЛЗС та супутніх клінічних проблем (табл. 2).
|
Таблиця 2. Переваги та ризики реваскуляризації у хворих із ПЛЗС |
|
|
Переваги |
Ризики |
|
Висока поширеність оклюзій коронарних артерій, незважаючи на відсутність елевації сегмента ST за даними першої ЕКГ |
Дуже нестабільні хворі з високим ризиком ускладнень після КАГ. Необхідно виявити тих, кому ця процедура принесе користь, шляхом визначення інших потенційно виліковних причин ЗС, забезпечити клінічну оптимізацію стану перед КАГ |
|
Виключення ІХС, що веде до полегшення диференційної діагностики стосовно альтернативної етіології ЗС |
Побічні ефекти, пов’язані з проведенням КАГ |
|
Відміна потенційно шкідливого антитромботичного лікування у разі |
Перикатетеризаційний період потребує субоптимального догляду, |
Невідкладна КАГ може бути пов’язана із підвищеним ризиком кровотечі та процедурних ускладнень. Особливо це важливо у нестабільних хворих та осіб із неврологічними проявами після інтенсивної реанімації. З іншого боку, первинна реваскуляризація коронарних оклюзій підвищує життєздатність міокарда. Забезпечення кращої серцево-судинної та перфузійної стабільності може мати першочергове значення у пацієнтів із тяжкою гострою дисфункцією міокарда. У випадках, коли коронарна реваскуляризація неможлива, виключення ІХС може допомогти при диференційній діагностиці ускладнених випадків ПЛЗС та обрати оптимальну фармакотерапію.
Деякі дослідники вважають, що реорганізація та спрощення лікування ПЛЗС мають значні клінічні переваги. У поточному дослідженні ARREST вивчається ефективність спрощеної організації менеджменту осіб із ПЛЗС у хворих на NSTEMI порівняно зі стандартною допомогою (Patterson et al., 2018). S. Laver et al. (2004) виявили, що основними причинами смерті осіб із ПЛЗС є гіпоксичне ураження головного мозку, рефрактерний шок та поліорганна недостатність, незалежно від початкового ритму чи змін на ЕКГ. Це також було підтверджено у дослідженні COACT, де неврологічні захворювання були причиною летальних випадків у більш ніж 70% хворих (Lemkes et al., 2019).
Алгоритм лікування при ПЛЗС
На виживання хворих із ПЛЗС впливають швидкість реагування та якість медичної допомоги. Для поліпшення одужання після ПЛЗС має значення доступ до специфічних методів лікування, таких як (Sip et al., 2020; Bielski et al., 2021):
- раннє надання екстреної медичної допомоги;
- доступ до реанімації;
- розширена допомога після госпіталізації з акцентом на лікуванні основної причини ПЛЗС.
Після надходження хворого із ПЛЗС до відділення невідкладної допомоги (ВНД) необхідна швидка та детальна оцінка стану для розробки індивідуального плану лікування. Останній має бути реалізовано у відділенні, що спеціалізується на інтенсивній терапії (рисунок) (Jentzer et al., 2019; Kelly et al., 2019). Важливо відзначити, що 80% осіб із ПЛЗС, які були госпіталізовані живими, знаходяться без свідомості (Gorjup et al., 2007; Grand et al., 2020). З огляду на високу частоту ІХС як причини ПЛЗС, інтервенційні кардіологи часто розглядають проведення КАГ. Згідно з рекомендаціями, невідкладну КАГ слід виконувати хворим на STEMI. Однак серед лікарів існує загальна думка про передбачувану користь КАГ у пацієнтів із ПЛЗС та NSTEMI, яка не підтверджується наявними доказами.
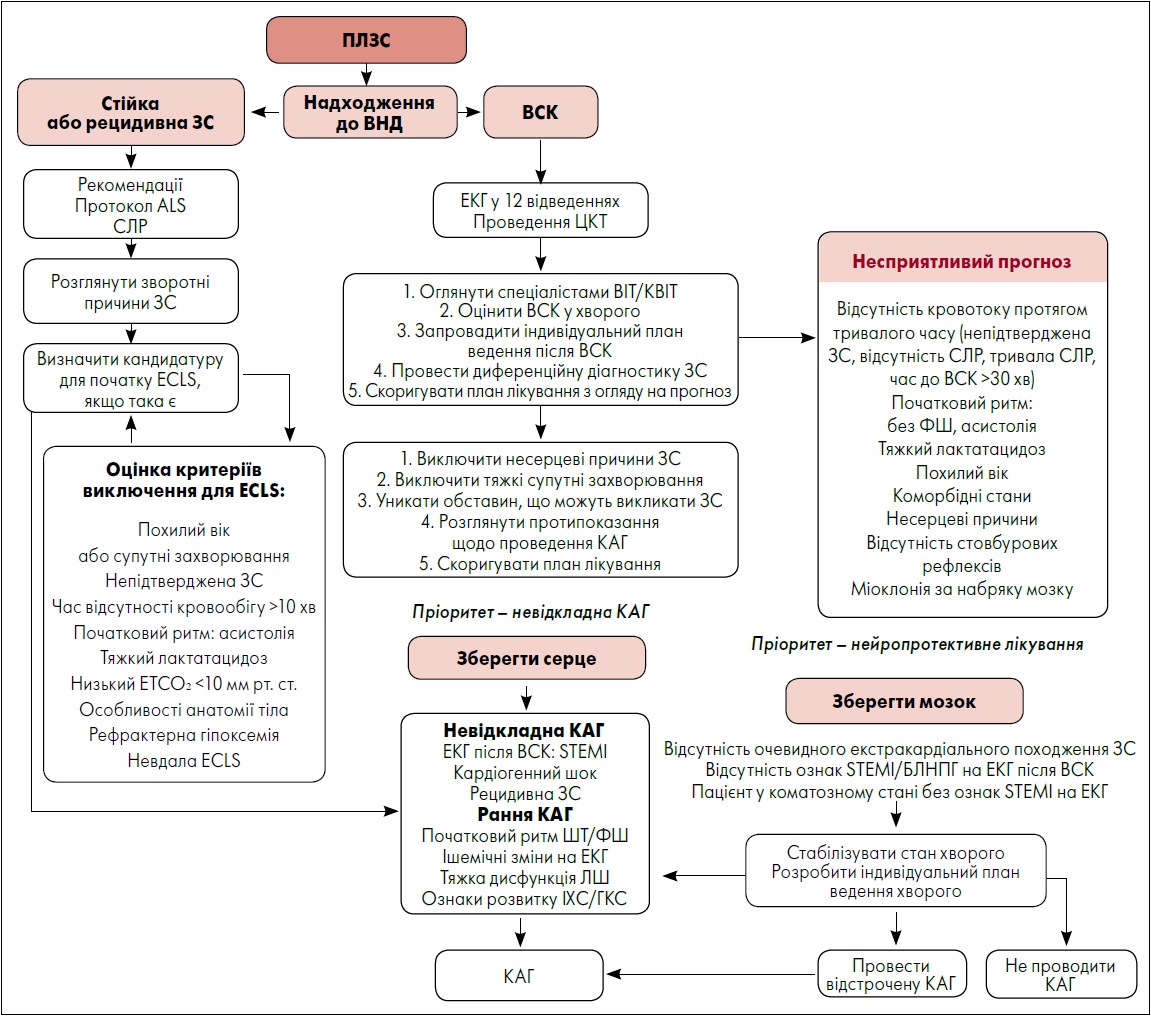
Рисунок. Алгоритм катетеризації коронарних артерій
Примітки: ALS – розширена підтримка життєдіяльності; ECLS – екстракорпоральна підтримка життя; ETCO₂ – рівень вуглекислого газу наприкінці видиху;
СЛР – серцево-легенева реанімація; ЦКТ – цільовий контроль температури; ВІТ – відділення інтенсивної терапії; КВІТ – кардіологічне відділення інтенсивної терапії;
ЛШ – лівий шлуночок; ФШ – фібриляція шлуночків; ШТ – шлуночкова тахікардія; БЛНПГ – блокада лівої ніжки пучка Гіса.
На підставі даних досліджень J.C. Jentzer et al. (2019) і E.M. Kelly et al. (2019), спочатку необхідно виключити несерцеві причини ЗС (як-то гостра дихальна недостатність, некардіогенний шок). Далі слід провести хірургічне лікування травм, нейрохірургічних або судинних причин, комп’ютерну томографію головного мозку та грудної клітки із подальшою тромбектомією церебральних артерій, усуненням пневмотораксу тощо.
Своєчасне проведення лікування після ВСК, включно із госпіталізацією до КВІТ або ВІТ, цілеспрямоване регулювання температури, підтримка життєво важливих органів і лікування основної причини ЗС знижують негативні неврологічні наслідки. Згідно з даними досліджень, саме неврологічні ускладнення є найчастішою причиною смерті хворих після ЗС (Kowalik et al., 2020; Sielski et al., 2020). При проведенні будь-яких процедур, які можуть затримувати початок терапії після ВСК, слід враховувати потенційне співвідношення користі та ризику для кожного окремого пацієнта.
Зазвичай лікування після ВСК базується на одній із двох обраних схем:
- Проведення розширених процедур візуалізації та консультацій на рівні ВНД до надходження пацієнта у КВІТ або ВІТ.
- Своєчасна госпіталізація до КВІТ або ВІТ, де за початковою стабілізацією стану хворого та стартом лікування після ВСК йдуть додаткові процедури.
Клінічний стан пацієнта та прояви ПЛЗС залишаються суттєвою рушійною силою для різноманітних етапів лікування. У разі нечітких проявів необхідне не лише загальне спостереження після ВСК, але й проведення диференційної діагностики та визначення індивідуальної терапії. Будь-які супутні захворювання, які сприяли ПЛЗС або ускладнили його прояв, потребують термінової медичної допомоги та зазвичай є пріоритетними при розробці плану лікування. Це включає (але не обмежується) корекцію зворотних причин зупинки серця, хірургічне лікування травм, нейрохірургічних або судинних причин, КАГ та/або КТ головного мозку і грудної клітки, усунення пневмотораксу тощо. Незважаючи на відтермінування госпіталізації хворого у ВІТ, ці процедури можуть забезпечити життєво важливі клінічні резерви для стабілізації та подальшого поліпшення стану пацієнтів у майбутньому.
Висновки
Спрощення процедур та індивідуалізація плану лікування хворих із ПЛЗС є ключовими для поліпшення клінічних результатів. Сьогодні пацієнти мають низьку виживаність і потребують своєчасного неврологічного або серцево-судинного лікування. Це підтверджує наявність нагальної потреби у дослідженнях стосовно необхідності КАГ при ПЛЗС. Особливо важливим дане питання є для хворих на NSTEMI, а саме прийняття рішення щодо проведення негайної або відстроченої ангіографії.
Підготувала Ірина Климась
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 4 (95) 2024 р.


