20 вересня, 2024
Порушення мікробіоти у пацієнтів із серцевою недостатністю
За матеріалами науково-практичної конференції «Актуальні питання невідкладної кардіології»
(27‑28 червня 2024 року)
 Сучасна інформаційно-наукова подія відбулася в Києві у змішаному форматі (офлайн і онлайн) і традиційно була присвячена важливим проблемам кардіології. Під час роботи секції «Діалог експертів» учасники обговорювали актуальні теми, часто на стику кардіології та інших галузей медицини. Пропонуємо до вашої уваги огляд доповіді професора кафедри терапії Національного університету охорони здоров’я імені П.Л. Шупика (м. Київ), д.мед.н. Андрія Едуардовича Дорофєєва, підготованої у співавторстві з д.мед.н., старшим науковим співробітником відділу інтенсивної терапії та реанімації ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України (м. Київ) Ярославом Михайловичем Лутаєм. Фахівці розглянули питання порушення мікробіоти у пацієнтів із серцевою недостатністю (СН).
Сучасна інформаційно-наукова подія відбулася в Києві у змішаному форматі (офлайн і онлайн) і традиційно була присвячена важливим проблемам кардіології. Під час роботи секції «Діалог експертів» учасники обговорювали актуальні теми, часто на стику кардіології та інших галузей медицини. Пропонуємо до вашої уваги огляд доповіді професора кафедри терапії Національного університету охорони здоров’я імені П.Л. Шупика (м. Київ), д.мед.н. Андрія Едуардовича Дорофєєва, підготованої у співавторстві з д.мед.н., старшим науковим співробітником відділу інтенсивної терапії та реанімації ННЦ «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска» НАМН України (м. Київ) Ярославом Михайловичем Лутаєм. Фахівці розглянули питання порушення мікробіоти у пацієнтів із серцевою недостатністю (СН).
У своїй доповіді професор А.Е. Дорофєєв відмітив, що синдром підвищеної епітеліальної проникності (СПЕП) – патологічний стан, який характеризується зниженням бар’єрної функції кишківника і транслокацією кишкової мікробіоти у кровоносне русло. СПЕП описано за наявності серцево-судинних патологій (зокрема СН), психічних і неврологічних розладів, як-от шизофренія, депресія, розлади спектра аутизму, хвороба Альцгеймера, хронічних обструктивних захворювань легень тощо (Fukui, 2016).
Роль кишківника в патогенезі СН пояснює так звана кишково-спрямована гіпотеза СН. Згідно з нею, зниження серцевого викиду й підвищений системний застій можуть спричинити ішемію та/або набряк слизової оболонки кишківника, зміну мікробіоти і збільшення проникності слизового бар’єра. Це призводить до посилення бактеріальної транслокації та зростання рівня циркулюючих ендотоксинів, додаткового навантаження на імунну систему та розвитку мікрозапалення, що може бути однією із причин виникнення СН. Оцінка кишкової бар’єрної функції може сприяти кращому розумінню впливу цих змін на перебіг СН та розробці «кишково-спрямованої» терапії (Sandek et al., 2007).
Важливість слизового бар’єра шлунково-кишкового тракту
Структура слизового бар’єра шлунково-кишкового тракту (ШКТ) включає три шари:
- Преепітеліальний – шар слизу, який містить компоненти хімічного бар’єра (антимікробні пептиди, глікопротеїни, секреторний імуноглобулін IgA).
- Епітеліальний – складається із клітин епітелію кишківника, зв’язаних адгезійними контактами і десмосомами.
- Субепітеліальний – являє собою власне пластинку слизової оболонки, яка містить клітини імунної системи.
Концепція слизового бар’єра нині не розглядається у відриві від змін мікробіоти (Alonso-Cotoner et al., 2021). Перспективним напрямом вивчення змін епітеліальної проникності у пацієнтів зі СПЕП є дослідження міжклітинних щільних контактів. Важливу роль у цьому явищі відіграють кілька сімейств білків, як-от оклюдини, клаудини, зонуліни та дифензини, які можуть виконувати функції відкривання/закривання «шлюзів», через які проникають як перетравлені продукти харчування, так і «агресивні» молекули (прозапальні регулятори) або навіть мікроби (так звана транслокація кишкової мікробіоти).
В організмі пацієнта із СН за наявності СПЕП відбуваються певні процеси із залученням важливих молекул. Передусім це триметиламіноксид (ТМАО), який є токсичним для серцевого м’яза і аномально метаболізується в організмі хворих на тлі дисбіозу. Це також бактеріальні ліпополісахариди, які можуть призводити до синтезу перехресно реагуючих антитіл. Коротколанцюгові жирні кислоти, про які менше відомо кардіологам, являють собою субстрати, які зокрема відповідають за поліпшення життєздатності деяких клітин на тлі енергодефіциту (що безумовно має місце за СН). Жовчні кислоти та уремічні токсини можуть спричиняти ураження серцево-судинної системи (Tang et al., 2017).
У контексті ТМАО слід зазначити, що його концентрація та механізм метаболізації можуть бути пов’язані не тільки зі змінами мікробіоти, але також із дієтичними навантаженнями. У нормі попередник ТМАО триметиламін метаболізується печінкою, але за наявності надлишку на тлі порушень слизового бар’єра відбувається його часткова метаболізація кишковою флорою. В результаті ТМАО потрапляє до кровотоку і згубно впливає як на судини, так і на серцевий м’яз (Zhang et al., 2020).
Збільшення продукції ТМАО в організмі призводить до:
- гіпертрофії міокарда;
- зростання рівня фіброзу;
- ремоделювання шлуночків;
- розвитку СН (прямий ефект).
Окрім того, ТМАО викликає запальні реакції, посилює мітохондріальну дисфункцію. Непрямий ефект ТМАО пов’язаний із порушенням функції нирок. Отже, надлишок ТМАО має надзвичайно високу несприятливу прогностичну цінність при СН і є додатковим фактором ризику. Це свідчить на користь необхідності корекції дисбіозу в пацієнтів із СН (Tang et al., 2014).
Роль синтезу метану
Важливу роль відіграє синтез метану. У практиці охорони здоров’я значна увага приділяється вивченню метан-продукувальної флори, яку переважно складають не бактерії, а анаеробні прокаріоти археї. У пацієнтів із СН частіше спостерігається схильність до закрепів. З одного боку, це може бути пов’язано із базисною терапією СН, з іншого – із тенденцією до ішемізації кишківника, пов’язаною безпосередньо з СН, наслідком якої є порушення перистальтики. Наявність метан-продукувальної флори може призводити до аномальної метаболізації деяких препаратів, зокрема β-адреноблокаторів.
Метан не лише порушує перистальтику, але й сповільнює транзит хімусу (напіврідкого вмісту шлунка або кишківника, який складається із частково перетравленої їжі), пригнічує та підвищую тонус стінок кишок. Модифікація співвідношення бродильних та гнилісних процесів у кишківнику зі зростанням метан-продукувальних анаеробів може призводити до:
- зменшення декон’югації жовчних кислот;
- підвищення газоутворення за рахунок метану.
У пацієнтів із синдромом подразненого кишківника (СПК) виявлене зниження кількості регуляторних бутират-продукувальних бактерій Faecalibacterium prausnitzii, Akkermansia muciniphila на тлі підвищення рівня основного представника метаногенної флори Methanobrevibacter smithii (Kim et al., 2012). Підвищений вміст метану в кишківнику може слугувати маркером наявності СПЕП у пацієнтів із СН.
Методи виявлення дисбіозу
Існують методи, за допомогою яких можна виявити мікробіоти у хворих на СН (дисбіоз). Одним із них є неінвазивний водневий дихальний тест на наявність синдрому надмірного бактеріального росту. Згідно із даними досліджень, у пацієнтів із закрепами, які часто супроводжують СН:
4. Синдром надмірного бактеріального росту спостерігався набагато частіше, ніж серед здорових учасників (∼60 і ∼5% відповідно).
5. Рівень водню в повітрі при видиху значно перевищував такий у здорових учасників (29,9±2,9 і 16,9±1,5 ppm відповідно).
Згідно з європейськими стандартами, аналіз калу на наявність дисбіозу практично не застосовується. Із цією метою використовують методику полімеразної ланцюгової реакції (ПЛР) або секвенування кишкової мікробіоти (останній, на жаль, наразі не застосовують в Україні). Метод ПЛР дозволяє вивчати ентеротипи (сімейства представників мікрофлори) в пацієнтів із СПК, що супроводжується закрепами, і визначати особливості, характерні саме для української популяції. Для нашої країни це здебільшого чотири ентеротипи: Bacteroidetes, Firmicutes, Actinobacteria та Proteobacteria.
За результатами дослідження професора А.Е. Дорофєєва та співавт. (2023), у пацієнтів із СПК‑3 порівняно зі здоровими учасниками знижувався рівень Bacteroidetes (р<0,05). Ці зміни поєднувалися зі збільшенням вмісту Firmicutes (р<0,05) та Actinobacteria і підвищенням в мікробіомі частки представників іншої флори, яка може складатися переважно з Proteobacteria. Визначення частки метаногенних представників може слугувати маркером наявності у пацієнтів СПК (рисунок, таблиця).
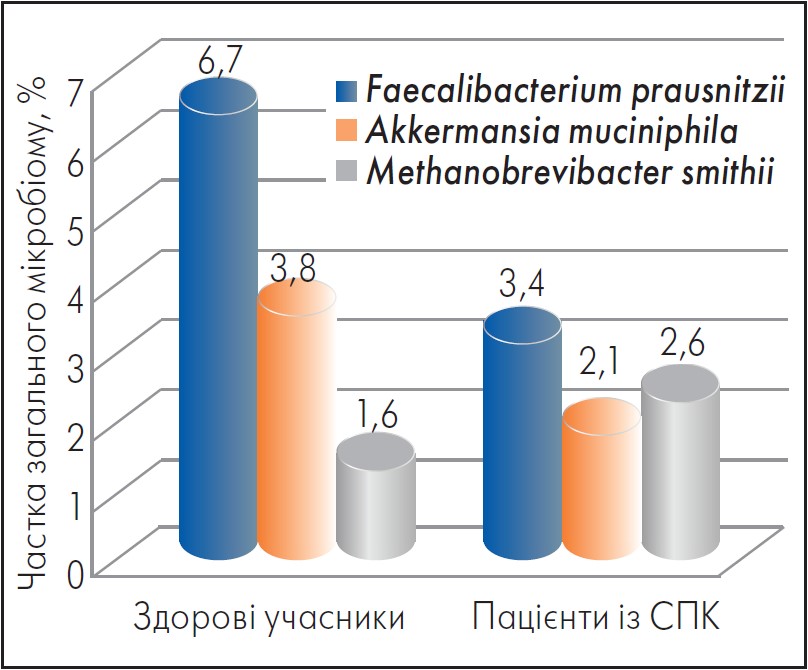
Рисунок. Вміст Faecalibacterium prausnitzii, Akkermansia muciniphila та Methanobrevibacter smithii в кишківнику здорових осіб і пацієнтів із СПК
Адаптовано за: Дорофєєв і співавт. (2023)
|
Таблиця. Кількість Methanobrevibacter smithii у здорових учасників і пацієнтів із СПК |
|
|
Група |
Вміст Methanobrevibacter smithii (копій/г) |
|
Здорові учасники |
1,7±0,3Ч106 |
|
Пацієнти із СПК |
2,8±0,5Ч108* |
|
Примітка: * Достовірна різниця (p<0,05) при порівнянні пацієнтів із СПК та здорових учасників. Адаптовано за: Дорофєєв і співавт. (2023) |
|
Одним із базисних маркерів зміни мікробіоти у пацієнтів із СН є значне зменшення різноманіття бактерій (Ye et al., 2018). Подібне ж явище характерне і для захворювань ШКТ: чим агресивніший перебіг, наприклад, неспецифічного виразкового коліту або хвороби Крона, тим бідніший склад мікрофлори.
Особливостями мікробіому та метаболізму його представників при СН є (Ye et al., 2018):
- зменшення різноманітності флори;
- збільшення у складі мікробіому представників Ruminococcus gnavus, Streptococcus spp. та Veillonella spp.;
- зменшення представників Faecalibacterium prausnitzii, Oscillibacter spp. і Sutterella wadsworthensis;
- зниження синтезу коротколанцюгових жирних кислот, особливо бутирату, який сприяє розвитку і стабільності здорового мікробіому;
- підвищення біосинтезу бактеріальних ліпополісахаридів;
- модифікація бактеріального метаболізму ліпідів та триптофану.
Отже, відносне збільшення вмісту ацетату і пропіонату на тлі зменшення вмісту бутирату має слугувати для лікаря сигналом необхідності корекції мікробіоти, що було переконливо продемонстровано для пацієнтів із захворюваннями ШКТ.
На додаток, зміни мікробіоти спостерігаються не лише в пацієнтів із СН, а також в осіб з атеросклерозом: збільшується кількість представників роду Lactobacillus і зменшується частка представників роду Roseburiam, підвищується концентрація ТМАО; мікробна трансплантація від пацієнта передає схильність до захворювання. Окрім того, такі зміни мають місце у хворих на артеріальну гіпертензію, а саме збільшується співвідношення представників родів Firmicutes / Bacteroides ratio, зростає вміст коротколанцюгових жирних кислот, інфузії ангіотензину II / ТМАО, що пов’язано з підвищенням артеріального тиску. Щодо пацієнтів із СН, у них спостерігається збільшення специфічних представників родів Escherichia, Klebsiella та Streptococcus, підвищення вмісту ТМАО і на цьому тлі – зростання кишкової проникності та ремоделювання серця, що значно погіршує прогноз (Tang et al., 2017).
Доцільно зазначити, що для діагностування СПЕП у пацієнтів із СН функціональні (навантажувальні) методи не використовуються. Що стосується клінічних, наявність закрепів свідчить про збільшення проникності кишкового бар’єра. Бактеріальні тести дають можливість визначення біомаркерів, а морфологічні методи наразі не застосовують для пацієнтів із СН.
Ефективність бактеріальних тестів доведено в дослідженнях. Вони дозволяють визначати бактеріальне різноманіття кишкового мікробіому, а також досліджувати вміст «ключових» бактерій. Можлива також оцінка бактеріальних ліпополісахаридів, які являють собою ендотоксини. Імуноферментний аналіз дозволяє визначати вміст ліпополісахаридів. Застосовують також методи латекс-аглютинації, коаглютинації, LAL-тест (Limulus Amebocyte Lysate), ПЛР, вимірювання у сироватці крові циркулюючих антитіл до ядра ендотоксину; визначення рівня коротколанцюгових жирних кислот, особливо бутирату (Bergheim et al., 2008; Grootjans et al., 2010).
Концептуально нові методи визначення біомаркерів включають (Singh et al., 20219):
- перша група – маркери ушкодження епітеліальних клітин (цитрулін, білки, що зв’язують жирні кислоти, α-глутатіон S-трансферазу);
- друга група – маркери кишкового запалення (фекальний кальпротектин, α1-антитрипсин, секреторний IgA, дефензини, мікроРНК, зонулін.
Вкрай важливим і перспективним є визначення змін щільних контактів при СПЕП. У разі зниження експресії білків щільних контактів відбуваються зміни балансу між різними видами клаудинів. Кишкове запалення пов’язане зі зниженням експресії герметизувальних клаудинів, передусім 1, 3, 5, 7 (Barmeyer et al., 2025).
Підходи до лікування пацієнтів зі СПЕП і СН
Корекція СПЕП при СН включає передусім базисну терапію основного захворювання, з обов’язковим урахуванням впливу препаратів на кишківник пацієнтів. Необхідно також здійснювати корекцію запалення та мікрозапалення у слизовій оболонці товстої кишки. Хворі мають дотримуватися дієти (бажано середземноморської, зі зменшенням вмісту холіну та збільшенням кількості харчових волокон). Слід призначати лікування дисбіозу антибіотиками, про-/пребіотиками, можливе здійснення фекальної трансплантації.
Зокрема, доцільним є застосування так званих топічних антибіотиків, як-от рифаксимін альфа (Альфа Нормікс), яким притаманна висока антимікробна активність щодо грампозитивної та грамнегативної флори і низька системна абсорбція, навіть у пацієнтів зі СПЕП (<0,4%). Окрім того, до рифаксиміну альфа не розвивається значуща резистентність, що зумовлено зменшенням імовірності передачі плазмід у 99% випадків (Scarpignato et al., 2006). Це особливо цінно, оскільки лікування пацієнтів із СН вимагає здійснення повторних курсів антибіотикотерапії. Дуже важливо дотримуватися рекомендованого дозування 1200 мг/добу протягом 14 днів, оскільки рифаксиміну альфа властивий дозозалежний ефект.
Щодо препарату накопичено значну доказову базу: він рекомендований як Американським товариством гастроентерологів (ACG, 2020), так і Європейським товариством гастроентерологів (ECG, 2020) для ерадикації синдрому надмірного бактеріального росту, який часто наявний в осіб із СН.
Своєю чергою д.мед.н. Я.М. Лутай з позиції кардіолога погодився з важливою роллю, яку відіграє мікробіота у пацієнтів із СН. Як правило, порушення бар’єрної функції кишечника передують розвитку СН, згодом низький серцевий викид і застій призводять до погіршення перфузії кишечника, ішемії та посилення кішкової проникності. Підвищене потрапляння мікробів та їх метаболітів у кров сприяють розвитку та прогресуванню СН та можуть зумовлювати рефрактерність до терапії, з чим доводиться іноді стикатися у практиці невідкладної кардіології.
У клінічних роботах останніх років було підтверджене незалежне прогностичне значення рівня ТМАО та синдрому надмірного бактеріального росту тонкого кишечника у пацієнтів із СН (Suzuki et al., 2016; Song et al., 2021). Наразі активно вивчаються методи корекції кишкової мікробіоти в осіб із СН, при цьому застосування топічних антибіотиків виглядає дуже перспективним.
У 2021 р. були оприлюднені результати пілотного багатоцентрового рандомізованого дослідження GutHeart, до якого залучили 151 пацієнта із СН та зниженою фракцією викиду (ФВ) лівого шлуночка (ЛШ), які мали симптоматику на рівні ІІ або ІІІ функціонального класу за класифікацією Нью-Йоркської асоціації серця (NYHA), незважаючи на оптимальну медикаментозну терапію (Awoyemi et al., 2021). Учасники були розподілені на три групи: стандартного лікування (контроля), рифаксиміну та Saccharomyces boulardii, які, відповідно, отримували зазначені препарати для корекції кишкової мікробіоти додатково до рекомендованої терапії СН. Після тримісячного лікування єдиною групою, в якій спостерігали достовірне підвищення ФВ ЛШ порівняно із початковими значеннями, була саме група рифаксиміну.
Серед основних механізмів реалізації шкідливого впливу дисбіозу в пацієнтів із СН виділяють збільшення системного запалення, підсилення ендотеліальної дисфункції та фіброзу міокарда, а також безпосередній негативний вплив на скоротливість міокарда. На додаток, ендотеліальна дисфункція розглядається як один із проявів синдрому підвищеної епітеліальної проникності. Було показано, що корекція кишкової мікробіоти позитивно впливає на функцію ендотелію, яка є важливою складовою у розвитку та прогресуванні СН (Catry et al., 2018).
Окрім того, доповідачі підкреслили позитивний вплив на функцію ендотелію у пацієнтів із СН препарату сулодексид (Вессел дуе Ф), структура якого подібна до ендотеліального глікокаліксу – захисного шару із глкозаміногліканів, який вистілає внутрішню поверхню ендотелію. Глікокалікс у фізіологічних умовах запобігає адгезії лейкоцитів і тромбоцитів, а за його ушкодження погіршуються захисні властивості ендотелію, що спричиняє підвищення його проникності та розвиток системної запальної реакції. Завдяки своїй унікальній структурі, сулодексид відновлює і стабілізує структуру глікокаліксу та поліпщує функцію ендотелію, зокрема в осіб із СН. Окрім ендотелій-протекторної дії, препарату властиві антитромботичний і протизапальний ефекти, які є дуже важливими для хворих на СН.
У 2020 р. Голандською фундацією серця (DHF) було започатковане дослідження сулодексиду в пацієнтів із СН та зниженою ФВ ЛШ (EudraCT, 2020‑002864‑30).
Висновки
СПЕП внаслідок дисбіозу може розглядатися як додатковий потенційний патогенетичний механізм розвитку та прогресування СН. Активно вивчаються можливості корекції кишкової мікробіоти для лікування пацієнтів із СН. Ендотеліальна дисфункція є одним із проявів СПЕП та важливою патогенетичною ланкою у розвитку СН. Корекція ендотеліальної дисфункції – невід’ємна складова у лікуванні осіб із серцево-судинною патологією та СН зокрема.
Підготувала Наталія Купко
Тематичний номер «Кардіологія. Ревматологія. Кардіохірургія» № 4 (95) 2024 р.


