20 березня, 2024
Сучасний погляд на проблему інфекційного ендокардиту
Розпізнавання хвороби за зовнішнім виглядом – це іскра божа,
за вислуховуванням – надзвичайна майстерність,
за допомогою питань – спритність,
а за дослідженням пульсу – мистецтво
Пян Чіао (VI ст. до н.е.), китайський лікар
 Інфекційний ендокардит (ІЕ) протягом останніх 30 років стає дедалі значущою проблемою в галузі терапії та кардіології. Від першого опису ІЕ і до сьогодні його діагностика лишається доволі складним завданням для клініцистів, зокрема, через часті атипові ознаки хвороби та необхідність покладатися на дані інтегрального оцінювання клінічних, мікробіологічних, лабораторних та ехокардіографічних параметрів.
Інфекційний ендокардит (ІЕ) протягом останніх 30 років стає дедалі значущою проблемою в галузі терапії та кардіології. Від першого опису ІЕ і до сьогодні його діагностика лишається доволі складним завданням для клініцистів, зокрема, через часті атипові ознаки хвороби та необхідність покладатися на дані інтегрального оцінювання клінічних, мікробіологічних, лабораторних та ехокардіографічних параметрів.
ІЕ – це клінічний хамелеон, епідеміологія та природний перебіг якого постійно змінюються, відображаючи складну взаємодію між старінням населення, зростанням осіб, які приймають ін’єкційні наркотичні речовини, швидко прогресуючим розвитком кардіохірургічної допомоги з малоінвазивними втручаннями (зокрема, імплантовані кардіостимулятори, кардіовертер-дефібрилятори, транскатетерні клапани серця) у тісному зв’язку зі зміною етіології вбік переважання Staphylococcus spp. та Enterococcus spp. [3]. Не простежується тренду до зниження захворюваності з показниками несприятливих клінічних наслідків, що, ймовірно, не пов’язано з обмеженням режимів антибіотикопрофілактики, оскільки не фіксується зростання стрептококового ІЕ [37].
Своєю чергою, зростає захворюваність на ІЕ навіть в економічно розвинених країнах. У США та країнах Західної Європи захворюваність ІЕ коливається від 25 до 93 на мільйон населення. За даними дослідження Глобального тягаря хвороб, 2019 р. зареєстровано 1,09 млн випадків ІЕ, при цьому стандартизований за віком показник становив 13,8 на 100 тис. осіб, що на 39,4% перевищувало аналогічний 1990 р. (9,9 на 100 тис.) [38].
Летальність за ІЕ теж є високою (18‑36%), попри ефективну антибактеріальну терапію (АБТ) та методи хірургічної корекції клапанів, які досить широко використовують у сучасній клінічній практиці [22]. До основних причин летальності належать септичні ускладнення, серцева недостатність та емболічні події (ЕП). За даними останнього великого реєстрового дослідження EURO-ENDO, емболії різних органів (головний мозок, легені, міокард) є причиною смерті у 20% випадків пацієнтів з ІЕ [22].
Етіологія
Етіологічна картина сучасного ІЕ має доволі різноманітний характер залежно від економічного статусу країни та розвитку медичної допомоги. Так, у країнах, що розвиваються, зберігається історично сформований зв’язок ІЕ з переважанням стрептококової етіології, водночас у розвинених країнах простежуються небезпечні тенденції зростання стафілококового та ентерококового ІЕ. Етіологічна структура сучасного ІЕ: S. aureus – 17‑43%, Str. viridans – 9‑26%, коагулазонегативні стафілококи (CoNS) – 7‑13%, Enterococcus spp. – 9‑16,2%, Str. bovis – 2‑10%, Streptococcus spp. (інші) – 3,1‑7%, гриби – 1‑7,2%, HACEK (Haemophilus spp. (Haemophilus parainfluenzae), Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella spp.) – 0,3‑3,5%, поліфлора – 0,4‑1% [26, 40]. Також є відмінності щодо етіології ІЕ залежно від фенотипу ІЕ (табл. 1).
|
Таблиця 1. Розподіл збудників залежно від фенотипу ІЕ |
|
|
Патологія |
Збудник |
|
ІЕ нативного клапана |
S. aureus, Str. viridans, Enterococcus spp., CoNS |
|
Вроджені вади серця і хронічна ревматична хвороба |
Str. Viridans, Enterococcus spp., Streptococcus spp. (інші), S. aureus |
|
ІЕ протезованого клапана (ранній) |
S. aureus, CoNS, Candida spp. |
|
ІЕ протезованого клапана (пізній) |
CoNS, Enterococcus spp., Str. Viridans, S. aureus |
|
Особи, які приймають ін’єкційні наркотичні речовини |
S. aureus, P. aeruginosa, Enterococcus spp., C. albicans |
|
ІЕ внутрішньосерцевого приладу |
S. aureus, CoNS |
|
Адаптовано за M. zsoy Infective endocarditis. J Transl Pract Med. 2022. Vol. 1, № 1. P. 23‑29. |
|
Чоловіки хворіють на ІЕ вдвічі частіше, ніж жінки. Якщо інфекційне ураження ендокарда розвивається із залученням до патологічного процесу інтактних клапанів, то визначають первинний ІЕ. Втім, не є рідкісною подією ураження патогенними мікроорганізмами вже змінених клапанів і підклапанних структур, зокрема у пацієнтів із ревматичними вадами серця, дегенеративними змінами клапанів, пролапсом мітрального клапана, штучними клапанами (вторинний ІЕ) (рис. 1) [8, 36].
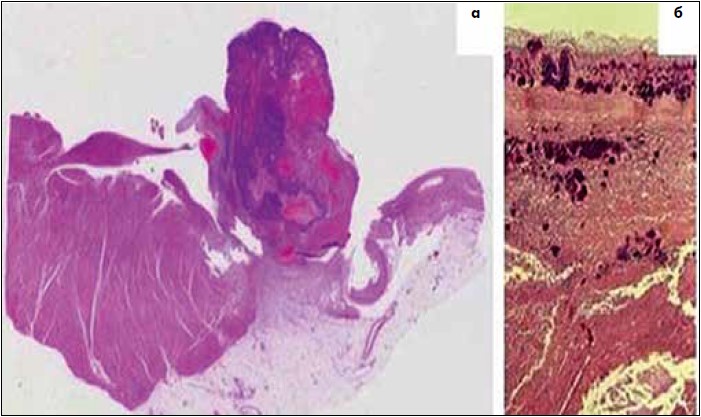
Рис. 1. Ураження патогенними мікроорганізмами вже змінених клапанів і підклапанних структур: а – гістологічний зріз вегетації фібринозно-геморагічного субстрату з лейкоцитарною інфільтрацією (початкове збільшення, х5); б – бактеріальні колонії (початкове збільшення, х20)
Етіологічна діагностика ІЕ
Через різноманітну етіологію ІЕ виникають значні труднощі для традиційного діагностичного алгоритму, заснованого на мікробіологічному дослідженні (МБД) крові та тканин резецованих клапанів (за їх доступності). Одну з провідних сучасних проблем ІЕ становить висока частота отримання важко інтерпретованих, хибнопозитивних і негативних результатів МБД (за різними даними на рівні 8,6‑85%, у середньому 20‑40%) [1]. Це визначає складність підбору ефективної терапії та несприятливий прогноз. Висока частота ІЕ з невстановленою етіологією за МБД зумовлена призначенням АБТ більш, ніж половині пацієнтів ще до встановлення діагнозу ІЕ, а також через зв’язок зі збудниками, які важко культивуються, і похибкою у виконанні МБД [4]. Найменш вивченим нині є ІЕ, спричинений рідкісними збудниками (Bartonella spp., Coxiella burnetii, Tropheryma Whipplei та Brucella spp.), що фіксують лише у спорадичних малокогортних дослідженнях [26]. Вищезазначене робить актуальним модернізацію етіологічної діагностики ІЕ із застосуванням додаткових методів, серед яких найширші можливості можуть мати молекулярно-біологічні дослідження у різних модифікаціях (полімеразна ланцюгова реакція [ПЛР], секвенування, секвенування нового покоління, флуоресцентна гібридизація).
Дані низки раніше виконаних досліджень підтвердили користь запровадження ПЛР-дослідження клапанів для етіологічної діагностики, зокрема з рекомендацією до включення його до діагностичних критеріїв Дюка [5]. Втім, згідно з міжнародними та національними клінічними рекомендаціями, молекулярно-біологічні дослідження, як-от імунохімічні, розглядаються лише як додаткові, після отримання негативних результатів МБД крові, що, ймовірно, обумовлено недостатньо доведеною користю застосування ПЛР-дослідження, заснованого переважно на вивченні тканин резецованих клапанів на малих популяціях оперованих пацієнтів. Теоретично ідеальним є виконання етіологічної діагностики ІЕ за допомогою ПЛР-дослідження зразків крові на широкий спектр патогенів, особливо в разі невиявленого збудника при МБД крові. Натепер такі дослідження є нечисленними і мають неоднозначні результати діагностичної переваги (чутливість 14‑65%). При цьому слід зазначити їхню низьку якість із малою кількістю спостережень ретроспективного дизайну, у яких вивчення ПЛР-дослідження крові не є першочерговою метою і було відтермінованим за часом (тільки за негативних результатів МБД крові) [14].
Безумовно, підвищення точності етіологічного діагностування, покращить якість ведення пацієнтів з ІЕ та сприятиме підвищенню рівня їх виживання. Проте сьогодні їхній прогноз лишається несприятливим. Привертає увагу госпітальна летальність, яка не знижується (14,4‑58,8%), недостатній рівень виконання кардіохірургічних втручань (28,9‑63,9%) і розвиток щонайменше одного ускладнення у 50% пацієнтів [4, 23]. Серед добре вивчених предикторів несприятливого прогнозу як у короткостроковому, так і у віддаленому періоді є: серцева недостатність, гостре порушення мозкового кровообігу, гостре ушкодження нирок, гостра / хронічна хвороба нирок, ІЕ протезованого клапана, вегетації ≥15 мм, ураження аортального клапана, S. aureus, ІЕ з невстановленою етіологією, високий індекс коморбідності Чарльсона [1].
Найбільш патогномонічним та одночасно небезпечним ускладненням ІЕ є розвиток ЕП без можливості їх достовірного прогнозування. Сучасна концепція патоґенезу ІЕ описана у межах імунотромбозу (як результату складної взаємодії збудника з тромбоцитами, ендотелієм та імунними клітинами), що дає підстави вважати як можливий «внесок» нових потенційних маркерів до оцінювання прогнозу ЕП та ускладнень ІЕ загалом, як-от розрахункові індекси запалення та нейтрофільні позаклітинні пастки (НПП) – мало або практично не вивчені за ІЕ [19].
Із патофізіологічної точки зору ключовим компонентом вродженого імунітету є макрофаги, які значно інфільтрують тканини уражених органів, наприклад клапани серця, проте їхня участь у різних патологічних процесах, як-от за тяжких інфекцій, що супроводжуються бактеріємією, зокрема в разі сепсису, варіативна та пов’язана з їхньою пластичністю (здатністю змінювати власний фенотип) [27]. Класично активовані прозапальні макрофаги (М1) продукують прозапальні цитокіни і підсилюють запальну відповідь; альтернативно активовані макрофаги (М2) продукують протизапальні цитокіни і беруть участь у розрішенні запалення, проте, передбачається існування континууму функціональних станів макрофагів залежно від чинника впливу [27]. Результати раніше виконаних досліджень на тваринах і у пацієнтів із сепсисом (як найближчого до ІЕ захворювання) продемонстрували зв’язок прозапальних макрофагів (М1) із несприятливим прогнозом [7]. Також у пацієнтів із сепсисом було виявлено мало вивчений зв’язок макрофагів із нейтрофільними позаклітинними пастками (НПП) через піроптоз [10]. Наукові роботи з вивчення макрофагів при ІЕ нечисленні, переважно мають експериментальний характер із поодинокими клінічними дослідженнями, спрямованими на встановлення морфофункціональних характеристик макрофагів завдяки аналізу експресії цитокінів, і різні дизайни за типом досліджуваного біологічного матеріалу (насамперед кров, рідше клапани) [12].
Тому виявлення значущості застосування ПЛР-дослідження зразків крові / тканин клапана, а також особливостей МБД зразків крові / тканин клапана для якісної етіологічної діагностики, розробка критеріїв визначення справжнього збудника з пропозицією модернізації алгоритму етіологічного обстеження пацієнтів з ІЕ, що дало б змогу точніше вивчити етіологічну структуру сучасного ІЕ, зокрема з визначенням ролі рідкісних збудників, із перспективою таргетного призначення АБТ, а також прогностичного значення маловивчених, доступних, патогенетично обґрунтованих маркерів (нейтрофільно-лімфоцитарний, тромбоцитарно-лімфоцитарний, системний імунозапальний індекси, НПП) є надзвичайно актуальною та нерозв’язаною дотепер проблемою. Визначення напрямку поляризації макрофагів в уражених клапанах серця у пацієнтів з ІЕ відкриває перспективи вивчення їхнього функціонального профілю для діагностичних цілей та оцінювання прогнозу, особливо у поєднанні з НПП.
Втім, згадані додаткові методи застосовують уже на пізніх термінах діагностики, після отримання негативних результатів МБД крові, що в умовах реальної клінічної практики становить не менш ніж 5‑6 днів. До цього часу бактеріємія, яка супроводжує ІЕ і початково вирізняється транзиторним характером із невисокою концентрацією збудника в крові, стає ще менш значущою, що визначає ймовірність отримання повторних позитивних результатів не тільки МБД, а й сучасних методів діагностики. Особливо цінним є виконання будь-якого етіологічного обстеження на якомога ранніх термінах, оптимальних до призначення АБТ або на її початкових етапах, що позначається на чутливості як МБД (переважно), так і, наприклад, молекулярно-біологічних методів (меншою мірою). Слід зазначити, що для широкого застосовування в рутинній практиці етіологічної діагностики ІЕ МБД (крові, клапанів) відомі випадки хибнонегативних і хибнопозитивних результатів. Результати низки досліджень на тканинах клапанів серця продемонстрували недостатню діагностичну чутливість і специфічність МБД: істинно позитивні результати у пацієнтів з ІЕ були лише у 6‑26% випадків ІЕ, а хибнопозитивні – у 28% осіб без ознак ІЕ [24]. Важливим аспектом є високі вимоги до взяття біологічного матеріалу для МБД і неприйнятно більшу тривалість виконання дослідження, попри незаперечну перевагу можливості визначення антибіотикочутливості / резистентності.
Ці обмеження диктують необхідність удосконалення алгоритму етіологічного діагностування ІЕ із ширшим застосуванням сучасних методів, насамперед незалежних від стадії культивування, для достовірного виявлення широкого спектра збудників зі швидкими термінами виконання [17].
Проблеми діагностики ІЕ
Основу сучасного алгоритму етіологічної діагностики ІЕ становлять модифіковані критерії Дюка, представлені у міжнародних посібниках щодо ведення хворих на ІЕ [18]. Відповідно до них ідентифікація збудника – єдиний параметр, двічі відображений в умовах діагностування ІЕ як великий і малий критерій Дюка. Втім, варто зазначити, що в сучасних алгоритмах етіологічної діагностики ІЕ основним методом ідентифікації збудника є МБД крові / клапанів (вегетацій або інших біологічних середовищ, уражених за ІЕ). Проблемою більшості пацієнтів з ІЕ є виконання дослідження біологічного матеріалу (як правило, крові) на тлі тривалої АБТ, що часто визначають неефективність традиційного МБД [18]. Ба більше, недостатньо вивченим в Україні та в багатьох країн світу є ІЕ, асоційований із рідкісними, важко / некультивованими мікроорганізмами [15].
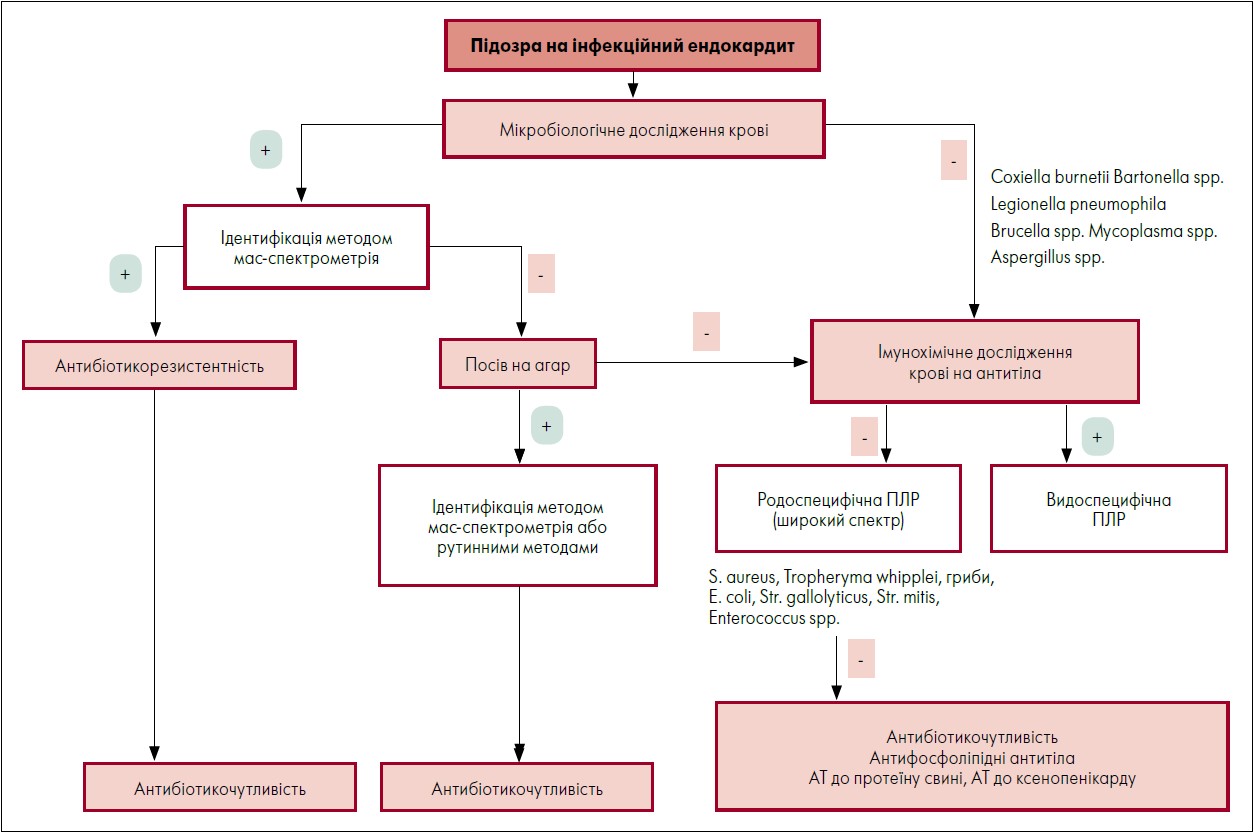
Усе це визначає найбільш нерозв’язану проблему ІЕ – високу частоту ІЕ з невиявленим збудником. Відповідно до алгоритму етіологічного діагностування національних і міжнародних клінічних рекомендацій у разі отримання негативних результатів МБД крові, рекомендовано виконати додаткові дослідження (насамперед крові) високоточними та чутливими методами, представленими імунохімічними (в обмеженому аспекті) та молекулярно-біологічними дослідженнями (рис. 2).
Рис. 2. Алгоритм етіологічної діагностики інфекційного ендокардиту
Примітки: етап 1 – виконання триразового МБД крові, доповненого мас-спектрометрією; етап 2 – за отримання негативних результатів на попередньому етапі виконання імунохімічного дослідження на антитіла до вузького спектра збудників, за позитивного результату – підтвердження збудника при ПЛР-дослідженні, за негативного результату – виконання ПЛР-дослідження крові на широкий спектр збудників. 1 – родоспецифічна ПЛР, спрямована на дослідження великої групи можливих збудників (якщо немає підозри про можливий збудника при ІЕ з негативною культурою крові); 2 – видоспецифічна ПЛР, спрямована на виявлення певного збудника (загалом для виявлення збудників, що важко / не культивуються, як-от C. burnetii, Bartonella spр., T. Whipplei, C. acnes та M. hominis).
Адаптовано за G. Habib Management of infective endocarditis. Heart (British Cardiac Society. 2006. V. 92, № 1. P. 124‑30.
Диференційна діагностика ІЕ
Перелік захворювань, із якими доводиться диференціювати ІЕ на ранніх стадіях захворювання, надзвичайно широкий. Найважливішими є: лихоманка неясної етіології (ЛНЕ); ревматоїдний артрит (РА) із системними ознаками, гостра ревматична лихоманка (ГРЛ); системний червоний вовчак (СЧВ); вузликовий полі артеріїт; неспецифічний аортоартеріїт; первинний / вторинний антифосфоліпідний синдром (П/ВАФС); інфекційні захворювання, які мають ознаки лихоманки, висипки і спленомегалії (генералізована форма сальмонельозу, бруцельоз); злоякісні новоутворення (неходжинські лімфоми, лімфогранулематоз); сепсис [16].
Труднощі у диференційній діагностиці між ІЕ та системними захворюваннями сполучної тканини визначаються ураженням судин і розвитком панартеріїту [39]. Прикладом цього може бути ГРЛ у межах системних симптомів, ще притаманне формування серцевих вад [34]. Виконуючи диференційну діагностику ГРЛ та ІЕ, слід звернути увагу на характерні для ІЕ ознаки. В анамнезі є вказівки на медичні маніпуляції, що супроводжуються бактеріємією; озноби; швидке прогресування вади серця або швидке формування нової вади з переважанням недостатності клапана; петехії на шкірі та слизових оболонках; спленомегалія; високі гострофазові показники; виявлення масивних вегетацій на клапанах під час ЕхоКГ; неефективність нестероїдних протизапальних препаратів [29].
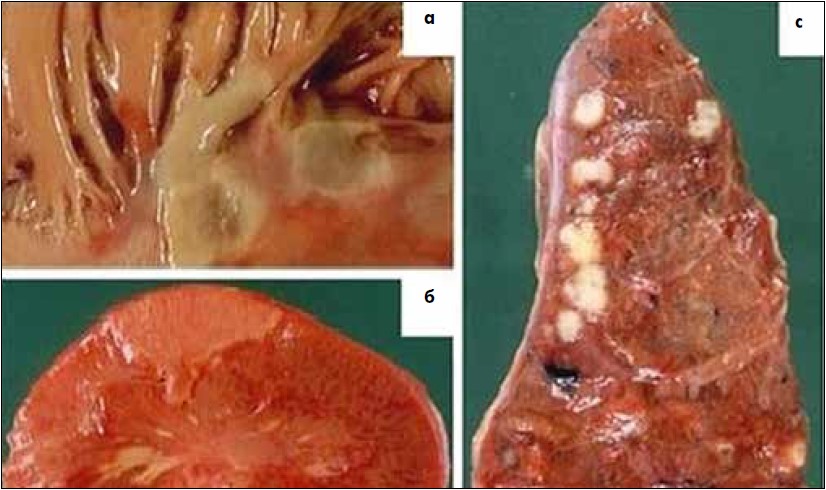
Виявити масивні вегетації на стулках клапанів серця часом у цій ситуації вкрай важко, проте наявність таких ускладнень, як перфорація та абсцедування стулок, безумовно, свідчить про ІЕ. Різноманітні клінічні та параклінічні зміни, як-от виразний лейкоцитоз, гіпохромна анемія, значне збільшення концентрації імуноглобулінів, циркулюючих імунних комплексів у крові, гепатоспленомегалія, тромбоемболічні ускладнення, гломерулонефрит, пневмонія, плеврити, позитивна гемокультура, виразна і стійка лихоманка, що зникає лише після виконання АБТ, також свідчать про наявність ІЕ [8, 6] (рис. 3).
Рис. 3. Клінічні та параклінічні зміни за ІЕ: a – запалення та тромботичні нашарування, що спричиняють ушкодження папілярних м’язів за ІЕ; б – інфаркт селезінки, спричинений емболією інфікованим тромбом; c – абсцеси легень в умовах емболізації
Серед захворювань сполучної тканини, із якими необхідно виконувати диференційну діагностику ІЕ, важливе місце посідає РА із системними ознаками. Для РА характерний розвиток ерозивно-деструктивних уражень суглобів та ураження серця за типом ендокардиту (50‑60% випадків) [11]. Підгострому ІЕ також притаманний розвиток імунокомплексної патології із залученням опорно-рухового апарату (23‑60% випадків) і артралгій, артритів, тендинітів та ентезопатій. У 40‑50% випадків клінічний перебіг РА супроводжується гектичною лихоманкою, ендокардитом і складними порушеннями серцевого ритму [2].
Важливе значення у діагностиці системного васкуліту має біопсія шкірно-м’язового клаптя з виявленням у біоптатах запально-інфільтративних і некробіотичних змін ендотелію судин [22].
За диференційного діагностування використовують критерії нозологічних форм системних васкулітів – без бактеріємії, висока ефективність глюкокортикоїдної терапії та неефективність АБТ (на відміну від ІЕ) [32]. Певні труднощі можуть виникати за диференційної діагностики ІЕ та неспецифічного аортоартеріїту (хвороби Такаясу), що має перебіг із формуванням аортальної недостатності, зумовленої дилатацією аорти. При цьому недостатність аортального клапана не супроводжується утворенням вегетацій на ньому [20].
На користь СЧВ свідчать відсутність виразної клапанної деструкції та регургітації, наявність негативної гемокультури та позитивного ефекту від застосування глюкокортикостероїдів та цитостатиків. Однією з найчастіших клінічних варіацій ВАФС є ураження клапанного апарату серця – до 88% усіх випадків [2]. Втім, у разі ІЕ частіше розвивається деструктивна пневмонія, а при СЧВ – судинні ураження легень у вигляді пульмонітів [30]. Досить складна диференційна діагностика ІЕ зі злоякісними новоутвореннями, особливо в осіб похилого віку [28]. Гектична лихоманка часто буває за гіпернефроми, пухлин товстої кишки, підшлункової залози, жовчного міхура [31].
Водночас у людей похилого віку як наслідок хронічної ішемічної хвороби серця нерідко виникає грубий систолічний шум мітральної регургітації або протодіастолічний шум аортальної регургітації на тлі атеросклеротичного ураження аортального клапана. У таких ситуаціях, особливо у пацієнтів з анемічним синдромом і прискореним ШОЕ, перш ніж зупинитися на діагнозі ІЕ, слід виключити пухлинний процес [31]. Для підтвердження ІЕ у пацієнта мають бути наявними два «великі» критерії, або один «великий» і три «малі», або всі п’ять «малих» критеріїв Дюка. У цьому випадку призначення специфічного лікування можливе без виконання подальших діагностичних тестів [9].
Значні труднощі становить диференційна діагностика ІЕ та інших захворювань інфекційно-аутоімунної природи, а також пухлинних процесів. Ознаки ураження нирок при ІЕ підвищують ймовірність розвитку інших системних ознак, зокрема прогностично значущі, що дає змогу розглядати ураження нирок як важливий маркер несприятливого перебігу ІЕ. Діагноз ІЕ, особливо у людей похилого віку, потребує виключення пухлинного процесу за допомогою відповідних сучасних діагностичних методів [25]. Ризик розвитку ІЕ за наявності пухлин досить високий, оскільки пацієнти в межах верифікації онкологічного процесу часто зазнають інвазивних діагностичних процедур [13].
Ускладнення
Ускладненнями ІЕ є: ушкодження клапанів із формуванням серцевої недостатності; абсцеси міокарда – до 20%, тромбоемболічні ускладнення – у 15‑30% пацієнтів, мікотичні аневризми судин (частіше за підгострого – до 15‑20% спостережень); ураження нирок (раніше виявляли майже у всіх випадках), а також рецидивування ІЕ. Емболічні події є патогномонічними та одночасно найнебезпечнішими ознаками ІЕ, проте, як і раніше, важко спрогнозувати ризик ЕП у пацієнтів з ІЕ [35]. ЕП розвивається у 30% пацієнтів з ІЕ, але її частота знижується до 9‑21% після початку АБТ. При цьому найбільше прогностичне значення мають ЕхоКГ параметри, проте обговорюється можлива роль низки потенційних перспективних параметрів (СРБ, середній об’єм тромбоцитів, співвідношення нейтрофілів та лімфоцитів, антитіла до β2-глікопротеїну I, матриксні металопротеїнази, а також деякі мікробіологічні чи клінічні характеристики). Емболія може мати безсимптомний перебіг приблизно у 20% пацієнтів з ІЕ і має бути діагностована за допомогою методів неінвазивної візуалізації (головний мозок і селезінка є найчастішими органами, схильними до емболії при ІЕ) [17].
Профілактика емболічних ускладнень продовжує бути провідною проблемою для клінічних лікарів і складним завданням, оскільки найчастіше ЕП трапляються до госпіталізації. У рекомендаціях Європейського товариства кардіологів (ESC, 2015) щодо ведення хворих з ІЕ зазначено, що найвищий ризик емболії спостерігається впродовж перших двох тижнів АБТ, який пов’язаний із розміром та рухливістю вегетації. Тому для профілактики ЕП розглядають раннє хірургічне втручання (у перші дні АБТ), що значно знижує ризик смерті в пацієнтів із великими вегетаціями порівняно з консервативною терапією. Крім того, слід враховувати ризик операції, клінічний статус і супутні захворювання пацієнта. Нині вивчають методи профілактики ЕП консервативною терапією з використанням антиагрегантів та антикоагулянтів і ведеться пошук нових мішеней для лікарських препаратів. Результати профілактики ІЕ в експериментальних дослідженнях антиагрегантами та антитромбіновими препаратами у щурів підтвердили їхню потенційну користь щодо профілактиці ІЕ у людини.
Аспірин у комбінації з тіклопідином, а також абциксимаб запобігали ІЕ, зумовленому Str. gordonii та S. aureus у 45‑88% тварин. Дабігатрану етексилат запобігав ІЕ, спричиненому S. aureus у 75% щурів, без ефекту щодо ІЕ, викликаного Str. gordonii (<30% захисту). Неефективним був аценокумарол. Автори пропонують розглянути застосування дабігатрану етексилату в пацієнтів із протезованими клапанами, які потребують довічної антикоагуляція і які мають S. aureus ІЕ, асоційований із високою смертністю [33].
Хоча потенційна користь різних антитромботичних стратегій підтверджена в експериментальних дослідженнях, наявні клінічні дані є суперечливими. Натепер немає достовірних даних про необхідність розпочинати антитромботичне лікування в осіб із діагнозом ІЕ. Пацієнти, які мають серйозні показання до антитромботичного лікування антиагрегантами або антикоагулянтами, ймовірно, мають продовжувати це лікування, якщо немає протипоказань (наприклад, кровотечі).
Сьогодні найкращими антиемболічними стратегіями є рання діагностика, своєчасна адекватна АБТ та ретельний відбір пацієнтів, яким показано раннє хірургічне втручання.
Клінічний випадок
Пацієнт, 34 роки, без попереднього кардіологічного анамнезу. У вересні 2022 року, перебуваючи в зоні бойових дій, отримав мінно-вибухову травму: вогнепальне поєднане проникаюче осколкове сліпе черепно-мозкове поранення з вхідним отвором у правій лобній ділянці з наявністю численних металевих осколків кісткових уламків і геморагічного крововиливу по ходу ранового каналу; забій головного мозку ІІІ ступеня; травматичний масивний субарахноїдальний крововилив; пневмоцефалія; дірчастий вогнепальний перелом у правій лобній ділянці; розтрощення очного яблука з повною втратою внутрішніх оболонок; вогнепальні осколкові сліпі поранення тулуба з наявністю металевих осколків у м’яких тканинах на рівні LIII‑LIV хребців і в м’яких тканинах грудної клітки на рівні VIII‑IX ребер зліва. Після надання первинної медичної допомоги був евакуйований до Запорізької обласної клінічної лікарні, де виконано кістково-пластичну трепанацію черепа праворуч, видалення кісткових уламків і металевих осколків із порожнини черепа, видалення внутрішньомозкової гематоми, пластика твердої мозкової оболонки (ТМО) аутотканинами (окістям), евісцерація правого очного яблука, торакотомія, видалення стороннього тіла з плевральної порожнини, ушивання лівої легені, дренування плевральної порожнини по Бюлау. На подальших етапах евакуації лікувався консервативно. У листопаді 2022 року пацієнта переведено до Головного військового клінічного госпіталю (м. Київ), де йому було встановлено гастростому та продовжено консервативну терапію. Наприкінці грудня 2022 року потрапив на реабілітаційне лікування до Медичного реабілітаційного центру. Відтоді в пацієнта відзначалося підвищення температури (To) до 39‑40оС з ознобами та пітливістю, приймав симптоматичну терапію. Для продовження лікування пацієнта перевели до Військово-медичного клінічного центру Західного регіону (м. Львів) із діагнозом: лихоманка неясного ґенезу.
Загальний стан. На момент госпіталізації загальний стан пацієнта був тяжким, Тo – 38,1оС. Шкірні покриви та видимі слизові блідо-рожевого забарвлення, чисті. Наявні післяопераційні рубці. Периферичні лімфовузли не збільшені. Грудна клітка правильної форми, симетрична. Частота дихання 18 уд./хв. Перкуторно над легенями ясний легеневий звук. Аускультативно над легенями везикулярне дихання із жорстким відтінком, ослаблене в нижніх відділах з обох боків, де прослуховуються провідні хрипи в помірній кількості. Межі відносної серцевої тупості не розширені. Серцеві тони ослаблені, ритмічні. ЧСС – 88 уд./хв, АТ – 125/75 мм рт. ст.
Язик вологий. Живіт м’який, безболісний, гастростома функціонує. Нижній край печінки виступає на 2 см із-під правої реберної дуги. Перкуторно печінкова тупість збережена. Селезінка виступає на 0,5 см із-під лівої реберної дуги. Нирки не пальпуються. Постукування по попереку безболісне. Периферичних набряків немає. Сечопускання через катетер.
Неврологічний статус. Свідомість – акінетичний мутизм. Реагує на звернену мову розплющуванням ока, повертанням голови. Виконує елементарні команди, швидко виснажується. Очні щілини D
Об’єм рухів лівим очним яблуком в повному обсязі. М’язовий тонус у кінцівках різко підвищений за спастичним типом: у лівому ліктьовому суглобі наявна згинально-привідна контрактура, у колінних і гомілковоступеневих суглобах – згинальні контрактури. Глибокі сухожилкові рефлекси з рук і ніг пожвавлені, S>D.
Позитивні рефлекси: хоботковий, дистанс-оральний, Марінеску-Радовичі. Менінгеальних знаків немає. Функцію тазових органів не контролює.
Зважаючи на лихоманку, запідозрено, і підтверджено COVID‑19. Через тяжку дихальну недостатність (ЧД – 34 на хвилину, зниження SpO2 до 78%) пацієнта інтубовано та розпочато респіраторну підтримку.
У крові: лабораторно-запальний синдром (лейкоцити – 17*109/л, п/с – 82,6%, СРБ – 95 г/л, прокальцитонін – 2,4 нг/мл, ШОЕ – 70 мм/год), залізодефіцитна анемія середнього ступеня тяжкості (еритроцити – 2,93*1012/л, гемоглобін – 83 г/л, залізо – 2,9 мкмоль/л), гіпопротеїнемія (загальний білок – 56 г/л, альбумін – 20 г/л).
Коагулограма: протромбіновий індекс – 71,4%, фібриноген – 5,69 г/л. D-димер – 3524,6 → 1588,9 → 2899,4 нг/мл.
Загальний аналіз сечі: щільність – 1032, лейкоцитурія – до 48 п/зр, еритроцитурія – до 81 п/зр.
При МБД зразків крові – S. aureus.
При МБД харкотиння – K.pneumoniae 108 копій/мл, P. аeruginosa 107 копій/мл, Proteus spp. 104 копій/мл.
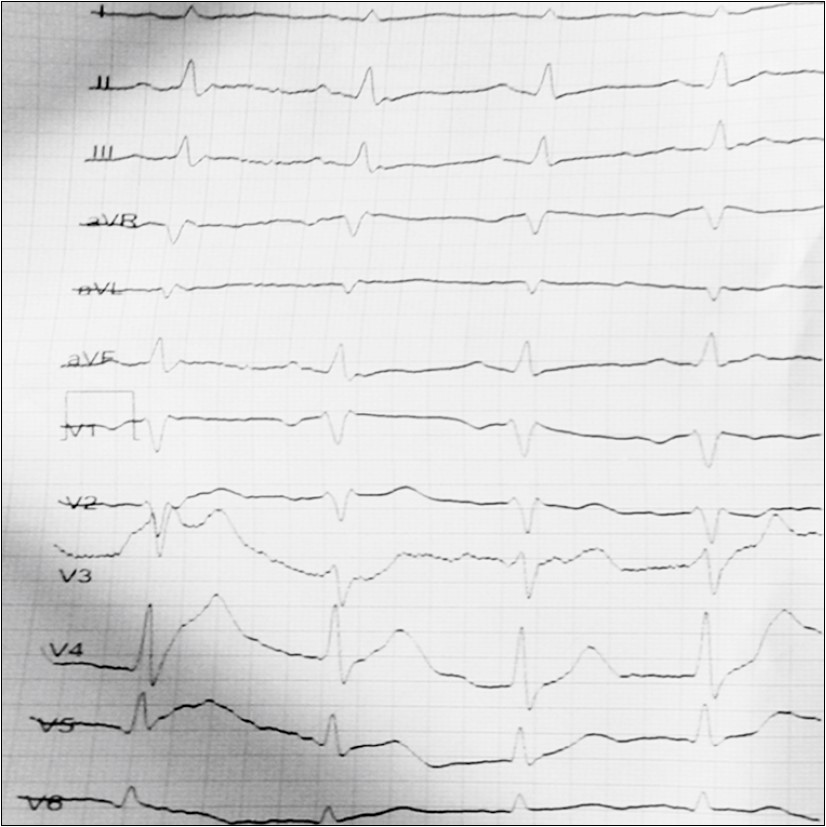
ЕКГ: синусова тахікардія із ЧСС – 120 уд./хв, неповна блокада правої ніжки пучка Гіса, дифузні зміни міокарду (рис. 4).
Рис. 4. ЕКГ пацієнта
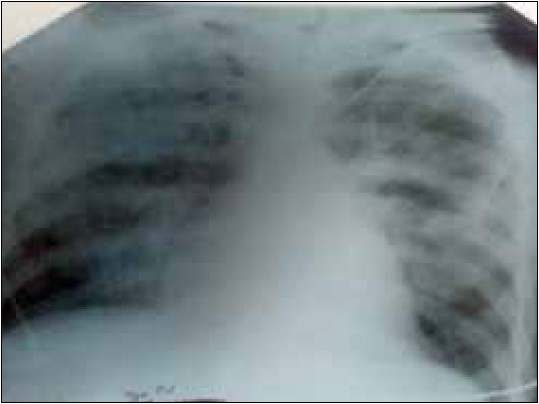
На рисунку 5 зображено рентгенологічну картину двобічної пневмонії на тлі явищ інтерстиційного набряку легень.
Рис. 5. Рентгенографія ОГК пацієнта
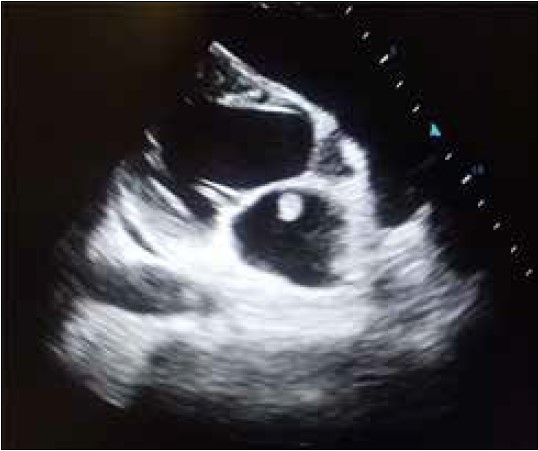
ЕхоКГ: незначна дилатація лівого передсердя (ЛП – 4,3 см), гіпермобільна вегетація фіксована до основи передньої стулки мітрального клапана з боку ЛП діаметром 1,5х1,0 см на ніжці діаметром 4 мм. Дифузна гіпокінезія та незначне зниження загальної скоротливості лівого шлуночка (ФВ ЛШ – 53%). Гідроперикард. Фіброз стулки та недостатність мітрального клапана з регургітацією 1-го ступеня (рис. 6).
Рис. 6. ЕхоКГ пацієнта
УЗД органів черевної порожнини: гепатоспленомегалія, септичні вогнища селезінки, інфаркт селезінки.
КТ органів грудної клітки: двобічна полісегментарна пневмонія з появою вогнищ деструкції та випоту в плевральних порожнинах. КТ органів черевної порожнини з в/в контрастуванням: ознаки інфаркту селезінки з множинними абсцесами, множинні апостеми обох нирок, гепатомегалія. КТ головного мозку з в/в підсиленням: абсцес правої півкулі головного мозку.
Діагноз: Первинний гострий ІЕ МК, спричинений S. аureus, активна стадія. Недостатність МК 2-го ступеня. НК І. Двобічна полісегментарна пневмонія, тяжкого перебігу. Двобічний гідроторакс. Гідроперикард. Абсцес лобно-скроневої ділянки праворуч. Інфаркт селезінки з множинними абсцесами. Залізодефіцитна анемія середньої тяжкості.
Із першого дня стаціонарного лікування пацієнту призначено АБТ (гепацеф 4 г/добу+левофлоксацин 500 мг/добу), дексаметазон внутрішньовенно, без чіткого ефекту на перебіг пневмонії та ІЕ. У зв’язку із збереженням То до 39оС та з урахуванням результатів МКД (S. аureus) на 3-й день проведено заміну АБТ на меропенем 3 г/добу+ванкоміцин 2 г/добу з подальшим переходом на лінезолід 1,2 г/добу+ванкоміцин 2 г/добу. На підставі результатів МКД харкотиння (K. pneumoniae, P. aeruginosa, Proteus spp.) скориговано АБТ: гентаміцин 240 мг/добу+колістин 2 г/добу+ванкоміцин 2 г/добу+флуконазол 150 мг, що в комплексі сприяло терапевтичному успіху.
На тлі терапії вперше було досягнуто стану стійкої нормотермії та зниження запальних маркерів крові [лейкоцити 17*109/л 7,8*109/л, СРБ 95 10 мг/л, прокальцитонін 0,073 нг/мл], проте, за даними ЕхоКГ, встановлено збільшення мітральної регургітації до 2-го ступеня.
На 10-ту добу пацієнта було від’єднано від апарата ШВЛ. Дихання самостійне ефективне. ЧД – 20 на хвилину, SpO2‑98‑100% при FiO2 0,3.
За контрольного ЕхоКГ ущільнення та зменшення розмірів вегетації до 1 см, на КТ органів грудної клітки – регрес пневмонії, за контрольного УЗД селезінки – розрідження вогнищ, за контрольного КТ головного мозку – розсмоктування абсцесу. При МБД крові – збудник не виявлено.
У пацієнта були безперечні показання для екстреного хірургічного лікування (судинні емболії, неконтрольований перебіг інфекційного процесу, порушення функції клапанного апарату), у зв’язку з чим отримав консультацію лікаря-кардіохірурга. Гемодинамічно значущих порушень не виявлено, вегетація ущільнилася та зменшилась. Зважаючи на тяжкість стану пацієнта та відмову родичів пацієнта від хірургічного лікування, від екстреного виконання оперативного втручання утрималися на користь продовження консервативного лікування та динамічного спостереження лікарями-кардіохірургами.
На тлі комбінованої АБТ відзначалася позитивна динаміка – регрес лихоманки, зменшення вегетацій до 0,5 см, регрес лабораторно-запального синдрому, негативні результати МБД крові. Пацієнта виписано в задовільному стані без ознак активності ІЕ.
Через 6 і 12 міс. після виписки зі стаціонару стан пацієнта стабільно-задовільний, епізодів підвищення Тo не відзначалося, за даними ЕхоКГ чітка позитивна динаміка у вигляді організації вегетації, зменшення ступеня регургітації.
Отже, у молодого пацієнта клінічно був гострий достовірний ІЕ МК (два великі критерії Дюка – вегетації на МК, при МБД крові S.aureus та два малі (лихоманка та судинний чинник) із вегетацією 1,5 х 1,0 см, ускладненою помірною клапанною недостатністю, проте поєднання з COVID‑19 і, як наслідок, множинні внутрішньовенні маніпуляції могли трактуватися як схильний стан (третій малий критерій).
Діагноз ІЕ був достовірним та не викликав сумніву. Перебіг ІЕ ускладнився двобічною пневмонією з розвитком гострої дихальної недостатності, що потребувала тривалої ШВЛ.
Особливістю цього клінічного спостереження є важкий контрольований перебіг ІЕ МК у пацієнта з поліморбідним станом, що призводив до ослаблення імунного статусу (важке поранення, супутній COVID‑19) та наявністю обтяжливих чинників для прогресування інфекційного процесу (неадекватна стартова емпірична АБТ і неодноразова зміна АБТ).
Принциповим завданням було визначення етіопатогенетичного агента ІЕ для підбору оптимальної етіотропної АБТ. Призначення специфічної АБТ за збудником сприяло позитивному результату.
Висновки
Сучасний ІЕ вирізняється негативними тенденціями, пов’язаними зі зростанням захворюваності, а також частоти госпіталізації з обтяженням фенотипів, що визначають труднощі діагностики, лікування та несприятливого прогнозу.
Набули також певних обрисів небезпечні тренди зміни етіології ІЕ, як-от збільшення частки стафілококового та ентерококового ІЕ і зниження стрептококового ІЕ, за одночасно збереженої тенденції до зростання частки ІЕ з невстановленою етіологією при МБД, що, своєю чергою, позначається на тактиці лікування та формуванні негативного прогнозу.
Вищезазначене свідчить про необхідність модернізації етіологічного обстеження пацієнтів з ІЕ, оскільки встановлення точного патогену відбивається не лише на діагностиці і виборі АБТ, а й визначає розробку специфічних заходів профілактики та формування уточнених схем емпіричної АБТ, заснованих на епідеміологічних особливостях.
Своєчасна якісна етіологічна діагностика ІЕ відіграє важливу роль для визначення подальшої тактики ведення пацієнтів, підбору оптимальної етіотропної терапії та сприяє успішному результату лікування. Водночас несвоєчасне отримання або брак достовірних даних про етіологію призводять до зростання антибіотикостійких штамів, ускладнень АБТ, збільшення вартості лікування та тривалішого перебування пацієнта в стаціонарі зі зниженням показників виживання.
МБД є базовим методом ідентифікації збудника у пацієнтів з ІЕ, проте у науковій літературі все частіше зустрічаються дані про недостатню діагностичну ефективність цього методу. Актуальним також є впровадження нових підходів, що не залежать від стадії культивування – молекулярно-біологічних методів (ПЛР-дослідження та секвенування).
Емболічні події – один із головних предикторів внутрішньолікарняної летальності. Власне, своєчасна діагностика, прогнозування та профілактика ЕП сприяють зниженню летальності від ІЕ. Пацієнти, які мають серйозні показання до антитромботичного лікування антиагрегантами або антикоагулянтами, мають продовжувати це лікування, якщо немає протипоказань (наприклад, кровотечі).
Найкращими антиемболічними стратегіями нині є рання діагностика, своєчасна адекватна АБТ та ретельний відбір пацієнтів, яким показано раннє хірургічне втручання.
Література
Abdelgawad H., Azab S., Abdel-Hay M.A., Almaghraby A. Clinical features and outcomes of infective endocarditis: a single-centre experience. Cardiovasc J Afr. 2022. Vol. 33. P. 1‑7.
Ackerman I.N., Pratt C., Gorelik A., LiewD. The projected burden of osteoarthritis and rheumatoid arthritis in Australia: A population-level analysis. DOI: 10.1002/acr.23414. Text: electronic. Arthritis Care Res. 2017.
Arnautovic J.Z., Yamasaki H., Rosman H.S. Multiple embolic strokes as a result of Libman-Sacks endocarditis associated with lupus and secondary antiphospholipid antibody syndrome: a case report. Eur Heart J Case Rep. 2018. Vol. 2, № 3.
Arshad V.,Talha K.M., Baddour L.M. Epidemiology of infective endocarditis: novel aspects in the twenty-first century. Expert Review of Cardiovascular Therapy. 2022. Vol. 20, № 1. – P. 45‑54.
Blanchard V., Pagis B., Richaud R. Infective endocarditis in French Polynesia: Epidemiology, treatments and outcomes. Arch Cardiovasc Dis. 2020. Vol. 113, № 4. P. 252‑262.
Bast A., Dohmen P.M., Podbielski A. et al. Rapid Microbiological Diagnostics from Explanted Heart Valves by a Multiplex PCR Assay. J Clin Microbiol. 2019.Vol. 57, № 2: e01575‑18.
Beaton A., Nascimento B.R., Diamantino A.C. Efficacy of a standardized computer-based training curriculum to teach echocardiographic identification of rheumatic heart disease to nonexpert users. Am J Cardiol. 2016. Vol. 117, № 11. P. 1783‑1789.
Benoit M., Desnues B., Mege J.L. Macrophage polarization in bacterial infections. The Journal of Immunology. 2008. Vol. 181, № 6. Р. 3733‑3739.
Bussani R., DE-Giorgio F., Pesel G. Overview and Comparison of Infectious Endocarditis and Non-infectious Endocarditis: A Review of 814 Autoptic Cases. In Vivo. 2019. Vol. 33, № 5. P. 1565‑1572.
Cahill T.J., Baddour L.M., Habib G. Challenges in Infective Endocarditis. J Am Coll Cardiol. 2017. Vol. 69, № 3. P. 325‑344.
Chen L., Zhao Y., Lai D. Neutrophil extracellular traps promote macrophage pyroptosis in sepsis. Cell Death & Disease. 2018. Vol. 9, № 6. Р. 597.
Choi J.H., Park J.E., Kim J.Y. et al. Non-Bacterial Thrombotic Endocarditis in a Patient with Rheumatoid Arthritis. Korean Circ J. 2016. Vol. 46, № 3. P. 425‑428.
Diab M., Tasar R., Sponholz C. Changes in inflammatory and vasoactive mediator profiles during valvular surgery with or without infective endocarditis: A case control pilot study. PLoS One. 2020. Vol. 151, № 2: e0228286.
Duval X., Millot S., Tubiana S. et al. Prevention of Infective endocarditis. Presse Med. 2019. Vol. 48, № 5. P. 556‑562.
Fournier P.E., GourietF., Casalta J.P. Blood culture-negative endocarditis: Improving the diagnostic yield using new diagnostic tools. Medicine (Baltimore). 2017. Vol. 96, № 47: e8392.
Godfrey R., Curtis S., SchillingW. et al. Blood culture negative endocarditis in the modern era of 16S rRNA sequencing. Clinical Medicine. 2020. Vol. 20, № 40. P. 412‑416.
Gupta S., Bravo M.C., Heiman M. Mathematical model of thrombin generation and bleeding phenotype in Amish carriers of Factor IX: C deficiency vs. controls. Thromb Res. 2019. Vol. 182. P. 43‑50.
Habib G., Lancellotti P., Antunes M.J. 2015 ESC Guidelines for the management of infective endocarditis: the Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J. 2016. Vol. 36, № 44. P. 3075‑3128.
Habib G. Management of infective endocarditis. Heart (British Cardiac Society). 2006. V. 92, № 1. P. 124‑30.
Hu W., Wang X., Su G. Infective endocarditis complicated by embolic events: Pathogenesis and predictors. Clin Cardiol. 2021. Vol. 44. P. 307‑315.
Hu X.,Wang J., Li Y. The β-fibrinogen gene 455G / A polymorphism associated with cardioembolic stroke in atrial fibrillation with low CHA2DS2-VaSc score. Sci Rep. 2017. Vol. 7.
Huang D., ChenH., Hu X. Identification of a novel splicing mutation in the fibrinogen gamma chain gene leading to dysfibrinogenaemia in a Chinese pedigree. Pathology. 2015. Vol. 47, № 2.P. 145‑150.
Jeffs L.S., Peh C.A., Nelson A. IgM ANCA in healthy individuals and in patients with ANCA-associated vasculitis. Immunol Res. 2019.
Kim J.H., Lee H.J., Ku N.S. Infective endocarditis at a tertiary care hospital in South Korea. Heart. 2021. Vol. 107, № 2. P. 135‑141.
Lamas C.C., Fournier P.E., Zappa M. Diagnosis of blood culture-negative endocarditis and clinical comparison between blood culture-negative and blood culture-positive cases. Infection. 2016. Vol. 44. P. 459‑466.
Mesa Del Castillo-Payб C., Rodrнguez-Esteban M., Quijada-Fumero A. Infective endocarditis in patients with oncological diseases. Enferm Infecc Microbiol Clin. 2016.
Цzsoy M., Cesur S. Infective endocarditis. J Transl Pract Med. 2022. Vol. 1, № 1. P. 23‑29.
Pйrez S., Rius-Pйrez S. Macrophage Polarization and Reprogramming in Acute Inflammation: A Redox Perspective. Antioxidants (Basel). 2022. Vol. 11, № 7. P. 1394.
Prendki V. Management of elderly patients with infective endocarditis. Clin Microbiol Infect. 2019. Vol. 25, № 10. P. 1169‑1170.
Russell E.A., Walsh W.F., Costello B. Medical management of rheumatic heart disease: a systematic review of the evidence. Cardiol Rev. 2018. Vol. 26, № 4. P. 187‑195.
Selton-Suty C., Maigrat C.H., Devignes J. Possible relationship between antiphospholipid antibodies and embolic events in infective endocarditis. Heart. 2018. Vol. 104, № 6. P. 509‑516.
Shoji M.K., Kim J.H., Bakshi S. Nonbacterial thrombotic endocarditis due to primary gallbladder malignancy with recurrent stroke despite anticoagulation: case report and literature review . J Gen Intern Med. 2019.
Sugiura A., Funabashi N., Ozawa K. et al. Immunological and inflammatory processes in systemic autoimmune disease may not only cause pericardium inflammation, but may also cause mitral valve deterioration and left ventricular wall thickening. Int J Cardiol. 2016. Vol. 215. P. 466‑471.
Veloso T.R., Oechslin F., Que Y.-A. et al. Prophylaxis of Experimental Endocarditis With Antiplatelet and Antithrombin Agents: A Role for Long-term Prevention of Infective Endocarditis in Humans. Journal of Infectious Diseases. 2015. V. 211, № 1. P. 72‑9.
Vincent L.L., Otto C.M. Infective Endocarditis: Update on Epidemiology, Outcomes, and Management. Eur Curr Cardiol Rep. 2018.Vol. 20, № 10. P. 86.
Wang A., Gaca J.G., Chu V.H. Management considerations in infective endocarditis: a review. JAMA. 2018. Vol. 320, № 1. P. 72‑83.
Wei X.B., Su Z., Liu Y.H. Age, creatinine, and ejection fraction (ACEF) score: a simple risk-stratified method for infective endocarditis. QJM. 2019. Vol. 112, № 12. P. 885.
Williams M.L., Doyle M.P., McNamara N. Epidemiology of infective endocarditis before versus after change of international guidelines: a systematic review. Ther Adv Cardiovasc Dis. 2021. Vol. 15. P. 17‑53.
Yang X., Chen H., Zhang D. Global magnitude and temporal trend of infective endocarditis, 1990‑2019: results from the Global Burden of Disease Study. Eur J Prev Cardiol. 2021. P. 1‑10.
Younis S., Stein M., Reisfeld S. Screening for Q fever during other bacterial endocarditis in endemic areas: our experience with three patients. Case Rep Infect Dis. 2019.
Yucel E., BearnotB., Paras M.L. Diagnosis and Management of Infective Endocarditis in People Who Inject Drugs: JACC State-of-the-Art Review. JACC. 2022. Vol. 79, № 20. P. 2027‑2057.