21 березня, 2024
Наслідки непризначення терапії статинами в пацієнтів після ішемічного інсульту
Лікування статинами є ефективним для запобігання несприятливим судинним подіям після ішемічного інсульту. Проте багато пацієнтів не використовують статинотерапію після інсульту. Метою дослідження J. Aivo et al. було вивчити вплив відмови від застосування статинів на несприятливі результати у пацієнтів після ішемічного інсульту. Пропонуємо до вашої уваги огляд результатів цього дослідження, які було опубліковано у статті «Lack of statin therapy and outcomes after ischemic stroke: a population-based study» видання Stroke (2023 Mar; 54 (3): 781‑790).
Інсульт є однією з основних причин смерті та інвалідності у світі (Katan and Luft, 2018). Підвищений рівень ліпопротеїдів низької щільності (ЛПНЩ) збільшує ризик серцево-судинних захворювань (ССЗ) та інсульту (Yaghi and Elkind, 2015). Терапія статинами сприяє зниженню ризику серцево-судинних (СС) подій і смерті після інфаркту міокарда (ІМ), а також ризику рецидиву інсульту та основних коронарних подій після транзиторної ішемічної атаки (ТІА) або інсульту (Schwartz et al., 2001; Amarenco et al., 2009). Хоча переваги лікування статинами є менш очевидними у пацієнтів без атеросклеротичних СС захворювань в анамнезі, проте статинотерапія сприяє зниженню частоти несприятливих цереброваскулярних і СС подій, рівня смертності у пацієнтів з ішемічним інсультом (ІшІ) і фібриляцією передсердь (ФП), уповільнює прогресування захворювань дрібних судин головного мозку (Choi et al., 2019; Guo et al., 2020).
Антитромботичні препарати нині широко застосовують для вторинної профілактики ІшІ, хоча роль статинів є менш з’ясованою. Це відображається у відмінностях між настановами у США та Європі. Так, у настанові Американської кардіологічної асоціації та Американської асоціації з вивчення інсульту (AHA / ASA) рекомендовано призначати статини лише за інсульту атеросклеротичної етіології, а в документі Європейської організації з лікування інсульту (ESO) – незалежно від етіології інсульту (Ford et al., 2022; Dawson et al., 2022). Дотримання режиму лікування статинами також лишається проблемним (Dalli et al., 2021). Зокрема, повідомляється про погану прихильність до статинотерапії приблизно у третини пацієнтів з інсультом в анамнезі, здебільшого через ймовірні побічні ефекти (Kim et al., 2017; Chen et al., 2016; Chung et al., 2018; Newman et al., 2019; Zhang et al., 2013).
Побоювання з приводу того, що статини можуть підвищувати ризик геморагічного інсульту, особливо в пацієнтів із внутрішньомозковим крововиливом (ВМК), також можуть стати на заваді призначенню цих препаратів пацієнтам з інсультом (Amarenco et al., 2009; Scheitz et al., 2014).
Дані про віддалений вплив відмови від застосування статинів після ІшІ є обмеженими. Мета поздовжнього популяційного дослідження J. Åivo et al. – дослідити вплив на стан пацієнтів після ІшІ в разі неприймання статинотерапії.
Матеріали та методи дослідження
Дизайн дослідження
Автори вивчали вплив відмови від терапії статинами за ранніх стадій ІшІ на стан пацієнтів через 1 і 12 років відповідно. Основним результатом була смерть від усіх причин, вторинними – комбінована частота основних несприятливих цереброваскулярних або СС подій MACCE: повторний ІшІ, ІМ або СС смерть), субкомпонент MACCE, геморагічного інсульту та ВМК. Дані щодо дорослих пацієнтів, уперше госпіталізованих із приводу ІшІ від 01.01.2005 до 31.12.2017, отримано з реєстру медичних послуг у Фінляндії. ІшІ був ідентифіковано за кодом I63 Міжнародної класифікації хвороб десятого перегляду (МКХ‑10) як основний діагноз при виписці зі стаціонару (Sipila et al., 2016).
У Фінляндії препарати для лікування ССЗ поза стаціонаром доступні в аптеках лише за рецептом, а ліки за програмою реімбурсації (зокрема, всі досліджувані препарати) відпускають протягом максимального періоду 3 міс. Застосування ліків, які відпускають за рецептом, у ранній післяінсультний період було визначено як придбання ліків протягом 90 днів після виписки з лікарні (Kytц et al., 2022).
Вплив постійного приймання статинів під час спостереження аналізували з 90-денними інтервалами. У межах дослідження аналізували дані пацієнтів, які мали можливість (і потребували) ліків після ІшІ; дані тих, кого не виписали додому або до спеціалізованих закладів (зокрема, до будинків престарілих), із тривалим (>90 днів) перебуванням у медзакладах, а також тих, хто помер упродовж 90 днів після ІшІ, не залучали до дослідження. До уваги брали дані щодо супутніх захворювань і приймання рецептурних ліків (Kerola et al., 2022).
Послідовні переведення в лікарні / відділення після ІшІ об’єднували в одну госпіталізацію, періодом подальшого спостереження вважали проміжок через 90 днів після ІшІ, який завершувався не пізніше 31.12.2018. Середній термін спостереження становив 5,7 (міжквартильний діапазон 3,0‑8,9) року. Відмінності на вихідному рівні були врівноважені зважуванням оберненої ймовірності лікування (von Elm et al., 2007).
Статистичний аналіз
Відмінності між досліджуваними групами аналізували за t- і χ2 -тестами. Для аналізу тенденцій використовували тест Кокрена–Армітеджа. Розміри ефекту щодо характеристик пацієнтів між групами дослідження оцінювали за стандартизованими середніми відмінностями.
Логістичну регресію використовували для визначення схильності до відмови від раннього застосування статинів після ІшІ, зважаючи на вік, стать, супутні захворювання (як-от зловживання алкоголем, анемія, ФП, хронічне захворювання легень, коагулопатія, деменція, депресія, приймання наркотичних препаратів, серцева недостатність [СН], цукровий діабет [ЦД] тощо), виконання тромболізису / тромбектомії, нейрохірургічних втручань; приймання ліків після ІшІ (як-от інгібітори ангіотензинперетворювального ферменту / блокатори рецепторів ангіотензину, інгібітори рецепторів аденозиндифосфату, антигіпертензивні засоби, дипіридамол, езетиміб та пероральні антикоагулянти); періоду, коли стався ІшІ (2005‑2008, 2009‑2012, 2013‑2017). Оцінювали потенційне залишкове зміщення (Е) внаслідок дії чинників впливу, необхідне для зміни первинного результату (VanderWeele and Ding, 2017).
Первинний результат аналізували за допомогою методу Каплана–Мейєра та регресії Кокса, вторинні – із використанням кумулятивної функції частоти та регресії Fine-Gray. Результати представлено у вигляді середніх значень (±стандартна похибка), медіан, часток (%), стандартизованих середніх різниць, відношень ризиків (ВР) або суброзподілу ВР (сВР) із 95% довірчим інтервалом (ДІ). Дані вважалися статистично значущими за значення p<0,05.
Результати дослідження
У дослідженні вивчали дані 59 588 пацієнтів (27,1% не застосовували статини в ранній період після ІшІ). Частка пацієнтів, що не отримували статинотерапію впродовж раннього післяінсультного періоду, знизилася із 41,0% – 2005-го до 17,5% – 2017-го (p<0,0001). Довгострокова прихильність до статинів поступово знижувалася протягом перших років спостереження, але залишалася на плато впродовж тривалішого періоду. Загалом середня частка пацієнтів, які не приймали статини протягом усього 12-річного спостереження, становила 36,0%.
Приймання статинів у ранній післяінсультний період було менш поширеним у жінок, літніх пацієнтів та осіб із ФП, СН, ревматичними захворюваннями, нирковою недостатністю або психічними розладами. Зокрема, пацієнти із ЦД, попереднім ІМ або захворюванням периферичних судин, а також ті, кому було виконано реканалізацію, частіше застосовували статини на ранніх стадіях після ІшІ; вони ж частіше використовували антигіпертензивні, антитромбоцитарні та антикоагулянтні препарати. Відмінності між досліджуваними групами щодо базових характеристик, лікування та приймання інших ліків збалансовано завдяки зважуванню оберненої ймовірності лікування. Було сформовано дві досліджувані групи: пацієнти, які не приймали статинів у ранньому післяінсультному періоді (далі – група без статинотерапії; n=16 196) та ті, хто отримував статинотерапію в цей період (далі – група лікування статинами; n=43 402).
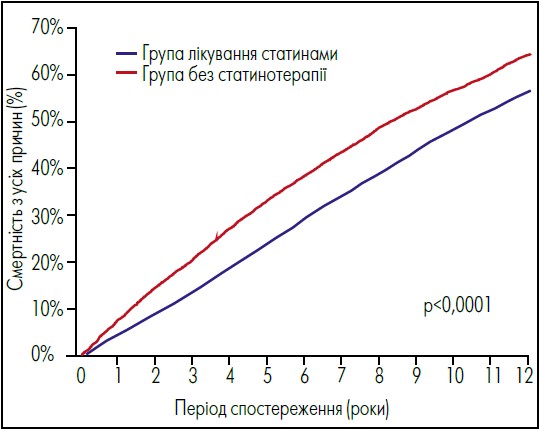
Упродовж спостереження померли 21 422 пацієнти (6868 у групі без статинотерапії) (рис. 1). Через рік смертність від усіх причин становила 7,5% у групі без статинотерапії в ранньому післяінсультному періоді, проти 4,4% у групі лікування статинами (ВР 1,74; 95% ДІ 1,61‑1,87; p<0,0001); через 12 років цей показник становив 56,8% проти 48,6% відповідно (ВР 1,37; 95% ДІ 1,33‑1,41; p<0,0001). Значення показника Е становило 2,08 (95% ДІ 1,99‑2,17). Популяція, у якій не приймали статини під час спостереження, асоціювалася з підвищеним ризиком смерті (ВР 3,03; 95% ДІ 2,96‑3,23; p<0,0001).
Рис. 1. Смертність від усіх причин пацієнтів із/без приймання статинів на ранніх стадіях після ішемічного інсульту
Адаптовано за J. Åivo et al. Lack of statin therapy and outcomes after ischemic stroke: a population-based study. Stroke. 2023 Mar. Vol. 54, № 3. Р. 781‑790.
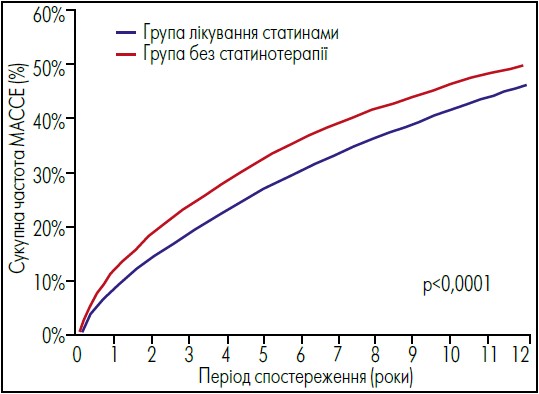
Упродовж спостереження MACCE трапилися у 19 828 пацієнтів (у 6021 у групі без статинотерапії) (рис. 2). Серед усіх пацієнтів у 10 914 стався рецидив ІшІ; у 4394 – ІМ; 11 663 померли через СС причини; 1607 перенесли геморагічний інсульт. Через рік сукупна частота MACCE становила 12,4% у групі без статинотерапії проти 9,3% у групі лікування статинами (сВР 1,36; 95% ДІ 1,29‑1,43; p<0,0001). Після 12-річного спостереження сукупна частота MACCE сягала 50,0% у групі без статинотерапії проти 46,3% у групі лікування статинами (сВР 1,21; 95% ДІ 1,18‑1,25; p<0,0001).
Рис. 2. Сукупна частота основних несприятливих цереброваскулярних або серцево-судинних подій (MACCE) у пацієнтів із/без терапії статинами в ранній період після ішемічного інсульту
Адаптовано за J. Åivo et al. Lack of statin therapy and outcomes after ischemic stroke: a population-based study. Stroke. 2023 Mar. Vol. 54, № 3. Р. 781‑790.
Через рік сукупна частота рецидиву ІшІ становила 8,4% у групі без статинотерапії проти 6,6% у групі лікування статинами (p<0,0001), а через 12 років – 25,4 проти 24,0% відповідно (сВР 1,13; 95% ДІ 1,09‑1,18; p<0,0001). Сукупна частота ІМ через рік спостереження становила 1,9% у групі без статинотерапії проти 1,4% у групі лікування статинами, а наприкінці періоду спостереження цей показник був 11,1% в обох групах (сВР 1,10; 95% ДІ 1,03‑1,17; p=0,006). Імовірність смерті від ССЗ через рік становила 4,2% у групі без статинотерапії проти 2,6% у групі лікування статинами (сВР 1,62; 95% ДІ 1,47‑1,78; p<0,0001) і 34,8% проти 30,2% відповідно через 12 років (сВР 1,32; 95% ДІ 1,27‑1,37; p<0,0001). У групі без статинотерапії сукупна частота геморагічного інсульту становила 0,7 проти 0,6% у групі лікування статинами через рік і 3,5 проти 4,2% через 12 років (сВР 0,91; 95% ДІ 0,81‑1,02; p=0,094).
Сукупна частота ВМК становила 2,9% у групі без статинотерапії, і 3,3% у групі лікування статинами (сВР 0,93; 95% ДІ 0,82‑1,06; p=0,272) через 12 років. За даними аналізу, у групі без терапії статинами в ранній період після ІшІ встановлено підвищену ймовірність смерті та розвитку MACCE у пацієнтів незалежно від статі, віку, ФП, ЦД, виконання реканалізації або використання антигіпертензивних, антитромботичних чи антикоагулянтних препаратів.
Обговорення
Результати обсерваційного поздовжнього популяційного дослідження засвідчили, що у групі без терапії статинами в ранній період після ІшІ пацієнти мали підвищену ймовірність смерті від усіх причин, СС смерті та ішемічних подій. Так, ризик смерті та розвитку MACCE збільшувався у пацієнтів, які не застосовували ранню терапію статинами, незалежно від статі, віку, ФП, ЦД, втручань із реканалізації або використання інших профілактичних препаратів. Ризик IшІ не відрізнявся між двома групами. Застосування статинотерапії сприяє поліпшенню прогнозу після ішемічних подій завдяки дії цих препаратів за декількома механізмами. Основним ефектом є зниження рівня холестерину ЛПНЩ через інгібування 3-гідрокси‑3-метилглутарил коензим А редуктази (Lennernas and Fager, 1997). Крім того, статини чинять сприятливий плейотропний вплив на ендотелій судин, імунну систему, тромбоцити та непосмуговані м’язи судин (Oesterle and Liao, 2019). Як зазначають дослідники, статини стабілізують атеросклеротичні бляшки і мають сприятливий вплив на їхню морфологію та об’єм (Yamada et al., 2009; Marchione et al., 2015). Переваги лікування статинами менш очевидні у пацієнтів без атеросклеротичних ССЗ в анамнезі, втім, вони знижують частоту несприятливих цереброваскулярних і СС подій, а також рівень смертності у пацієнтів з ІшІ та ФП (Choi et al., 2019).
За даними досліджень, статини також уповільнюють прогресування захворювань дрібних судин головного мозку (Guo et al., 2020). Додатково вплив статинів вивчали у межах дослідження профілактики інсульту завдяки зниженню рівня холестерину (SPARCL). Відомо, що не виявлено різниці щодо ефективності лікування статинами незалежно від підтипу інсульту (спричиненого захворюванням великих і дрібних судин та зумовленого невідомою причиною) (Amarenco et al., 2009). У дослідженні в умовах реальної клінічної практики статинотерапія була ефективною в підгрупах пацієнтів з інсультом, а також із ФП (Kim et al., 2017).
У дослідженні J. Åivo et al. у групі без ранньої терапії статинами виявлено підвищену ймовірністю несприятливих результатів незалежно від статі, віку, ФП або ЦД. Отримані дані свідчать, що раннє застосування статинотерапії може бути корисним для всіх пацієнтів з ІшІ. Так, за даними дослідження SPARCL, щоденне застосування статинів високої інтенсивності пацієнтами, які нещодавно перенесли інсульт або ТІА, сприяло зниженню на 16% відносного ризику рецидиву інсульту (Amarenco et al., 2009).
Результати декількох рандомізованих контрольованих досліджень (РКД) підтвердили вплив статинів на зниження ризику повторного інсульту та серйозних СС подій у пацієнтів з ІшІ в анамнезі (Castilla-Guerra et al., 2019). Дані попередніх обсерваційних досліджень засвідчили зв’язок між непризначенням терапії статинами з підвищенням смертності в короткостроковий період (Dearborn-Tomazos et al., 2021; O’Brien et al., 2015). Проте бракує результатів широкомасштабних довгострокових досліджень із тривалим періодом спостереження пацієнтів, які не приймають статини.
Як зазначають дослідники, приймання статинів упродовж перших 90 днів після ІшІ було асоційоване зі зниженням загальної смертності та частоти MACCE як через рік, так і через 12 років. Отримані довгострокові результати підтверджують дані попередніх РКД. Відмінності щодо результатів для тих, хто приймав і не приймав ці препарати в ранній післяінсультний період, фіксували протягом перших років спостереження, які були подібними протягом тривалішого спостереження (за винятком частоти ІМ). Причини спостережуваної моделі сукупної захворюваності на ІМ під час тривалого спостереження тих, хто приймав статини в ранній післяінсультний період, лишаються невідомими, але, на думку авторів, вони можуть бути пов’язані з потенційними відмінностями чинників ризику рецидиву ІшІ та первинного ІМ. За даними J. Åivo et al., 25% пацієнтів не розпочинали терапію статинами відразу після ІшІ, а 36% не отримували статинів протягом 12-річного спостереження. Ці результати відповідають попереднім висновкам.
У дослідженні F. Colivicchi et al. (2007) продемонстровано, що 38,9%пацієнтів із ІшІ припиняли терапію статинами протягом 12 міс. після виписки; середній час від виписки до припинення приймання статинів становив 48,6 доби. За даними дослідження P.W. Chung et al. (2018), близько 35% пацієнтів не дотримувалися режиму приймання статинів через 3 і 6 міс. після ІшІ. В іншому дослідженні 21,8% пацієнтів не отримували статини, а 34,9% учасників не дотримувалися належної схеми лікування статинами після ІшІ (Vitturi and Gagliardi, 2021).
Попри те, що загальна прихильність до приймання статинів виглядає відносно недостатньою, частка пацієнтів, які не застосовували статини на ранніх стадіях після ІшІ у межах дослідження знизилася із 41% (2005) до 17,5% (2017) є лише обмежені попередні дані про тенденції використання статинів і дотримання режиму. Як зазначають J. Kim et al. (2017), частка пацієнтів, які отримували статини після ІшІ, зросла з 18,3% (2002) до 63,1% (2012). У масштабному ретроспективному когортному дослідженні, проведеному в США, у пацієнтів із новими атеросклеротичними СС-захворюваннями частота застосування статинів зросла з 50,3% (2007) до 59,9% (2016). Пацієнти з ішемічною хворобою серця (ІХС) частіше отримували статини, ніж з ІшІ. Так, 2016 р. статини застосовували 80,9% хворих на ІХС та 65,8% пацієнтів із ІшІ/ТІА (Yao et al., 2020).
Через антитромбоцитарні та антитромботичні властивості статинів може зростати ризик геморагічного інсульту (Undas et al., 2014). Результати дослідження SPARCL і HPS (Heart Protection Study) підтвердили підвищений ризик ВМК, пов’язаний із застосуванням статинів у пацієнтів із ІшІ в анамнезі (Amarenco et al., 2009; Collins et al., 2003). М.В. Westover et al. (2011) вважали, що слід уникати терапії статинами у пацієнтів із ВМК в анамнезі. Втім, пізніші метааналізи продемонстрували дещо суперечливі дані. Зокрема, у двох масштабних метааналізах (даних 23 і 33 РКД відповідно) не виявлено зв’язку між лікуванням статинами та частотою ВМК (McKinney and Kostis, 2012; Hackam et al., 2012). І навпаки, дані оновленого метаналізу засвідчили підвищений ризик геморагічного інсульту, особливо в пацієнтів із ІшІ/ТІА в анамнезі (Sanz-Cuesta and Saver, 2021).
Результати масштабного популяційного дослідження не підтвердили, що статини збільшують ризик ВМК у пацієнтів із попереднім інсультом (Ribe et al., 2020). У загальнонаціональному дослідженні типу «випадок-контроль», проведеному в Данії, більша тривалість приймання статинів була пов’язана з меншим ризиком першого клінічного випадку ВМК (Rudolph et al., 2022).
За даними ще одного масштабного популяційного дослідження, початок терапії статинами після ВМК був асоційований зі зниженням ризику повторного ВМК (Lin et al., 2019).
Отже, результати J. Åivo et al. узгоджуються із цими доказами безпеки терапії статинами щодо ризику геморагічного інсульту. Серед переваг цього дослідження, як вважають автори, є використання загальнонаціональних реєстрів, що дало змогу охопити якнайбільшу частку пацієнтів після інсульту, щоб уникнути упередженості під час відбору. Отримані дані було скориговано із широким залученням зміщень і зіставлень схильностей пацієнтів. Хоча залишкові зміщення можуть мати вплив на результати (соціально-економічний статус безпосередньо не визначали). Пацієнтів, які не виписані додому або до закладів домашнього типу, було виключено з дослідження. Вони, на думку авторів, матимуть поганий прогноз і навряд чи отримають значну користь внаслідок застосування препаратів для вторинної профілактики. На додаток до оцінок граничного ефекту, основане на аналізі зважування оберненої ймовірності лікування, звичайний аналіз (залежно від часу лікування) засвідчив зв’язок у групі без статинотерапії під час спостереження та первинним результатом (смертю). Однак дані аналізу, проведеного під час лікування, слід інтерпретувати з обережністю, оскільки вони не мають впливу на причини припинення лікування, що може призвести до необ’єктивності (Yang et al., 2019).
Висновки
У межах представленого популяційного дослідження приблизно чверть пацієнтів не застосовували статини після виписки зі стаціонару, до якого вони були госпіталізовані з приводу ІшІ. За даними, отриманими J. Åivo et al., брак терапії статинами був достовірно асоційований із ризиком смерті та розвитку MACCE. Так, у пацієнтів, які не приймали статини, незалежно від віку, статі, ФП, втручань із реканалізації або приймання інших препаратів для вторинної профілактики, ризик смерті збільшувався. Показово, що ризик ВМК не відрізнявся у тих, хто приймав або не приймав статини. Отже, статинотерапія може бути корисною для всіх пацієнтів з ІшІ, незалежно від його підтипу, що підтверджує важливість заходів для сприяння своєчасному застосуванню статинів після інсульту.
Довідка «ЗУ»
Сьогодні на фармацевтичному ринку України серед препаратів статинів доступні лікарські засоби виробництва компанії ANANTA MEDICARE – Лімістин (аторвастатин) і Роместін (розувастатин). Завдяки потужній доказовій базі та досвіду застосування ці статини є препаратами вибору.
Основним показанням для застосування препарату Лімістин є запобігання ризику інфаркту міокарда (ІМ), інсульту, проведення процедур реваскуляризації та розвитку стенокардії у дорослих пацієнтів без клінічно виразної ішемічної хвороби серця (ІХС), але з декількома чинниками ризику її розвитку (тютюнопаління, артеріальна гіпертензія [АГ], низький рівень ліпопротеїдів високої щільності [ЛПВЩ], наявність ранньої ІХС у сімейному анамнезі). Дорослим пацієнтам із цукровим діабетом (ЦД) 2-го типу без клінічно виразної ІХС, але з кількома чинниками ризику її розвитку (ретинопатія, альбумінурія, тютюнопаління, АГ), препарат рекомендовано для зменшення ризику виникнення ІМ та інсульту. Дорослим пацієнтам із клінічно виразною ІХС вказаний препарат показаний для зменшення ризику: нелетального ІМ, летального та нелетального інсульту, проведення процедур реваскуляризації, госпіталізації через застійну серцеву недостатність чи розвиток стенокардії. Лімістин застосовують також у пацієнтів із гіперліпідемією (для зменшення підвищених рівнів загального холестерину, холестерину ЛПНЩ, аполіпопротеїну В і тригліцеридів, для підвищення рівня холестерину ЛПВЩ тощо).
Показаннями для застосування препарату Роместін передусім є лікування гіперхолестеринемії у дорослих, підлітків і дітей віком від 10 років із первинною гіперхолестеринемією або змішаною дисліпідемією; приймання як доповнення до дієти (коли недостатньо дотримання дієти та немедикаментозних засобів, як-от фізичні вправи, зниження маси тіла). Роместін застосовують також за гомозиготної сімейної гіперхолестеринемії та для профілактики серцево-судинних порушень у пацієнтів із високим ризиком першого випадку серцево-судинного порушення.
Обидва препарати випускають у формі таблеток, вкритих плівковою оболонкою, із дозуванням діючої речовини для Лімістину (аторвастатин) 20 і 40 мг та Роместіну (розувастатин) 10 і 20 мг.
Біоеквівалентність обох препаратів доведено у відповідних дослідженнях біодоступності.
Підготувала Наталія Купко