5 серпня, 2024
Метформін: огляд потенційних механізмів дії та плейотропних терапевтичних ефектів поза діабетом
Метформін – пероральний цукрознижувальний засіб, який зменшує базальний і постпрандіальний рівень глюкози в плазмі при цукровому діабеті (ЦД) 2 типу. У 1994 р. FDA (Управління із санітарного контролю харчових продуктів і медикаментів) США схвалило використання метформіну для лікування діабету, а наступного року він став комерційно доступним [1-3]. У 1998 р. UKPDS (Проспективне дослідження з вивчення діабету у Великій Британії) виявило, що довгострокова терапія метформіном пов’язана зі зниженням ризику гіпоглікемії, частоти серцево-судинних захворювань (ССЗ) і поліпшенням рівня виживання [5, 6]. У 2011 р. Всесвітня організація охорони здоров’я включила метформін до переліку основних (життєво необхідних) лікарських засобів [3, 4].
Сьогодні метформін має статус протидіабетичного препарату, що найчастіше використовується в пацієнтів із ЦД 2 типу окремо або в комбінації з іншими препаратами [7]. Крім підвищення чутливості до інсуліну цукрознижувальні ефекти метформіну реалізуються шляхом зниження синтезу глюкози в печінці та всмоктування глюкози в кишечнику. Метформін відрізняється від інших груп пероральних цукрознижувальних препаратів тим, що не призводить до гіпоглікемії чи гіперінсулінемії [8]. Завдяки плейотропним ефектам препарату досліджуються перспективи його використання для зниження ваги, лікування синдрому полікістозних яєчників (СПКЯ), злоякісних пухлин та ін. [9].
Механізм дії
Метаболізм глюкози
Передусім, метформін – це цукрознижувальний засіб, ефективність і безпеку якого визнано як у монотерапії, так і в комбінації з іншими антидіабетичними засобами, він є препаратом вибору при терапії ЦД 2 типу [5, 16, 17]. Гідрофільна природа метформіну ускладнює його проходження крізь клітинну мембрану, отже, його проникнення в клітину та секреція залежать від мембранних транспортерів, таких як hENT4, MATE, і представників родини SLC22A, зокрема ОСТ 3 [18, 19]. Останній відповідає за транспорт ліків та інших молекул шляхом всмоктування, метаболізму і виведення в тонкій кишці, печінці та нирках [20].
Встановлено, що метформін знижує рівень глюкози в крові переважно завдяки своїй дії на печінку, здебільшого за рахунок зменшення глюконеогенезу, що сприяє обмеженню ендогенного виробництва глюкози печінкою без супутнього підвищення концентрації інсуліну в плазмі [21, 22].
У здорових осіб глюконеогенез відповідає за приблизно 28-97% глюкози, що виробляється печінкою, і залежить від характеру харчування [23]. У разі тривалого ЦД 2 типу цей механізм може мати вирішальне значення, оскільки посилене та нерегульоване вивільнення глюкози печінкою є значущим патофізіологічним механізмом і його контроль може значною мірою поліпшити прогноз захворювання [10].
Висока експресія SLC22A1 у печінці та висока концентрація метформіну в портальному кровообігу порівняно з іншими частинами тіла сприяє його посиленому впливу на шляхи глюконеогенезу в печінці [24]. Наявні дані свідчать, що метформін посилює активність IRS‑2 (cубстрат рецептора інсуліну 2) у клітинах і переміщує транспортери глюкози, такі як транспортер глюкози (GLUT)-1, для посилення поглинання глюкози клітинами [25-29].
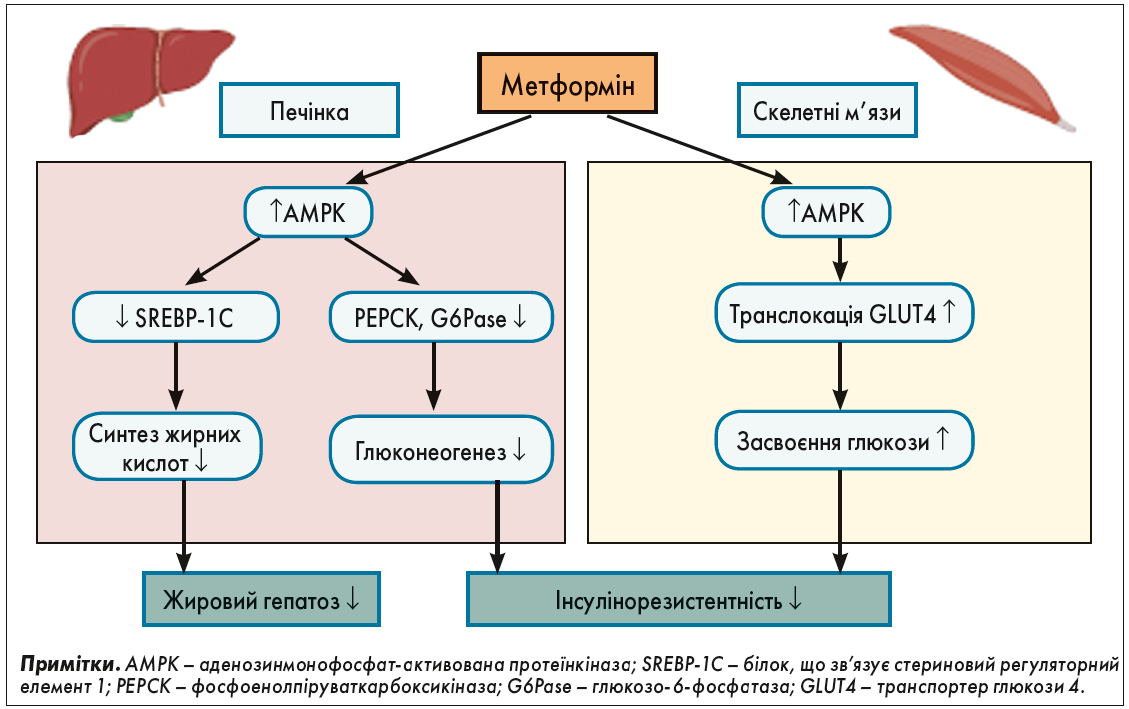
Було також виявлено, що метформін внутрішньоклітинно активує аденозинмонофосфат-активовану протеїнкіназу (AMPK), яка діє як датчик енергії в клітині. Активація AMPK запускає катаболічні процеси в клітинах, що призводить до утворення АТФ, тоді як анаболічні шляхи використання АТФ для синтетичних процесів відключаються [30-32]. Отримані дані показують, що AMPK є важливим фасилітатором складних внутрішньоклітинних молекулярних сигнальних шляхів метаболізму та росту, які діють інтегровано, щоб забезпечити баланс клітинної енергії (рис.) [30, 32].
Рис. Сприятливі ефекти метформіну
Метформін також діє за допомогою різноманітних периферичних механізмів, таких як посилення периферичного поглинання глюкози скелетними м’язами за рахунок підвищення активності GLUT4, модулювання всмоктування глюкози з кишечнику шляхом затримки всмоктування, а також стимуляція активності глюкагоноподібного пептиду‑1 (ГПП‑1) [42-46].
Результати досліджень показують, що в пацієнтів із ЦД 2 типу спостерігають порушення складу кишкової мікробіоти, також було виявлено, що метформін модулює склад мікробіоти, зменшуючи кількість Bacteroides fragilis [47]. Це призводить до підвищення рівня глікоурсодезоксихолевої кислоти, пригнічення активності кишкового фарнезоїду X-рецептора, що, своєю чергою, поліпшує толерантність до глюкози [48].
Незважаючи на численні дослідження метформіну, точний механізм його дії все ще залишається нез’ясованим.
Серцево-судинні переваги
Серцево-судинні захворювання є однією з головних причин смертності та захворюваності в усьому світі, і ймовірність їх розвитку зростає під впливом таких чинників ризику, як малорухливий спосіб життя, діабет, ожиріння, гіперліпідемія та гіпертензія [51]. Гіперглікемія може призводити до окислювального стресу, дисліпідемії та ендотеліальної дисфункції, які підвищують серцево-судинний ризик [42].
Було встановлено, що метформін знижує частоту ССЗ і пов’язану з ними смертність порівняно з іншими антидіабетичними препаратами [52-55].
Нещодавнє систематичне дослідження та метааналіз, проведені за участю 701 843 учасників із ЦД 2 типу, які приймали метформін, і 1 160 254 осіб контрольної групи, показали зниження ризику смертності [ВР=0,44 (0,34-0,57)] або несприятливих серцево-судинних подій [ВР=0,73 (0,59-0,90)] на тлі застосування метформіну [56]. Подібні результати також були отримані після метааналізу досліджень, де метформін знижував смертність від усіх причин і серцево-судинну смертність у пацієнтів із захворюваннями коронарних артерій [57]. Досі триває дослідження «MetCool ACS», розпочате для оцінки ефективності метформіну при гострому коронарному синдромі в пацієнтів без діабету. Випробування триває і, як очікують, буде завершено в 2025 р., тому немає остаточних доказів щодо захисного ефекту метформіну при ССЗ [58].
Також існують докази того, що метформін може бути корисним при серцевій недостатності (СН) завдяки модуляції енергетичного метаболічного стану міокарда шляхом активації AMPK і контрольованої регуляції метаболізму ліпідів і глюкози в кардіоміоцитах [60].
Точний механізм невідомий, але, імовірно, метформін діє шляхом підвищення доступності NO, обмеження інтерстиціального фіброзу та відкладення продуктів КППГ, а також стримування апоптозу кардіоміоцитів, що призводить до зменшення ремоделювання серця. Описані ефекти дають можливість зберегти систолічну і діастолічну функції лівого шлуночка, таким чином мінімізуючи схильність до серцевих розладів. Переваги метформіну при СН також були доведені в рандомізованих контрольованих дослідженнях, і сьогодні його можна вважати безпечним для використання в разі стабільної хронічної СН за умови постійного моніторингу функції нирок і серця [15, 61, 62].
Метформін і його протипухлинні властивості
Доказова база свідчить про те, що пацієнти з діабетом мають підвищений ризик розвитку онкологічних захворювань [98]. Когортний аналіз, проведений на півночі Італії, продемонстрував, що в пацієнтів, які страждають на ЦД 2 типу щонайменше 2 роки, загальна частота виникнення раку була вищою, ніж у пацієнтів без ЦД 2 типу [99]. Дані наукової літератури свідчать, що ЦД 2 типу здебільшого пов’язаний із підвищеним ризиком виникнення різних видів раку, зокрема раку підшлункової залози, печінки, молочної залози, товстого кишечнику, ендометрію та сечового міхура [100]. Подібні результати були отримані Bjornsdottir та співавт., які провели національне обсерваційне дослідження за участю пацієнтів із діабетом у період із 1998 по 2014 рік і виявили, що хворі на ЦД 2 типу мають більший ризик розвитку різних видів онкологічної патології [101]. Проте це не може бути повністю пов’язане з діабетом, а може бути зумовлене й іншими факторами ризику, такими як вага, особливості дієти, фізична активність і куріння / вживання алкоголю [100]. Ожиріння саме по собі здатне бути окремим незалежним фактором ризику розвитку раку. Наукові дані свідчать, що жирова тканина в нашому організмі також вивільняє низку молекул, таких як інтерлейкін-6 (ІЛ-6), фактор некрозу пухлин-α (ФНП-α), лептин, адипонектин тощо [102], деякі, наприклад ІЛ-6, можуть активувати сигнальний шлях білка STAT (Signal Transducer and Activator of Transcription, передавач сигналу та активатор транскрипції) і призводити до підвищення виживання, інвазії та проліферації клітин карциноми, одночасно захищаючи їх від імунітету хазяїна [103].
На основі клінічних і доклінічних досліджень з’являється все більше доказів того, що метформін чинить протипухлинну дію. Метааналіз 17 досліджень показав значне зниження ризику розвитку раку при застосуванні метформіну в пацієнтів із діабетом або без нього порівняно з пацієнтами, які не приймали метформін [104]. У схожому дослідженні, результати якого було опубліковано в низці статей, також повідомлялось, що застосування метформіну може знизити ризик розвитку раку, якщо порівняти цей засіб з іншими протидіабетичними препаратами [105]. Аналіз 8 когортних досліджень показав, що застосування метформіну в пацієнтів із ЦД 2 типу пов’язане зі зменшенням захворюваності на рак порівняно з монотерапією препаратами сульфонілсечовини [106]. Метааналіз досліджень раку легень також продемонстрував подібні результати, а це означає, що застосування метформіну може знизити ризик розвитку раку легень у пацієнтів із ЦД 2 типу на відміну від інших цукрознижувальних засобів [107]. Доказова база доклінічних досліджень свідчить про те, що метформін стримує проліферацію клітин і сприяє частковій зупинці клітинного циклу в культурі клітинних ліній ракових клітин [108 -110]. Кілька досліджень на лініях ракових клітин показали, що лікування метформіном призводить до пригнічення розвитку і проліферації та індукує апоптоз ракових клітин таких органів, як молочна залоза, нирки, мозок, яєчники, легені та ендометрій [108-116].
Метформін також показав переваги застосування в тих пацієнтів із діабетом, які отримують неоад’ювантну хіміотерапію. Пацієнти, які отримували метформін разом із хіміотерапією, мали ліпшу патоломорфологічну відповідь порівняно з групою, учасники якої метформін не приймали [130]. Усі ці різноманітні дані свідчать про те, що метформін демонструє свою антипроліферативну активність у ракових клітинних лініях. Це може бути корисним у лікуванні онкологічної патології, але концентрація, при якій ці ефекти проявляються, є доволі високою проти терапевтичних рівней у плазмі крові і може виявитися токсичною, тому в майбутньому необхідно провести дослідження з удосконаленими протоколами, в яких передбачено більш низьку концентрацію, щоб встановити ефективну протиракову дію метформіну.
Нейропротекторна роль
Ще одним плейотропним ефектом метформіну є здатність цього звичайного протидіабетичного препарату уповільнювати процеси старіння шляхом модуляції мітохондріального метаболізму та сигналінгу інсуліну [131]. Докази свідчать, що метформін проникає крізь гематоенцефалічний бар’єр у мозок і виявляє різноманітні нейропротекторні ефекти, які можуть виявитися корисними при когнітивних порушеннях, хворобі Гантінгтона, інсульті та, імовірно, деменції [132-137].
При хворобі Паркінсона (ХП) накопичення α-синуклеїну вважається однією з ознак нейротоксичності [138-140]. У доклінічних дослідженнях було виявлено, що метформін знижує експресію α-синуклеїну та загальну кількість α-синуклеїн-позитивних клітин [141]. У моделі ХП на C. elegans (вільноживуча нематода) було виявлено, що лікування метформіном знижує накопичення α-синуклеїну та зменшує втрату дофамінергічних нейронів [142]. В аналогічній моделі мишей, які отримували ротенон, було виявлено, що метформін захищає ротенон-індуковані дофамінергічні нейрони від дегенерації шляхом мінімізації перекисного окислення ліпідів [143]. Фосфорилювання α-синуклеїну зменшується за рахунок підвищення активності фосфатаз під впливом метформіну [144]. На основі вищезазначених доказів можна зробити висновок – метформін, маючи нейропротекторні властивості, може діяти як хворобомодифікувальний препарат при ХП.
Терапевтичне застосування метформіну
Метформін і ЦД
Метформін отримав статус «основної терапії» в пацієнтів із ЦД 2 типу, в яких цільовий глікемічний рівень не досягається, незважаючи на дієту та інші зміни способу життя. Причиною такої популярності є ефективний контроль глікемії при використанні препарату, відсутність збільшення ваги, широкий терапевтичний діапазон, безпека і низька вартість [63]. Окрім того, метформін забезпечує помірний кардіопротекторний ефект, поліпшує ліпідний профіль і знижує рівні запальних маркерів.
Метформін сам по собі та в комбінації з іншими цукрознижувальними засобами ефективно знижує рівень глюкози в крові в разі ЦД 2 типу [64, 65]. Окрім контролю рівня глюкози метформін також допомагає при супутніх захворюваннях, пов’язаних із діабетом. ЦД – відомий чинник ризику розвитку ішемічної хвороби серця. Масштабне рандомізоване клінічне дослідження UKPDS в популяції з вперше діагностованим ЦД 2 типу виявило значне та стійке зниження ризику інфаркту міокарда (33%; p=0,005), смерті від будь-яких причин (27%; p=0,002) і кінцевої точки, пов’язаної з діабетом (21%; p=0,01) в осіб, які отримували метформін [66].
Нещодавно було висунуто гіпотезу щодо використання метформіну як допоміжного лікування при ЦД 1 типу для зменшення необхідної дози інсуліну та запобігання довгостроковим ускладненням діабету, таким як збільшення ваги, прогресування атеросклерозу, а також підвищення рівня холестерину ліпопротеїнів низької щільності (ЛПНЩ) [67].
Метформін при порушенні толерантності до глюкози / предіабеті
Метформін є препаратом для початкової терапії ЦД 2 типу. Його також використовують у пацієнтів із предіабетом для відстрочення або запобігання розвитку захворювання [72]. Нещодавнє збільшення поширеності предіабету підкреслює важливість обізнаності щодо цього стану і зусиль, спрямованих на зменшення або відстрочення початку ЦД 2 типу. Найліпшою стратегією контролю ризику діабету в разі предіабету є корекція способу життя з подальшим фармакологічним втручанням. Доступними фармакологічними варіантами є метформін, інгібітори альфа-глюкозидази, тіазолідиндіони та агоністи ГПП‑1. Проте, на відміну від інших протидіабетичних препаратів, ефективність і безпека метформіну підтверджені доказами, що робить його кращим фармакологічним засобом для профілактики діабету [73-75]. У дослідженні DPP (програма профілактики діабету) 3234 пацієнти з предіабетом були рандомізовані на 3 групи: групу модифікації способу життя; групу, де учасники приймали метформін у дозі 850 мг двічі на добу, і групу плацебо.
Після середньої тривалості спостереження 2,8 року частота виникнення діабету знизилася на 31% у групі метформіну та на 58% у групі модифікації способу життя порівняно з групою плацебо [76]. У тому самому дослідженні після 15-річного спостереження середня річна частота діабету була на 27% нижчою в пацієнтів, які модифікували спосіб життя, і на 18% нижчою в тих, хто використовував метформін, порівняно з плацебо [76]. У 2022 р. Американська діабетична асоціація (ADA) рекомендувала терапію метформіном для дорослих із предіабетом, зокрема віком від 25 до 59 років з ІМТ ≥35 кг/м2, рівнем глікованого гемоглобіну (HbA1c) ≥6,0%, рівнем глюкози в плазмі натще ≥110 мг/дл та в жінок, які в минулому хворіли на гестаційний ЦД. Тривале застосування метформіну пов’язане з дефіцитом вітаміну B12, тому ADA рекомендує періодичне визначення рівня цього вітаміну в осіб, які приймають метформін [74].
Метформін і втрата ваги
Метформін активно досліджується як препарат для зниження ваги в пацієнтів з ожирінням, як із супутнім ЦД, так і без нього.
Передбачуваний механізм, за допомогою якого метформін знижує вагу, полягає в зменшенні споживання їжі та підвищенні чутливості до інсуліну за рахунок тканиноспецифічної дії AMPK. Крім того, метформін підвищує рівень ГПП‑1, гормону, який виділяється в кишечнику, і знижує рівень глюкози в крові шляхом зниження апетиту та зменшення абсорбції вуглеводів [77-79].
Дослідження було проведено за участю 154 учасників з ожирінням, без супутнього ЦД 2 типу і з нормальним рівнем глюкози незалежно від чутливості до інсуліну. Середня доза метформіну становила 2230 мг/добу. Загальна втрата ваги в групі, яка отримувала метформін, становила 5,8±7 кг. Зменшення ваги було дуже суттєвим порівняно з контрольною групою (p<0,0001), де середній приріст ваги становив 0,8±3,5 кг. Дослідження також виявило, що втрата ваги внаслідок прийому метформіну була більш вираженою в пацієнтів із сильною інсулінорезистентністю порівняно з чутливими до інсуліну учасниками [80].
Метформін також порівнювали з іншими пероральними гіпоглікемічними засобами для зниження ваги в пацієнтів із ЦД 2 типу. Kahn та співавт. провели чотирирічне дослідження за участю 4360 пацієнтів із ЦД і виявили, що пероральні гіпоглікемічні засоби розиглітазон і глібурид спричинили збільшення ваги на 4,8 і 1,6 кг відповідно, тоді як прийом метформіну супроводжувався втратою ваги на 2,7 кг протягом такого самого періоду використання [81].
Ще одне дослідження показало, що агоністи рецепторів ГПП‑1 і метформін зменшили масу тіла приблизно на 3,4±3,0 і 1,9±2,9 кг відповідно в пацієнтів без ЦД [82].
Дослідницька група Програми профілактики діабету провела ще одне довготривале спостереження для оцінки ефективності і стійкості ефекту метформіну в пацієнтів з ожирінням і ЦД для зниження ваги. Аналіз тривав 10 років і складався зі сліпої (2,8 року) та відкритої (7 років) фази. В обох фазах втрата ваги була більшою в групі метформіну порівняно з групою плацебо та прямо пов’язана з прихильністю до терапії метформіном (сліпа фаза 2,06 ±5,65 проти 0,02 ±5,52%; p<0,001; відкрита фаза 2,0 проти 0,2%; p<0,001) [83].
У нещодавньому метааналізі було здійснено спробу узагальнити вплив метформіну на пацієнтів з ожирінням у різних групах населення. Загалом було оцінено 21 дослідження (n=1004). ІМТ використовували як кінцевий показник для визначення впливу метформіну на втрату ваги. Дослідження показало, що метформін спричиняє помірне зниження ІМТ (середньозважена різниця -0,98; від -1,25 до -0,72) серед учасників дослідження. Зменшення ІМТ в учасників з ожирінням і діабетом або без нього становило 1,1 та 1,3 одиниці відповідно. Результати в обох категоріях були статистично значущими. Оскільки зниження ІМТ на 1 одиницю недостатньо, щоб спричинити відчутну втрату ваги, автори запропонували масштабніші клінічні випробування для оцінки ефективності метформіну для схуднення [84].
Метформін і СПКЯ
Патогенез СПКЯ здебільшого зумовлений інсулінорезистентністю; отже, для лікування СПКЯ намагалися застосовувати препарати, які збільшують чутливість до інсуліну, такі як метформін [85, 86]. Було проведено метааналіз для вивчення ефективності метформіну як препарату, що індукує овуляцію, у жінок із СПКЯ. Як показали результати, у групі метформіну частота овуляції була вища, ніж у групі плацебо (ВР [відношення ризиків]= 2,64; 95% ДІ 1,85-3,75; I2=61%). Метформін також знижував рівень тестостерону в пацієнток із СПКЯ. Ефект був очевиднішим у жінок без ожиріння [87].
Метформін і рак молочної залози
У клітинах раку молочної залози (РМЗ) метформін пригнічує активацію mTOR шляхом фосфорилювання інгібіторної ділянки Ser789 IRS-1 через активацію AMPK. Метформін також бере участь у пригніченні промоторів IGF-1R та IR. Ко-експресія IGF1R та MRP1 (Multidrug Resistance-Associated Protein 1, білок, асоційований із множинною лікарською резистентністю-1) пов’язана з погіршенням відповіді на протионкологічні препарати [130]. Метформін пригнічує mTOR шляхом активації AMPK через LKB1-залежний механізм, що значно знижує швидкість проліферації клітин у багатьох ракових клітинних лініях [213].
Ефективність метформіну як профілактичного засобу в жінок, схильних до ризику розвитку РМЗ, зараз вивчається в багатьох дослідженнях. Вплив метформіну на осіб з ожирінням або надмірною вагою, які мають підвищений ризик РМЗ залежно від сімейного анамнезу або наявності в анамнезі атипової гіперплазії МЗ, вивчається в рандомізованому клінічному дослідженні (NCT01793948). Пацієнтки з атиповою гіперплазією в анамнезі, сімейним анамнезом РМЗ, карциномою in situ або високим ризиком за моделлю Gail включені в інше поточне дослідження (NCT01905046) [216]. Ураховуючи, що гормональна хіміопрофілактика в носіїв генної мутації BRCA1 є дискутабельною, здатність метформіну зменшувати метаболічну перебудову та пухлиноініціювальний потенціал BRCA1-«епітеліальних клітин» МЗ in vitro може вказати нові шляхи методів хіміопрофілактики із застосуванням метформіну в носіїв мутації BRCA1.
Метформін і рак ендометрію
Гени, залучені в гліколіз та ліпогенез, більш поширені, коли йдеться про пухлинний ендометрій, ніж у нормальному ендометрії. Деякі клітини раку ендометрію людини мають помітно підвищену активність транспортера глюкози GLUT6 та активацію AKT порівняно з незлоякісними клітинами [217]. Плейотропний метаболічний інгібітор, такий як метформін, спричиняє цитотоксичність у культурах клітин раку ендометрію, як це було продемонстровано в попередніх дослідженнях. Метформін in vitro запобігає росту обох типів клітинних ліній «раку ендометрію» людини – типу I та II, а високі дози метформіну (5 або 10 мМ) спричиняють апоптоз p53-дефіцитних клітин раку ендометрію [219].
Вплив метформіну на виникнення раку ендометрію привернув увагу деяких дослідників. За даними кількох епідеміологічних досліджень, чиї результати були проаналізовані різними організаціями, що вивчають цю проблему, у пацієнтів, які приймали метформін, спостерігалося зниження загальної захворюваності на рак [221-226].
Метааналіз 6 досліджень, який було зроблено у 2017 р., свідчить про те, що пацієнти, хворі на ЦД 2 типу, з раком ендометрію, які приймали метформін, мали вищу виживаність, ніж ті, хто не приймав метформін, так само як і пацієнти без діабету [234]. Згідно з даними метааналізу 28 досліджень, у пацієнтів із супутнім діабетом застосування метформіну пов’язане зі зниженням смертності від усіх причин і багатьох форм раку, у тому числі від раку ендометрію [235].
Метформін і колоректальний рак
Відомо, що з ЦД 2 типу часто пов’язані різні форми раку. Висока частота пухлиногенезу пов’язана з гіперінсулінемією, резистентністю до інсуліну, підвищеним рівнем інсуліноподібного фактору росту (ІФР)-1 і гіперглікемією. Метформін, як сенсибілізатор інсуліну, знижує резистентність до інсуліну та гіперінсулінемію.
Згідно з результатами останніх метааналізів метформін достовірно знижував частоту колоректальної аденоми та колоректального раку (КРР) у пацієнтів із ЦД [88, 89]. Метформін опосередковано знижує ризик КРР, зменшуючи частоту аденоми товстої кишки в осіб з акромегалією та запальних захворювань кишечнику в пацієнтів із ЦД. Відповідно до результатів клінічних досліджень II фази протиракові переваги таких хіміотерапевтичних препаратів, як 5-FU (5-фторурацил), а також іринотекан при рефрактерному КРР, можуть бути посилені додаванням метформіну.
Метформін також знижує ймовірність розвитку нових поліпів і аденом у людей без діабету. З огляду на результати попередніх доклінічних і клінічних досліджень, доцільно оцінити вплив метформіну на осіб із нормоглікемією і КРР та розширити терапевтичні показання до застосування препарату для лікування або профілактики КРР у групах високого ризику [90].
Метформін і меланома
Однією з найнебезпечніших пухлин у молодих людей і підлітків є меланома шкіри, яка виникає внаслідок альтерації меланоцитів, що продукують пігмент. Метастатична меланома, віддалено поширюючися за межі шкіри, одна з найагресивніших видів раку людини із середньою тривалістю виживання лише від 6 до 9 місяців. Процес, відомий як аеробний гліколіз, при меланомі є результатом здатності клітин меланоми змінювати спосіб переробки глюкози і виробляти більше енергії [254]. Відомо, що метформін є одним з активаторів AMPK, який запобігає проліферації змінених клітин [255]. Незалежно від різновиду мутації, яка має місце – BRAF або NRAS, – метформін спричиняє зупинку клітинного циклу фази G0/G1 і значне зниження життєздатності клітин шляхом індукції апоптозу та аутофагії [256]. Дія метформіну була підтверджена in vivo, оскільки він пригнічує утворення пухлин меланоми в мишей шляхом індукції аутофагії та апоптозу [257]. Крім того, метформін знижує експресію білків, що беруть участь в епітеліально-мезенхімальному переході, таких як N-кадгерин, фібронектин, SPARC, Snail і Slug, а також активує матриксні металопротеїнази-2 та -9 (ММР-2 і ММР-9). Для цього процесу необхідна активація AMPK і білка-супресора пухлин p53 [258].
Як AMPK-залежні, так і AMPK-незалежні механізми використовуються метформіном для спричинення загибелі клітин меланоми. Вивчалися лікувальні ефекти метформіну в поєднанні з інгібітором BRAF-мутації, такими як вемурафеніб. Щоб запобігти резистентності клітин меланоми до лікування, застосовують комбіновану терапію із застосуванням інгібіторів BRAF-мутації – так, спостерігали позитивні результати щодо загибелі клітин меланом при комбінованій терапії метформіном і вемурафенібом [259]. Дійсно, дослідження in vitro демонструють синергічні антипроліферативні ефекти, особливо в мутантних клітинних лініях BRAFV600E. У кількох дослідженнях хіміотерапевтичний препарат цисплатин виявився шкідливішим для клітин меланоми саме в разі застосування з метформіном [260].
Висновок
Історично метформін був наріжним каменем у лікуванні ЦД 2 типу. З появою нових молекул пероральних антигіперглікемічних засобів терапевтичний арсенал ведення діабету розширився, однак метформін із його плейотропними ефектами все ще має перевагу над іншими препаратами. Інсулінзберігальний ефект метформіну, у поєднанні з різноманітними внутрішньоклітинними механізмами, робить препарат справді унікальним.
Користь метформіну була підтверджена при багатьох захворюваннях, у тому числі ЦД, ожирінні, раку, ССЗ, неврологічних захворюваннях і багатьох інших, але більшість доказів базується на дослідженнях in vitro й in vivo, де препарат використовували в концентрації, вищій за терапевтичну. Попередні докази на підтримку ефективності метформіну були зібрані в ході доклінічних і обсерваційних досліджень, але нині препарат також вивчають у різних клінічних випробуваннях.
Сучасні дані дають можливість сподіватися на ширше використання метформіну за різних станів, однак необхідні подальші дослідження та великі клінічні випробування на різних популяціях, щоб розширити діапазон застосування препарату в реальній клінічній практиці.
Список літератури – у редакції.
Реферативний огляд статті Siddhartha Dutta et al. Metformin: A Review of Potential Mechanism and Therapeutic Utility Beyond Diabetes, Drug Designe Development and Therapy 2023:17.
Підготувала Ганна Кирпач
Тематичний номер «Діабетологія. Тиреоїдологія. Метаболічні розлади» № 2 (66) 2024 р.