28 квітня, 2021
Гіперплазія наднирників: практичні аспекти лабораторної діагностики
 Виступ доктора медичних наук, професора Андрія Миколайовича Кваченюка (ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ) під час засідання науково-освітнього проєкту «Школа ендокринолога» був присвячений гіперпластичним процесам наднирників. У доповіді надані підходи до регламентованої діагностики синдрому Кушинга та особливості використання результатів досліджень кортизолу в різних біологічних матеріалах. Також висвітлені аспекти діагностики первинного гіперальдостеронізму, синдрому Карні, нейроендокринних пухлин і карциноїдів. Для скринінгу цих синдромів сьогодні застосовують сучасні маркери карциноїдів і нейро-ендокринних пухлин, як-от: Хромогранін А, серотонін, 5-індолоцтова кислота.
Виступ доктора медичних наук, професора Андрія Миколайовича Кваченюка (ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ) під час засідання науково-освітнього проєкту «Школа ендокринолога» був присвячений гіперпластичним процесам наднирників. У доповіді надані підходи до регламентованої діагностики синдрому Кушинга та особливості використання результатів досліджень кортизолу в різних біологічних матеріалах. Також висвітлені аспекти діагностики первинного гіперальдостеронізму, синдрому Карні, нейроендокринних пухлин і карциноїдів. Для скринінгу цих синдромів сьогодні застосовують сучасні маркери карциноїдів і нейро-ендокринних пухлин, як-от: Хромогранін А, серотонін, 5-індолоцтова кислота.
Ключові слова: гіперкортицизм, синдром Кушинга, комплекс Карні, рівень кортизолу в слині, лабораторна діагностика, Діла
– Усі причини гіперплазії наднирників можна поділити на 3 основні групи:
1. Ендогенний гіперкортицизм, зумовлений:
- гіперстимуляцією кори наднирників адренокортикотропним гормоном (АКТГ): хвороба Кушинга (мікроаденома гіпофіза), ектопічний АКТГ-синдром (дрібноклітинна карцинома легень, нейроендокринні пухлини бронхів, тимуса та іншої локалізації);
- карциномою, аденомою, мікро- чи макронодулярною гіперплазією наднирників.
2. Порушення рецепторного сприйняття: макронодулярна гіперплазія наднирників.
3. Дисферментативні розлади: вроджена дисфункція кори наднирників, яка в 90% випадків представлена різними формамии дефіциту 21-гідроксилази.
За даними епідеміологічних досліджень, поширеність підтвердженого синдрому Кушинга становить 39,1 випадку на мільйон, а рівень захворюваності – 2-3 випадки на мільйон населення (Steffensen C. et al., 2010; Feelders R.A. et al., 2012). В етіопатогенетичній структурі синдрому Кушинга 85% випадків зумовлені АКТГ-продукувальними пухлинами. Так, захворюваність на хворобу Кушинга становить 1,2-2,4 випадку на мільйон населення, тоді як рівень захворюваності на аденому наднирників удвічі нижчий і дорівнює 0,6 випадку на мільйон (Steffensen C. et al., 2010).
Варто розуміти, що в багатьох пацієнтів синдром Кушинга не супроводжується класичною клінічною картиною, з диспластичним ожирінням, стріями та гірсутизмом, а має субклінічний перебіг, тому залишається невиявленим. Зокрема, синдром Кушинга виникає:
- у 2-5% пацієнтів із цукровим діабетом (ЦД) на тлі ожиріння або неадекватного контролю глікемії;
- 4,8% хворих на ідіопатичний остеопороз;
- 4% пацієнтів з артеріальною гіпертензією (АГ);
- в 0,4% жінок із гірсутизмом, тобто в 1 з 250 жінок.
Ці дані підтверджуються результатами аутопсій гіпофіза, під час яких аденоми були виявлені в 344 випадках із 3048, що свідчить на користь гіподіагностики цього стану в загальній популяції.
Клінічні прояви гіперкортицизму можуть спостерігатися і за відсутності синдрому Кушинга. При цьому диференційна діагностика має охоплювати неконтрольований ЦД, алкогольну залежність, ожиріння, вагітність, резистентність до глюкокортикоїдів, депресію та інші психічні розлади. Треба пам’ятати, що прийом антидепресантів сам по собі може підвищувати рівень кортизолу в крові.
Первинне діагностичне обстеження в разі підозри на синдром Кушинга полягає у визначенні рівня кортизолу за допомогою:
- визначення вільного кортизолу в сечі – щонайменше 2 вимірювання;
- нічного тесту з пригніченням секреції дексаметазоном у дозі 1 мг. При цьому діагностично значущим вважають рівень кортизолу сироватки >1,8 мкг/дл;
- більш тривалого тесту з низькими дозами дексаметазону (2 мг/добу впродовж 48 год) – малий тест Ліддла;
- визначення кортизолу в слині (проводять 2 виміри, один з яких – пізно увечері). Діагностично значущим є підвищення рівня кортизолу до значення >145 нг/дл (4 нмоль/л). Цей тест є неінвазивним і надзвичайно зручним для пацієнта.
Сьогодні визначити рівень кортизолу в слині, використовуючи біотин-незалежну методику, можна в мережі медичних лабораторій ДІЛА. На відміну від інших лабораторій у МЛ ДІЛА використовують спеціалізований під згадане дослідження контейнер Sarstedt Cortisol-Salivette. Матеріали контейнера не руйнують і не абсорбують на стінки кортизол навіть у малому об’ємі (достатньо 0,8 мл слини) або низьких концентраціях, що забезпечує збереження біоматеріалу. Крім того, синтетичний тампон із поліпропілену, на відміну від інших матеріалів, є оптимальним для просочування слиною та практично 100-відсотково відділяє її під час центрифугування. Це мінімізує необхідність «перевзяття» слини або помилкового зниження результату.
Ще однією перевагою визначення кортизолу в слині в МЛ ДІЛА є наявність погодинних референсів. Це особливо важливо в разі призначення замісної гормональної терапії, наприклад після тотальної білатеральної адреналектомії. У подібних клінічних ситуаціях якість життя пацієнтів напряму залежить від адекватного режиму замісної терапії. Інколи гормони необхідно приймати не один, а кілька разів на добу, а погодинні референси дають можливість досягти найбільш фізіологічного дозування, яке мінімізує прояви гіпокортицизму впродовж дня.
Визначення АКТГ і кортизолу сироватки проводиться в МЛ ДІЛА за допомогою біотин-незалежної методики, що на 20% зменшує вірогідність хибних результатів.
Другий біохімічний крок у разі підтвердженого гіперкортицизму полягає у визначенні рівня АКТГ в плазмі крові (Nieman L.K. et al., 2008). Концентрація АКТГ >10 пг/мл вказує на хворобу Кушинга або ектопічний синдром Кушинга, а рівні <10 пг/мл, в поєднанні з негативною малою дексаметазоновою пробою, – на аденому або карциному наднирників або синдром Карні.
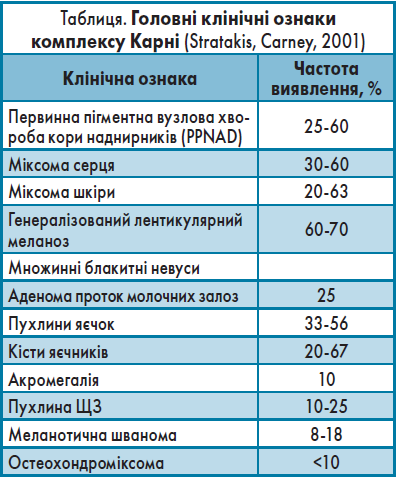
Синдром Карні (комплекс Карні, синдром Карнея) – рідкісне спадкове захворювання з аутосомно-домінантним типом успадкування, описане вперше в 1985 році як комбінація міксоми серця, плямистої пігментації та підвищеної активності ендокринних органів. Мутація локалізується в локусах17q22-24, 2p16 гена PRKAR1A. У 25% пацієнтів розвивається рак щитоподібної залози (ЩЗ), тому їм показане щорічне ультразвукове дослідження зазначеного органа (Carney A.J., 1985).
Основні клінічні ознаки синдрому Карні та їх частота відображені в таблиці.
Для встановлення діагнозу потрібно (Stratakis, Carney, 2001):
- ≥2 головні ознаки;
- 1 головна ознака та 1 додатковий критерій (хворий родич 1-го ступеня спорідненості або + PRKAR1A).
Синдром Карні, так само як інші пухлини нейроендокринного походження, у більшості випадків генетично зумовлені, їх важко діагностувати. Це пов’язано насамперед із широким спектром можливих локалізацій, починаючи від шиї і закінчуючи сечовим міхуром, і неспецифічністю клінічних проявів. Часто єдиним проявом нейроендокринних пухлин є судинні кризи і пароксизми, які виникають унаслідок продукції пухлинними клітинами низки вазоактивних речовин. У подібних випадках у діагностичному пошуку може допомогти визначення рівня онкомаркерів нейроендокринних пухлин, які виділяють клітини APUD-системи. Одним із таких маркерів є Хромогранін А. Переваги його визначення в МЛ ДІЛА:
- використання біотин-незалежної методики імуноаналізу (ELIA, DEMEDITEC DEE900 Germany);
- аналітична чутливість 5 нг/мл;
- широкий діапазон вимірювань від 8 до 700 нг/мл.
Що ж до діагностики карциноїдних пухлин, які можуть бути як джерелом ектопічної продукції АКТГ, так і вражати наднирники та виділяти надмірну кількість кортизолу, необхідно користуватися такими онкомаркерами, як серотонін і 5-гідроксиіндолоцтова кислота (5-ГІОК). У МЛ ДІЛА концентрацію серотоніну в цільній крові та 5-ГІОК у добовій сечі визначають за допомогою рідинної хроматографії з тандемною мас-спектрометрією. Подібна методика забезпечує максимальну точність вимірювання та може використовуватися не лише для діагностики, а й для післяопераційного моніторингу ефективності лікування карциноїдних пухлин.
Результати епідеміологічних досліджень показали, що за відсутності належного лікування розраховане 5-річне виживання при гіперкортицизмі становить 50%, тобто воно порівнянне з життєвим прогнозом у разі раку прямої кишки (Plotz C.M. et al., 1952). Більшість пацієнтів із гіперкортицизмом помирає від серцево-судинних і цереброваскулярних ускладнень, зумовлених метаболічними порушеннями. Водночас досягнення нормальних рівнів кортизолу після двосторонньої адреналектомії забезпечило подовження 5-річного виживання до 86% (O’Riordain D.S. et al., 1994).
Ще однією патологією, яка супроводжується гіперплазією наднирників, є первинний гіперальдостеронізм. Підозра на такий діагноз обґрунтована за наявності:
- АГ в поєднанні з гіпокаліємією;
- резистентної АГ;
- дебюту АГ в молодому віці (до 20 років);
- інциденталоми наднирника та АГ;
- тяжкої АГ;
- вторинної АГ.
У будь-якому з цих клінічних випадків необхідно визначити альдостерон-ренінове співвідношення (АРС). Умовою належного визначення АРС є фізична активність за 2 год до процедури, що не завжди можливо, зокрема в лежачих хворих. У подібних ситуаціях збір проби здійснюють у лабораторіях, де враховують положення хворого. Така опція доступна в МЛ ДІЛА, де передбачені референтні значення як для вертикального, так і для горизонтального положення пацієнта.
Первинна діагностика, так само як і контроль терапії пацієнтів із гіперплазією наднирників, неможливі без проведення цілої низки лабораторних обстежень, зокрема визначення рівня кортизолу, АКТГ, біомаркерів нейроендокринних і карциноїдних пухлин та АРС. Завдяки використанню сучасних біоконтейнерів і новітніх біотин-незалежних методик визначення згаданих показників МЛ ДІЛА гарантує достовірність результатів, а наявність референтних показників, що їх враховують час забору матеріалу і навіть положення тіла, дають можливість мінімізувати похибку навіть у нестандартних клінічних випадках.
Список літератури – у редакції.
Підготувала Ганна Кирпач
Література
1. Steffensen C., Bak A.M., Rubeck K.Z., Jоrgensen J.O. Epidemiology of Cushing’s syndrome. Neuroendocrinology. 2010;92 Suppl 1:1-5. doi: 10.1159/000314297. Epub 2010 Sep 10. PMID: 20829610. https://pubmed.ncbi.nlm.nih.gov/20829610/
2. Feelders R.A., Pulgar S.J., Kempel A., Pereira A.M. The burden of Cushing’s disease: clinical and health-related quality of life aspects. Eur J Endocrinol. 2012 Sep;167(3):311-26. doi: 10.1530/EJE‑11-1095. Epub 2012 Jun 22. PMID: 22728347. https://pubmed.ncbi.nlm.nih.gov/22728347/
3. Nieman L.K., Biller B.M., Findling J.W. et al. The diagnosis of Cushing’s syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2008 May;93(5):1526-40. doi: 10.1210/jc.2008-0125. Epub 2008 Mar 11. PMID: 18334580; PMCID: PMC2386281. https://pubmed.ncbi.nlm.nih.gov/18334580/
4. Plotz C.M., Knowlton A.I., Ragan C. The natural history of Cushing’s syndrome. Am J Med. 1952 Nov;13(5):597-614. doi: 10.1016/0002-9343(52)90027-2. PMID: 12996538. https://pubmed.ncbi.nlm.nih.gov/12996538/
5. O’Riordain D.S., Farley D.R., Young W.F. Jr, Grant C.S., van Heerden J.A. Long-term outcome of bilateral adrenalectomy in patients with Cushing’s syndrome. Surgery. 1994 Dec;116(6):1088-1093; discussion 1093-1094. PMID: 7985092.https://pubmed.ncbi.nlm.nih.gov/7985092/