20 листопада, 2023
Сучасні стратегії лікування захворювань шлунково-кишкового тракту у практиці педіатра
За матеріалами PRIME PEDIATRICS 2023
 Нещодавно відбувся п’ятий щорічний конгрес PRIME PEDIATRICS 2023, організований Українською академією педіатричних спеціальностей (УАПС). Щороку мультидисциплінарна команда експертів у різних галузях педіатрії зустрічається для обговорення актуальних питань із лікування найпоширеніших захворювань дитячого віку. Пропонуємо ознайомитися із сучасною інформацією щодо терапії захворювань шлунково-кишкового тракту (ШКТ) у практиці педіатра, яка була представлена у секції «Гастро».
Нещодавно відбувся п’ятий щорічний конгрес PRIME PEDIATRICS 2023, організований Українською академією педіатричних спеціальностей (УАПС). Щороку мультидисциплінарна команда експертів у різних галузях педіатрії зустрічається для обговорення актуальних питань із лікування найпоширеніших захворювань дитячого віку. Пропонуємо ознайомитися із сучасною інформацією щодо терапії захворювань шлунково-кишкового тракту (ШКТ) у практиці педіатра, яка була представлена у секції «Гастро».
 Доцентка кафедри педіатрії № 1 НМУ ім. О.О. Богомольця, доктор медичних наук Анастасія Горобець розповіла про роль нутритивної корекції в менеджменті еозинофільного езофагіту:
Доцентка кафедри педіатрії № 1 НМУ ім. О.О. Богомольця, доктор медичних наук Анастасія Горобець розповіла про роль нутритивної корекції в менеджменті еозинофільного езофагіту:
– Еозинофільні гастроінтестинальні захворювання – це група хронічних імуноопосередкованих хвороб, що характеризуються гастроінтестинальною симптоматикою та наявністю еозинофільної інфільтрації слизової оболонки ШКТ. Згідно із сучасною класифікацією, виділяють: еозинофільне ураження стравоходу – еозинофільний езофагіт (ЕоЕ), еозинофільне ураження інших відділів ШКТ – шлунка (еозинофільний гастрит), тонкої кишки (еозинофільний дуоденіт/єюніт/ілеїт), товстої кишки (еозинофільний коліт) та поєднані форми ураження.
Точні показники поширеності патології достеменно невідомі. Допускають наявність патології в 1,9% дорослих із гастроінтестинальними симптомами. Це зумовлено труднощами верифікації діагнозу. Сьогодні золотим стандартом діагностики ЕоЕ є ендоскопічне обстеження з гістологічною діагностикою. Проте основні «знахідки» про ендоскопічному обстеженні, такі як набряк (зникнення судинного малюнку), фіброзні кільця (трахеалізація), ексудати (білі бляшки), поздовжня лінеарність, стриктури, можуть бути подібними до таких при іншій патології або невираженими, і при невираженій клінічній симптоматиці можуть бути відсутніми. Для достовірної верифікації діагнозу слід досліджувати не менше 6 біоптатів з різних ділянок стравоходу, за результатами гістологічного аналізу яких буде виявлено кількість еозинофілів у біоптаті більше 15 еоз у полі зору або більше 60 еоз\мм2. Еозинофілія слизової оболонки стравоходу також супроводжується базальною гіперплазією, набряком (спонгіозом), еозинофільними мікроабсцесами, субепітеліальним склерозом.
Серед клінічних симптомів ЕоЕ у дітей найпоширеніші – порушення фізичного розвитку, проблеми з годуванням, нудота, блювання, абдомінальний біль, печія. Через неспецифічність клінічних проявів ЕоЕ буває важко відрізнити від гастроезофагеальної рефлюксної хвороби (ГЕРХ). У третини дітей із ЕоЕ раніше була діагностована ГЕРХ. Патогенетичні механізми ГЕРХ можуть сприяти виникненню ЕоЕ, оскільки низька кислотність стабілізує еозинофіли, індукує виділення прозапальних медіаторів опасистими клітинами, сприяє розширенню міжклітинних проміжків у стравоході, що призводить до пенетрації алергенів. У свою чергу, наявний ЕоЕ внаслідок гострого запалення або фіброзу стінки стравоходу порушує функціонування нижнього стравохідного сфінктера і може сприяти виникненню ГЕРХ.
Доведена ефективність у лікуванні ЕоЕє медикаментозної терапії та дієти. Виділяють наступні підходи дієтотерапії:
- елементна дієта – протягом 6 тижнів дитина отримує лише амінокислотну суміш; різновид елементної дієти – напівелементна – дитина отримує суміш на основі гідролізованого білка;
- елімінаційна дієта з виключенням від 1 до 7 продуктів, серед яких молоко, пшениця, яйця, соя, горіхи, риба, морепродукти, червоне м’ясо.
Ефективність елементної дієти була доведена у 6 обсерваційних дослідженнях за участю 431 пацієнта, результат становив 93,6%. Недоліками такої терапії є дороговартісність суміші для годування та її специфічні смакові якості, що може порушувати прихильність пацієнта до терапії. Частіше таку дієту застосовують у дітей старшого віку і дорослих. Суміш можна вводити через назогастральний зонд, якщо є необхідність у введенні великих об’ємів, проте слід уникати тривалого зондового годування у дітей із порушенням харчової поведінки.
Елементна дієта розглядається як перша лінія терапії у разі тяжкого перебігу та/або наявності виразної мальнутриції. У дітей перших років життя суміш повноцінно забезпечує нутритивні потреби дитини і терапія має високий комплаєнс. Перевагами такого типу харчування є швидка і повна ремісія вже протягом 2-х тижнів. Проте після елементної дієти повторне введення груп продуктів може посилити IgE-опосередковану харчову алергію, а тривале годування через зонд або стому може змінювати харчові звички пацієнта.
Реінтродукцію продуктів харчування після елементної дієти треба проводити покроково.
- Введення найменш алергенних продуктів (овочі, стручкові бобові).
- Введення мінімально алергенних продуктів (цитруси, тропічні фрукти, ягоди, зернові, рис, пшоно, кіноа).
- Введення помірно алергенних продуктів (інші зернові, крім пшениці; бобові, ягнятина, курчатина, свинина, індичатина).
- Введення найбільш алергенних продуктів (риба, морепродукти, горіхи, арахіс, кукурудза, телятина, яловичина, соя, яйця, пшениця, молоко; А. Clanferoni et al., 2019).
Молочна продукція та пшениця є основними групами продуктів, що провокують розвиток ЕоЕ, майже у 85 та 60% відповідно. Тому інший підхід дієтотерапії, елімінаційна дієта, передбачає виключення основних груп алергенних продуктів. Розрізняють два підходи імплементації елімінаційної дієти:
- Step-up – кожні 6 тижнів під ендоскопічним та гістологічним контролем поступово виключаються пари груп продуктів: на початку це молочні продукти/пшениця, через 6 тижнів за відсутності позитивного результату додатково виключають продукти з вмістом яєць/сої, у подальшому виключають з раціону всі 6 харчових тригерів – молоко, пшеницю, яйця, сою, горіхи, морепродукти. Такий підхід може сприяти ранній ідентифікації харчового тригера ЕоЕ;
- Top-down – з початку терапії виключають всі 6 груп харчових тригерів на 6 тижнів, далі кожні 2-4 тижні вводять у раціон по одному продукту та проводять ендоскопічний і гістологічний контроль (рис.).
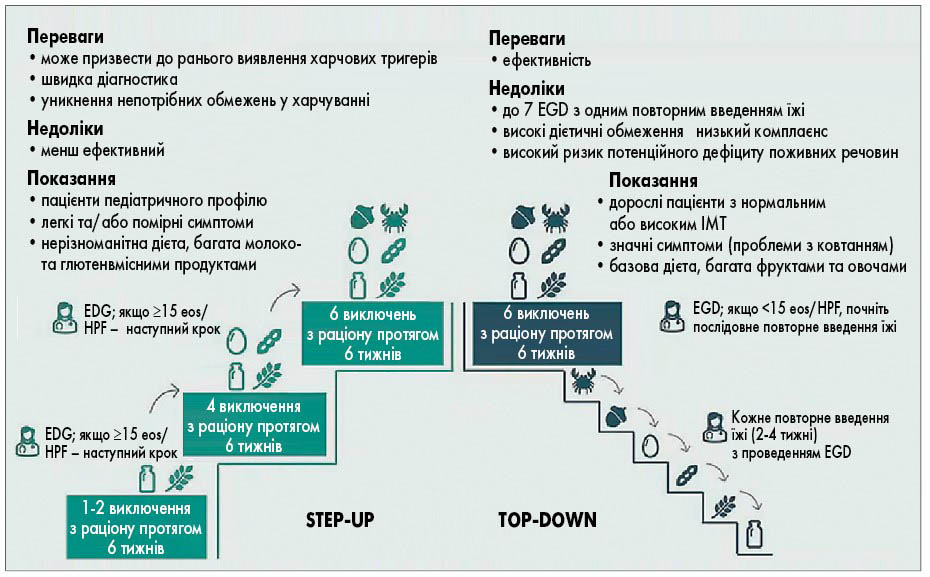 Рис. Підходи до імплементації дієти з виключенням 6 груп продуктів
Рис. Підходи до імплементації дієти з виключенням 6 груп продуктів
Примітки: EDG – езофагогастродуоденоскопія; eos/HPF – еозинофілів/поле потужного мікроскопа; ІМТ – індекс маси тіла.
Елімінаційна дієта менш ефективна (67,9%) та потребує більшої кількості діагностичних втручань. Застосування таргетної елімінаційної дієти на основі результатів попередньо проведених алерготестів не рекомендоване на сьогодні через низькі показники ефективності та гістологічної ремісії (I. Hirano et al., 2020).
У великої кількості пацієнтів з ЕоЕ є порушення нутритивного статусу внаслідок співіснуючих порушень харчової непереносимості, рестриктивної дієти, затримки встановлення діагнозу, хронічного запалення та хронічних симптомів, особливостей харчової поведінки. Тому при виключенні певних груп продуктів важливо пам’ятати про потенційне формування макро- та мікронутритивної недостатності і пропонувати заміну основних груп продуктів з раціону дитини.
 Власний клінічний досвід діагностичного пошуку та лікування ЕоЕ представила педіатр Наталія Суханова. Під час своєї доповіді вона акцентувала увагу на тяжких розладах харчування у дітей першого року життя та шляхах подолання проблеми:
Власний клінічний досвід діагностичного пошуку та лікування ЕоЕ представила педіатр Наталія Суханова. Під час своєї доповіді вона акцентувала увагу на тяжких розладах харчування у дітей першого року життя та шляхах подолання проблеми:
– В основі формування педіатричних розладів годування (Pediatric Feeding Disorder, PFD) лежать 4 компоненти: медична сфера включає анатомічні, неврологічні та проблеми розвитку, які можуть призвести до PFD; харчова – змінене споживання, якісне і кількісне недоїдання; навички годування – необхідність використовувати додаткові, незвичайні методи і техніки споживання; психосоціальна – взаємодію між дитиною та її опікунами.
Через тісний взаємозв’язок між цими компонентами порушення в одному з них може призвести до дисфункції в будь-якому іншому. Тому менеджмент PFD полягає у роботі мультидисциплінарної команди, яка складається з лікаря, спеціалістів з поведінки та харчування, соціальних робітників. Кожен член мультидисциплінарної команди проводить первинну оцінку стану дитини, а потім розробляється єдиний план лікування.
Ключовим симптомом при PFD є дисфагія. Це загальний термін, який використовується для опису будь-яких труднощів у переході їжі/рідин із ротової порожнини до стравоходу. За допомогою шкали Functional Oral Intake Scale виділяють різні рівні дисфагії, починаючи від повної дисфагії їжі будь-якої консистенції до дисфагії лише рідкої їжі (табл.). 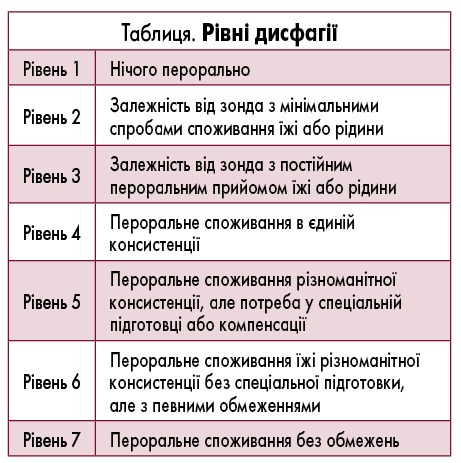
Пані Наталія наголосила, що в усіх пацієнтів із утрудненим ковтанням слід запідозрити запалення стравоходу. Значне запалення призводить до одинофагії, що, у свою чергу, може призвести до зниження споживання їжі та її уникання. Запалення стравоходу може бути наслідком ГЕРХ, ЕоЕ або інших видів патології.
 Доцент кафедри дитячої хірургії, анестезіології НУОЗ ім. П.Л. Шупика, кандидат медичних наук Володимир Гончар представив доповідь про сучасні діагностичні підходи до лікування запорів у дітей:
Доцент кафедри дитячої хірургії, анестезіології НУОЗ ім. П.Л. Шупика, кандидат медичних наук Володимир Гончар представив доповідь про сучасні діагностичні підходи до лікування запорів у дітей:
– Запор – це порушення функції кишечнику, що проявляється збільшенням інтервалів між актами дефекації або систематичним недостатнім випорожненням кишечнику. Частота випорожнень у здорової дитини в перший місяць життя збігається з кількістю годувань, протягом першого року становить 2-4 рази на день і поступово до 4 років змінюється на однократне випорожнення на день. У підлітків і дорослих частота становить 1 раз на 1-2 дні.
Основні клінічні прояви запорів включають затримку випорожнення, відчуття неповного випорожнення кишечнику, зміну консистенції калових мас, біль у животі, метеоризм, біль під час дефекації, домішки крові у випорожненнях, енкопрез. Як і будь-яке захворювання, запор має декілька стадій перебігу хвороби.
- Компенсована: на цій стадії частота випорожнень близько 1 разу на 2-3 дні. Труднощі діагностики на цій стадії зумовлені складнощами комунікації з маленькими пацієнтами і неможливістю дітей сформулювати скарги на відчуття неповного спорожнення кишечнику і біль у животі.
- Субкомпенсована: самостійного випорожнення немає, але його легко домогтися при застосуванні проносних засобів та очисних клізм, дефекація може бути болісною, присутні елементи каломазання. Внаслідок калової інтоксикації на цій стадії з’являються позакишкові симптоми, такі як загальна слабкість, млявість, стомлюваність, головний біль, зниження уваги та відставання у школі.
- Некомпенсована: випорожнення можливі тільки після застосування гіпертонічних чи сифонних клізм, наявне калове каміння, стійке каломазання, калова інтоксикація.
Діагностика запорів заснована на клініко-анамнестичних даних, результатах морфофункціональних, інструментальних та лабораторних методів дослідження. З метою вивчення анатомо-фізіологічного стану товстої кишки проводять рентгеноконтрастну іригографію, що дозволяє оцінити евакуаторну функцію товстої кишки і наявність структурних змін. Для оцінки стану слизової оболонки товстої кишки показано проведення ендоскопічного дослідження з прицільною біопсією для гістологічного і гістохімічного аналізу. Такий підхід дозволяє виявити гострі та хронічні запальні захворювання товстої кишки, провести диференційну діагностику хвороб, що можуть супроводжуватися запорами, уточнити стадію хвороби і контролювати ефективність лікування.
Для характеристики функціональних порушень товстої кишки застосовують спеціальні методи дослідження: сфінктерометрія оцінює силу запірного апарату; балонометрія досліджує активність (кінетику) дистальних відділів товстої кишки та встановлює тип фонової моторики. З метою оцінки роботи сфінктерного апарату прямої кишки можливе проведення електроманометрії або профілометрії анального каналу. Останні роки також активно використовують ультразвукове дослідження з метою виявлення функціональних порушень дистальних відділів кишечнику.
Пізня первинна діагностика та призначення патогенетично обумовленого лікування призводить до ускладнення перебігу запорів, що не дозволяє лікарям застосовувати виключно консервативні методи для лікування запорів нехірургічної етіології.
 З доповіддю про вплив мікробіоти кишечнику на здоров’я та спадковість виступила науковий співробітник Інституту педіатрії, акушерства і гінекології ім. О.М. Лук’янової, кандидат медичних наук Ірина Матвієнко:
З доповіддю про вплив мікробіоти кишечнику на здоров’я та спадковість виступила науковий співробітник Інституту педіатрії, акушерства і гінекології ім. О.М. Лук’янової, кандидат медичних наук Ірина Матвієнко:
– Відомо, що лише 2% ДНК людини виконує функції кодування, решта 98% – некодуюча ДНК, що є набором факторів, які забезпечують пристосування до змін навколишнього середовища. Генетична інформація – це чіткий алгоритм життєдіяльності живого організму. Проте необхідне уточнення умов, за яких генетична інформація може бути реалізована. Цей сучасний науковий напрямок називається епігенетикою.
Епігеном – це набір факторів, що регулюють активність генів, але не здатні змінювати первинну структуру ДНК. Вже є добре досліджені епігенетичні фактори, що регулюють синтез білка, серед яких: метилювання та деметилювання ДНК, ацетилювання та деацетилювання ДНК, модифікації гістонів, МРНК (K. Luger et al., 2012). Доведено, що певні мікроорганізми кишечнику здатні впливати на ці процеси. Чисельні епігенетично значущі речовини не тільки регулюються дієтою, а також продукуються кишечними бактеріями. Таким чином, крім прямих змін у дієті та способі життя, зміни мікробіоти кишечнику можуть робити свій внесок у зміну складу активних речовин, що впливають на формування унікального епігеному та метаболому кожного індивідуума.
Кожна група бактерій відповідає за певний напрямок метаболічної роботи. Унікальність цих зв’язків зумовлена тим, що продукти метаболізму одних бактерій можуть бути субстратом для інших. Наприклад, коротколанцюгові жирні кислоти (КЛЖК) утворюються шляхом бактеріальної ферментації неперетравлюваних рослинних вуглеводів у товстій кишці. Меншою мірою КЛЖК утворюються з білків та пептидів. На рівні кишечнику пропіонат та бутират беруть участь у підтриманні стабільності мікрофлори. Рівень цих КЛЖК залежить від кількості бактерій Clostridium, Bacteroides, Eubacterium, Ruminococcus, Bifidobacterium, Lactobacillus, Actinomyces, що, в свою чергу, залежить від раціону харчування хазяїна. На генетичному рівні КЛЖК впливають на системи молекулярної сигналізації: пропіонова кислота інгібує NF-kB – транскрипційний ядерний фактор, що контролює експресію генів імунної відповіді, апоптозу та клітинного циклу, а також регулює чутливість клітин до інсуліну. Порушення регуляції NF-kB призводить до розвитку запалення, онкології та аутоімунних захворювань.
До інших бактеріальних метаболітів, що впливають на активність епігенетичних механізмів, відносять:
- органічні кислоти (лактат), що продукуються Lactobacillus, Bifidobacterium Streptococcus. Ці сполуки помірно інгібують деацетилази гістонів за рахунок зниження рівня pH, що викликає порушення спіралізації та конденсації хроматину ДНК;
- специфічні фенольні та сірчані сполуки, які є продуктами діяльності кишкової флори, впливають на метилювання ДНК та ацетилювання гістонів (M. Roberfroid, 2010; Mei Shang, 2017; Luthord , 2017).
Як відомо, на порушення мікробіоти впливає спосіб життя (стреси); тип харчування (нерегулярне/нераціональне), відсутність кисломолочної та ферментованої продукції в раціоні, відсутність/обмеження рослинних продуктів; хронічні захворювання ШКТ; прийом медикаментів. Негативний вплив антибіотикотерапії на мікробіом кишечнику підтверджений Lі. Dethlefsen та співавт. (2011) у дослідженні, в якому здорові волонтери отримали 2 курси антибіотикотерапії. Було проаналізовано більше 1,7 млн бактерій. Згідно з результатами дослідження, вплив антибіотиків (АБ) був помітний вже на 3-4 добу у вигляді зміни різноманітності складу мікробіоти. Через 1 тиждень після закінчення курсу АБ склад мікробіоти тільки частково повертався до початкових параметрів, а через 6 місяців деякі бактерії залишалися повністю пригніченими. В усіх волонтерів до кінця дослідження стан мікробіоти стабілізувався, але не повернувся до початкового. Але навіть таке глибоке розуміння взаємозв’язків процесів, що відбуваються у людському організмі, поки що не дає розуміння, як функціонує цілісний організм.
 Голова правління УАПС, доктор медичних наук, професор Марина Маменко представила доповідь про важливість раціонального призначення АБ у практиці педіатра та запобігання антибіотикорезистентності (АР):
Голова правління УАПС, доктор медичних наук, професор Марина Маменко представила доповідь про важливість раціонального призначення АБ у практиці педіатра та запобігання антибіотикорезистентності (АР):
– Пандемія COVID-19 стала тригером для нового етапу посиленої боротьби світової медичної спільноти з АР. У 2022 р. Центр з контролю і профілактики захворювань США зазначав, що у 2020 р. був втрачений прогрес у боротьбі зі стійкістю до АБ, значною мірою через наслідки пандемії COVID-19. Загроза інфекційних агентів, стійких до АБ, не тільки все ще існує, але й погіршилася. Це зумовлено нераціональним застосуванням АБ для профілактики бактеріального інфікування на початку пандемії. Згідно з настановою Всесвітньої організації охорони здоров’я з лікування COVID-19, АБ-терапія або профілактика не рекомендується для пацієнтів із легким або середнім ступенем тяжкості COVID-19, окрім як при наявності ознак та симптомів бактеріальної інфекції. Для пацієнтів із підозрою або підтвердженим COVID-19 тяжкого ступеню рекомендується застосовувати емпіричне лікування АБ. Також АБ можуть бути призначені для лікування пневмонії у дітей молодше 5 років із помірним перебігом COVID-19.
У 2017 р. комітетом експертів ВООЗ була розроблена класифікація АБ AWaRe (Access, Watch, Reserve), яка обґрунтовує вибір та використання основних антимікробних лікарських засобів і є інструментом управління АР. Згідно з цією класифікацією, АБ поділяють на 3 групи.
- ACCESS Group, або група доступу (A): за рекомендацією ВООЗ, АБ цієї групи рекомендовані як емпіричний вибір 1-ої або 2-ої лінії терапії для лікування поширених інфекційних синдромів. Вони мають бути доступними за ціною, за відповідними формами випуску та гарантованої якості. АБ першого вибору, як правило, мають вузький спектр дії з позитивним співвідношенням користь/ризик та низьким потенціалом резистентності. АБ другого вибору мають ширший спектр дії, але вищий потенціал резистентності або менш сприятливе співвідношення користь/ризики.
- WATCH Group, або група спостереження (B): це клас АБ, які мають більш високий потенціал АР і рекомендовані як препарати першого або другого вибору, але за обмеженою кількістю показань. Саме на ці АБ мають бути спрямовані локальні та національні програми моніторингу резистентності. Препарати цієї групи відносять до переліку критично важливих АБ.
- RESERVE Group, або група резерву (C): АБ цієї групи слід розглядати як варіанти останнього призначення, або спеціально розроблені для специфічної категорії пацієнтів і показань. Ці препарати використовують у ситуаціях, коли інші альтернативи були б недостатніми або вже виявилися неефективними. Ліки цієї групи мають бути захищеними та потребують моніторингу використання, щоб зберегти їх ефективність.
Відповідно до класифікації ВООЗ, експерти України у 2022 р. опублікували стандарт медичної допомоги «Раціональне застосування антибактеріальних та антифунгальних препаратів із лікувальною та профілактичною метою» для сприяння попередженню АР на національному рівні. З переліком антимікробних засобів, що відносяться до кожної класифікаційної групи, можна ознайомитися у документі. Сьогодні вибір АБ у рутинних ситуаціях у практиці педіатра на будь-якому етапі медичної допомоги має здійснюватися у межах концепції подолання АР.
Підготувала Ольга Загора
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (69) 2023 р.


