4 лютого, 2022
Лікування пацієнтів з облітеруючими захворюваннями судин нижніх кінцівок: результати нового рандомізованого дослідження APOLLO
У вересні 2021 р. в Києві пройшла науково-практична конференція «Сухаревські читання: судинна хірургія, флебологія та ангіологія в епоху COVID‑19». Пропонуємо до вашої уваги огляд озвучених у межах заходу доповідей від провідних вітчизняних фахівців, що були присвячені аспектам лікування облітеруючих захворювань судин нижніх кінцівок та результатам нового рандомізованого дослідження APOLLO.
Досвід клінічного застосування препарату депротеїнізованого гемодеривату із крові телят Актовегін у терапії різних неврологічних розладів, зокрема цереброваскулярних патологій та когнітивних порушень різного походження, налічує близько 45 років. Препарат має тривалу історію як засіб для лікування захворювань периферичних артерій та діабетичної полінейропатії (ДПН) (Guekht et al., 2017).
Водночас Актовегін продовжує бути у фокусі уваги вчених, а результати нових досліджень підтверджують його ефективність та профіль безпеки, поглиблюючи наші уявлення про механізми дії та терапевтичний потенціал (Brock et al., 2020).
Фармакотерапія переміжної кульгавості: погляд клінічного фармаколога
Як зазначила завідувачка кафедри фармакології Національного медичного університету імені О. О. Богомольця (м. Київ), д. мед. н., професорка Ганна Володимирівна Зайченко, сучасний компетентний клініцист використовує у своїй практиці в середньому не більш ніж 100 лікарських препаратів, обізнаний – до 50. Загалом в Україні зареєстровано близько 14 тис. лікарських препаратів, а світовий фармринок налічує понад 350 тис. ліків.
сучасний компетентний клініцист використовує у своїй практиці в середньому не більш ніж 100 лікарських препаратів, обізнаний – до 50. Загалом в Україні зареєстровано близько 14 тис. лікарських препаратів, а світовий фармринок налічує понад 350 тис. ліків.
Для корекції кардіоваскулярних ризиків та поліпшення прогнозу щодо функціонування кінцівки доцільними є зміна способу життя хворих і застосування інгібіторів ангіотензинперетворювального ферменту, блокаторів рецепторів ангіотезину ІІ, статинів та антитромбоцитарних засобів. Своєю чергою арсенал фармакотерапії для корегування симптомів та впливу на якість життя у пацієнтів із переміжною кульгавістю (стадії ІІ за Фонтейном) налічує набагато менше лікарських препаратів, що довели свою ефективність.
Вочевидь, облітеруючі захворювання судин нижніх кінцівок мають певний бекграунд, який пацієнти із коморбідними станами, індивідуальними особливостями та генетичною схильністю накопичують роками. Усі ці фактори ризику потребують медикаментозної корекції або принаймні спеціальної підготовки на преопераційній стадії, під час втручання та особливо – у післяопераційному періоді.
«Точками прикладання» при розгляді підходів до терапії уражень периферичних артерій (ЗПА) є:
- кардіоваскулярні ризики;
- прогноз щодо функціонування кінцівки (вплив на чинники ризику, ступінь і швидкість атеросклеротичної оклюзії);
- симптоми переміжної кульгавості (вплив на ішемізовані тканини та якість життя хворих).
Тож для лікування переміжної кульгавості слід впливати як на основні чинники захворювання, так і на ішемізовані тканини, що суттєво змінюють свій метаболізм та чутливість. Також потрібно дбати про якість життя пацієнта та пам’ятати про необхідність дотримуватися засад доказової медицини.
Доповідачка нагадала, що найдавнішим представником периферичних вазодилататорів є пентоксифілін, який поліпшує реологічні властивості крові (плинність), зменшуючи її підвищену в’язкість. Він покращує знижену здатність еритроцитів і лейкоцитів до деформації, інгібує агрегацію еритроцитів та адгезію нейтрофілів до ендотелію судин.
Водночас нещодавній метааналіз досліджень ефекту застосування пентоксифіліну в пацієнтів із переміжною кульгавістю показав невтішний результат: у дозі 400 мг 3 р/добу він майже не впливав на основні клінічні показники. На тлі приймання лікарського препарату (порівняно із плацебо) спостерігалося вірогідне збільшення максимальної дистанції ходи (МДХ) лише на 11% та безбольової (БДХ) – на 9% (Stevens et al., 2019).
Своєю чергою інгібітор фосфодіестерази ІІІ цилостазол пригнічує агрегацію тромбоцитів, сприяє вазодилатації, чинить антипроліферативний ефект на клітини непосмугованих м’язів судин та при тривалому застосуванні може дещо покращувати ліпідограму. Результати метааналізу дев’ятьох плацебо-контрольованих досліджень за участю 1634 пацієнтів, що отримували цилостазол у дозі 100 мг двічі на добу протягом 24 тижнів, продемонстрували збільшення МДХ на 60,4-129,1 м, ДБХ – на 47,3-93,6 м. Загалом хворі на тлі використання цилостазолу досягали на 42,1 м суттєвішого подовження МДХ, ніж у групі плацебо (Pande et al., 2011). Цей ефект був нижчим в осіб із цукровим діабетом (ЦД).
Порівняльне дослідження ефективності цилостазолу та пентоксифіліну в пацієнтів із переміжною кульгавістю продемонструвало кращу ефективність цилостазолу щодо впливу на МДХ (Dawson et al., 2000).
Проте 2013 р. у відповідь на повідомлення Іспанського агентства з контролю за препаратами та медичними виробами (AEMPS) був ініційований перегляд співвідношення користь/ризик для цилостазолу, зазначені побічні ефекти з боку серцево-судинної системи та ризики кровотеч, розширений перелік протипоказань. Відповідно до рекомендацій Європейського товариства кардіологів (ESC) спільно з Європейським товариством васкулярних хірургів (ESVS) щодо діагностики та лікування ЗПА, цилостазол характеризується високою варіабельністю ефекту (від 25 до 75% за показником МДХ) та має антитромботичну дію, тому його необхідно застосовувати з обережністю в поєднанні з іншими антиагрегантами, що підвищують ризик кровотеч.
Європейське агентство з лікарських засобів (ЕМА) зазначає, що цилостазол може бути застосований як препарат другої лінії терапії для пацієнтів, у яких зміна способу життя та інші відповідні заходи не сприяли значущому послабленню симптомів переміжної кульгавості. Ефект терапії слід переоцінювати кожні 3 місяці, а за його відсутності приймання цилостазолу має бути припинене (ЕМА, 2013). Натомість стосовно пентоксифіліну немає достатньої кількості послідовних даних рандомізованих клінічних досліджень (РКД), щоб його можна було рекомендувати пацієнтам із переміжною кульгавістю (ESC/ESVS, 2017). Аналогічні рекомендації надані Американською асоціацією серця та Американською колегією кардіологів (АНА/АСС, 2016).
Своєю чергою L‑аргінін, що є субстратом для NO‑синтази – ферменту, який каталізує синтез оксиду азоту в ендотеліоцитах, використовують протягом останніх 10 років. У подвійному засліпленому плацебо-контрольованому дослідженні за участю пацієнтів із переміжною кульгавістю пероральне приймання L‑аргініну в дозі 3 г/добу протягом 6 місяців було менш ефективним порівняно із плацебо щодо поліпшення ендотеліальної функції та збільшення дистанції ходи. Отже, він не є корисною дієтичною добавкою для пацієнтів із переміжною кульгавістю та ЗПА (Wilson et al., 2007).
В європейських рекомендаціях із діагностики та лікування ЗПА зазначено, що для L‑аргініну бракує послідовних даних РКД, щоб рекомендувати його пацієнтам із переміжною кульгавістю (ESC/ESVS, 2017).
Слід зазначити, що Актовегін має низку досліджених ефектів. Він чинить метаболічні (підвищення утилізації кисню та глюкози, енергетичного метаболізму), мікроциркуляторні (збільшення капілярного кровотоку, ендотеліопротективна дія, поліпшення реології еритроцитів) та нейропротекторні ефекти (підвищення показника виживання нейронів при ішемії, зменшення інтенсивності процесів апоптозу, оксидативного стресу). Завдяки цьому підвищується виживання клітин в умовах ішемії та поліпшується їх енергетичний, а відтак – функціональний стан, що зумовлює клінічну ефективність лікарського засобу.
Актовегін покращує параметри мікрогемодинаміки та вазомоторної активності мікросудинного ендотелію (Федорович, Соболева, 2015). Він значуще збільшує капілярний кровоток, кількість функціонуючих капілярів та зменшує необхідність артеріоловенулярного шунтування. Препарат підвищує метаболічну активність ендотелію мікросудин і поліпшує оксид-синтазну функцію ендотелію мікросудин (ендотеліопротективний ефект).
Клінічну ефективність Актовегіну підтверджено в багатьох РКД (Muller-Buhl et al., 1991; Zigler, 2009; Brock et al., 2020). У нещодавно проведеному дослідженні APOLLO (2020) показане достовірне збільшення дистанції ходи під його впливом відповідно до сучасних стандартів доказової медицини. Зокрема, доведено ефективність дозування 1200 мг/добу та застосування таблетованої форми.
Збереження ефекту після закінчення курсу терапії протягом щонайменше 12 тижнів свідчить про те, що Актовегін впливає на певні патогенетичні механізми ЗПА. Актовегін починає працювати дуже швидко, після чого ефект нарощується, і при переході з ін’єкційної форми на таблетовану, та навіть після його відміни, відзначено післядію лікарського препарату.
Таким чином, згідно із сучасними рекомендаціями, наявні лише обмежені дані (які мають слабку або помірну силу з високою варіабельністю), що підтверджують ефективність вазоактивних засобів. Додаткова користь від їх застосування у поєднанні з фізичними вправами і терапією статинами невідома (ESC/ESVS, 2017).
Актуальність нових досліджень щодо оптимальної фармакотерапії у пацієнтів із переміжною кульгавістю підкреслюється в усіх консенсусних документах провідних профільних товариств.
Ефективність та безпека застосування Актовегіну в пацієнтів із захворюванням периферичних артерій: результати дослідження APOLLO
Завідувач кафедри загальної хірургії Івано-Франківського національного медичного університету, д. мед. н., професор Іван Михайлович Гудз зауважив, що історія вивчення застосування Актовегіну в пацієнтів із ЗПА є довгою, і попередні дослідження продемонстрували його ефективність. У подвійному засліпленому РКД із плацебо-контролем APOLLO вивчали ефективність та профіль безпеки препарату в пацієнтів з облітеруючим ЗПА стадії ІІb за Фонтейном у межах симптоматичної терапії. Дослідники мали на меті визначити стійкість позитивного ефекту Актовегіну щодо подовження дистанції ходьби, а також впливу препарату на якість життя та профіль безпеки порівняно із плацебо.
зауважив, що історія вивчення застосування Актовегіну в пацієнтів із ЗПА є довгою, і попередні дослідження продемонстрували його ефективність. У подвійному засліпленому РКД із плацебо-контролем APOLLO вивчали ефективність та профіль безпеки препарату в пацієнтів з облітеруючим ЗПА стадії ІІb за Фонтейном у межах симптоматичної терапії. Дослідники мали на меті визначити стійкість позитивного ефекту Актовегіну щодо подовження дистанції ходьби, а також впливу препарату на якість життя та профіль безпеки порівняно із плацебо.
У дослідження було включено 366 хворих на ЗПА стадії ІІb за Фонтейном із 19 медичних центрів трьох країн (Грузія, Казахстан, Росія). Пацієнти були рандомізовані до груп Актовегіну або плацебо у співвідношенні 1:1 (184 та 182 відповідно). Учасники мали симптоми переміжної кульгавості, яка на момент скринінгу спостерігалася впродовж останніх шести місяців. Діагноз ЗПА стадії ІІb за Фонтейном (ДБХ <200 м) підтверджували даними ультразвукового дослідження та тредміл-тесту.
Також критеріями включення були:
- вік 40-75 років;
- стійка поведінка щодо тютюнокуріння впродовж не менше трьох місяців до рандомізації;
- кісточково-плечовий індекс у стані спокою ≤0,9 (за даними доплерографії);
- інформована згода на ініціювання процедур дослідження.
Основні критерії виключення: ІІІ або IV стадія за Фонтейном (біль у спокої, ішемічна виразка чи гангрена); варіабельність МДХ >25% під час тредміл-тесту; реконструкція артерій нижніх кінцівок або симпатектомія впродовж трьох місяців до скринінгу; наявність показань до хірургічної/інтервенційної реваскуляризації; інфаркт міокарда або серйозне кардіохірургічне втручання впродовж трьох місяців до скринінгу, застійна серцева недостатність ІІІ-IV функціонального класу за критеріями Нью-Йоркської асоціації серця (NYHA), неконтрольований ЦД або ДПН, приймання вазоактивних препаратів протягом 14 днів до рандомізації.
Дослідження включало 1-2-тижневий період скринінгу та рандомізації, 12-тижневий період лікування та 12-тижневий період спостереження (загальна тривалість – 25-26 тижнів). Протягом перших 2 тижнів після рандомізації пацієнти отримували Актовегін у дозі 1200 мг/добу внутрішньовенно із подальшим переходом на таблетовану форму впродовж ще 10 тижнів (1200 мг/добу). Через 12 тижнів хворі припиняли застосування Актовегіну і протягом наступних 12 тижнів отримували лише стандартну терапію (антиагреганти, антигіпертензивні засоби, статини тощо).
Первинною кінцевою точкою була зміна ДБХ (%) на 12-й тиждень порівняно з вихідними даними (тредміл-тест). Вторинні кінцеві точки включали такі параметри, як:
- зміна ДБХ (%) на 2-му та 24-му тижнях після рандомізації;
- зміна МДХ порівняно із початковими даними на 2, 12 та 24-му тижнях;
- частка пацієнтів із появою болю у спокої на 12-му та 24-му тижнях;
- кількість хворих, яким було проведено реваскуляризаційні процедури на 24-й тиждень;
- модифікація якості життя згідно з опитувальником SF‑36 на 12-му та 24-му тижнях.
Додатково дослідники оцінювали безпеку та переносимість Актовегіну за розвитком небажаних явищ шляхом аналізу лабораторних показників, даних електрокардіографії, стану основних органів і систем, результатів загального огляду, зміни маси тіла.
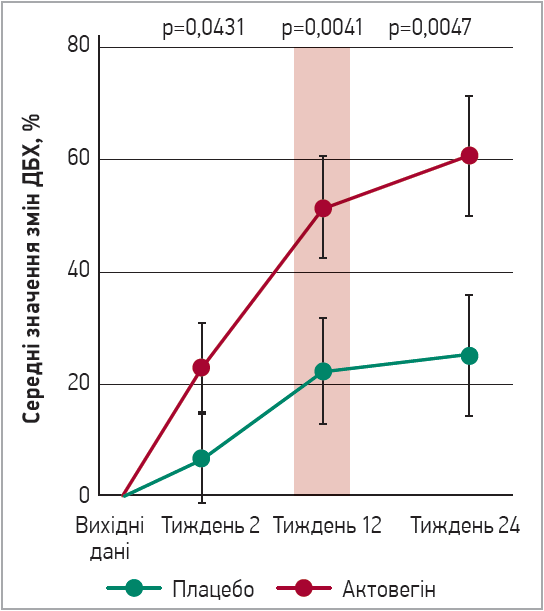
Завершили дослідження 174 та 177 пацієнтів у групах Актовегіну і плацебо відповідно. За отриманими результатами, на 2-й тиждень було зафіксоване суттєве збільшення ДБХ – на 22,4% у групі Актовегіну та 6,6% на тлі плацебо; на 12-й тиждень – 51,2 та 22% відповідно; на 24-й тиждень (через 12 тижнів після завершення приймання препарату) – 60,6 та 25,1% відповідно. Отже, у групі Актовегіну спостерігалися статистично значущі переваги порівняно із плацебо щодо подовження ДБХ через 12 тижнів (первинна кінцева точка), а також 2 і 24 тижні (вторинні кінцеві точки) (рис. 1).
Рис. 1. Динаміка змін ДБХ у групах: результати дослідження APOLLO
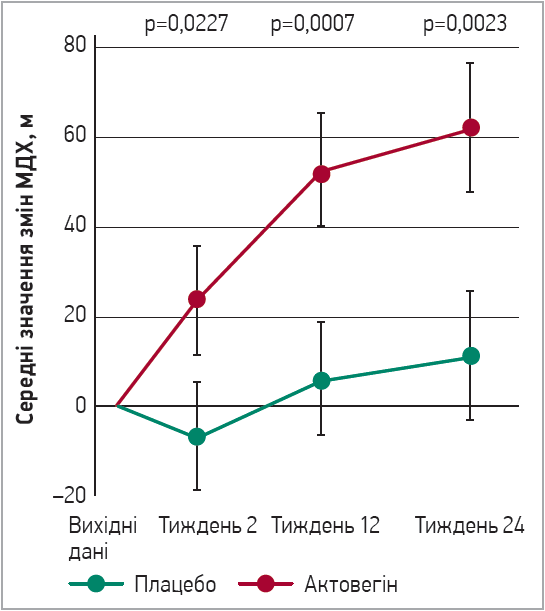
Що стосується вторинної кінцевої точки – оцінки ефективності змін МДХ (м), на 2-й тиждень (після завершення інфузійної терапії) у групі плацебо мало місце погіршення МДХ (-6,85 м), тоді як на тлі застосування Актовегіну – статистично достовірне подовження МДХ (на 23,37 м). Ще виразніші зміни було відзначено на 12-му тижні: МДХ у групах плацебо та Актовегіну становила 5,69 і 52,23 м відповідно, на 24-й тиждень – 10,9 та 61,82 м відповідно (рис. 2).
Рис. 2. Динаміка змін МДХ у групах: результати дослідження APOLLO
Своєю чергою зміни якості життя щодо фізичного здоров’я від вихідного рівня згідно з оцінкою за SF‑36 на 12-му тижні становили 2,36 бала у групі Актовегіну та 1,92 бала – плацебо, на 24-му тижні – 2,36 і 1,59 бала відповідно. Тобто показники поліпшення фізичного здоров’я у групі Актовегіну зберігалися після відміни терапії до кінця дослідження, тоді як на тлі плацебо вони знижувалися, хоча й не були підтверджені статистично значущими достовірними даними. Натомість статистично значимі зміни якості життя щодо ментального здоров’я на 12-му тижні становили 2,95 бала у групі Актовегіну та 1,8 бала – плацебо, на 24-му тижні – 3,45 і 1,17 бала відповідно.
Окрім того, профіль безпеки Актовегіну виявився прийнятним – не було зафіксовано серйозних побічних ефектів, пов’язаних із застосуванням препарату. Частота несприятливих явищ не відрізнялася від такої для плацебо. Під час спостереження науковці не зафіксували жодної побічної реакції, яку було розцінено як асоційовану з досліджуваним препаратом.
Загалом було показано, що Актовегін сприяє статистично достовірному збільшенню ДБХ у пацієнтів із ЗПА стадії ІІb за Фонтейном порівняно із плацебо через 12 тижнів терапії. Досягнення статистично значущої різниці за вторинним кінцевим результатом щодо збільшення ДБХ через 2 і 24 тижні та зміни МДХ через 2, 12 і 24 тижні порівняно із початковими даними також свідчить про переваги Аковегіну в лікуванні ЗПА стадії ІІb за Фонтейном на відміну від плацебо. Досягнутий терапевтичний ефект Актовегіну щодо збільшення ДБХ зберігався та навіть дещо посилювався після завершення терапії. Внаслідок лікування суттєво поліпшувалась якість життя хворих за показником ментального здоров’я, при цьому було показано сприятливий профіль безпеки препарату.
Таким чином, як зазначив спікер, отримані дані дослідження APOLLO підтвердили результати попередніх РКД. Продемонстровано, що Актовегін поліпшує функціональний стан ішемізованих тканин у пацієнтів з атеросклеротичним ураженням периферичних артерій, при цьому ефект терапії зберігається після відміни препарату.
Клінічні прояви та способи нівелювання хронічної загрозливої ішемії нижніх кінцівок у хворих на ЦД
Завідувач відділення діабетичної стопи Українського науково-практичного центру ендокринної хірургії, трансплантації ендокринних органів та тканин МОЗ України (м. Київ), д. мед. н., Микола Васильович Свиридов підкреслив, що у своїй практиці лікарі постійно стикаються з пацієнтами із ЦД, що мають виразні судинні розлади нижніх кінцівок. Згідно з даними ВООЗ (2019), світова поширеність ЦД продовжує зростати, відповідно, спостерігається і підвищення частоти його ускладнень у вигляді синдрому діабетичної стопи (17-19%). За прогнозами, до 2040 р. у світі буде на 200 млн більше осіб із ЦД, ніж сьогодні, при цьому 46,3% випадків залишаються недіагностованими (Diabetes Atlas, 2015).
підкреслив, що у своїй практиці лікарі постійно стикаються з пацієнтами із ЦД, що мають виразні судинні розлади нижніх кінцівок. Згідно з даними ВООЗ (2019), світова поширеність ЦД продовжує зростати, відповідно, спостерігається і підвищення частоти його ускладнень у вигляді синдрому діабетичної стопи (17-19%). За прогнозами, до 2040 р. у світі буде на 200 млн більше осіб із ЦД, ніж сьогодні, при цьому 46,3% випадків залишаються недіагностованими (Diabetes Atlas, 2015).
При ЦД на тлі діабетичної нейропатії відбувається зниження больової та інших видів чутливості, що призводить до травм і деформацій стопи, утворення пресорних виразок з їх подальшим інфікуванням та виконанням різноманітних ампутацій. Також виразки є наслідком судинних розладів на тлі діабетичної макро- та мікроангіопатії, що наявна у 10% хворих. В останніх дослідженнях показано, що частка пацієнтів із хронічною загрозливою ішемією нижніх кінцівок (ХЗІНК) вже становить близько 50% (EWMA, 2018).
Отже, недооцінка стану кровотоку в нижній кінцівці є однією з причин незадовільних результатів хірургічного лікування осіб із синдромом діабетичної стопи. Це пов’язано з тим, що стан кровотоку часто оцінюють запізно, коли вже розвиваються серйозні ускладнення.
У хворих на ЦД є власні особливості як ураження судинного артеріального русла, так і формування виразково-некротичних проявів на ступні. Причина – поступовий розвиток ХЗІНК на тлі діабетичної полінейропатії. Варто зазначити, що фонова ДПН у хворих на ЦД згладжує класичні прояви ХЗІНК.
Саме у пацієнтів із ЦД є власні нюанси та особливості ураження артеріальних судин різного діаметра (переважно артерій середнього калібру на рівні гомілки). Це дає надію на загоєння ран за допомогою розширеної консервативної терапії без реваскуляризації (за відсутності можливості її виконання судинними хірургами) при ретельному догляді за раною з урахуванням сучасних підходів до ведення ранового процесу. У таких випадках імовірність загоєння виразки/рани існує, але вона є суттєво нижчою, ніж при адекватній реваскуляризації.
Варто зазначити, що фонова ДПН у хворих на ЦД згладжує класичний прояв ХЗІНК.
Сучасні уявлення про комплексне лікування ХЗІНК, а саме дію Актовегіну, суттєво розширилися завдяки дослідженню APOLLO (2020), що ґрунтується більш на клінічних проявах ураження периферичних артерій (переміжна кульгавість). Частка осіб із ЦД становила лише 18,8%, проте не були включені пацієнти із глікованим гемоглобіном >9% та ДПН).
Ймовірно, повною мірою застосовувати результати дослідження APOLLO для хворих на ЦД можна не завжди. Проте на підставі даних цієї та інших робіт (Muller-Buhl et al., 1991; Zigler et al., 2009) можна глибше зрозуміти механізми мультимодальної дії Актовегіну з точки зору доказової медицини. Це дозволяє широко використовувати препарат при всіх формах ураження стопи в осіб із ЦД та оцінювати доцільність його внесення до локальних протоколів.
У пацієнтів із ЦД Актовегін чинить такі ефекти (Ziegler et al., 2009; Buchmayer et al., 2011):
- підвищує утилізацію клітинами глюкози завдяки вмісту інозитол фосфоолігосахаридів;
- підвищує інтенсивність транспорту глюкози із крові до мозку на 20%;
- сприяє достовірному зниженню глікованого гемоглобіну при тривалому застосуванні (шість місяців) у дозі 2000 мг.
Лектор зазначив, що власний 30-річний досвід застосування Актовегіну дозволяє спостерігати розкриття потенціалу його терапевтичної дії, особливо при ішемічних станах. Разом із позитивним ефектом при використанні у високих дозах клініцисти констатують головну перевагу препарату – незначну кількість побічних явищ.
Що ж стосується деструктивних процесів на ступні: якщо при нейроішемічному варіанті ураження стоп протягом чотирьох тижнів стандартна комплексна терапія раньового процесу малоефективна або неефективна протягом 10 днів при ішемії, рекомендовано включати допоміжні опції ведення ран, які мають системний ад’ювантний характер (IWGDF, 2019).
Основні проблеми терапії хворих на ЦД із ХЗІНК спостерігаються у постреперфузійному періоді, коли виникає синдром реоксигенаційних розладів. Для їх усунення в нашій клініці розроблено окрему лікувальну програму зі збереження опороздатності стопи з використанням ланки антигіпоксантів, ключовим з яких є «реаніматор клітин» – високоочищений депротеїнізований гемодериват Актовегін.
Критеріями ефективності застосування програми є:
- динаміка клінічної картини: зменшення больового синдрому, поліпшення сну, потепління стопи, відновлення усіх видів чутливості;
- перехід вологої гангрени в суху;
- альтерація у рані шляхом поліпшення трофіки тканин;
- перебіг ранового процесу: відмежування зон некрозів, «оживлення» ран;
- поява перспектив виконання «малих» операцій та дистальних ампутацій стопи на противагу високому усіченню нижньої кінцівки.
М. В. Свиридов навів дані з власної клінічної практики щодо вивчення ефективності Актовегіну у високих дозах (2000 мг/добу) в постперфузійному періоді за визначенням транскутанної напруги кисню (ТСРО2). Якщо від початку дослідження показники ТСРО2 автори використовували як метод діагностики ступеня ішемії стопи, то надалі після відновлення кровотоку оксиметрія мала оцінювальний характер ефекту реваскуляризації в поєднанні з призначенням Актовегіну.
У таких хворих при включенні до лікувальної програми Актовегіну больовий синдром зникав через 1-2 доби, а клінічний ефект змін у рані спостерігався на 8-10-ту добу після реваскуляризації. Плавне нівелювання явищ постперфузійних розладів без ускладнень мало місце вже на 4-5-ту добу після відновлення кровотоку. В рази зменшилася кількість виконання високих ампутацій нижніх кінцівок.
Висновки
Доцільність застосування Актовегіну в пацієнтів із хронічними облітеруючими захворюваннями судин нижніх кінцівок доведено з позицій доказової медицини.
Відповідно до результатів дослідження APOLLO, Актовегін поліпшує функціональний стан ішемізованих тканин у осіб з атеросклеротичним ураженням периферичних артерій. При цьому ефект терапії зберігається щонайменше впродовж трьох місяців після відміни препарату.
Вперше результатами РКД за участю пацієнтів із захворюваннями периферичних артерій підтверджено ефективність Актовегіну в дозі 1200 мг, зокрема таблетованої форми. Поліпшення функціонального стану ішемізованих тканин відбувається за рахунок метаболічних та мікроциркуляторних ефектів, що були доведені у доклінічних і клінічних дослідженнях.
У хворих на ЦД із деструктивними формами діабетичної стопи на тлі ХЗІНК комплексне хірургічне лікування, що включає і призначення Актовегіну, сприяє оптимізації перебігу раньового процесу, поліпшенню динаміки клінічної картини хвороби та збереженню опороздатності нижньої кінцівки.
Підготувала Олександра Демецька
За сприяння ТОВ «Такеда Україна».
C-APROM/UA/AVG/0447