1 серпня, 2024
Роль інгібіторів протеасом другого покоління у подоланні рецидивів і рефрактерності при множинній мієломі: досвід застосування карфілзомібу
Множинна мієлома (ММ) залишається невиліковним захворюванням з неминучим розвитком рецидивів і рефрактерності до протипухлинної терапії. Впровадження новітніх лікарських засобів, зокрема, інгібіторів протеасом другого покоління, істотно розширило терапевтичні опції для пацієнтів з рецидивною / рефрактерною (р/р) формою ММ. На сателітному симпозіумі, який відбувся під час XIII Науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань», було розглянуто сучасні стратегії лікування р/рММ з особливим фокусом на застосуванні карфілзомібу. У рамках сателітного симпозіуму провідні українські експерти галузі онкогематології поділилися думками щодо нових інгібіторів протеасом у терапії р/рММ, зокрема, щодо клінічного досвіду застосування карфілзомібу та перспектив його ширшого впровадження у вітчизняну практику.
.jpg) Завідувачка клініки хіміотерапії та онкогематології ДНП «Національний інститут раку» (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок представила доповідь «Сьогоденні підходи до лікування хворих з р/рММ».
Завідувачка клініки хіміотерапії та онкогематології ДНП «Національний інститут раку» (м. Київ), доктор медичних наук, професор Ірина Анатоліївна Крячок представила доповідь «Сьогоденні підходи до лікування хворих з р/рММ».
– ММ є другим за частотою гематологічним злоякісним новоутворенням у світі, що складає 10% від усіх онкогематологічних захворювань. За епідеміологічними даними, кожна 132-га людина має ризик захворіти на ММ упродовж життя. Незважаючи на значний прогрес у лікуванні, близько 50% пацієнтів живуть приблизно 5 років після встановлення діагнозу. ММ переважно діагностується у людей похилого віку, при цьому лише до 20% випадків виявляються на ранній стадії, тоді як решта – на пізніших стадіях захворювання, що асоціюється з гіршим прогнозом.
Відповідно до сучасних даних, 5-річна загальна виживаність пацієнтів з ММ на сьогодні складає близько 56%. Поширеність захворювання зростає з віком, досягаючи піку у віковій групі 65-74 роки. Однак третина пацієнтів є старшими за 75 років. Ця вікова група особливо вразлива, оскільки характеризується наявністю коморбідних станів і зниженим функціональним статусом, що впливає на якість життя й ефективність терапії. Слід зазначити, що поширеність ММ і несприятливий прогноз є вищими в країнах з низьким і середнім рівнем доходу, до яких наразі належить Україна. Це пов’язано з обмеженою доступністю сучасних методів діагностики та лікування хворих на ММ.
Сьогодні існує широкий спектр опцій для першої лінії лікування пацієнтів з ММ. Вони включають інгібітори протеасом (бортезоміб), імуномодулятори (леналідомід), моноклональні антитіла (даратумумаб) у комбінації з дексаметазоном. В Україні доступна триплетна схема бортезоміб + леналідомід + дексаметазон (VRD), яку призначають при ММ згідно з міжнародними рекомендаціями. Для певної категорії пацієнтів, за умови фінансової спроможності, може бути запропонована схема з додаванням даратумумабу.
Важливим методом консолідації ремісії у пацієнтів з ММ залишається високодозова хіміотерапія з аутологічною трансплантацією гемопоетичних стовбурових клітин. Прикро, що в Україні значна частка пацієнтів, які є кандидатами на трансплантацію, не отримують її з різних причин. При пізніх рецидивах ММ пріоритетним напрямом є долучення пацієнтів до клінічних досліджень, що дозволяє отримати доступ до інноваційних лікарських засобів.
Відповідно до міжнародних настанов, при виборі терапії р/рММ важливо враховувати низку факторів, зокрема, номер рецидиву (перший, другий або наступний), попередні лінії терапії та рефрактерність до окремих препаратів (леналідоміду чи бортезомібу). Важливо враховувати, що на пізніх стадіях захворювання може розвиватися резистентність до трьох або більше класів протипухлинних агентів, що значно обмежує терапевтичні опції.
Згідно з рекомендаціями Європейської асоціації гематологів (EHA) та Європейського товариства медичної онкології (ESMO), терапевтичні опції для пацієнтів з р/рММ окрім традиційних схем на основі бортезомібу, леналідоміду та даратумумабу включають низку нових препаратів. Серед них особливе місце посідає карфілзоміб – інгібітор протеасом другого покоління. Так, відповідно до останніх настанов, для пацієнтів з рефрактерністю до леналідоміду рекомендовані схеми на основі помалідоміду. У разі збереженої чутливості до бортезомібу спектр терапевтичних опцій достатньо широкий і включає комбінації на основі карфілзомібу, помалідоміду чи венетоклаксу з бортезомібом або леналідомідом.
Водночас варіабельність схем терапії для р/рММ є меншою порівняно з першою лінією. При другому й наступних рецидивах перевага надається залученню пацієнтів у клінічні дослідження, що дозволяє отримати доступ до інноваційних лікарських засобів. На жаль, в умовах воєнного стану проведення клінічних досліджень в Україні значно ускладнене, а пацієнти, включені у них до початку повномасштабного вторгнення, потребували релокації в інші центри.
Рекомендації Національної онкологічної мережі США (NCCN) передбачають стратифікацію пацієнтів з р/рММ на дві групи залежно від рефрактерності до бортезомібу або леналідоміду. Вибір схеми терапії ґрунтується на принципі повторного призначення препаратів, до яких збережена чутливість, з додаванням нових агентів. Водночас точне визначення рефрактерності до бортезомібу або леналідоміду при застосуванні комбінованих режимів може бути утрудненим. Розвиток рецидиву на фоні підтримуючої терапії бортезомібом або леналідомідом розглядається як свідчення резистентності до відповідного препарату.
На ефективність протипухлинної терапії у пацієнтів з ММ впливає низка факторів, зокрема, загальний стан пацієнта, коморбідна патологія, симптоми захворювання, токсичність попереднього лікування та індивідуальні вподобання хворого. В Україні важливе значення має також фінансова токсичність, пов’язана з обмеженим доступом до інноваційних лікарських засобів. Основними завданнями терапії ММ залишаються досягнення максимальної ефективності, збереження якості життя пацієнта та врахування його побажань.
Сьогодні на фармацевтичному ринку України доступний препарат карфілзомібу під торговою назвою Корліса® виробництва компанії Dr. Reddy’s Laboratories Ltd. Реєстрація препарату стала важливим кроком на шляху до розширення терапевтичних опцій для пацієнтів з р/рММ у нашій країні. Ефективність і безпека карфілзомібу були продемонстровані у низці ключових клінічних досліджень. Зокрема, у дослідженнях ASPIRE та ENDEAVOR застосування карфілзомібу асоціювалося зі статистично значущим і клінічно релевантним покращенням виживаності без прогресування (ВБП) та загальної виживаності (ЗВ) порівняно зі стандартними режимами терапії на основі леналідоміду та бортезомібу відповідно.
Таким чином, впровадження карфілзомібу в клінічну практику дозволяє розширити спектр терапевтичних опцій для пацієнтів з р/рММ. Дані сучасних досліджень підтвердили ефективність і безпеку використання препарату для цієї категорії пацієнтів, що дозволяє розглядати карфілзоміб як важливий компонент сучасних схем лікування.
 Із доповіддю «Діагностичні підходи та стратифікація ризиків при р/рММ» виступив керівник Центру гематології, хіміотерапії гемобластозів та трансплантації кісткового мозку Клінічної лікарні «Феофанія» ДУС, завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Вікторович Клименко, проаналізувавши ключові аспекти оцінки прогнозу та вибору тактики лікування у пацієнтів із цією патологією.
Із доповіддю «Діагностичні підходи та стратифікація ризиків при р/рММ» виступив керівник Центру гематології, хіміотерапії гемобластозів та трансплантації кісткового мозку Клінічної лікарні «Феофанія» ДУС, завідувач кафедри клінічної лабораторної діагностики Національного університету охорони здоров’я України імені П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Вікторович Клименко, проаналізувавши ключові аспекти оцінки прогнозу та вибору тактики лікування у пацієнтів із цією патологією.
– ММ – складне онкогематологічне захворювання, яке характеризується хронічним рецидивуючим перебігом. На відміну від дифузної В-великоклітинної лімфоми, крива виживаності пацієнтів з ММ демонструє поступове зниження без вираженого плато. Це зумовлює необхідність використання численних терапевтичних опцій і ретельної стратифікації пацієнтів на різних етапах перебігу захворювання.
Перебіг ММ проходить певні етапи, починаючи з моноклональної гаммапатії неясного значення (MGUS), яка згодом трансформується у тліючу (smoldering) мієлому і, врешті-решт, в симптоматичну ММ. Клінічно виражена ММ характеризується чергуванням періодів ремісії та рецидивів із поступовим зменшенням чутливості пухлинного клону до лікування. На термінальній стадії захворювання пухлина є рефрактерною до наявних терапевтичних опцій.
Стратифікація пацієнтів на групи ризику – важлива складова вибору оптимальної тактики лікування. Історично використовували стадіювання за Durie – Salmon, проте на сьогодні доступний ширший спектр прогностичних інструментів. До них належать:
- цитогенетичні аномалії, асоційовані з високим ризиком (транслокації t(4;14), t(14;16), gain/amp(1q) та ін.);
- лабораторні показники (рівень β2-мікроглобуліну, альбуміну тощо);
- клінічні характеристики (екстрамедулярні ураження, плазмоклітинна лейкемія, вік);
- функціональні параметри, які визначаються після ініціації терапії (первина рефрактерність, швидке прогресування протягом 18 міс після встановлення діагнозу).
У рутинній клінічній практиці широко застосовується Міжнародна система стадіювання (International Staging System, ISS), що базується на визначенні рівнів β2-мікроглобуліну та альбуміну. Загалом ММ асоціюється з широким спектром цитогенетичних аномалій, які умовно поділяють на первинні (ініціюючі) та вторинні генетичні події. До первинних подій належать перебудови гена важких ланцюгів імуноглобулінів (IgH), що локалізований на хромосомі 14q32. Найчастіше виявляють транслокації t(4;14), t(6;14), t(11;14), t(14;16), t(14;20), які можуть виникати ще на етапі MGUS або тліючої мієломи. Вторинні генетичні аберації, такі як інактивація гена TP53, асоціюються з прогресуванням захворювання та гіршим прогнозом.
Дані щодо цитогенетичних аномалій інкорпоровані в сучасні системи стратифікації ризику ММ. Зокрема, значного поширення сьогодні набула шкала Revised International Staging System (R-ISS), яка окрім традиційних лабораторних показників (β2-мікроглобулін, альбумін) враховує наявність del(17p), t(4;14) та t(14;16), а також рівень лактатдегідрогенази (ЛДГ). Визначення цих прогностично несприятливих цитогенетичних маркерів рекомендоване для всіх пацієнтів на момент встановлення діагнозу ММ. Стратифікація за R-ISS дозволяє ефективно виділити групу високого ризику. Так, 5-річна ЗВ для пацієнтів з R-ISS I (низький рівень β2-мікроглобуліну, нормальний рівень альбуміну, сироваткової ЛДГ, відсутність цитогенетичних аномалій високого ризику) становить 82%, тоді як для пацієнтів з R-ISS III цей показник знижується до 40%.
Важливість розширеного цитогенетичного профілювання при ММ зумовлена прогностичною цінністю аномалій, не включених до шкали R-ISS. Яскравим прикладом є ампліфікація 1q21 – цитогенетична аберація, асоційована з агресивним перебігом захворювання і коротшою ЗВ. На сьогодні доведено «дозозалежний» вплив цієї аномалії на прогноз: пацієнти з ампліфікацією (≥4 копії 1q21) мають гірші показники виживаності порівняно з пацієнтами з трисоміями чи нормальним каріотипом за 1-ю хромосомою.
Іншим підходом до стратифікації є оцінка кількості несприятливих цитогенетичних маркерів у конкретного пацієнта. Наявність двох і більше аберацій високого ризику (так звана double-hit або triple-hit мієлома) асоціюється з украй несприятливим прогнозом і потребує інтенсифікації першої лінії терапії. Тому серед комплексних систем оцінки ризику варто назвати шкалу mSMART 3.0 (Mayo Stratification of Myeloma and Risk-Adapted Therapy), яка крім класичних цитогенетичних факторів, визначених в R-ISS, інтегрує дані щодо ампліфікації 1q21, а також клінічні характеристики (ранній рецидив після трансплантації, прогресування протягом 1 року після встановлення діагнозу). Додатковим параметром, який слід враховувати в рутинній практиці, є відсутність у пацієнта можливості застосування нових лікарських засобів, що істотно звужує терапевтичні опції в умовах обмежених ресурсів.
Ще однією багатопараметричною шкалою є R2-ISS, яка включає оцінку ампліфікації 1q крім лабораторних і цитогенетичних маркерів, що входять до R-ISS. Модель R2-ISS дуже ефективна у стратифікації пацієнтів на групи ризику та може бути рекомендована для використання в клінічній практиці. Відтак вибір оптимальної системи стратифікації має базуватись на діагностичних можливостях конкретного закладу, економічній доцільності та меті застосування (клінічні дослідження, рутинна практика). Визначення групи високого ризику має бути адаптованим до локального протоколу ведення пацієнтів з ММ.
Незважаючи на наявність численних прогностичних систем, загальноприйнятим критерієм високого ризику при ММ, відповідно до консенсусу Міжнародної робочої групи з мієломи (International Myeloma Working Group, IMWG), є очікувана медіана ЗВ менше 3 років для кандидатів на трансплантацію і менше 2 років для пацієнтів, яким трансплантація не показана. Тож всі наявні системи стратифікації пацієнтів з ММ підводять до того, наскільки прогнозована виживаність для пацієнтів з ММ. Так, ретельна оцінка динаміки рівня М-протеїну, мієлограми та радіологічних даних дозволяє вчасно діагностувати рецидив або рефрактерність та обгрунтовано змінювати терапевтичну тактику.
При виборі оптимальної схеми лікування рецидивів слід зважати на ефективність і токсичність попередніх ліній терапії, наявність екстрамедулярних вогнищ, швидкість підвищення рівня М-протеїну, вік і коморбідний статус пацієнта. Біохімічний рецидив за відсутності клінічних проявів не завжди потребує негайного початку лікування, в деяких випадках можна застосувати вичікувальну тактику. Варто зазначити, що спектр цитогенетичних аномалій при прогресуванні ММ може змінюватись. Зокрема, частота del(17p) та ампліфікації 1q зростає в пізніх рецидивах. Тому повторне вивчення цитогенетичного профілю може мати значення для вибору оптимальної терапевтичної стратегії.
Попри вагоме мутаційне навантаження та виражену внутрішньопухлинну гетерогенність, впровадження нових протимієломних засобів дозволило істотно розширити терапевтичний арсенал і покращити довгострокові результати лікування. Зокрема, використання карфілзомібу (Корліса®) – селективного незворотного інгібітора протеасом другого покоління – відкрило нові можливості в лікуванні р/рММ.
Історично для лікування рецидивів застосовували дуплети, а сучасні підходи передбачають використання триплетів на основі леналідоміду та бортезомібу (наприклад, схема RVd) вже в першій лінії з подальшою підтримувальною терапією леналідомідом. За таких умов застосування схем на основі карфілзомібу особливо актуальне при рецидивах у пацієнтів, що отримували леналідомід як підтримувальну терапію. До опцій другої лінії у цієї категорії хворих належать комбінації карфілзоміб + дексаметазон, карфілзоміб + леналідомід + дексаметазон, а також чотирикомпонентні схеми з включенням карфілзомібу та моноклональних антитіл (даратумумабу).
Таким чином, діагностика та лікування ММ в еру інноваційної терапії набувають нових рис і потребують комплексної оцінки клінічних, лабораторних та молекулярно-генетичних даних на різних етапах перебігу захворювання. Моніторинг клональної еволюції пухлини та раціональне застосування нових протимієломних засобів, зокрема інгібіторів протеасом другого покоління, є запорукою успішного тривалого контролю цього невиліковного захворювання.
 Про використання нових інгібіторів протеасом у терапії р/рММ розповіла завідувачка відділення онкогематології ДНП «Національний інститут раку» (м. Київ) Тетяна Вікторівна Каднікова.
Про використання нових інгібіторів протеасом у терапії р/рММ розповіла завідувачка відділення онкогематології ДНП «Національний інститут раку» (м. Київ) Тетяна Вікторівна Каднікова.
– Сучасні здобутки в лікуванні ММ дозволяють досягати хорошої відповіді на терапію у цієї категорії пацієнтів. В Україні, як і в усьому світі, стандартом лікування є схема VRD. Проте при рецидиві захворювання після такої терапії виникають труднощі, оскільки пацієнти вже отримували інгібітори протеасом та імуномодулюючі препарати. У таких випадках на допомогу приходять інгібітори протеасом другого покоління, такі як карфілзоміб, що дозволяють досягти глибшої та тривалішої відповіді.
Карфілзоміб уперше зареєстрований у світі у 2013 році, а в Україні – у 2023 році. На сьогодні в Україні доступний лише один препарат карфілзомібу – Корліса® (Dr. Reddy’s Laboratories Ltd.). Карфілзоміб може застосовуватись у складі дво- або трикомпонентної терапії, наприклад, у комбінації з дексаметазоном, леналідомідом і дексаметазоном, даратумумабом та дексаметазоном.
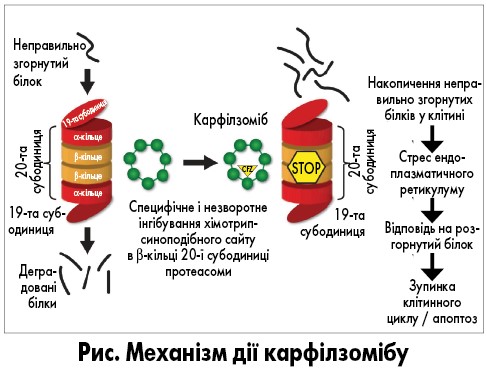 Механізм дії карфілзомібу полягає у селективному та незворотному зв’язуванні з протеолітичною субодиницею протеасоми, що призводить до індукції внутрішньоклітинної стрес-реакції на неправильно згорнуті білки, зниження ефективності фактора некрозу пухлини, модифікації метаболізму кісткової тканини та мікрооточення кісткового мозку, а також індукції моногенної загибелі мієломних клітин шляхом посиленого лізосомального протеолізу (рис.). На відміну від бортезомібу, зв’язування карфілзомібу з протеасомами є незворотним, що забезпечує більш стійке їх пригнічення. Крім того, карфілзоміб проявляє вищу активність проти резистентних до бортезомібу клітинних ліній і потенційно знижує ризик розвитку периферичної нейропатії.
Механізм дії карфілзомібу полягає у селективному та незворотному зв’язуванні з протеолітичною субодиницею протеасоми, що призводить до індукції внутрішньоклітинної стрес-реакції на неправильно згорнуті білки, зниження ефективності фактора некрозу пухлини, модифікації метаболізму кісткової тканини та мікрооточення кісткового мозку, а також індукції моногенної загибелі мієломних клітин шляхом посиленого лізосомального протеолізу (рис.). На відміну від бортезомібу, зв’язування карфілзомібу з протеасомами є незворотним, що забезпечує більш стійке їх пригнічення. Крім того, карфілзоміб проявляє вищу активність проти резистентних до бортезомібу клітинних ліній і потенційно знижує ризик розвитку периферичної нейропатії.
Ефективність комбінації карфілзоміб + леналідомід + дексаметазон (KRd) порівняно зі стандартним режимом леналідомід + дексаметазон (Rd) була доведена в рандомізованому дослідженні III фази ASPIRE. Медіана ВБП у групі KRd становила 26,3 проти 17,6 міс у групі Rd (різниця 8,7 міс). Покращення ВБП спостерігалося в усіх підгрупах пацієнтів, включаючи осіб із високим цитогенетичним ризиком. Застосування схеми KRd також асоціювалося з подовженням ЗВ: медіана ЗВ склала 48,3 міс у групі KRd порівняно з 40,4 міс у групі Rd.
Окрім покращення виживаності, застосування карфілзомібу давало змогу досягти вищої частоти відповіді на лікування. Частка пацієнтів, що досягли повної відповіді, становила 31,8% в групі KRd та 9,3% в групі Rd. Дуже хорошу часткову або кращу відповідь було зареєстровано у 69,9 та 40,4% пацієнтів відповідно.
Профіль безпеки карфілзомібу в цілому був прогнозованим і керованим. Хоча частота побічних явищ ≥3 ступеня була зіставною в обох групах (83,7% для KRd і 80,7% для Rd), відміна лікування через побічні ефекти була дещо вищою в групі Rd (17,7 проти 15,3% в групі KRd). До найбільш клінічно значущих небажаних явищ на фоні прийому карфілзомібу належали задишка, серцева недостатність, ішемічна хвороба серця, артеріальна гіпертензія та гостре ураження нирок. Втім, застосування карфілзомібу асоціювалося з покращенням якості життя, починаючи з 1-го циклу і зберігаючись до 18-го циклу терапії.
Рандомізоване дослідження III фази ENDEAVOR, що проводилось у 198 центрах 27 країн, включаючи 5 центрів в Україні (Львів, Харків, Київ, Черкаси та Хмельницький), мало на меті порівняти ефективність і безпеку схем Kd та бортезоміб + дексаметазон (Vd) у пацієнтів із рецидивуючою або прогресуючою ММ. Медіана ВБП була майже вдвічі вищою в групі Kd порівняно з групою Vd (18,7 проти 9,4 міс). Переваги Kd спостерігались в усіх підгрупах пацієнтів, незалежно від попереднього застосування інгібіторів протеасом. Окрім покращення ВБП, у пацієнтів групи Kd спостерігалась вища ЗВ – 47,6 проти 40,0 міс для групи Vd.
Хоча профілі безпеки обох препаратів були в цілому керованими, спектр побічних ефектів дещо відрізнявся. Частота артеріальної гіпертензії ≥3 ступеня, задишки та серцевої недостатності була вищою в групі Kd, а частота периферичної нейропатії ≥2 ступеня – значно нижчою (32% у групі Vd проти 6% в групі Kd), відповідно, пацієнти продовжували приймати досліджуване лікування. Частота припинення терапії через побічні ефекти та смерть під час дослідження були порівнянними.
Карфілзоміб був схвалений Управлінням з контролю якості харчових продуктів і лікарських препаратів США в 2019 році для лікування р/рММ. В Україні препарат Корліса® зареєстрований для терапії дорослих пацієнтів з ММ, які отримали щонайменше одну попередню лінію протипухлинного лікування, в комбінації з даратумумабом і дексаметазоном, леналідомідом і дексаметазоном або лише з дексаметазоном.
Перед ініціацією терапії карфілзомібом слід забезпечити адекватну гідратацію та ретельно контролювати водно-електролітний баланс з урахуванням індивідуальних особливостей пацієнта, особливо за наявності серцевої недостатності або факторів ризику її розвитку. Висока ефективність препарату асоціюється з ризиком виникнення синдрому лізису пухлини та ниркової токсичності, що зумовлює необхідність ретельного моніторингу стану пацієнтів.
Пацієнтам, які отримують карфілзоміб, рекомендована противірусна профілактика оперізуючого герпесу, а при застосуванні комбінації з леналідомідом і дексаметазоном – також тромбопрофілактика.
При використанні карфілзомібу в комбінації лише з дексаметазоном препарат вводиться внутрішньовенно в дозі 56 мг/м2 площі поверхні тіла в 1-й, 2, 8, 9, 15 і 16-й дні 28-денного циклу. В 1-й та 2-й дні першого циклу доза карфілзомібу редукується до 20 мг/м2. Дексаметазон вводять перорально або внутрішньовенно в дозі 20 мг у 1-й, 2, 8, 9, 15, 16, 22 та 23-й дні кожного 28-денного циклу.
У разі розвитку гематологічної токсичності рекомендовані такі модифікації дози карфілзомібу (згідно з інструкцією до препарату Корліса®):
- нейтропенія 4 ступеня: призупинити використання препарату до відновлення абсолютної кількості нейтрофілів ≥0,5×109/л, потім відновити введення в попередній дозі, при повторних епізодах – редукція дози на 1 рівень;
- фебрильна нейтропенія: відтермінувати застосування препарату до відновлення початкової абсолютної кількості нейтрофілів та нормалізації температури тіла, потім продовжити введення в попередній дозі;
- тромбоцитопенія <10×109/л: призупинити використання препарату до відновлення кількості тромбоцитів ≥10×109/л і контролю кровотечі, потім відновити введення в попередній дозі; при повторних епізодах – редукція дози на 1 рівень.
Рекомендації щодо корекції дози карфілзомібу при розвитку негематологічної токсичності:
- ниркова токсичність (підвищення рівня креатиніну сироватки ≥2 рази від базового або зниження кліренсу креатиніну <15 мл/хв): відмінити препарат і контролювати функцію нирок; відновити введення зі зниженням дози на 1 рівень при поверненні показників у межі 25% від початкового рівня; для пацієнтів на діалізі застосовувати карфілзоміб після процедури діалізу;
- інша негематологічна токсичність (переважно кардіальна): призупинити введення препарату до зникнення проявів або повернення до початкового рівня; розглянути можливість відновлення введення зі зниженням дози на 1 рівень.
Отже, карфілзоміб є ефективною опцією лікування р/рММ з прийнятним профілем безпеки. Ретельний моніторинг стану пацієнта, своєчасна корекція дози та належний менеджмент побічних ефектів дають змогу оптимально використовувати терапевтичний потенціал цього інноваційного препарату.
Підготувала Анна Сочнєва
Статтю підготовлено за підтримки компанії «Др. Редді’с Лабораторіз» для надання професійної інформації спеціалістам у сфері охорони здоров’я.
Містить відомості про лікарський засіб (інформацію про який також див. у супутньому інфоблоці).
COR-12.06.2024-ONCO-7.1, ч. 2.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 4 (90) 2024 р.


