29 жовтня, 2024
NALIRIFOX у порівнянні зі стандартною терапією при метастатичній протоковій аденокарциномі підшлункової залози
Результати дослідження NAPOLI 3
Протокова аденокарцинома підшлункової залози (ПАПЗ) залишається однією з найбільш летальних форм раку із вкрай несприятливим прогнозом. Особливо складною є ситуація з метастатичною ПАПЗ (мПАПЗ). Агресивний характер захворювання, пізня діагностика та обмежена ефективність наявних методів лікування сприяють високій смертності від цієї патології.
Сучасні стратегії терапії мПАПЗ базуються на застосуванні комбінованих режимів хіміотерапії. До недавнього часу стандартами першої лінії лікування вважалися два режими: FOLFIRINOX (комбінація фторурацилу, лейковорину, іринотекану та оксаліплатину) і комбінація наб-паклітакселу з гемцитабіном. Хоча ці режими продемонстрували покращення виживаності порівняно з монотерапією гемцитабіном, їхня ефективність залишається обмеженою, а токсичність – значною. У цьому контексті розробка нових терапевтичних підходів є критично важливою для покращення результатів лікування пацієнтів із мПАПЗ. Одним із перспективних напрямків є використання ліпосомальних форм хіміотерапевтичних препаратів, які можуть забезпечити кращу доставку діючої речовини до пухлини при зниженні системної токсичності. Дослідження NAPOLI 3 представляє новий режим NALIRIFOX, що включає ліпосомальний іринотекан у комбінації з 5-фторурацилом, лейковорином та оксаліплатином. Це рандомізоване дослідження 3 фази порівнювало NALIRIFOX зі стандартною терапією наб-паклітакселом та гемцитабіном у пацієнтів із мПАПЗ, які раніше не отримували лікування. Результати дослідження демонструють статистично значуще покращення і загальної виживаності (ЗВ), і виживаності без прогресування (ВБП) при застосуванні режиму NALIRIFOX із керованим профілем безпеки.
ПАПЗ залишається одним із найбільш летальних злоякісних новоутворень з оціненим п’ятирічним виживанням лише 3% для пацієнтів, у яких діагностовано метастатичне захворювання [1, 2]. За останнє десятиліття два комбіновані режими хіміотерапії, квадруплет фторурацилу, лейковорину, іринотекану і оксаліплатину (FOLFIRINOX) та дуплет наб-паклітакселу і гемцитабіну стали стандартом першої лінії лікування [3-5]. Проте ці режими ніколи не порівнювалися безпосередньо, через що існує невизначеність щодо оптимального режиму лікування. За винятком раку підшлункової залози з високою мікросателітною нестабільністю, інгібітори імунних контрольних точок продемонстрували лише часткові переваги, і хоча існує великий інтерес до використання геномного профілювання для покращення результатів, відносно мало пацієнтів придатні для отримання молекулярно спрямованих препаратів [6-8]. Поганий прогноз та низька кількість доступних варіантів лікування для більшості пацієнтів спонукають до подальших досліджень для порівняння ефективних та толерантних нових підходів до лікування, а також для максимізації переваг режимів цитотоксичної хіміотерапії.
Іринотекан, який належить до класу інгібіторів топоізомерази I, виявляє фармакологічну активність переважно через свій активний метаболіт SN-38 [9]. Пегильована ліпосомальна формуляція іринотекану є інноваційною формою препарату, де молекули іринотекану інкапсульовані у ліпідному двошаровому пухирці або ліпосомі. Ліпосомальна інкапсуляція іринотекану подовжує його циркуляцію та обмежує розподіл порівняно з неліпосомальними формами іринотекану. Пегильований ліпосомальний не є еквівалентним неліпосомальним формам іринотекану і не має замінюватись [10, 11].
У дослідженні 3 фази NAPOLI 1 ліпосомальний іринотекан у комбінації із фторурацилом та лейковорином значно подовжив ЗВ порівняно із фторурацилом та лейковорином у пацієнтів із мПАПЗ, чиє захворювання прогресувало після терапії на основі гемцитабіну [13]. Фаза 1/2 дослідження NCT02551991 продемонструвала перспективну протипухлинну активність ліпосомального іринотекану в комбінації із фторурацилом, лейковорином та оксаліплатином (NALIRIFOX) у пацієнтів із мПАПЗ, які раніше не отримували лікування. Медіана ВБП становила 9,2 місяця (95% довірчий інтервал (ДІ) 7,69-11,96), а ЗВ – 12,6 місяця (8,74-18,69) [14].
Ґрунтуючись на цих результатах, дослідження 3 фази NAPOLI 3 мало на меті порівняти ефективність NALIRIFOX із наб-паклітакселом та гемцитабіном у пацієнтів із мПАПЗ, які раніше не отримували лікування в метастатичній стадії.
Методи
Дизайн дослідження та учасники
NAPOLI 3 було рандомізованим, відкритим дослідженням 3 фази, проведеним у 187 медичних центрах 18 країн світу. До участі залучалися пацієнти віком 18 років і старші з гістологічно або цитологічно підтвердженою мПАПЗ. Підставою для участі була наявність щонайменше однієї вимірюваної метастатичної пухлини згідно з Критеріями оцінки відповіді при солідних пухлинах (RECIST) версії 1.1, а також функціонального статусу 0 або 1 за шкалою Східної об’єднаної онкологічної групи (ECOG). Важливою умовою було встановлення початкового діагнозу метастатичного захворювання не раніше ніж за шість тижнів до процедури скринінгу.
Рандомізація та стратифікація
Процес рандомізації здійснювався у співвідношенні 1:1 із використанням стратифікованої блокової рандомізації, що проводилася незалежною, третьою стороною через інтегровану систему інтерактивного голосового або вебвідгуку. Стратифікація враховувала три ключові фактори: географічний регіон (Північна Америка, Східна Азія, решта світу), функціональний статус за ECOG (0 проти 1) та наявність метастазів у печінці.
Схеми лікування
Пацієнти, які рандомізовано потрапили в експериментальну групу, отримували режим NALIRIFOX, що складався з ліпосомального іринотекану (50 мг/м2), оксаліплатину (60 мг/м2), лейковорину (400 мг/м2) та фторурацилу (2400 мг/м2). Препарати вводилися послідовно у вигляді безперервної внутрішньовенної інфузії тривалістю 46 годин на перший та 15-й дні кожного 28-денного циклу. Контрольна група отримувала стандартну терапію наб-паклітакселом (125 мг/м2) та гемцитабіном (1000 мг/м2), що вводилися внутрішньовенно на перший, восьмий та 15-й дні 28-денного циклу.
Оцінка ефективності та безпеки
Оцінка розмірів пухлини проводилася за допомогою комп’ютерної томографії або магнітно-резонансної томографії при скринінгу та кожні вісім тижнів протягом лікування до прогресування захворювання з використанням критеріїв RECIST v1.1. У пацієнтів без прогресування на момент припинення лікування оцінка продовжувалася із тією ж періодичністю до виявлення прогресування або початку нової протиракової терапії.
Лікування тривало до радіологічно підтвердженого прогресування захворювання або розвитку неприйнятної токсичності, що визначалася дослідниками. Після його припинення пацієнти спершу проходили 30-денну оцінку безпеки, а потім фазу довгострокового спостереження з оцінкою кожні два місяці. Спостереження тривало до смерті, втрати для подальшого спостереження, відкликання згоди або закриття дослідження.
Кінцеві точки та оцінка безпеки
Первинною кінцевою точкою дослідження була ЗВ, що визначалася як час від рандомізації до смерті з будь-якої причини. Ключовими вторинними кінцевими точками були ВБП та загальна частота об’єктивної відповіді.
Безпека оцінювалася з допомогою реєстрації побічних явищ, які кодувалися згідно з Медичним словником для регуляторної діяльності (версія 25.0). Тяжкість побічних явищ класифікувалася відповідно до Загальних термінологічних критеріїв побічних явищ Національного інституту раку (версія 5.0).
Результати
Дослідження NAPOLI 3 проводилось у період з 19 лютого 2020-го по 17 серпня 2021 р. У ньому брали участь 770 пацієнтів із мПАПЗ, рандомізовані у співвідношенні 1:1 для отримання режиму NALIRIFOX (n=383) або комбінації наб-паклітакселу та гемцитабіну (n=387). Популяція безпеки складалася із 749 пацієнтів (370 у групі NALIRIFOX та 379 у групі наб-паклітакселу та гемцитабіну), які отримали принаймні одну дозу досліджуваного препарату.
Ефективність лікування
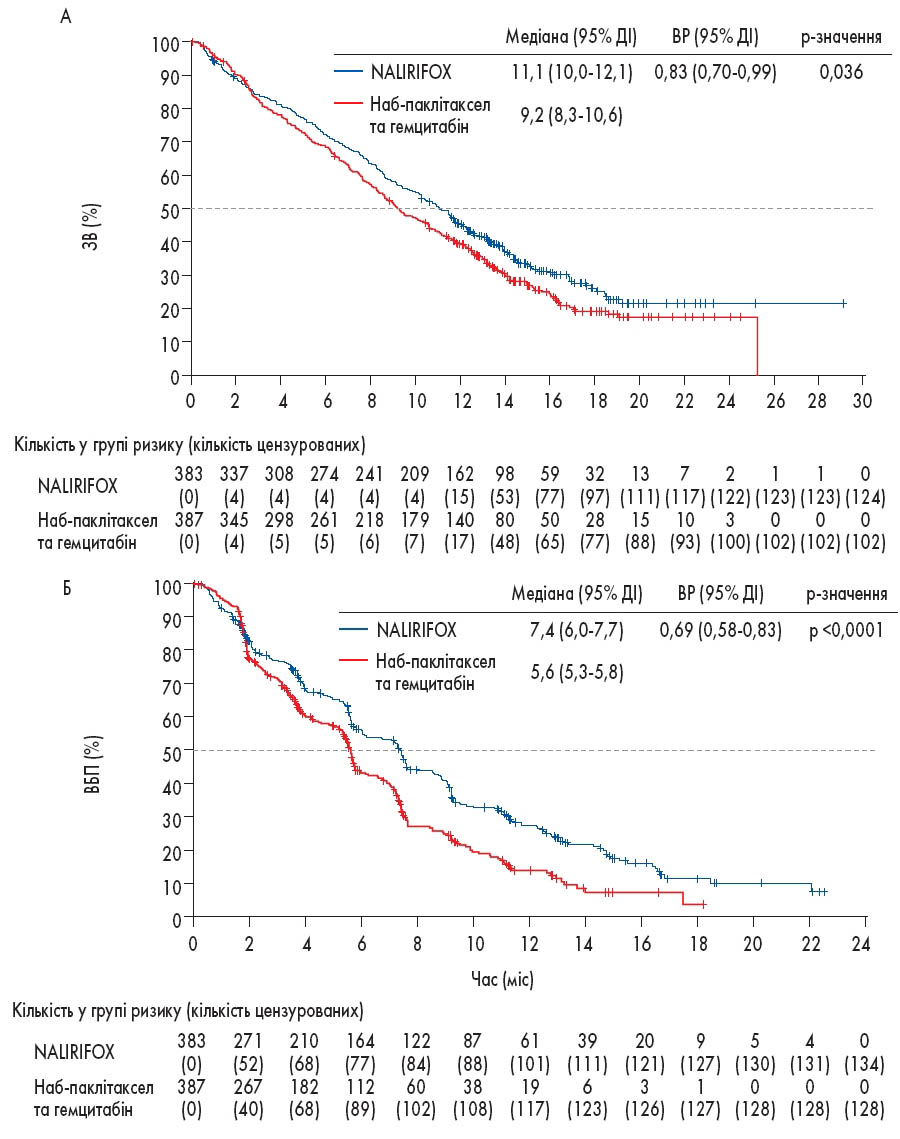
Аналіз ЗВ базувався на 544 випадках смерті за медіану спостереження 16,1 місяця (міжквартильний діапазон 13,4-19,1). Медіана ЗВ у групі NALIRIFOX становила 11,1 місяця (95% ДІ 10,0-12,1) порівняно з 9,2 місяця (95% ДІ 8,3-10,6) у групі наб-паклітакселу та гемцитабіну. Відношення ризиків (ВР) становило 0,83 (95% ДІ 0,70-0,99; p=0,036), що свідчить про статистично значуще зниження ризику смерті на 17% у групі NALIRIFOX. Показники 12-місячної ЗВ становили 45,6% (95% ДІ 40,5-50,5) та 39,5% (95% ДІ 34,6-44,4) для груп NALIRIFOX і наб-паклітакселу/гемцитабіну відповідно. На 18 місяців ЗВ становила 26,2% (95% ДІ 20,9-31,7) для NALIRIFOX та 19,3% (95% ДІ 14,8-24,2) для наб-паклітакселу та гемцитабіну (рисунок).
Рисунок. Оцінки Каплана-Меєра ЗВ (A) та ВБП (Б)
ВБП також продемонструвала значне покращення у групі NALIRIFOX. Медіана ВБП становила 7,4 місяця (95% ДІ 6,0-7,7) для NALIRIFOX проти 5,6 місяця (95% ДІ 5,3-5,8) для наб-паклітакселу та гемцитабіну (ВР 0,69; 95% ДІ 0,58-0,83; p<0,0001). Показники 12-місячної ВБП – 27,4% (95% ДІ 22,3-32,7) та 13,9% (95% ДІ 9,7-18,9) для груп NALIRIFOX та наб-паклітакселу/гемцитабіну відповідно. На 18 місяців ВБП становила 11,4% у групі NALIRIFOX та 3,6% у групі наб-паклітакселу та гемцитабіну.
Об’єктивна відповідь на лікування спостерігалася у 160 (42%) із 383 учасників у групі NALIRIFOX та у 140 (36%) із 387 пацієнтів у групі наб-паклітакселу та гемцитабіну (p=0,11). Медіана тривалості відповіді була довшою у групі NALIRIFOX і становила 7,3 місяця (95% ДІ 5,8-7,6) порівняно з 5,0 місяцями (95% ДІ 3,8-5,6) у групі наб-паклітакселу та гемцитабіну (ВР 0,67; 95% ДІ 0,48-0,93).
На момент припинення збору даних (23 липня 2022 р.) 44 пацієнти (12%) у групі NALIRIFOX та 7 (2%) у групі наб-паклітакселу та гемцитабіну все ще дотримувались досліджуваного режиму. Найпоширенішою причиною припинення лікування було прогресування захворювання у 184 осіб (48%) у групі NALIRIFOX та 177 пацієнтів (46%) у групі наб-паклітакселу та гемцитабіну.
Безпека та переносимість
Медіана тривалості лікування була довшою у групі NALIRIFOX і становила 24,3 тижня (міжквартильний діапазон 8,4-42,1; медіана 5,0 циклів лікування) порівняно з 17,6 тижня (міжквартильний діапазон 8,1-30,1; медіана 4,0 циклів лікування) у групі наб-паклітакселу та гемцитабіну. Зниження дози згідно з протоколом було необхідне для 60% пацієнтів, які отримували NALIRIFOX, та 54% осіб, що отримували наб-паклітаксел та гемцитабін.
Побічні явища, пов’язані з лікуванням, спостерігалися у переважної більшості пацієнтів в обох групах: у 369 (>99%) із 370 осіб, які отримували NALIRIFOX, та у 376 (99%) із 379 пацієнтів, що отримували наб-паклітаксел та гемцитабін. Найпоширенішими побічними явищами 3-4 ступеня у групі NALIRIFOX були нейтропенія, діарея та гіпокаліємія, тоді як у групі наб-паклітакселу та гемцитабіну переважали нейтропенія, анемія та периферична нейропатія. Летальні побічні явища, пов’язані з лікуванням, виникли у 2% пацієнтів в обох групах (шість пацієнтів у групі NALIRIFOX та вісім пацієнтів у групі наб-паклітакселу та гемцитабіну).
Отже, дослідження NAPOLI 3 демонструє значні переваги режиму NALIRIFOX порівняно зі стандартною терапією наб-паклітакселом та гемцитабіном у пацієнтів із мПАПЗ. NALIRIFOX показав статистично значуще покращення медіани ЗВ (11,1 проти 9,2 місяця, ВР 0,83, p=0,036) та ВБП (7,4 проти 5,6 місяця, ВР 0,69, p<0,0001). Хоча різниця у загальній частоті відповіді не досягла статистичної значущості, тривалість відповіді була довшою у групі NALIRIFOX. Також спостерігалися вищі показники довгострокової виживаності. Ці результати свідчать про потенціал NALIRIFOX як нового стандарту першої лінії терапії мПАПЗ. Важливо зазначити, що NALIRIFOX був визнаний Національною онкологічною мережею США (NCCN) і рекомендований як кращий варіант лікування категорії 1 при метастатичному захворюванні першої лінії та як один із варіантів лікування першої лінії при місцево-поширеному захворюванні.
Реферативний огляд Wainberg Z.A., Melisi D., Macarulla T. et al. (2023) NALIRIFOX versus nab-paclitaxel and gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (NAPOLI 3): a randomised, open-label, phase 3 trial. Lancet. Oct 7;402(10409):1272-1281. doi: 10.1016/S0140-6736(23)01366-1.
Підготувала Олена Речмедіна
Підготовлено на замовлення ТОВ «Серв’є Україна».
OncoST-NonP-С1-2 (2024-2026, 2 years)-29
Коментар експерта
 Сергій Володимирович Земсков, доктор медичних наук, професор, проректор з наукової роботи та інновацій Національного медичного університету імені О.О. Богомольця (м. Київ)
Сергій Володимирович Земсков, доктор медичних наук, професор, проректор з наукової роботи та інновацій Національного медичного університету імені О.О. Богомольця (м. Київ)
? Які переваги протоколу NALIRIFOX як нового стандарту лікування метастатичного раку підшлункової залози (мРПЗ) порівняно з наявними в Україні протоколами лікування?
Беручи до уваги результати дослідження NAPOLI 3, можна зазначити, що застосування нової схеми NALIRIFOX (пегильований ліпосомальний іринотекан 50 мг/м2 + 5-ФУ 2400 мг/м2 + ЛВ 400 мг/м2 + оксаліплатин 60 мг/м2) у першій лінії терапії метастатичної аденокарциноми підшлункової залози у нелікованих пацієнтів надає значущі переваги, пов'язані із збільшенням ЗВ, ВБП та профілем безпеки, порівняно з лікуванням за схемою GemNab.
? Дані дослідження NAPOLI 3 вже враховані в Міжнародних рекомендаціях (NCCN 2.2024, ESMO 2023). Чи заплановане включення нового протоколу в Національні рекомендації?
Так, робота над створенням перших в нашій країні протоколів лікування пацієнтів з раком підшлункової залози (РПЗ) триває. За основу національних протоколів ми взяли NCCN-рекомендації. В останній версії цього документа схема NALIRІFOX рекомендована як перша лінія лікування пацієнтів із місцево розповсюдженою та метастатичною формою РПЗ (ECOG 0-1). Слід зазначити, що для метастатичного РПЗ схема NALIRІFOX має найвищу категорію 1, що базується на доказах високого рівня (≥1 рандомізоване дослідження 3 фази або високоякісні, надійні метааналізи; ≥85% підтримки групи експертів). Ми включили цю схему в наші національні протоколи як важливу опцію лікування, щоб українські пацієнти мали можливість отримувати необхідну терапію зі сприятливим профілем безпеки.
? Які переваги протоколу NALIRIFOX порівняно з FOLFIRINOX?
Прямого порівняння NALIRIFOX зі схемою FOLFIRINOX немає. Це пояснюється тим, що для порівняння брали більш сучасну схему, яка має подібну ефективність, але менш токсична, тобто гемцитабін + наб-паклітаксел (GemNab), що частіше використовується в інших країнах.
Клінічно значущими перевагами NALIRIFOX є ефективність та прийнятний профіль безпеки. Щодо клінічної ефективності, то слід зазначити, що медіана ЗВ становила 11,1 місяця у групі NALIRIFOX і 9,2 місяця у групі GemNab. ЗВ протягом 12 та 18 місяців становила 45,6% та 26,2% відповідно у групі NALIRIFOX та 39,5% і 19,3% для GemNab.
Профіль безпеки схеми NALIRIFOX пов'язаний з кількома факторами. Першим є застосування нижчої (ніж у FOLFIRINOX) дози оксаліплатину (60 мг/м2), що зменшує токсичність, пов’язану з розвитком периферичної нейропатії (лише 3% пацієнтів у групі NALIRIFOX та 6% у групі GemNab). Слід зазначити, що відсоток пацієнтів із нейропатією на FOLFIRINOX в дослідженні PRODIGE (2011) був втричі вищий (9%).
Наступною важливою перевагою комбінації NALIRIFOX є використання пегильованої ліпосомальної форми іринотекану, яка дозволяє досягати терапевтичного ефекту при використанні у п'ять разів нижчої дози препарату – лише 10 мг/кг маси тіла. А завдяки пегилюванню препарат довго (понад дві доби) циркулює у крові, ліпосомальна форма сприяє тривалому впливу на клітини (168 год), призводячи до значного пригнічення їхнього росту з одночасною мінімізацією системної токсичності.
Також важливою особливістю, на мій погляд, є те, що схему GemNab рекомендації дозволяють застосовувати більш тяжким пацієнтам з ECOG 2. За результатами NAPOLI 3, профіль токсичності NALIRIFOX не перевищує GemNab, а в групу пацієнтів, що отримували NALIRIFOX, був включений один пацієнт з ECOG 2. Тож логічно постає питання про можливе застосування NALIRIFOX у пацієнтів з ECOG 2. Сподіваємося, у майбутньому ми побачимо на це дозвіл в рекомендаціях .
Тож маємо певні переваги і можемо вважати схему NALIRIFOX новим стандартом у лікуванні пацієнтів із місцево розповсюдженим та метастатичним РПЗ.
? Ваш власний клінічний досвід застосування протоколу NALIRIFOX та спостереження щодо його переваг?
Це були пацієнти з метастатичним РПЗ, дехто з них після застосування в першій лінії GemNab. Привертала увагу гарна переносимість NALIRIFOX. Враховуючи редуковану дозу оксаліплатину, ми не спостерігали типових для нього відчуттів першіння та клубка в горлі під час інфузії. Також не фіксували у довгостроковому періоді прогресуючих явищ нейропатій, навіть якщо вони вже були присутні на момент початку схеми. Інфузії ліпосомального іринотекану традиційно передувало введення атропіну з метою профілактики діареї, як і при звичайному іринотекані. Лоперамід було рекомендовано за умови діареї тричі та більше разів на добу. Ми не фіксували тяжкої діареї у наших хворих, дози протягом лікування не редукували.
Можу сказати, що у пацієнтів на NALIRIFOX відмічались у цілому кращий комплаєнс порівняно з пацієнтами на FOLFIRINOX і зіставні результати виживаності.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (91) 2024 р.