31 жовтня, 2024
Профілактика та лікування інфекційних ускладнень у дорослих пацієнтів з онкологічними та онкогематологічними захворюваннями
Стандарт медичної допомоги
Смертність від інфекційних ускладнень пацієнтів з онкологічними та онкогематологічними захворюваннями в сучасних умовах може сягати від 10-30% при інтенсивній хіміотерапії до 50% при трансплантації гемопоетичних стовбурових клітин (ТГСК). Відповідно адекватні профілактика та лікування ускладнень можуть покращити кінцевий результат лікування таких пацієнтів. Ефективна взаємодія учасників процесу вважається найкращою практикою профілактики та лікування інфекційних ускладнень, а також неодмінною умовою скоординованої допомоги.
Цей документ ґрунтується на принципах доказової медицини з урахуванням сучасних рекомендацій для надання медичної допомоги пацієнтам з онкологічними та онкогематологічними захворюваннями з приводу інфекційних ускладнень.
Загальна частина
Назва діагнозу: Злоякісні новоутворення.
Коди стану або захворювання. НК 025:2021 «Класифікатор хвороб та споріднених проблем охорони здоров’я»: Злоякісні новоутворення (С00-С96).
Розділ І. Організація надання медичної допомоги пацієнтам з онкологічними та онкогематологічними захворюваннями з приводу інфекційних ускладнень
Положення стандарту медичної допомоги. Медична допомога пацієнтам з онкологічними та онкогематологічними захворюваннями з приводу інфекційних ускладнень надається у закладах охорони здоров’я (ЗОЗ) або підрозділах ЗОЗ, що спеціалізуються з онкологічної та онкогематологічної допомоги.
Надання медичної допомоги пацієнтам з онкологічними та онкогематологічними захворюваннями з приводу інфекційних ускладнень потребує міждисциплінарної співпраці та інтегрованого ведення пацієнтів мультидисциплінарною командою фахівців, що спеціалізується на злоякісних новоутвореннях та включає лікаря-гематолога або онколога, рентгенолога, мікробіолога, інфекціоніста, анестезіолога, патологоанатома та, за потреби, інших фахівців. Лікарі загальної практики – сімейні лікарі, лікарі інших спеціальностей – мають бути обізнані щодо основних факторів ризику та початкових клінічних проявів інфекційних ускладнень в онкологічних та онкогематологічних пацієнтів для їхнього раннього виявлення та скерування пацієнтів до ЗОЗ, що надають спеціалізовану медичну допомогу, а також сприяють виконанню усіх рекомендацій фахівців онкологічного профілю з профілактики та своєчасної діагностики інфекційних ускладнень під час протипухлинного лікування, у перервах між його елементами та після його завершення.
Усі можливі варіанти профілактики та лікування потрібно обговорювати з пацієнтом так, щоб йому було зрозуміло, враховуючи його індивідуальний культурний та освітній рівень. Особливо важливим є обговорення додаткових ризиків, що виникають у разі невчасного та/або неадекватного лікування інфекційних ускладнень.
Обґрунтування. Відповідна профілактика, своєчасна діагностика і початок адекватного лікування інфекційних ускладнень у пацієнтів зі злоякісними новоутвореннями сприяють зниженню захворюваності та смертності у зв’язку з інфекціями, покращенню якості життя та підвищенню виживаності пацієнтів.
Критерії якості медичної допомоги
Обов’язкові
- Пацієнти з онкологічними та онкогематологічними захворюваннями з підозрою на інфекційні ускладнення для встановлення діагнозу та призначення лікування направляються до ЗОЗ, що надають спеціалізовану медичну допомогу.
- Існують локально узгоджені письмові документи, що координують та інтегрують медичну допомогу для забезпечення профілактики, діагностики, визначення групи ризику та лікування інфекційних ускладнень у пацієнтів з онкологічними та онкогематологічними захворюваннями.
- Існує задокументований індивідуальний план профілактики та діагностики інфекційних ускладнень, узгоджений з пацієнтом, членами родини/особами, які здійснюють догляд.
Бажані
4. Надання інформації пацієнтам, які перенесли лікування, щодо можливих віддалених побічних ефектів лікування, необхідності проведення періодичних обстежень через високу небезпеку виникнення рецидиву, а також рекомендацій щодо способу життя, режиму харчування та фізичних навантажень.
Розділ II. Визначення факторів інфекційного ризику та профілактика інфекційних ускладнень у пацієнтів з онкологічними та онкогематологічними захворюваннями
Положення стандарту медичної допомоги. Ризик розвитку інфекцій – низький, проміжний та високий – визначається за такими факторами, як базове захворювання, статус (активне захворювання чи ремісія захворювання), тривалість нейтропенії, попереднє використання хіміотерапії та інтенсивність імуносупресивної терапії.
За результатами визначення групи інфекційного ризику пацієнтам може бути призначена профілактична антибактеріальна/протигрибкова/противірусна терапія (табл. 1-3).
|
Таблиця 1. Види антимікробної профілактики, що призначаються залежно |
||
|
Загальний ризик інфекцій у пацієнтів з раком |
Види захворювань/терапії |
Антимікробна профілактика |
|
Низький |
Стандартні режими хіміотерапії для більшості солідних пухлин Очікувана нейтропенія менш ніж 7 днів |
Бактеріальна – ні Грибкова – ні Вірусна – ні, крім попередніх епізодів HSV1 |
|
Проміжний |
Аутологічна ТГСК Лімфома ХЛЛ 2 Терапія аналогами пурину (напр., флударабіном, клофарабіном, кладрибіном) Очікувана нейтропенія 710 днів |
Бактеріальна – профілактика фторхінолоном під час нейтропенії Грибкова – профілактика під час нейтропенії та очікування мукозиту; профілактика ПЦП3 Вірусна – під час нейтропенії та довше залежно від ризику |
|
Високий |
Алогенна ТГСК включно з кордовою кров’ю Гостра лейкемія: індукція консолідація/підтримувальна терапія Терапія алемтузумабом РТПГ4 помірного та тяжкого ступеня Очікувана нейтропенія понад 10 днів |
Бактеріальна профілактика фторхінолоном під час нейтропенії Грибкова профілактика під час нейтропенії; профілактика ПЦП Вірусна – під час нейтропенії та довше залежно від ризику |
|
1HSV – вірус простого герпесу. 2ХЛЛ – хронічна лімфоцитарна лейкемія. 3ПЦП – пневмоцистна пневмонія, викликана Pneumocystis jiroveci. 4РТПГ – реакція «трансплантат проти господаря». |
||
|
Таблиця 2. Профілактика грибкових інфекцій залежно від ризику виникнення інфекцій |
|||
|
Загальний ризик інфекцій у пацієнтів із раком |
Види |
Протигрибкова профілактика |
Тривалість |
|
Від проміжного до високого |
ГЛЛ |
Флуконазол 1 або ехінокандини2 Препарати амфотерицину В3 |
До розрішення нейтропенії |
|
МДС (нейтропенія) |
Посаконазол1 Вориконазол1, флуконазол, ехінокандини2 |
||
|
ГМЛ (нейтропенія) |
|||
|
Аутологічна ТГСК із мукозитом |
Флуконазол1 або ехінокандини3 |
||
|
Аутологічна ТГСК без мукозиту |
Профілактика відсутня |
Не застосовується |
|
|
Алогенна ТГСК |
Флуконазол1 або ехінокандини2 Вориконазол1, посаконазол1або амфотерицин В3 |
Продовжується на час нейтропенії |
|
|
Значна РТПГ |
Посаконазол1 (категорія 1) Вориконазол1, ехінокандини2 або амфотерицин В3 (усі категорії 2В) |
До розрішення значної РТПГ |
|
|
ГЛЛ – гостра лімфобласна лейкемія; МДС – мієлодиспластичний синдром; ГМЛ – гостра мієлоїдна лейкемія. 1 Ітраконазол, вориконазол і посаконазол є більш потужними інгібіторами печінкових ізоферментів цитохрому Р450 3A4, ніж флуконазол, і можуть значно знижувати кліренс кількох препаратів, що використовуються для лікування раку (наприклад, вінкристин). У деяких випадках, коли стандартна терапія протипоказана через лікарську взаємодію або ризик подовження інтервалу QTc, можливе використання ехінокандинів, амфотерицину В у профілактичних дозах. 2 Всі три препарати класу ехінокандинів (мікафунгін, каспофунгін і анідулафунгін) вважаються взаємозамінними. 3 Ліпідна форма амфотерицину В переважно є кращою через меншу токсичність. |
|||
|
Таблиця 3. Профілактика реактивації вірусів простого (HSV) |
||
|
Загальний ризик інфекцій у пацієнтів із раком1 |
Види захворювань/терапії |
Тривалість |
|
Низький |
Стандартні режими хіміотерапії солідних пухлин |
Профілактику не проводять до епізоду HSV; за потреби, здійснюють під час активної терапії включно з періодами нейтропенії |
|
Проміжний |
Аутологічна ТГСК Лімфома2 Множинна мієлома2 ХЛЛ 2 Терапія аналогами пурину (наприклад, флударабіном) |
Профілактику HSV3 розглядають під час активної терапії та, можливо, довше залежно від ступеня імуносупресії Профілактику VZV4 розглядають щонайменше 612 місяців після аутологічної ТГСК |
|
Високий |
Гостра лейкемія |
Профілактика HSV3 під час активної терапії включно з періодами нейтропенії |
|
|
Інгібітори протеасом |
Профілактика VZV4 під час активної терапії включно з періодами нейтропенії |
|
|
Терапія алемтузумабом Алогенна ТСГК РТПГ, що потребує значної ескалації імуносупресії |
Профілактика HSV3 – мінімум два місяці після алемтузумабу та доки стане CD4 >200 клітин/мкл Профілактика VZV4 має розглядатись щонайменше протягом року після алогенної ТГСК |
|
1Категорії ризику ґрунтуються на кількох факторах включно із основною злоякісністю, ремісією захворювання, тривалістю нейтропенії, попереднім впливом хіміотерапії та інтенсивністю імуносупресивної терапії (ІСТ). 2Це гетерогенне захворювання. Отже, методи лікування та тип злоякісної пухлини впливають на рівень ризику. 3Профілактика HSV показана серопозитивним дітям. 4Для педіатричних пацієнтів профілактика VZV зазвичай не проводиться, якщо в анамнезі немає повторних інфекцій оперізуючого лишаю або після першого оперізуючого лишаю під час мієлосупресивної терапії, навіть якщо вони є серопозитивними або вакцинованими дітьми. |
||
Вакцинація та мінімізація потенційного впливу умовно-патогенних мікроорганізмів, які можуть бути небезпечними для пацієнтів з ослабленим імунітетом внаслідок раку, є додатковими компонентами профілактики інфекційних захворювань.
Обґрунтування. Ряд злоякісних захворювань за своєю сутністю асоційовані з імунними дефектами. Пацієнти з гематологічними злоякісними захворюваннями можуть мати нейтропенію внаслідок інфільтрації кісткового мозку злоякісними клітинами або внаслідок дисфункції кісткового мозку. Ознак та симптомів інфекції може часто не бути, або вони послаблені за відсутності нейтрофілів, однак температура лишається ранньою ознакою, хоча і неспецифічною. Первинними місцями інфекції є шлунково-кишковий тракт (ШКТ), синуси, легені та шкіра. Інфікування на ранніх етапах фебрильної нейтропенії є бактеріальними, тоді як резистентні до антибактеріальних препаратів бактерії, дріжджі, інші гриби та віруси є частою причиною повторних інфекцій. Імунітет слизових порушується хіміо- та радіотерапією. Опромінення селезінки призводить до функціональної аспленії, яка обумовлює схильність пацієнта до пневмококового сепсису.
Пацієнти з онкологічними захворюваннями та нейтропенією, індукованою хіміотерапією, мають ризик тяжких бактеріальних інфекцій. Фторхінолони є профілактичними антибактеріальними препаратами, що найчастіше використовуються у дорослих із нейтропенією, індукованою хіміотерапією. Пацієнти, яким проводять алогенну ТГСК, мають високий ризик пневмококового сепсису внаслідок функціональної аспленії та порушеного В-клітинного імунітету. Пневмококовий сепсис частіше спостерігається у пізньому трансплантаційному періоді – від трьох місяців до року після ТГСК.
Інфекції HSV та VZV є поширеними у пацієнтів із ХЛЛ, які отримують алемтузумаб із моноклональним антитілом. Реактивація та інфікування HSV відбувається у 60-80% реципієнтів ТГСК та у пацієнтів (без профілактики) з гострим лейкозом на індукційній або реіндукційній терапії, які є серопозитивними щодо HSV. Серед реципієнтів алогенної ТГСК інфікування HSV, найімовірніше, виникне протягом першого місяця після трансплантації, але може виникнути і на пізніших стадіях під час інтенсивної імуносупресії. Порушення клітинного імунітету є основним фактором ризику реактивації вірусу VZV. Серед реципієнтів алогенної ТГСК з інфекцією VZV в анамнезі, у яких не проводилась противірусна профілактика, близько 30% мали реактивацію захворювання VZV.
Пацієнти з онкогематологічними захворюваннями мають вищий ризик розвитку інфекційних ускладнень, ніж пацієнти із солідними пухлинами. Грипозна інфекція спричиняє значну захворюваність та смертність у пацієнтів зі злоякісним новоутворенням. ТГСК-пацієнти можуть втрачати імунітет до патогенів після трансплантації.
Рекомендації щодо вакцинації у пацієнтів із гематологічними злоякісними захворюваннями та ТГСК-пацієнтів є більш ширшими, ніж для загальної популяції пацієнтів зі злоякісними новоутвореннями. У будь-якого пацієнта з ослабленим імунітетом живі вакцини включно із живою ослабленою вакциною проти грипу можуть сприяти захворюванню, тому їх не слід вводити під час хіміотерапії або періодів значної імуносупресії, таких як лікування РТПГ.
Ефективність і безпеку кожної вакцини слід ретельно оцінювати, щоб оптимізувати схему лікування у кожному конкретному випадку.
Критерії якості медичної допомоги
Обов’язкові
1. Пацієнтам із низьким ступенем ризику інфекцій (із солідними пухлинами, які отримують стандартні режими хіміотерапії та тривалість нейтропенії до семи днів) антимікробна профілактика рутинно не проводиться.
Для серопозитивних пацієнтів HSV, які належать до цієї категорії, проводиться профілактика протигерпетичними засобами (ацикловір, фамцикловір, валацикловір).
2. Пацієнтам із проміжним ступенем ризику (тривалість нейтропенії 7-10 днів [абсолютна кількість нейтрофілів <1000 нейтрофілів/мкл]), лімфомою, множинною мієломою (ММ), ХЛЛ, реципієнтам аутологічної TСГК або тим, хто отримує лікування схемами, що включають аналоги пуринів (найчастіше неходжкінська лімфома [НХЛ] чи ХЛЛ), профілактику проводять у період нейтропенії антибактеріальними засобами, такими як фторхінолони (перевага надається левофлоксацину).
Противірусні лікарські засоби призначають на час нейтропенії та для реципієнтів аутологічної ТГСК щонайменше протягом місяця після ТГСК; одночасно проводять антивірусну профілактику VZV протягом 6-12 місяців після ТГСК.
Протигрибкові лікарські засоби призначають на час періоду нейтропенії та при очікуваному мукозиті (належить до аутологічної ТГСК) у пацієнтів із проміжним ризиком. Пацієнтам з проміжним ризиком проводять профілактику ПЦП.
3. Пацієнтам із високим ступенем ризику інфекційних ускладнень (нейтропенія понад 10 днів, отримання інтенсивної індукційної/консолідаційної хіміотерапії гострих лейкемій [ГЛЛ або ГМЛ]), які отримують лікування алемтузумабом, реципієнтам алогенної ТГСК та тим, хто має РТПГ після алогенної ТГСК, НХЛ (особливо при Т-клітинних підтипах), під час нейтропенії проводять профілактику антибактеріальними лікарськими засобами (наприклад, фторхінолонами), протигрибковими лікарськими засобами (пацієнтам із ГЛЛ та ГМЛ/МДС) та антивірусну профілактику (включно із VZV) протягом року після ТГСК.
4. Пацієнтам зі злоякісним новоутворенням із проміжним або високим ризиком антимікробну профілактику проводять фторхінолонами (перевага надається левофлоксацину). У пацієнтів, які не переносять фторхінолони, може бути розглянутий триметоприм/сульфаметоксазол (TMП/СМК) чи пероральний цефалоспорин третього покоління. За умови резистентності до пеніцилінів або їхньої індивідуальної непереносимості використовується TMП/СМК.
5. Протигрибкова профілактика не проводиться рутинно усім пацієнтам із нейтропенією та реципієнтам аутологічної ТГСК без проявів мукозиту.
6. Пацієнтам із хронічною тяжкою нейтропенією проводять профілактику протигрибковими лікарськими засобами (перевагу надають посаконазолу або вориконазолу).
7. Превентивні заходи проти інфікування та реактивації HSV, VZV, цитомегаловірусу (CMV), вірусами гепатиту В (HBV), вірусами гепатиту С (HCV) та вірусу імунодефіциту людини (ВІЛ) (табл. 3).
8. Пацієнтам із серопозитивним HSV результатом перед алогенною ТГСК та пацієнтам, які продовжують отримувати системну ІСТ, противірусну профілактику проводять протягом року після трансплантації вищими дозами протигерпетичних препаратів.
9. Пацієнтам, які отримують інтенсивну ІСТ включно з ТГСК та донорам перед лікуванням проводять скринінг на HBV, HCV та ВІЛ. На початковому етапі проводиться оцінка HBsAg, HBcAb і HBsAb.
10. Пацієнтам, які раніше не були хворі на HBV (тобто негативних на HBsAg, HBsAb і HBcAb), проводять вакцинацію проти HBV (табл. 4).
|
Таблиця 4. Рекомендації щодо графіка вакцинації після аутологічної та алогенної ТГСК |
||
|
Інактивовані, субодиночні або токсоїдні вакцини |
Рекомендований час після ТГСК |
Кількість доз |
|
Дифтерія/правець/кашлюк |
612 місяців |
3 |
|
Haemophilus influenzae тип В |
612 місяців |
3 |
|
Пневмококова вакцинація: 3 дози з проміжком 48 тижнів |
612 місяців |
3 |
|
Гепатит А |
612 місяців |
2 |
|
Гепатит В |
612 місяців |
3 |
|
Менінгококова кон’югована вакцина |
612 місяців |
12 |
|
Грип (ін’єкційна) |
46 місяців |
1, щороку |
|
Інактивована поліомієлітна вакцина |
612 місяців |
3 |
|
Вакцина проти папіломавірусу людини (HPV) |
>612 місяців Для пацієнтів до 26річного віку, розглядається до 45 років |
3 |
|
Живі вакцини |
Рекомендований час після ТГСК |
Кількість доз |
|
Кір/свинка/краснуха |
>24 місяців |
12 |
|
Вакцина проти вітряної віспи |
>24 місяців, якщо немає РТПГ або продовження імуносупресії та пацієнт був серонегативним на вітряну віспу до трансплантації |
2 |
11. Усім реципієнтам алогенної ТГСК спостереження проводять протягом 6-12 місяців після трансплантації або під час РТПГ.
12. У пацієнтів із позитивним тестом на HBsAg та/або HBcAb для з’ясування вірусного навантаження проводять визначення базового кількісного дослідження ПЛР на ДНК HBV. Під час протипухлинної терапії вірусне навантаження HBV контролюється за допомогою ПЛР щомісяця, а потім кожні три місяці після завершення лікування. Якщо вірусне навантаження залишається невизначеним, профілактика противірусними препаратами продовжується до 12 місяців після завершення протипухлинної терапії.
13. Моніторинг рівня АЛТ і вірусного навантаження HCV проводять щомісяця або за клінічними показаннями як частину спостереження.
14. Пацієнтам, яким проводять алогенну ТГСК, слід уникати трансплантатів від HBsAg-позитивних або ДНК-позитивних до HBV донорів, за можливості. Донорам, які не контактували з HBV, перед збором гемопоетичних клітин пропонується вакцинація проти HBV.
15. У HBsAg-позитивних чи HBcAb-позитивних пацієнтів проводять визначення початкової кількісної ПЛР ДНК HBV. У кандидатів на алогенну ТГСК з ознаками активної HBV-інфекції (хронічний гепатит, за даними біопсії, або позитивний HBsAg, або високий рівень ДНК HBV) трансплантацію, за можливості, відкладають на час проведення противірусної терапії протягом 3-6 місяців до стабілізації стану.
16. Кандидатам на ТГСК, які є HBsAg-позитивними або HBcAb-позитивними, але без ознак активного процесу HBV, проводять противірусну профілактику (незадовго до процедури трансплантації).
17. У реципієнтів алогенної ТГСК із РТПГ або з частими реактиваціями HSV перед трансплантацією період профілактики довший (початковими препаратами вибору є ацикловір, фамцикловір або валацикловір).
18. Пацієнтам після реактивації HSV проводять профілактику HSV протягом усіх майбутніх епізодів нейтропенії, викликаної цитотоксичною терапією.
19. Для ВІЛ-позитивних пацієнтів зі злоякісним новоутвореннями проводять консультацію лікаря-інфекціоніста щодо призначення антиретровірусної терапії. Вірусне навантаження ВІЛ-інфекції контролюють щомісяця під час терапії та потім за клінічними показаннями.
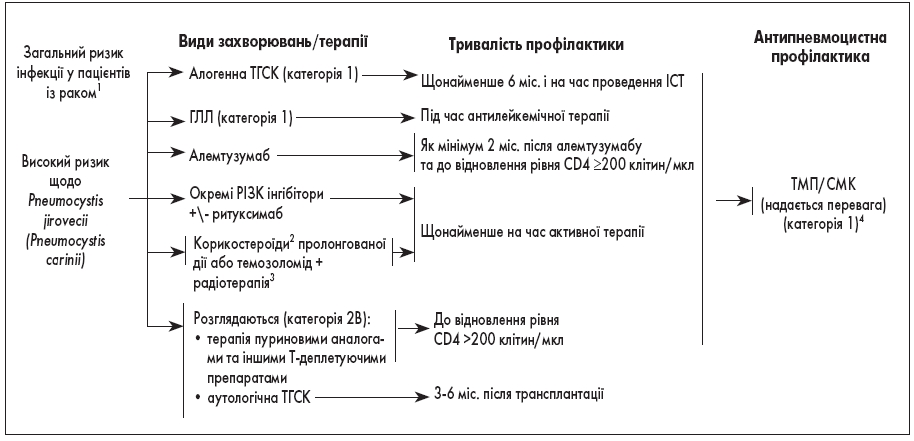
20. Профілактику ПЦП проводять відповідно до алгоритму (рис. 1).
Рис. 1. Алгоритм попередження інфікування Pneumocystis jirovecii (Рneumocystis carinii)
1Категорії ризику ґрунтуються на кількох факторах включно з основним злоякісним новоутворенням, станом ремісії захворювання, тривалістю нейтропенії, попередніім впливом хіміотерапії та інтенсивністю ІСТ.
2Ризик пневмонії, спричиненої ПЦП, пов’язаний із добовою дозою та тривалістю терапії глюкокортикостероїдами.
3Профілактику ПЦП слід продовжувати до одужання від лімфоцитопенії. TМП/СМК при належному дозуванні може проявляти активність проти інших патогенів включно із Nocardia, Toxoplasma та Listeria.
4Розгляньте можливість десенсибілізації TМП/СМК, якщо потрібна профілактика ПЦП у пацієнтів із непереносимістю TМП/СМК.
21. Реципієнтам алогенної ТГСК та пацієнтам із функціональною аспленією (опромінення селезінки) профілактику пневмококової інфекції починають антибактеріальним препаратом пеніцилінового ряду на третьому місяці після ТГСК та продовжують щонайменше до року після трансплантації. Профілактику проводять незалежно від попереднього застосування пневмококової вакцини. У пацієнтів із хронічною РТПГ профілактика триває до припинення ІСТ. У пацієнтів із високим ризиком пневмококової інфекції (наприклад, реципієнти алогенної ТГСК із РТПГ) застосовується комплексна профілактика пеніциліном та комбінованим лікарським засобом TMП/СМК.
22. Вакцинацію пацієнтів з онкологічними та онкогематологічними захворюваннями проводять відповідно до графіка (див. табл. 4).
23. Скринінг стану гуморального імунітету перед ініціацією лікування розглядають за наявності високого ризику розвитку гіпогамаглобулінемії (ГГГ) (під час діагностики ХЛЛ) та після консультації клінічного імунолога.
24. Профілактичну замісну терапію імуноглобуліном (IgG-ЗТ) здійснюють за відсутності інфекцій при рівні IgG меншому за 4 г/л.
25. Пацієнтам, які отримують імунну або таргетну терапію, призначають антимікробну профілактику.
Розділ ІІІ. Ведення пацієнтів із фебрильною нейтропенією (ФН)
Положення стандарту медичної допомоги. Фебрильна температура визначається як одноразове підвищення температури в порожнині рота вище 38,3 °С або температури тіла вище 38,0 °С протягом години за відсутності очевидної, неінфекційної причини. Нейтропенію визначають як абсолютну кількість нейтрофілів (АКН) ≤500 нейтрофілів/мкл або АКН ≤1000 нейтрофілів/мкл із прогнозованим зниженням до 500 нейтрофілів/мкл чи нижче протягом наступних 48 годин. Ініціальна оцінка ФН має фокусуватись на визначенні потенційних місць і мікроорганізмів, що спричинили інфекцію, лабораторній/радіологічній оцінці (що включає гемограму, визначення функції печінки та нирок, сатурацію крові, аналіз сечі, рентгенографію органів грудної порожнини) та на визначенні ризику пацієнта щодо розвитку пов’язаних з інфекцією ускладнень.
Обґрунтування. ФН була визначена як основний фактор ризику для розвитку інфекцій у пацієнтів, що отримують хіміотерапію.
Основою ведення інфекції у пацієнтів із ФН є застосування емпіричної антибіотикотерапії широкого спектра дії при перших ознаках інфекції (тобто лихоманці) для зниження смертності у зв’язку із пізнім початком лікування. Порожнина рота, стравохід та пазухи носа є поширеними місцями інфекції у пацієнтів із ФН. Пацієнти з тяжкою і тривалою нейтропенією (тобто понад 10 днів) і реципієнти алогенної ТГСК із РТПГ є особливо сприйнятливими до інвазивних грибкових інфекцій. Мукозит обумовлений цитостатичною терапією, що викликає схильність слизової рота та травного тракту до порушень, порушення природних механізмів захисту в носових проходах та підвищення колонізації.
Критерії якості медичної допомоги
Обов’язкові
1. Здійснюється початкова оцінка стану пацієнта із ФН (див. рис. 2), що передбачає збір анамнезу, ретельний огляд ймовірних місць інфекції (ШКТ, шкіра, легені, синуси, вуха, перивагінальна/периректальна зони, урологічне, неврологічне та місце входу центрального венозного катетера [ЦВК]), визначення потенційних збудників інфекції і ризику розвитку інфекційних ускладнень.
Рис. 2. Початкова оцінка стану пацієнта із ФН
2. Початкова оцінка ризику інфікування пацієнта із ФН (див. панель). За результатами оцінки призначають початкове емпіричне лікування.
3. Зразки для мікробіологічного посіву потрібно зібрати під час обстеження пацієнта. Необхідно провести посів двох зразків крові. Для отримання гемокультури є три варіанти: один набір можна взяти із периферичної крові, а другий набрати із ЦВК (бажано); обидва набори можна набрати із периферичної крові або із венозного катетера.
4. Біопсію із мікробіологічною та гістологічною оцінкою потрібно розглядати за появи нових або не діагностованих раніше ураженнях шкіри. Культивування вірусів із везикулярних або виразкових уражень шкіри чи слизових оболонок можуть ідентифікувати інфекції HSV.
5. У пацієнтів із симптомами респіраторної вірусної інфекції вірусні культури та швидкі тести на вірусні антигени з назофарингеальних виділень можуть бути корисними під час локальних спалахів таких інфекцій. За відсутності уражень або клінічних ознак і симптомів рутинне взяття посівів із передніх відділів носа, ротоглотки, сечі, калу та прямої кишки не проводять.
6. Пацієнтам із діареєю рекомендують скринінг на визначення ентеральних патогенів включно з ротавірусом та норовірусом у зимові місяці та під час спалахів у місцевості. Симптоми інфекції сечовивідного тракту слід оцінювати за допомогою проведення аналізу сечі та її посівом. Також потрібно провести посіви з місць запалення судинного доступу або дренажу.
7. У пацієнтів із нейтропенією, що мають ризик інвазивних грибкових інфекцій, але у яких не була раніше виявлена така інфекція після клінічного обстеження та збору культур при тривалій ФН, що не відповідає на антибактеріальні препарати широкого спектра дії, розпочинають емпіричну протигрибкову терапію.
Панель
ШКАЛА ОЦІНКИ РИЗИКУ інфікування пацієнта із ФН
Використання шкали індексу ризику MASCC1
- З допомогою візуальної шкали оцінюють ураження пацієнта хворобою на час первинного клінічного огляду. Відсутні або слабкі ознаки чи симптоми – 5 балів, помірні – 3 бали. Вони є взаємовиключними. Жодні бали не нараховуються за серйозні ознаки чи симптоми або у помираючих.
- З огляду на вік пацієнта, медичний анамнез, наявні клінічні симптоми та місце лікування (госпіталізація/амбулаторно при підвищенні температури) підрахуйте та підсумуйте інші фактори моделі.
- Шкала оцінки ризику MASCC є прийнятною лише для дорослих. Вона не застосовується для педіатричних пацієнтів.
Оцініть ураження хворобою з урахуванням усіх супутніх захворювань
|
Показник індексу ризику MASCC/модель |
|
|
Характеристика |
бали |
|
Тягар хвороби: відсутність симптомів або слабкі симптоми помірні симптоми Відсутність гіпотонії Немає ХОЗЛ Солідна пухлина або гематологічна злоякісна пухлина без попередньої грибкової інфекції Відсутність зневоднення Амбулаторний статус Вік <60 років |
5 3 5 4 4
3 3 2 |
|
Модель шкали CISNE |
|
|
Характерні точки |
бали |
|
ECOG PS ≥2 Гіперглікемія, викликана стресом ХОЗЛ Хронічні серцевосудинні захворювання Мукозит NCI ступеня ≥2 Моноцити <200/мкл |
2 2 1 1
1 1 |
1MASCC – Мультинаціональна асоціація з терапії супроводу при раку.
Розділ ІV. Лікування локальних інфекцій
Положення стандарту медичної допомоги. У пацієнтів із нейтропенією або імуноскомпрометованим з інших причин (наприклад, реципієнти ТГСК) необхідно виявляти специфічні для локалізації інфекції порожнини рота та стравоходу, пазух носа, печінки, черевної порожнини, прямої кишки, місць доступу до судин, легенів, шкіри/м’яких тканин, сечовивідних шляхів та центральної нервової системи (ЦНС) з метою проведення своєчасної оцінки за допомогою лабораторних та інструментальних методів і призначення терапії.
Обґрунтування. Пацієнти з порушенням клітинного імунітету мають підвищений ризик загальних бактеріальних та опортуністичних інфекцій включно із грибами (наприклад, Aspergillus та інші нитчасті гриби, Cryptococcus neoformans, диморфні гриби), Legionella, Pneumocystis jirovecii, M. tuberculosis, нетуберкульозними мікобактеріями, штамами Nocardia та вірусними патогенами.
Емпірична антибіотикотерапія має враховувати ендогенну анаеробну флору та зміни у флорі порожнини рота внаслідок серйозних захворювань або застосування антибактеріальних препаратів. Попередня хронічна інфекція також може активізуватися на тлі нейтропенії. Для пацієнтів із довготривалою нейтропенією або пацієнтів, які отримують супутню терапію високими дозами кортикостероїдів, важливою небезпекою стають інвазивні грибкові інфекції.
Легеневі інфільтрати становлять складну діагностичну проблему у пацієнтів з онкологічними захворюваннями. Неінфекційні причини пульмональних інфільтратів включають застійну серцеву недостатність, набряк легень, крововилив, інфаркт, медикаментозний пульмоніт, променеве ураження, наявність пухлини, облітеруючий бронхіоліт та гострий респіраторний дистрес-синдром. Поширені процеси можуть мати нетипові рентгенологічні прояви, а два чи більше легеневих процесів можуть існувати одночасно. Ретельний анамнез має включати час появи респіраторних симптомів, контакти з хворими (наприклад, респіраторні вірусні інфекції, туберкульоз), нещодавню госпіталізацію, подорожі, контакт із тваринами та контакт з водою із системи розподілу (Legionella). Спалахи епізодів інфекцій, викликаних специфічними патогенами (наприклад, грип, кашлюк), слід враховувати при диференціальній діагностиці та виборі початкової терапії. Діагностична оцінка та початкова терапія негоспітальної пневмонії мають враховувати фактори організму та попереднє використання антибактеріальних препаратів. У лікуванні дорослих із госпітальною пневмонією важливим фактором ризику для специфічних патогенів, що можуть бути стійкими до антибактеріальних препаратів, є час початку захворювання. Ранній початок госпітальної пневмонії (виникає протягом перших чотирьох днів після госпіталізації), ймовірно, спричинений чутливими до антибактеріальних препаратів бактеріями та зазвичай має кращий прогноз. Однак пацієнти із злоякісними новоутвореннями можуть мати ризик інфікування антибіотикорезистентними бактеріями під час попередньої госпіталізації, попереднього прийому антибактеріальних препаратів та порушеного імунітету незалежно від того, коли почалась пневмонія під час цієї госпіталізації.
Більшість інфекцій у черевній порожнині, прямій кишці або печінці виявляють за допомогою клінічних ознак та симптомів (наприклад, біль у животі, периректальний/перианальний біль, діарея) та відхилень від нормальних значень біохімічних показників (наприклад, відхилення показників функції печінки). Удосконалені методи візуалізації зменшили потребу в хірургічному втручанні. Антимікробна терапія інфекцій ШКТ має враховувати високу ймовірність полімікробних збудників і наявність ендогенної анаеробної флори ШКТ. ШКТ і ЦВК є основними воротами системного кандидозу.
Коліт, викликаний Clostridium difficile, зазвичай є ускладненням антибіотикотерапії та госпіталізації, а також ускладненням нейтропенії. У разі діареї необхідно виконати щонайменше два аналізи калу на токсин Clostridium difficile. Додатково, залежно від клінічної ситуації, можна розглянути шлунково-кишкову мультиплексну панель для ідентифікації інших патогенів включно з аденовірусами, ротавірусом та норовірусом. Нейтропенічний ентероколіт є серйозним, потенційно небезпечним для життя захворюванням, яке характеризується підвищеною температурою, діареєю і болем у животі. Це ускладнення часто асоціюється з гострою лейкемією, нейтропенією та інтенсивною цитотоксичною терапією.
Ураження шкіри можуть бути проявами системної інфекції. Гангренозна ектіма є найбільш характерним ураженням шкіри, пов’язаним із системною інфекцією P. Aeruginosa, S. aureus, інфекцією, викликаною кишковими грамнегативними паличками та нитчастими грибами. Швидко прогресуюча інфекція м’яких тканин із газоутворенням свідчить про клостридіальний міонекроз (або полімікробний некротичний фасцит).
Інфекції, пов’язані з ЦВК, є наслідком широко розповсюдженого використання ЦВК у пацієнтів, які проходять інтенсивну або безперевну хіміотерапію. Ризик інфікування залежить від використовуваного судинного доступу (довгострокові імплантовані катетери та короткочасні центральні катетери), тривалості використання катетера та ступеня імуносупресії пацієнта. Інфекції ЦВК поділяють на запалення входу або його розташування, тунельні інфекції, інфекції кишені порту або септичний флебіт.
У пацієнтів з онкозахворюванням ЦНС-інфекції можуть поділятись на хірургічні та нехірургічні. До неінфекційних причин менінгіту належать прийом нестероїдних протизапальних препаратів, TMП/СМК, карциноматозний менінгіт та сироваткова хвороба.
Емпірична антибіотикотерапія має враховувати ендогенну анаеробну флору та зміни у флорі порожнини рота, що можуть трапитись під час серйозних захворювань або застосування антибактеріальних препаратів.
Критерії якості медичної допомоги
Обов’язкові
- Специфічна оцінка ступеня ризику локальних інфекцій та їхнє подальше лікування.
- У разі наявності клінічних ознак або у період епідемії респіраторних інфекцій для їхньої діагностики рекомендовано проводити змив із носоглотки та за допомогою мазка з горла або носоглотки – швидкий тест.
- Пацієнтам, що мають виразки слизової оболонки порожнини рота, проводять посів для визначення патогенного мікроорганізму та призначають додаткову противірусну або системну протигрибкову терапію відповідно до результатів.
- У пацієнтів із високим ризиком грибкових інфекцій проводять ендоскопію пазух носа з біопсією та посівом.
- При підозрі на інфекцію у черевній порожнині, прямій кишці або печінці необхідно ретельно зібрати анамнез, провести біохімічні аналізи крові (із визначенням показників функції печінки), УЗД, КТ, МРТ, радіонуклідні та ендоскопічні дослідження.
- Для оцінки потенційних інфекцій шкіри/м’яких тканин перевіряються усі ділянки включно із промежиною.
- Пацієнтам із нейтропенією протягом менш ніж сім днів та підозрою на легеневу інфекцію проводять посів крові, рентгенограму грудної клітки та, за можливості, зразок мокротиння для фарбування за Грамом і посіву.
- Пацієнтам із нейтропенією та іншим особам із імунодефіцитом та симптомами, що вказують на езофагіт, призначають флуконазол та/або ацикловір (5 мг в/в кожні 8 годин у пацієнтів із нормальною функцією нирок).
- У пацієнтів, які не мають нейтропенії, отримують ІСТ або потребують госпіталізації (на основі оцінки валідованого індексу тяжкості пневмонії), терапія включає фторхінолон (левофлоксацин 750 мг/день, моксифлоксацин) або бета-лактамний антибактеріальний препарат (наприклад, високі дози амоксициліну або амоксицилін/клавуланат) плюс макролід (наприклад, азитроміцин).
- Під час спалахів сезонного грипу пацієнтам протягом 48 годин після появи симптомів, що вказують на грип (висока температура, нежить, міалгія, сухий кашель), призначають емпіричну противірусну терапію інгібіторами нейрамінідази (озельтамівір або занамівір).
- У пацієнтів із підозрою на пневмонію перед початком лікування або під час зміни антибактеріальних препаратів проводять посів мокротиння та крові.
- Для діагностики грибкової пневмонії проводять аналіз на галактоманнан (специфічним для інвазивного аспергільозу) та аналіз на бета-глюкан (виявляє аспергільоз та інші інвазивні грибкові інфекції включно з інвазивним кандидозом, Pneumocystis jirovecii та фузаріозом, але зігомікоз дає негативні результати тестів на галактоманнан і бета-глюкан у сироватці крові).
- Якщо клінічний перебіг не свідчить про гострий бактеріальний процес, інфекція не відповідає на початкову антибіотикотерапію та/або неінвазивне тестування дало негативні результати, можуть знадобитися інвазивні діагностичні процедури.
- Пацієнтам із госпітальною пневмонією з пізнім початком або факторами ризику мультирезистентних збудників, незалежно від того, коли пневмонія розвинулась у зв’язку з госпіталізацією, проводять лікування антибактеріальними препаратами широкого спектра дії. Початковою схемою є антипсевдомонадний бета-лактамний антибактеріальний препарат (наприклад, цефтазидим, цефепім, іміпенем/циластатин, меропенем, піперацилін/тазобактам) плюс антипсевдомонадний фторхінолон (наприклад, ципрофлоксацин або левофлоксацин) чи аміноглікозид, плюс або лінезолід, або ванкоміцин. Схему застосування антибактеріальних препаратів слід переглянути відповідно до результатів посіву.
- У пацієнтів із тяжким респіраторним захворюванням (наприклад, утруднене дихання, що потребує кисневої підтримки) емпірична терапія має розпочинатись до проведення бронхоальвеолярного лаважу (БАЛ). В очікуванні результатів БАЛ початкова схема може включати фторхінолон проти позалікарняних патогенів і TMП/СМК проти можливого ПЦП. У пацієнтів із ПЦП, асоційованою із СНІДом, рекомендовано застосування кортикостероїдної терапії. Зокрема, при підозрі на ПЦП та наявності гіпоксемії зі значенням сатурації кисню ≤75 мм рт. ст. слід розглянути додавання кортикостероїдів до основної терапії. Початкова доза преднізолону становить 40 мг двічі на добу з подальшим поступовим зниженням дози відповідно до клінічного протоколу. Така стратегія спрямована на зменшення запальної реакції та покращення оксигенації у пацієнтів із тяжким перебігом ПЦП.
- У пацієнтів із підозрою на пневмонію слід регулярно проводити посів мокротиння та крові перед початком або при зміні антибіотикотерапії. Якщо клінічне покращення настає протягом 48-72 годин після початку терапії, додаткові діагностичні заходи не потрібні; антибіотикотерапію слід продовжувати до завершення нейтропенії та протягом щонайменше 7-14 днів після цього.
- У пацієнтів із нейтропенією схема лікування має включати антибактеріальні препарати з антипсевдомонадною дією. Антимікробна терапія інфекцій ШКТ має враховувати високу вірогідність полімікробних збудників і наявність ендогенної анаеробної флори ШКТ – рекомендована монотерапія карбапенемами (іміпенем/циластатин, меропенем або ертапенем), піперацилін/тазобактам або поєднання цефтриаксону з метронідазолом.
- Для лікування підозри на псевдомембранозний коліт призначається ванкоміцин або перорально метронідазол. В/в метронідазол може використовуватись у пацієнтів, які не можуть лікуватись пероральними препаратами.
- Пацієнтам із інфекціями кровообігу, пов’язаними із ЦВК, викликаними грибами або нетуберкульозними мікобактеріями, та клінічно нестабільним необхідно негайно видалити інфікований катетер.
- При підозрі на інфекцію ЦНС проводять консультацію лікаря-невропатолога, КТ голови (для виключення внутрішньочерепного крововиливу) та/або МРТ, а також люмбальну пункцію (за умови відсутності протипоказань).
Дослідження спинномозкової рідини включає підрахунок клітин із диференціальними показниками, рівнем глюкози та білка, фарбування за Грамом виявленої бактеріальної культури, криптококового антигена та посів спинномозкової рідини на гриби.
21. За умови підозри на менінгіт емпірична терапія включає антипсевдомонадний бета-лактамний антибактеріальний препарат (наприклад, цефепім, цефтазидим, меропенем), плюс ванкоміцин, плюс ампіцилін (для перекриття лістеріозу).
22. У пацієнтів із ризиками щодо P. aeruginosa менінгіту (наприклад, нейтропенія, нейрохірургічне втручання протягом останніх двох місяців, алогенна ТГСК, інфекція P. aeruginosa в анамнезі) використовується цефепім (2 г кожні 8 годин у дорослих з нормальною функцією нирок) або меропенем (2 г кожні 8 годин у дорослих з нормальною функцією нирок). Схему антибактеріальної терапії слід підбирати на основі результатів бактеріального посіву.
23. Пацієнтам без імунодефіциту з бактеріальним абсцесом головного мозку проводять початкову терапію цефтриаксоном (2 г кожні 8 годин у дорослих) плюс метронідазол (7,5 мг/кг кожні 6-8 годин у дорослих з нормальною функцією нирок).
24. У пацієнтів із тривалою нейтропенією, які не отримують кортикостероїди або препарати, що виснажують лімфоцити, початкова схема складається з комбінації цефепіму, метронідазолу та вориконазолу (в/в 6 мг/кг кожні 12 годин двома дозами, а потім 4 мг/кг кожні 12 годин).
25. У реципієнтів алогенної ТГСК та інших пацієнтів з ураженням Т-клітин додавання високих доз TMП/СМК (компонент триметоприму 5 мг/кг кожні 8 годин) має розглядатись для перекриття токсоплазмозу і нокардіозу до встановлення остаточного діагнозу.
Бажані
26. В усіх випадках підозри або підтвердженої інфекції проводять консультацію лікаря-інфекціоніста.
Розділ V. Лікування інвазивних грибкових інфекцій
Положення стандарту медичної допомоги. Протигрибкову профілактику не слід проводити рутинно усім пацієнтам із нейтропенією. Обґрунтуванням протигрибкової профілактики є попередження грибкових інфекцій у групі пацієнтів високого ризику, особливо тих, хто має довготривалу нейтропенію або РТПГ після алогенної ТГСК. Вибір протигрибкового препарату визначається захворюванням або терапією.
Обґрунтування. Штами Candida є четвертою найпоширенішою причиною нозокоміальних інфекцій кровообігу. Candida albicans є найпоширенішим серед штамів Candida, виділеним із крові. Штам non-albicans Candida становить приблизно 50% усіх ізолятів із кровообігу. Штами Fusarium і Scedosporium є важливими причинами смертності, пов’язаної з інвазивною грибковою інфекцією, при лейкемії та у реципієнтів алогенної ТГСК.
Загальна смертність від кандидемії коливається від 20% до 40%. На цю варіабельність смертності впливає наявність серйозних супутніх захворювань (таких як злоякісне захворювання і нейтропенія), популяція пацієнтів (доросла проти педіатричної), а також хвороби, що потребують тривалого перебування у відділенні інтенсивної терапії. Частота та різноманіття інвазивних кандидозів зросли.
Критерії якості медичної допомоги
Обов’язкові
- Пацієнтам із нейтропенією протягом 10-14 днів і постійною або рецидивуючою появою температури невідомого походження, яка не відповідає на емпіричні антибактеріальні препарати, проводять КТ грудної клітки. Пацієнтам із кількома попередніми циклами інтенсивної цитотоксичної хіміотерапії та тим, хто отримує системну терапію кортикостероїдами, КТ необхідно провести раніше.
- До діагностики інвазивної грибкової інфекції додаються лабораторні тести з галактоманнаном і бета-глюканом.
- Лікування кандидемії проводять ехінокандинами (початкова терапія). Перехід з ехінокандинів на флуконазол проводять пацієнтам, у яких штами, ймовірно, чутливі до флуконазолу (наприклад, Candida albicans), що є клінічно стабільними та які нещодавно не приймали азоли.
- При інвазивному фузаріозі терапія включає вориконазол, посаконазол або амфотерицин В. При виявленні штаму Scedosporium (стійкі до амфотерицину B) терапія включає ітраконазол, вориконазол або посаконазол.
- При інвазивному аспергільозі у якості первинної терапії застосовують монотерапію вориконазолом.
- При мукормікозі як підтримувальну терапію призначають посаконазол, після отримання контролю над інфекцією за допомогою амофтерицину В та/або хірургічної санації.
- При фузаріозі призначають вориконазол, посаконазол або ліпідні форми амфотерицину В. Штами Scedosporium резистентні до амфотерицину В; терапія загалом включає ітраконазол, вориконазол або посаконазол.
Бажані
8, В усіх випадках інвазивної грибкової інфекції необхідна консультація лікаря-інфекціоніста, особливо щодо рідкісних та резистентних видів грибів.
Індикатори якості медичної допомоги
Наявність у ЗОЗ клінічного маршруту пацієнта (КМП) з онкологічними та онкогематологічними захворюваннями з інфекційними ускладненнями.
Індикатор характеризує організаційний аспект запровадження сучасних медико-технологічних документів у регіоні. Якість надання медичної допомоги пацієнтам, відповідність надання медичної допомоги вимогам КМП, відповідність КМП чинним стандартам медичної допомоги цей індикатор висвітлювати не може, але для аналізу цих аспектів необхідне обов’язкове запровадження КМП у ЗОЗ.
ЗОЗ, що надають спеціалізовану медичну допомогу пацієнтам з онкологічними та онкогематологічними захворюваннями, розташовані на території обслуговування, надають дані до структурних підрозділів з питань охорони здоров’я місцевих державних адміністрацій.
Затверджено наказом Міністерства охорони здоров’я України 17 червня 2024 р. № 1054
Дата оновлення стандартів – 2029 р.
Публікується скорочено. Текст адаптовано та уніфіковано відповідно до стандартів Тематичного випуску Медичної газети «Здоров’я України».
Повний текст за посиланням: https://www.dec.gov.ua/wp-content/uploads/2024/06/smd_1054_17062024.pdf
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (91) 2024 р.