31 жовтня, 2024
Комплексне управління здоров’ям кісток при раку грудної залози: від профілактики до лікування
У пацієнток з ранніми стадіями раку грудної залози (РГЗ) та позитивною експресією гормональних рецепторів (HR+) ад’ювантна ендокринна терапія, яка проводиться протягом 5-10 років після встановлення діагнозу, демонструє значне зниження ризику рецидиву та смертності. Однак ця терапевтична перевага супроводжується низкою коротко- та довгострокових побічних ефектів, які можуть суттєво впливати на якість життя (ЯЖ) пацієнток та їхню прихильність до лікування.
Тривале пригнічення естрогенів, асоційоване з ад’ювантною ендокринною терапією в жінок у пре- і постменопаузі, може призводити до виникнення симптомів генітоуринарного менопаузального синдрому (ГУМС), що значно впливають на повсякденне життя включно із сексуальною дисфункцією. Крім того, особливої уваги потребує загроза зниження мінеральної щільності кісткової тканини та підвищеного ризику переломів, яка потребує своєчасної профілактики та лікування за наявності відповідних показань. Для молодих жінок з діагнозом HR+ РГЗ, які ще не реалізували свої репродуктивні плани, виникають специфічні проблеми, пов’язані з фертильністю та можливістю вагітності. Тому належний менеджмент щодо вирішення цих питань є критично важливим компонентом комплексного лікування та має здійснюватися з моменту встановлення діагнозу і впродовж усього континууму терапії РГЗ.
HR+ РГЗ є найпоширенішим підтипом цього захворювання, і ендокринна терапія становить основу його лікування. На ранніх стадіях РГЗ застосування тамоксифену або інгібітору ароматази (ІА), а також пригнічення функції яєчників (замісної гормональної терапії – ЗГТ) у жінок у пременопаузі асоціюється зі значним зниженням ризику рецидиву та смертності [1-3]. Однак ця терапевтична користь супроводжується потенційно несприятливими коротко- та довгостроковими побічними ефектами, які негативно впливають на ЯЖ пацієнток і знижують прихильність до лікування [4].
Гостра токсичність (нео)ад’ювантної хіміотерапії часто має оборотний характер і зазвичай обмежується періодом лікування. На противагу цьому ад’ювантна ендокринна терапія призначається на термін до десяти років, коли побічні ефекти можуть бути постійними і, за відсутності належного лікування, незворотними [5]. Хоча очікувані переваги ендокринної терапії у зменшенні рецидивів захворювання добре відомі, її небажані побічні ефекти часто недооцінюються і не завжди піддаються оптимальному лікуванню [6].
У сучасній онкологічній практиці лікування фізичних і психологічних наслідків раку та його терапії вважається критично важливим компонентом догляду за пацієнтами, які вижили [7]. Нехтування цими проблемами може негативно вплинути на прихильність до лікування. Проактивний підхід до лікування симптомів та пов’язаного з ними тягаря ендокринної терапії потребує складного балансу між переносимістю, прихильністю до лікування та ЯЖ [4].
ГУМС у контексті РГЗ
Антиестрогенна терапія хоча і ефективно знижує ризик РГЗ у профілактичних і ад’ювантних випадках, може викликати симптоми менопаузи, що суттєво впливають на ЯЖ пацієнток. Тривале пригнічення рівня естрогенів нижче від нормального постменопаузального діапазону та модифікація рецепторів естрогенів можуть призвести до таких симптомів, як припливи, сухість піхви та болісність під час статевого акту. Ігнорування порушень сексуального здоров’я та загального благополуччя негативно впливає на прихильність до лікування і може звести нанівець зусилля, спрямовані на покращення результатів лікування онкологічних захворювань [4].
Вазомоторні симптоми
Поява припливів є однією з ключових ознак пригнічення естрогенів, спричиненого порушенням гормонального фону в організмі. Вазомоторні симптоми спостерігаються у понад 80% жінок, які отримують антиестрогенну терапію, і переважно більш виражені у молодих пацієнток [4]. Припливи виникають у 80% жінок, що приймають тамоксифен, і у 93% при додаванні ЗГТ. Ці симптоми можуть суттєво погіршувати ЯЖ пацієнток [4].
Окрім поведінкових модифікацій, таких як фізичні вправи, уникнення тригерів та багатошаровий одяг, рандомізовані дослідження продемонстрували ефективність когнітивно-поведінкової терапії [8]. Дані щодо ефективності акупунктури суперечливі [9].
Клонідин, центрально діючий альфа-агоніст, хоча і показав 37% зниження припливів, може призвести до порушення сну, сухості в роті та закрепів [10]. Габапентин ефективний лише в дозі 900 мг/добу (300 мг тричі на день), яка може викликати значну седацію, якщо не збільшувати дозу поступово [11].
Інгібітори зворотного захоплення серотоніну (флуоксетин і пароксетин) [12, 13] та інгібітори зворотного захоплення серотоніну-норепінефрину (венлафаксин) [14] призвели до більш ніж 50% зменшення припливів, але побічні ефекти та занепокоєння щодо взаємодії з тамоксифеном обмежили їхнє використання [15]. Варто зазначити, що симптоми сексуальної дисфункції, такі як гіпоактивний статевий потяг і порушення оргазму, поширені у 80% осіб, які приймають антидепресанти [16].
Оксибутинін у нещодавньому плацебо-контрольованому дослідженні показав значне зменшення припливів та покращення показників ЯЖ і, здається, відносно добре переноситься. Побічні ефекти оксибутиніну під час шеститижневого курсу дослідження були подібними до інших антихолінергічних засобів і включали сухість у роті, біль у животі та утруднене сечовипускання [17].
Практичне застосування стратегій управління побічними ефектами ендокринної терапії при РГЗ
- Для подолання вазомоторних симптомів застосовується комплексний підхід, що включає і немедикаментозні, і фармакологічні методи. Серед немедикаментозних підходів рандомізовані дослідження продемонстрували ефективність когнітивно-поведінкової терапії [8]. Також рекомендують поведінкові модифікації, такі як фізичні вправи, уникнення тригерів та використання багатошарового одягу. Щодо акупунктури, дані про її ефективність досі неоднозначні [9].
- Фармакологічні методи лікування вазомоторних симптомів включають застосування клонідину, габапентину, антидепресантів у зменшених дозах (інгібітори зворотного захоплення серотоніну та інгібітори зворотного захоплення серотоніну-норепінефрину), а також оксибутиніну. Ці препарати ефективно зменшують частоту і тяжкість припливів. Однак під час вибору лікування необхідно враховувати супутні захворювання пацієнта та профілі побічних ефектів препаратів.
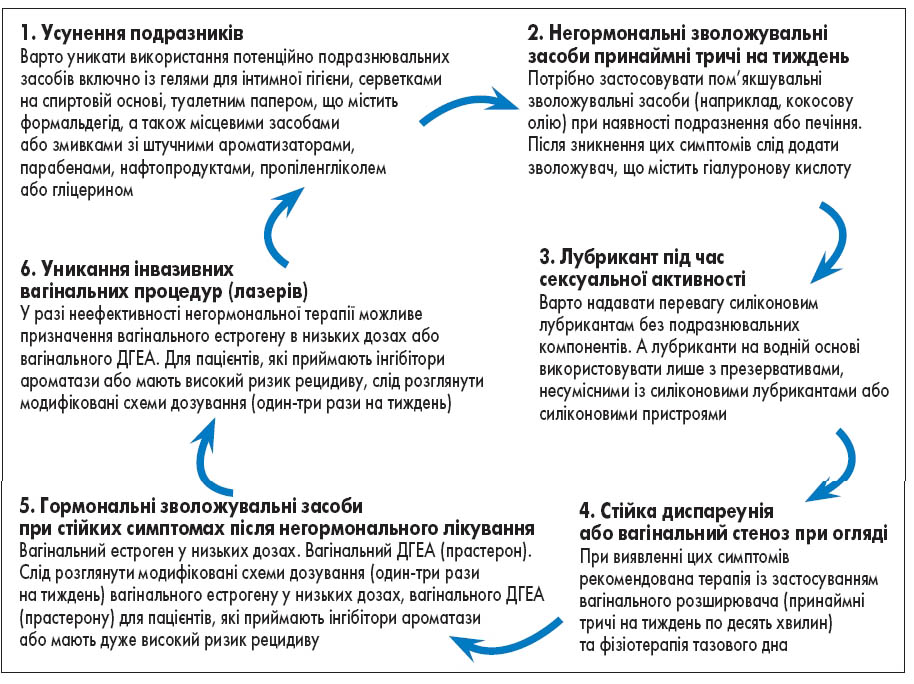
- ГУМС може проявлятися не лише сухістю піхви, але й підвищеною чутливістю до інфекцій, болісними статевими актами та рецидивуючими інфекціями сечового міхура. Його лікування має бути комплексним і включати обговорення щодо зменшення контакту з потенційними подразниками, регулярне використання негормональних зволожувачів та відповідних лубрикантів для статевих контактів. Для деяких пацієнток можуть бути корисними вагінальні розширювачі та фізіотерапія тазового дна. У разі серйозних порушень під час обстеження або неефективності негормональної терапії слід розглянути можливість застосування низьких доз вагінального естрогену або дегідроепіандростерону (ДГЕА) після ретельного обговорення потенційних ризиків та переваг такого лікування.
- Особливої уваги потребує питання збереження фертильності (ЗФ) у молодих жінок із РГЗ. Ці пацієнтки піддаються ризику безпліддя після проходження гонадотоксичної хіміотерапії. Хоча ендокринна терапія не є безпосередньо гонадотоксичною, тривалість її проведення призводить до додаткового вікового зниження фертильності. Тому варіанти ЗФ потрібно обговорити і запропонувати до початку лікування. Жінкам, які пройшли відповідне обстеження, може бути доцільно зробити перерву в ендокринній терапії на термін 18-30 місяців, щоб спробувати завагітніти.
- Важливим аспектом ведення пацієнток, які отримують ад’ювантну ендокринну терапію, є моніторинг стану кісткової тканини. Дефіцит естрогенів, спричинений ендокринною терапією, є основною причиною зниження мінералізації кісткової тканини та підвищеного ризику переломів. Тому пацієнткам із РГЗ, які отримують таке лікування, потрібна належна увага та регулярний моніторинг стану кісткової тканини. За наявності показань існує декілька стратегій запобігання демінералізації кісток та зниження ризику переломів, які можуть бути застосовані в цих умовах.
Сухість та атрофічні зміни
ГУМС охоплює широкий спектр гінекологічних наслідків, від сухості до рецидивуючих інфекцій сечовивідних шляхів. Такі симптоми, як сухість, свербіж, печіння та дизурія, вказують на наявність атрофічних змін слизової оболонки вульви та піхви [1]. Ці гіпоестрогенні ефекти часто спонукають жінок застосовувати різноманітні безрецептурні засоби місцевої терапії, які можуть бути неефективними або навіть шкідливими [2].
Лікування ГУМС починається з мінімізації впливу потенційних подразників. Пацієнткам слід використовувати прості пом’якшувальні засоби, такі як органічна кокосова олія, що має природні антимікробні та протигрибкові властивості [18]. Негормональні вагінальні зволожувачі з гіалуроновою кислотою можуть бути ефективними для тривалого використання [19]. Важливо розрізняти зволожувачі та лубриканти, які мають різне призначення та тривалість дії [20].
Пацієнткам із більш вираженими змінами архітектури піхви можна порекомендувати додавання низьких доз вагінальних гормонів (естрадіолу або ДГЕА) [21]. Вагінальний естроген є найефективнішим методом лікування ГУМС, бо сприяє реколонізації лактобактерій, збільшенню вагінального кровообігу та покращенню еластичності слизової оболонки [21]. Однак його застосування у жінок із РГЗ в анамнезі обмежене через потенціал системної абсорбції [22, 23].
Дані спостережень загалом не вказують на підвищений ризик рецидиву РГЗ під час застосування вагінальних естрогенів [24]. Однак нещодавнє ретроспективне дослідження виявило зв’язок із рецидивом у певної підгрупи пацієнток [25, 26]. Тому рішення про застосування вагінальних естрогенів має базуватися на індивідуальному балансі ризиків та переваг.
Вагінальні андрогени, зокрема інтравагінальна таблетка 6,5 мг прастерону (синтетичний ДГЕА), можуть бути альтернативою для пацієнток із зовнішньою диспареунією [27, 28]. Комбінований вагінальний тестостерон також показав ефективність у лікуванні ГУМС, хоча наразі не існує схваленої FDA (Управління з контролю за продуктами і ліками США) версії цього препарату [30, 31].
Тобто вибір методу лікування має ґрунтуватися на індивідуальних потребах пацієнтки, враховувати потенційні ризики та переваги і супроводжуватися належним консультуванням відповідно до актуальних клінічних настанов (рис. 1) [29].
Рис. 1. Алгоритм лікування ГУМС
Вагінальний стеноз і спазм леватора
Нелікований ГУМС може прогресувати до вкорочення та звуження піхви, відомого як вагінальний стеноз (ВС). Це явище, вперше описане у жінок, що зазнали опромінення органів малого таза, також спостерігається у пацієнток, які отримують естроген-супресивну терапію [32]. Клінічно ВС може проявлятися відчуттям «наштовхування/впирання» на стінку під час статевого акту. Дослідження, проведене в межах програми сексуального здоров’я після раку у Південній Флориді, виявило, що приблизно у половини жінок, які отримують антиестрогенну терапію для лікування сексуальної дисфункції, спостерігається ВС, що робить статевий акт надзвичайно болючим або навіть неможливим [32].
Терапія ГУМС із ВС передбачає комплексний підхід, що включає застосування відповідного зволожувального засобу для атрофованої слизової оболонки у поєднанні з дилататорною терапією, що сприяє покращенню еластичності та забезпечує біологічний зворотний зв’язок під час вправ на розслаблення тазового дна [33-35]. Ефективність постійного використання вагінального розширювача (тричі на тиждень по десять хвилин за сеанс) була доведена в кількох дослідженнях [33-35]. Однак важливо зазначити, що прихильність пацієнток до режиму застосування вагінального розширювача є низькою – лише половина з них продовжує його використання через шість місяців [36]. Це підкреслює необхідність додаткової підтримки та мотивації пацієнток у дотриманні рекомендованого режиму лікування. Загалом комплексний підхід до лікування ВС та спазму леватора у пацієнток із ГУМС вимагає індивідуалізованого підходу, що поєднує фармакологічні та нефармакологічні методи лікування, а також активну участь пацієнтки у процесі терапії.
Репродуктивне планування для пацієнток із РГЗ
РГЗ є найпоширенішою злоякісною пухлиною серед жінок, причому приблизно 10% нових випадків діагностуються у жінок репродуктивного віку [41]. Враховуючи високу виживаність, яка досягає 90%, питання ЗФ та планування сім’ї набувають першорядного значення [42]. Багато жінок із діагнозом «рак» хочуть мати дітей, і неможливість реалізувати це бажання може викликати у них значний стрес.
Чинні клінічні настанови рекомендують консультування з питань фертильності та направлення на допоміжні репродуктивні технології (ДРТ) для всіх пацієнток із ризиком безпліддя, пов’язаного з раком [43-45]. Однак загальний рівень використання цих можливостей залишається низьким.
Лікування РГЗ створює кілька унікальних викликів щодо ЗФ:
- гонадотоксична хіміотерапія може призвести до передчасної оваріальної недостатності, причому ризик зростає з віком пацієнтки;
- алкілуючі агенти мають високу гонадотоксичність, але багато інших препаратів також наражають на певний ризик [46];
- для жінок із HR+ пухлинами необхідність ендокринної терапії протягом 5-10 років спричиняє репродуктивну перерву, що призводить до вікового зниження фертильності.
Стандартним підходом, спрямованим на ЗФ, є ДРТ – кріоконсервація ембріонів і ооцитів [47]. Обидва методи передбачають стимуляцію яєчників, набір декількох фолікулів та вилучення ооцитів. Цей процес займає близько двох тижнів і потребує декількох візитів пацієнтки для моніторингу загального стану. Нещодавні досягнення в галузі ДРТ зробили ЗФ більш доступним для жінок із РГЗ:
- протоколи випадкового старту дають змогу починати стимуляцію в будь-який момент менструального циклу [48];
- послідовні цикли стимуляції яєчників можливі для пацієнток, які можуть відкласти лікування [50];
- допоміжні засоби, що знижують рівень естрогену (ІА або селективні модулятори естрогенових рецепторів), дають змогу проводити стимуляцію яєчників без значного підвищення рівня естрадіолу [51, 52].
Важливо зазначити, що проведення ЗФ може дещо відтермінувати початок лікування раку, але дослідження показують відсутність негативного впливу на виживаність без інвазивних захворювань та загальну виживаність протягом п’яти років [49]. Для жінок зі спадковими синдромами РГЗ ДРТ надають додаткову перевагу можливості проведення передімплантаційного генетичного тестування на моногенні дефекти (PGT-M) [53]. Крім того, існують дані про підвищений ризик зниження оваріального резерву (DOR) у носіїв BRCA, хоча цей зв’язок залишається суперечливим [54]. ДРТ дають змогу таким жінкам максимізувати свій репродуктивний потенціал.
Для жінок, яким ДРТ не підходять через обмежений час або медичні показання, існують альтернативні варіанти:
- кріоконсервація тканини яєчника може бути доцільною для жінок до 35 років [56-59];
- пригнічення яєчників агоністами гонадотропін-рилізинг-гормону (ГнРГ) під час хіміотерапії може знизити ризик спричиненої хіміотерапією недостатності яєчників і покращити частоту настання вагітності після завершення лікування [60, 61].
Сучасні дані свідчать, що вагітність після належного лікування РГЗ не погіршує онкологічні результати, навіть у випадках HR+ пухлин або у носіїв BRCA [62-66]. Дослідження POSITIVE показало, що переривання ендокринної терапії через 18-30 місяців для спроб зачаття не погіршувало короткострокові онкологічні результати у жінок із РГЗ І або ІІ стадії [68].
Однак, незважаючи на значний прогрес, існують суттєві бар’єри:
- недостатня психологічна підтримка та допомога в ухваленні рішень щодо ДРТ і виношування вагітності після лікування раку;
- фінансовий доступ до ДРТ залишається значною перешкодою. Вартість одного циклу кріоконсервації ооцитів становить в середньому 8 тис. доларів США, а кріоконсервації ембріонів – 10 тис. доларів США, не враховуючи додаткових витрат [69];
- лише 13 штатів США вимагають обов’язкового страхового покриття ДРТ, через що ці послуги недоступні для багатьох пацієнток [69].
Для забезпечення цілісної, всебічної допомоги всім молодим жінкам із діагнозом РГЗ необхідно усунути ці бар’єри. Це дасть змогу пацієнткам, які перенесли РГЗ, мати можливість створювати свої сім’ї, незважаючи на потенційний вплив захворювання та його лікування на фертильність.
Здоров’я кісткової тканини у жінок із РГЗ
Швидкість втрати кісткової тканини у жінок збільшується з віком, водночас дефіцит естрогену є основною причиною цього процесу [70]. Ендокринна терапія, яка застосовується у жінок із РГЗ і в пре-, і в постменопаузі, призводить до дефіциту естрогену, що прискорює зниження оборотності кісткової тканини. А це спричиняє зниження мінеральної щільності кісткової тканини (МЩКТ) та підвищений ризик переломів [71].
У жінок у пременопаузі всі доступні варіанти ад’ювантного ендокринного лікування (тамоксифен, тамоксифен плюс ЗГТ, ІА плюс ЗГТ) призводять до збільшення втрати кісткової маси [72-74]. Найбільше погіршення стану кісткової тканини, із щорічною втратою МЩКТ до 11%, спостерігається при застосуванні ІА плюс ЗГТ. Прийом тамоксифену до менопаузи асоціюється зі зниженням МЩКТ до 2% на рік [70]. Ефект цих препаратів зберігається навіть після припинення лікування, що призводить до збільшення частки пацієнтів з остеопенією та остеопорозом.
Вплив втрати кісткової маси на ризик переломів у жінок, які отримують естрогенну супресію, недостатньо вивчений. Австрійська дослідницька група з вивчення РГЗ та раку товстої кишки (ABCSG-12) повідомила про схожу частоту переломів у пацієнток, які отримували ЗГТ плюс ІА або тамоксифен [73]. Однак результати дослідження тамоксифену та екземестану (TEXT) і дослідження пригнічення функції яєчників (SOFT) показали більшу кількість переломів під час ад’ювантної ендокринної терапії з пригніченням функції яєчників (ПФЯ) плюс ІА (7,7%) порівняно з ПФЯ плюс тамоксифен (6,0%) або лише тамоксифеном (5,3%) [75].
У жінок у постменопаузальному періоді ІА асоціюються з більшою кістковою резорбцією, втратою кісткової маси та ризиком переломів порівняно з тамоксифеном [70]. У двох великих метааналізах повідомлялося про 47% (відносний ризик [ВР] 1,47; 95% довірчий інтервал [ДІ] від 1,34 до 1,61) [76] та 35% (ВР 1,35; 95% ДІ 1,21-1,51) [77] вищого ризику переломів при застосуванні ІА, ніж при застосуванні тамоксифену. Застосування ІА понад п’ять років ще більше підвищує ризик переломів. У нещодавньому метааналізі тривале застосування ІА було пов’язане із 34% (ВР 1,34; 95% ДІ 1,16-1,55) вищого ризику переломів порівняно з плацебо або відсутністю лікування [78].
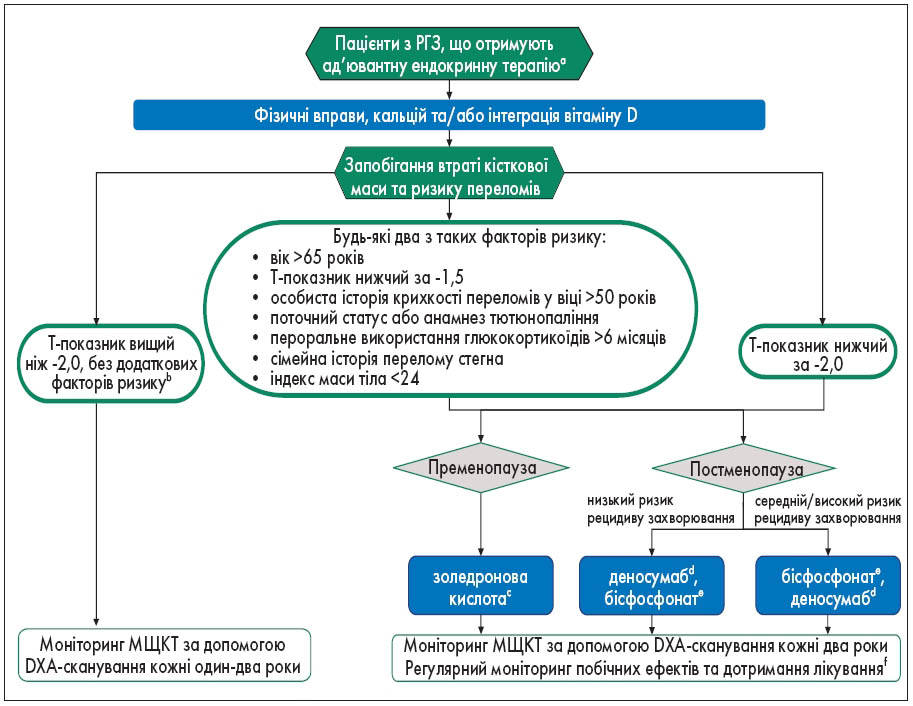
Враховуючи значний вплив ад’ювантної ендокринної терапії на стан кісткової тканини, всіх пацієнтів потрібно чітко поінформувати про ризик втрати кісткової маси та переломів перед початком лікування [79]. Оптимальне управління здоров’ям кісткової тканини в цих умовах включає належне оцінювання інших факторів ризику розвитку остеопорозу та МЩКТ пацієнта за допомогою подвійної рентгенівської абсорбціометрії [80-82] на початковому етапі та під час ад’ювантної ендокринної терапії (рис. 2).
Рис. 2. Алгоритм управління здоров’ям кісток у жінок, що отримують ад’ювантну ендокринну терапію при РГЗ (адаптовано Coleman R. et al. (2020) [79])
Примітки:
а Алгоритм включає застосування ІА, терапію пригнічення функції яєчників/оофоректомію (з тамоксифеном або ІА), а також монотерапію тамоксифеном у пацієнток у пременопаузі.
b Оцінювання стану кісткової тканини здійснюється за допомогою двоенергетичної рентгенівської абсорбціометрії (DXA), що дає змогу відстежувати зміни МЩКТ пацієнтки з використанням T-показника. Цей показник категоризує пацієнток на основі стандартних відхилень від середньої МЩКТ здорової молодої жінки. Загалом втрата 10% МЩКТ еквівалентна зниженню T-показника на одне стандартне відхилення і може підвищити ризик переломів у 2,6 раза. Для оцінювання слід використовувати найнижчий T-показник, отриманий при вимірюванні в ділянці хребта та стегна.
c Рекомендовані схеми лікування золендроновою кислотою: 4 мг внутрішньовенно кожні шість місяців.
d Рекомендовані схеми лікування деносумабом: 60 мг підшкірно кожні шість місяців. Після завершення терапії деносумабом слід застосовувати бісфосфонати для запобігання ефекту рецидиву остеопорозу.
e Альтернативні схеми: внутрішньовенне введення золедронової кислоти кожні шість місяців, щотижневий пероральний прийом алендронату чи ризедронату або щоденний пероральний прийом ібандронату протягом усього періоду ендокринного лікування чи до п’яти років.
f Для запобігання можливого остеонекрозу щелепи рекомендовані регулярний догляд за зубами та увага до здоров'я ротової порожнини.
Профілактика та лікування втрати кісткової маси
Хоча існує обмежена кількість доказів щодо впливу кальцію, вітаміну D та фізичних вправ на здоров’я кісток у пацієнтів із РГЗ, збагачена кальцієм дієта, помірні фізичні навантаження, вправи з обтяженням і вживання вітаміну D рекомендовані всім пацієнткам, що отримують лікування, яке може негативно вплинути на здоров’я кісток, наприклад, ад’ювантну ендокринну терапію [79].
Кістковомозкові препарати, такі як бісфосфонати та деносумаб, є найбільш перевіреною та широко застосовуваною фармакологічною стратегією протидії втраті кісткової маси в клінічній практиці. Ці препарати інгібують резорбцію кісткової тканини за допомогою різних механізмів дії. Остеокласти поглинають бісфосфонати шляхом ендоцитозу під час резорбції кісткової тканини, що призводить до загибелі клітин через цитотоксичний ефект для сполук, що не містять азоту (наприклад, клодронат) або прямий апоптотичний ефект для азотовмісних агентів (наприклад, золедронова кислота, ібандронат та памідронат). Деносумаб – це моноклональне антитіло, що зв’язує рецептор активатора ліганду ядерного фактора каппа В (RANKL), яке інгібує зв’язування RANK із подальшим пригніченням резорбції кісткової тканини [79].
У жінок у пременопаузі, які отримують ЗГТ плюс ІА, порівняно з тамоксифеном з або без ЗГТ, внутрішньовенне введення золедронової кислоти (4 мг кожні три-шість місяців) є єдиним кістковомодифікуючим препаратом (Bone-Targeting Agents, BTAs), ефективним для запобігання втраті МЩКТ, за даними кількох рандомізованих досліджень [73, 83, 85]. До того ж її застосування асоціюється зі зниженням ризику переломів [85]. На сьогоднішній день в жодному рандомізованому дослідженні не вивчалося застосування пероральних бісфосфонатів або деносумабу у жінок в пременопаузі, які отримують ад’ювантну ендокринну терапію.
Що стосується пацієнток у постменопаузі, які отримують ІА, кілька рандомізованих досліджень продемонстрували користь і бісфосфонатів (внутрішньовенних або пероральних препаратів), і деносумабу в запобіганні втраті кісткової маси, тоді як щодо їхнього впливу на зниження ризику переломів існують більш обмежені докази [84, 86, 95]. Схеми дозування для пацієнток, які отримують естрогенну супресію, подібні до тих, що застосовуються для лікування остеопорозу в жінок у постменопаузі [88].
Незалежно від віку та МЩКТ на початку лікування, найпереконливіші докази на користь застосування деносумабу (60 мг раз на шість місяців з адекватним доповненням кальцію та вітаміну D) стосуються жінок у постменопаузі, які отримують ІА. Дослідження показали майже 50% зниження ризику переломів і у пацієнток з початковим рівнем T-score -1 або вищим (n = 1,872; ВР 0,44; 95% ДІ 0,31-0,64), і з показником T-score меншим за -1 (n = 1 548; ВР 0,57; 95% ДІ 0,40-0,82) [86].
Протиракова дія BTAs та практичне застосування у пацієнток із РГЗ
Дослідження BTAs як потенційної протипухлинної терапії ґрунтується на встановленій ролі кісткового мікрооточення у розвитку метастазів [89]. Однак ефективність цих препаратів різниться залежно від менопаузального статусу пацієнток та типу BTAs.
У жінок у пременопаузі застосування бісфосфонатів як протиракового засобу залишається суперечливим. Наразі немає даних рандомізованих досліджень, які б підтримували застосування деносумабу в цій популяції [90-93]. Дослідження ABCSG-12 і HOBOE повідомили про користь додавання золедронової кислоти до ПФЯ як допоміжної ендокринної терапії [91, 93]. Натомість дослідження AZURE не виявило користі від додавання золедронової кислоти до ендокринної терапії у жінок у пременопаузі [92]. Метааналіз групи дослідників ранніх стадій РГЗ (EBCTCG) серед 4 616 жінок віком до 45 років не виявив жодних переваг бісфосфонатів щодо кісткових рецидивів (ВР 1,00; 95% ДІ 0,79-1,26) [94].
У жінок у постменопаузі численні рандомізовані дослідження мали на меті визначити потенційний протираковий ефект ад’ювантних пероральних або внутрішньовенних бісфосфонатів [84, 90, 92, 95-97]. Метааналіз EBCTCG показав, що застосування бісфосфонатів значно знижувало ризик рецидивів раку кісток (ВР 0,83; 95% ДІ 0,73-0,94) та смертність від РГЗ (ВР 0,91; 95% ДІ 0,83-0,99) [94]. Серед різних бісфосфонатів подібну користь спостерігали для клодронату (n = 5 053), золедронової кислоти (n = 9 290) та ібандронату (n = 3 072), тоді як у меншій групі перорального памідронату (n = 953) очевидного ефекту не було виявлено. Позитивний ефект бісфосфонатів спостерігався при всіх підтипах РГЗ [94].
Дослідження SWOG S0307 не виявило різниці в результатах лікування між трьома різними бісфосфонатами, які приймали протягом трьох років: пероральним ібандронатом (50 мг на добу), пероральним клодронатом (1 600 мг на добу) або внутрішньовенною золедроновою кислотою (вводили щомісяця протягом пів року, а потім кожні три місяці) [97].
Що стосується деносумабу, існують суперечливі дані щодо його протиракової дії. Дослідження ABCSG-18 показало потенційний позитивний ефект переважно щодо безрецидивної виживаності [86, 95], однак дослідження D-CARE, в якому брали участь пацієнтки з високим ризиком РГЗ на ранніх стадіях, не виявило жодного ефекту [96].
Практичне застосування та перспективи BTAs
У пацієнток, які отримують ендокринну терапію, належна підтримка здоров’я кісткової тканини є критично важливим компонентом догляду за виживанням [99]. Під час їхнього консультування слід враховувати не лише профілактику втрати кісткової тканини, спричиненої лікуванням, але й зниження ризику рецидиву. Необхідно обговорити доступні типи і схеми дозування BTAs, а також їхні профілі токсичності включно із безпекою для нирок і ризиком остеонекрозу щелепи.
Остеонекроз щелепи є рідкісним явищем при застосуванні пероральних бісфосфонатів або деносумабу для запобігання втраті кісткової тканини при три- та шестимісячних схемах лікування порівняно з більш інтенсивним лікуванням у пацієнтів із метастазами в кістках [100]. В основних дослідженнях частота остеонекрозу щелепи коливалася від 0,1% при застосуванні клодронату, ібандронату або шестимісячного курсу золедронової кислоти [91, 97, 101] до приблизно 2-5% при більш інтенсивних схемах лікування золедроновою кислотою або деносумабом [96, 102].
Виведення бісфосфонатів відбувається через нирки, і пероральні, і внутрішньовенні препарати мають застереження або протипоказання щодо їхнього застосування у пацієнток зі зниженою функцією нирок. Однак при застосуванні відповідно до характеристик препарату бісфосфонати не продемонстрували додаткової ниркової токсичності навіть у літніх пацієнток [103, 104].
Слід зазначити, що після відміни деносумабу спостерігався рецидивний остеоліз [105]. Хоча його патофізіологія залишається невизначеною, неактивні попередники остеокластів можуть накопичуватися в кістках під час лікування деносумабом і швидко реактивуватися після відміни препарату [105]. Невеликі серії досліджень свідчать, що призначення золедронової кислоти у вигляді двох доз (через 6 та 12 місяців після останньої ін’єкції деносумабу) може допомогти запобігти виникненню ефекту рецидиву та підвищеному ризику переломів [106].
Майбутні дослідження в цій галузі мають краще враховувати вплив інших потенційних факторів ризику, пов’язаних із РГЗ, включно із профілями безпеки для кісток при застосуванні нових таргетних препаратів у поєднанні з ендокринною терапією. Уточнена стратифікація ризику могла б краще інформувати клінічні настанови. У зв’язку із цим біомаркери кісткового обороту і нові технології візуалізації (такі як периферична кількісна комп’ютерна томографія з високою роздільною здатністю) слід оцінювати надалі [107].
Анаболічні кісткові препарати не схвалені для використання в цій ситуації через побоювання щодо можливої стимуляції розвитку раку та підвищеного ризику рецидиву [99]. Отже, наразі бісфосфонати та деносумаб є єдиними BTAs, що застосовуються в клінічній практиці для пацієнток, які отримують ад’ювантну ендокринну терапію. Поточні дослідження спрямовані на оцінювання потенційного профілактичного ефекту інгібування RANK/RANKL за допомогою деносумабу у здорових носіїв із патогенним варіантом генів BRCA в зародковій лінії (ClinicalTrials.gov ідентифікатор: NCT04711109).
Висновок
Пацієнтки з ранніми стадіями HR+ РГЗ, які повідомляють про серйозні побічні ефекти від ендокринної терапії, у п’ять разів частіше припиняють приймати призначені їм ліки, а 70% із них передчасно припиняють лікування до п’яти років [108, 109]. Більш ефективне вирішення цих проблем ЯЖ включно із симптомами менопаузи, сексуальними розладами, ЗФ та підтримкою здоров’я кісток може покращити прихильність до лікування, а отже, і онкологічні результати.
Реферативний огляд Lambertini M., Arecco L., Woodard T.L. et al. (2023) Advances in the Management of Menopausal Symptoms, Fertility Preservation, and Bone Health for Women With Breast Cancer on Endocrine Therapy. Am Soc Clin Oncol Educ Book. May;43:e390442. doi: 10.1200/EDBK_390442.
Підготувала Анна Хиць
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (91) 2024 р.