11 листопада, 2020
Доброкачественные опухоли легких и бронхов: клинические, морфологические, эндоскопические и лучевые аспекты диагностики
Продолжение. Начало в №2 (51), стр. 5-8.
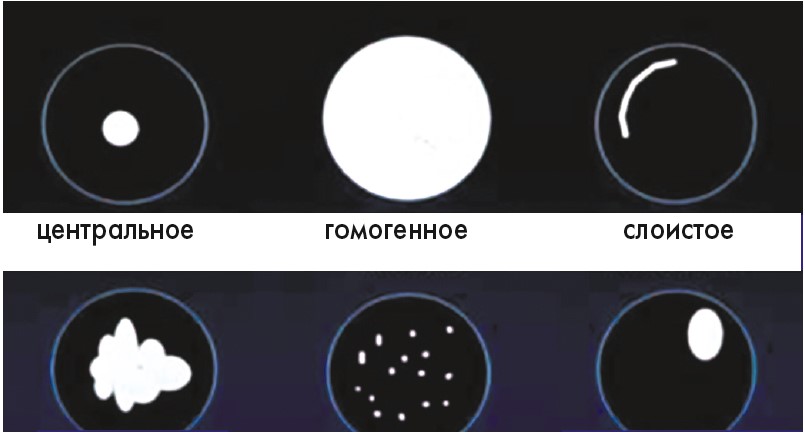
 В целом имеется 6 типов обызвествления образований легких и бронхов (рис. 21):
В целом имеется 6 типов обызвествления образований легких и бронхов (рис. 21):
- центральное;
- гомогенное;
- слоистое;
- в виде воздушной кукурузы;
- точечные аморфные;
- крупные эксцентричные.
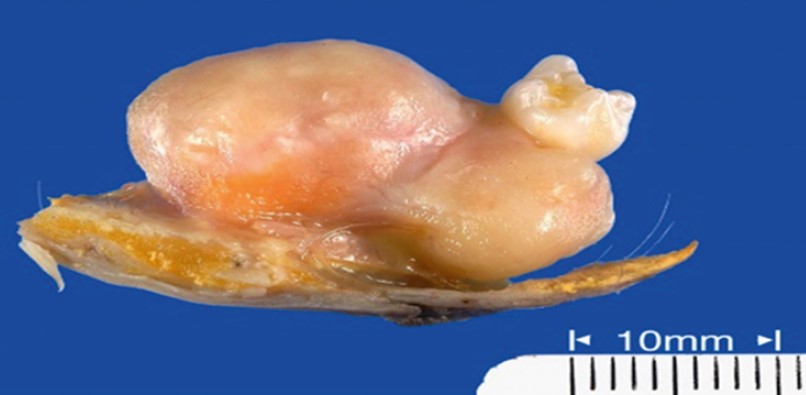
Еще одна доброкачественная опухоль, ткань которой нетипична для локализации, называется тератомой (teratoma, паразитирующий плод, сложная опухоль, дермоидная киста, эмбриома и др.). Гистологически это дисэмбриональное опухолевидное и кистозное новообразование, состоящее из разного типа тканей (сальных масс, волос, костей, зубов, потовых желез и др.). Макроскопически имеет вид плотной опухоли или кисты с четкой капсулой (рис. 22). Тератомы составляют 1,5-2,5% ДОЛ и преимущественно встречаются в молодом возрасте. Рост тератом медленный, возможно нагноение кистозной полости или озлокачествление опухоли (тератобластома). При дренировании нагноившейся кисты в просвет бронха или плевральную полость развивается клиническая картина абсцесса легкого или пиопневмоторакса. Локализация тератом всегда периферическая, чаще в верхней доле левого легкого и в средостении [30].
Рис. 21. Варианты обызвествленийв образованиях легких и бронхов
Рис. 22. Макропрепарат тератомы легкого
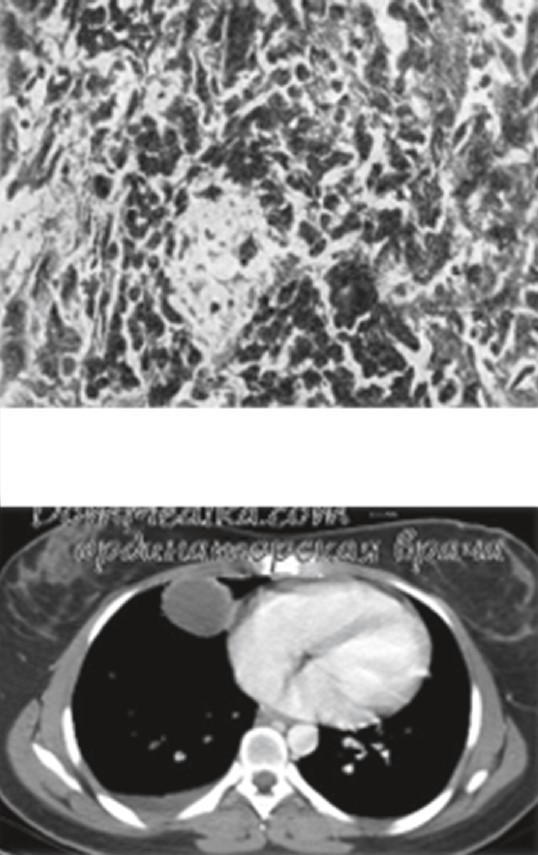
По современным представлениям тератома (teratoma, сложная опухоль, эмбриома, смешанная тератогенная опухоль, тридермома, монодермома, паразитирующий плод) относится к группе герминогенных опухолей, представляющих собой производные из полипотентного, то есть источника любых тканей организма, а именно, высокоспециализированного герминогенного эпителия гонад, способного подвергаться соматической и трофобластической дифференцировке и быть гистогенетическим источником разнообразных по строению опухолей (тератомы, хорионэпителиомы, полиэмбриомы и др.). Состоит тератома из тканей нескольких типов производных одного, двух или трех зародышевых листков, присутствие которых не свойственно тем органам и анатомическим областям организма, в которых развивается опухоль. Опухолевым клеткам тератомы присуща различная веретенообразная форма. Многие из них имеют разную длину и отростки в виде волоконец. Длинные отростки разделяются на несколько веточек и соединяются с такими же отростками других клеток. В участках соединения отростков образуются утолщения, называемые узлами. Короткие отростки также соединяются с отростками соседних клеток. Цитоплазма, широкая в зоне ядра, переходя в отростки, заметно суживается. Ядра небольшие, гиперхромные, чаще палочковидные. В палочковидных ядрах структура хроматина не определяется. Процесс локальный (рис. 23, 24).
Рис. 23. Тератома средостения в гистологическом и КТ ОГК изображении
Рис. 24. Тератома: макропрепарат
Папиллома – еще один вид ДОЛ. Растет в бронхах, торчащих из области поверхности, где она прикреплена. Папилломы не очень распространены и делятся на 3 типа.
Одна из категорий легочных папиллом – чешуйчатый тип: встречаются как у детей, так и у взрослых в результате заражения вирусом папилломы человека (тем же вирусом, который вызывает бородавки и некоторые венерические заболевания [31]) и может выглядеть как один узелок или несколько.
Причина появления папиллом железистого типа не установлена. Такого рода папилломы менее распространены, чем плоскоклеточные, развиваются они, в отличие от последних, в более крупных дыхательных путях. Наблюдаются у пациентов разного возраста, но в основном у взрослой популяции и почти всегда появляются как один узелок, расположенный в центре.
Смешанный – плоскоклеточный и железистый – тип содержит смесь ткани плоскоклеточной и железистой папилломы. Зарегистрирован в небольшом количестве случаев, имеет потенциал переродиться в злокачественную опухоль, так как плоскоклеточные клетки со временем могут меняться.
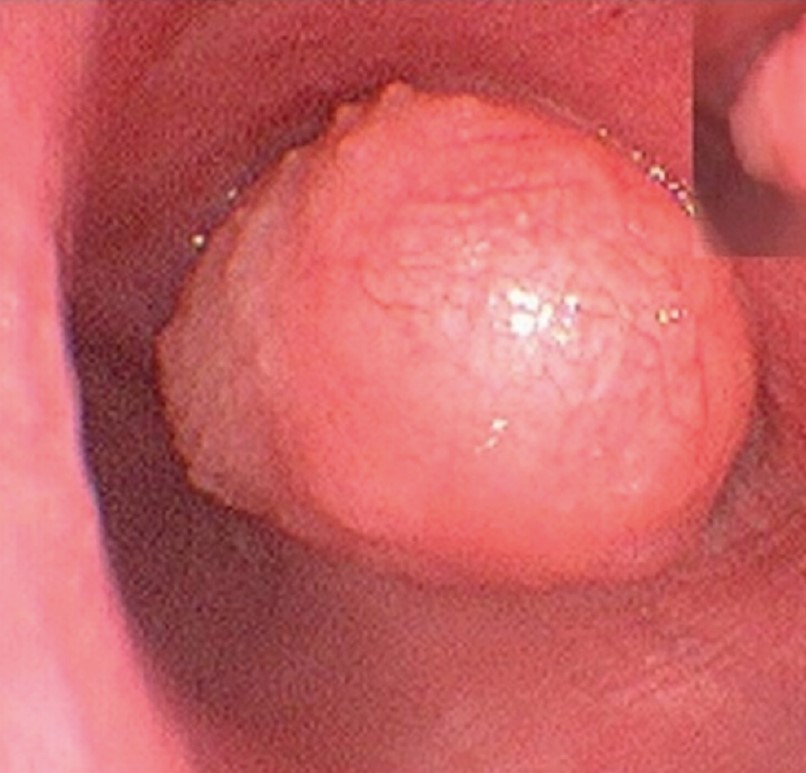
Папиллома (или фиброэпителиома) – это опухоль, состоящая из соединительнотканной стромы с множественными сосочковыми выростами, покрытая снаружи метаплазированным или кубическим эпителием. Папилломы развиваются преимущественно в крупных бронхах, растут эндобронхиально, иногда стенозируя просвет бронха целиком. Зачастую папилломы бронхов встречаются вместе с папилломами гортани и трахеи и могут подвергаться малигнизации. Внешний вид папилломы напоминает цветную капусту, петушиный гребень или ягоду малины. Макроскопически папиллома представляет собой образование на широком основании или ножке, с дольчатой поверхностью, розового или темно-красного цвета, мягкоэластической и, реже, плотноэластической консистенции (рис. 25).
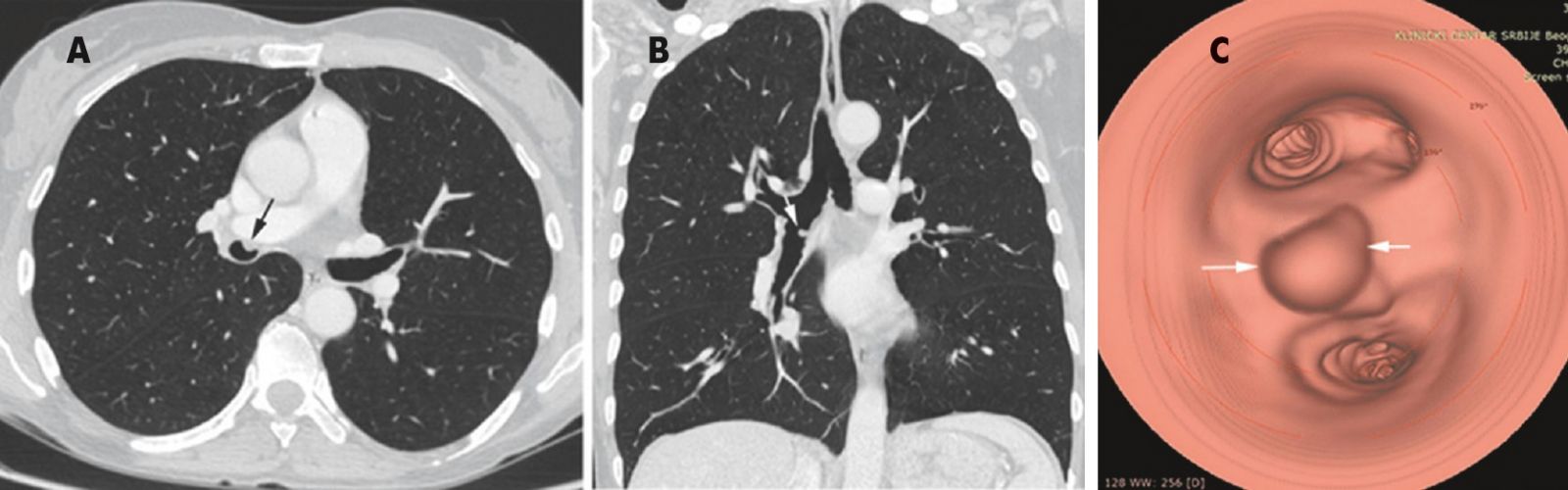 Рис. 25. Бронхиальная папиллома
Рис. 25. Бронхиальная папиллома
Осевое (A), коронарное изображение MPR (B) показывает гладкую полипоидную массу мягких тканей, возникающую из передней стенки правого нижнедолевого бронха (стрелка). Виртуальная бронхоскопия (С) показывает внутрибронхиальное формирование массы с гладкой поверхностью (стрелки).
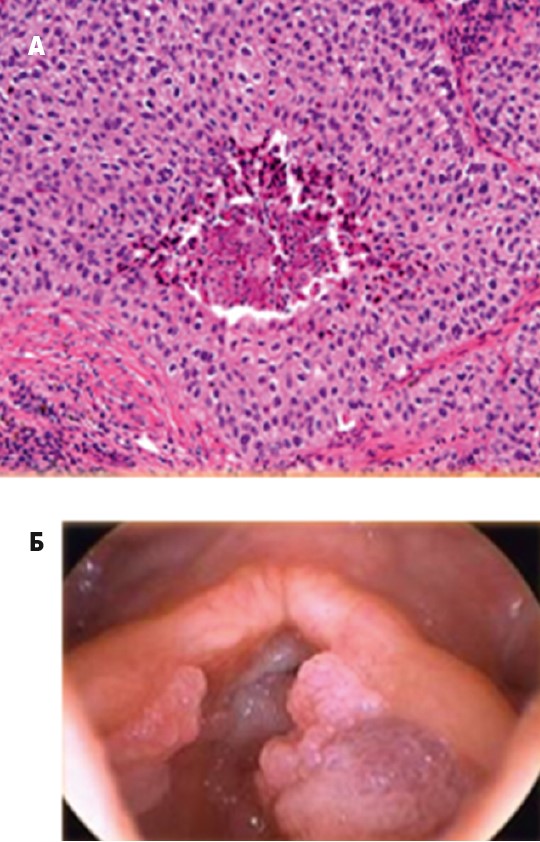
Гистологически структура ткани бронха изменена за счет опухолевых характеристик. Отмечается утолщение слоя эпителия на слое разросшейся соединительной ткани. Опухоль состоит из ворсин, в которых фиброваскулярные стержни покрыты гиперплазированным многослойным плоским эпителием. Выстилка опухолевых ворсин содержит вакуолизированные клетки, секретирующие слизь, а также очажки из клеток промежуточного типа, похожие на элементы переходно-клеточного эпителия. Обнаруживаются признаки дисплазии. Процесс местный (рис. 26).
Рис. 26. Папиллома бронха гистологически (А) и бронхоскопически (Б)
Термин «папиллярная аденома легкого» является синонимом или альтернативным названием заболевания, обозначающего легочную папиллярную аденому (ЛПА). ЛПА – редкая доброкачественная опухоль легкого. Возникает в основном в легочной ткани, а не в дыхательных путях (в отличие от некоторых других ДОЛ). Эти опухоли легких, как правило, одиночные и наблюдаются как во взрослой, так и в педиатрической популяции пациентов. Точная причина ЛПА неизвестна, и в настоящее время никаких конкретных факторов риска ее развития не выявлено. Большинство ЛПА протекает бессимптомно. По этой причине большинство из них часто диагностируют случайно, во время скрининговых исследований других заболеваний. Врач может провести хирургическое удаление опухоли, чтобы исключить рак легких. Полное удаление опухоли в подавляющем большинстве случаев приводит к излечению. Прогноз ЛПА, как правило, хороший, так как это доброкачественная опухоль и злокачественной трансформации (малигнизации) не отмечено [32].
Доброкачественные опухоли, развивающиеся из жировой ткани, в частности легкого, называются липомы. В легких жировые опухоли выявляются довольно редко, и они не наносят здоровью пациента особого ущерба. Липомы локализуются как в центральной части легкого, так и на его периферии (рис. 27). Липомы с локализацией внутри либо вне просвета бронха также редки. Но чаще все-таки встречаются внутрибронхиальные липомы (по данным Nanson, Horlay, Hilliard) – таковых примерно в 4-5 раз больше, чем внебронхиальных [33].
На рентгенограммах внутрибронхиальная липома проявляется весьма характерными признаками – спадением доли легкого вследствие обтурации соответствующего бронха. Чаще всего липомы локализуются в крупных бронхах – в долевом либо сегментарном. Диагноз липомы гистологически можно подтвердить после бронхоскопии, биопсии опухоли и тканевого исследования [34, 35]. Так, на рентгенограммах липома зачастую неотличима от центрального рака легкого (рис. 28-30).
На КТ грудной клетки можно попытаться распознать липому бронха по ее характерной низкой «жировой» плотности (-60…-90 единиц Хаунсфилда в зависимости от доли жира в структуре образования) (рис. 31, 32).
Рис. 27. Гистологически подтвержденная липома, расположенная в верхней доле левого легкого в виде округлого субплеврального образования с четкими контурами и больших размеров
Рис. 28. Гистологически подтвержденная липома бронха
Рис. 29. Эндобронхиально липома главного бронха слева
Рис. 30. Бронхоскопически резецированная липома
Рис. 31. Осевая КТ показала неоднородную массу в правом главном бронхе (липома)
Рис. 32. Эндоскопически мягкая масса с неровной поверхностью в правом главном бронхе (липома)
К редким доброкачественным опухолевидным поражениям легких, представленным конгломератом разросшихся и анастомозирующих кровеносных сосудов мезодермального происхождения, относится ангиома легкого. Ангиомы легких представляют собой сборную группу сосудистых новообразований. Сюда относят: ангиоэндотелиому, капиллярную и кавернозную гемангиому. Сосудистые опухоли легких (гемангиоэндотелиома, гемангиоперициома, капиллярная и кавернозная гемангиома, лимфангиома) составляют 2,5-3,5% всех доброкачественных образований данной локализации. Сосудистые опухоли легких могут образовываться периферически и центрально. Все они макроскопически округлой формы, плотной или плотноэластической консистенции и окружены соединительнотканной капсулой. Цвет опухоли варьирует от розоватого до темно-красного, а размеры – от нескольких миллиметров до ≥20 см. Локализация сосудистых опухолей в крупных бронхах вызывает кровохарканье или легочное кровотечение. В целом клиническая симптоматика варьирует от умеренных простудных симптомов, респираторного дистресса, цианоза и плеврального выпота до кровохарканья [36].
Таким образом, эти опухоли не дают характерной клинической картины и рентгеновских признаков, когда выявляется округлая тень с четкими контурами (рис. 33) [37]. Поэтому окончательно диагноз устанавливается лишь после гистологического исследования.
Структура ткани гемангиомы изменена за счет наличия опухолевых изменений. Опухолевые клетки – среднего размера и имеют округлые, овальные или слегка вытянутые ядра с сетчатым хроматином, центрально расположенными незаметными ядрышками и небольшим ободком эозинофильно окрашенной цитоплазмы. Границы клеток нечеткие. Клетки образуют папиллярные структуры, которые располагаются на границе между гемангиоматозными очагами и очагами кровоизлияний. Опухолевая ткань покрыта слоем кубоидальных или плоских клеток. Прилежащая к опухоли паренхима легких сдавлена, однако капсулы опухоль не имеет. Процесс распространен.
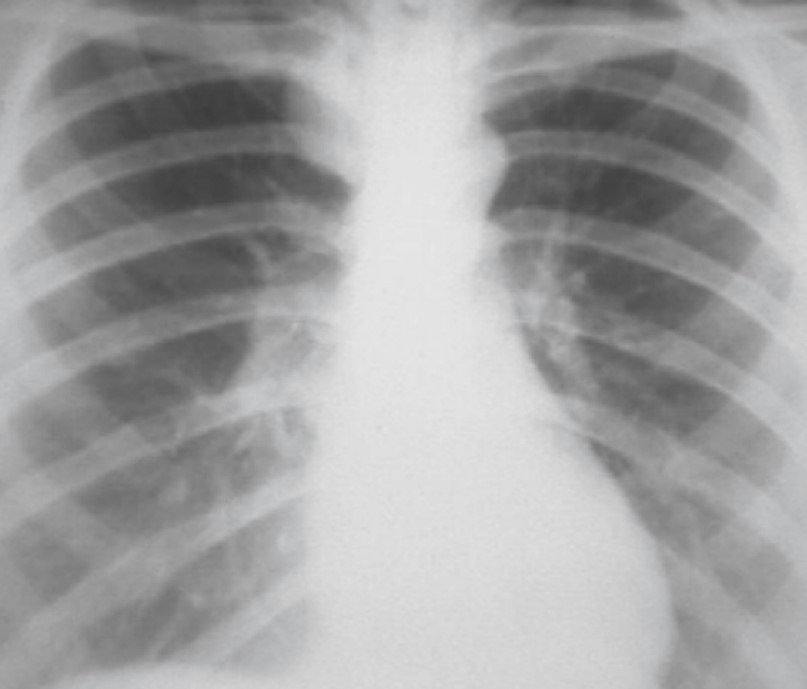
Рис. 33. Периферическая субплевральная лимфангиома справа
Клинический случай
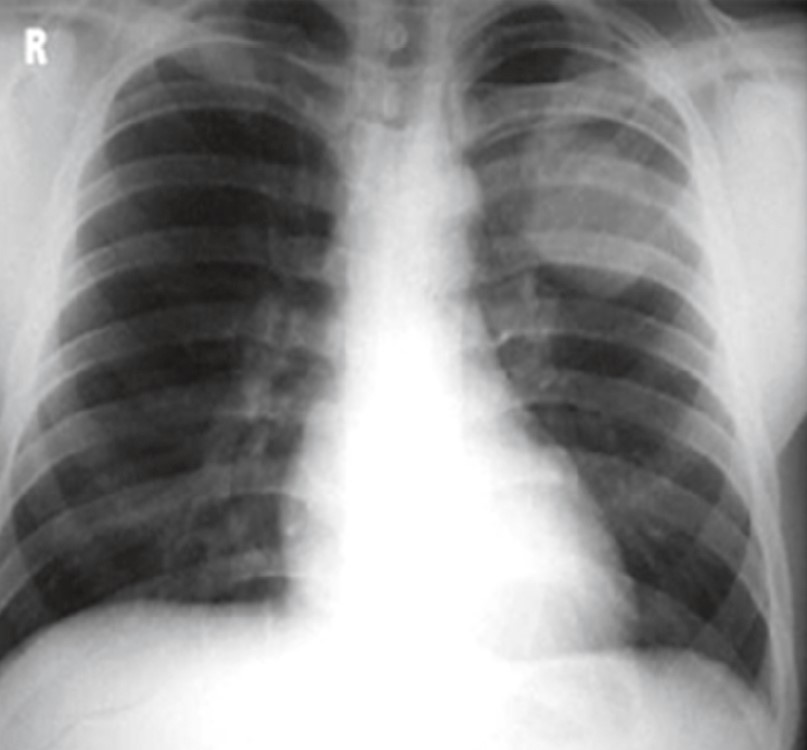
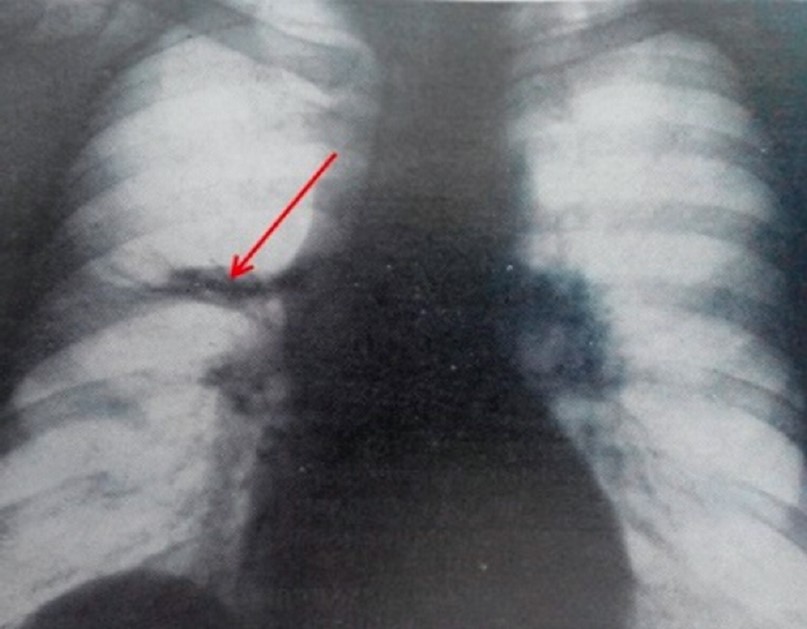
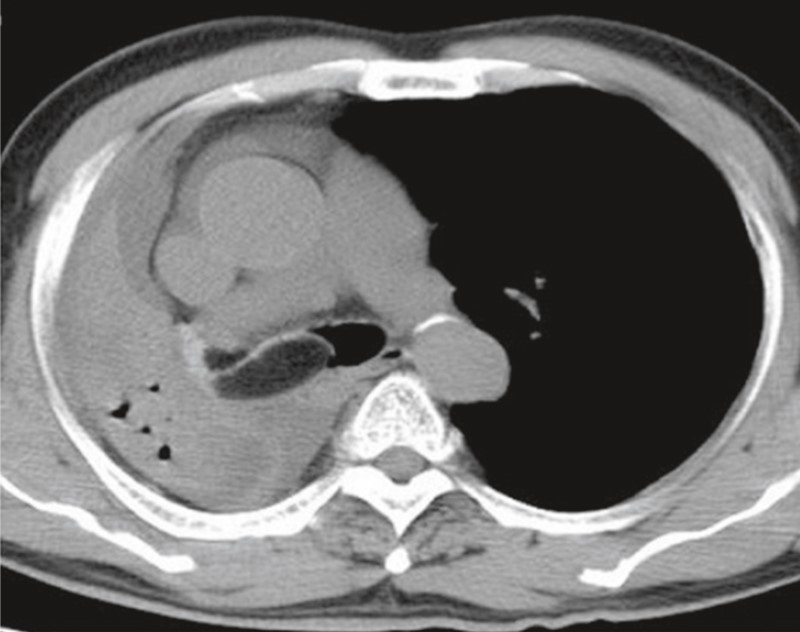
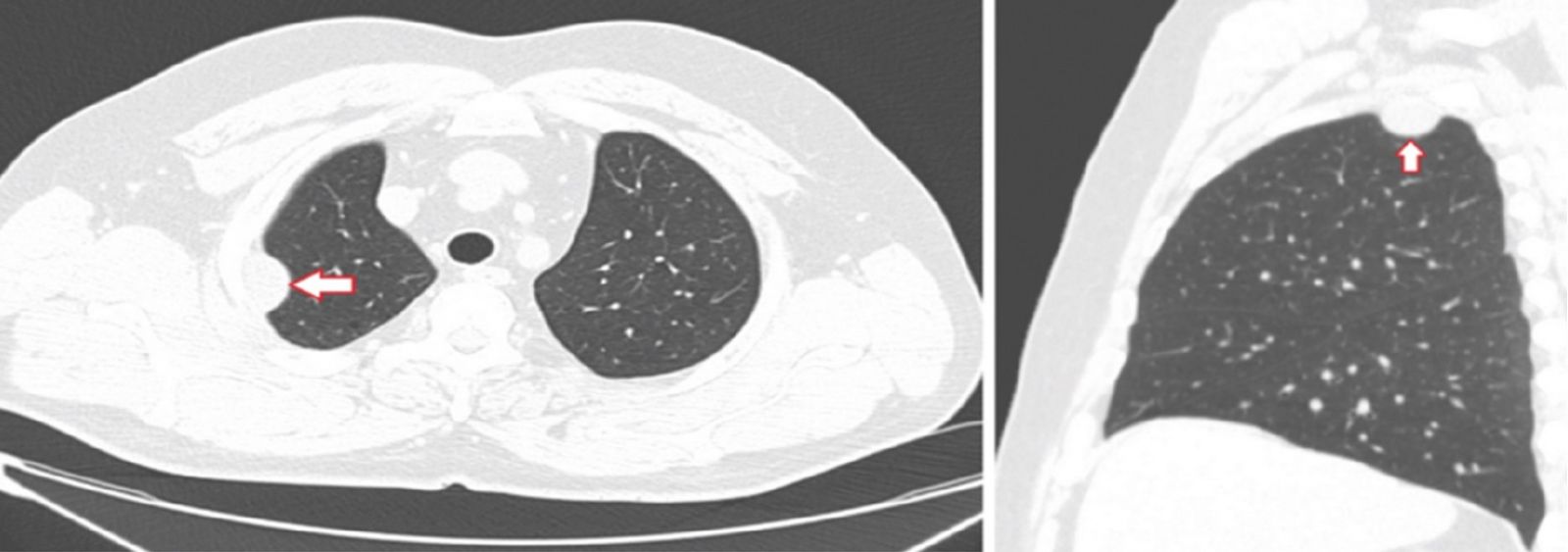
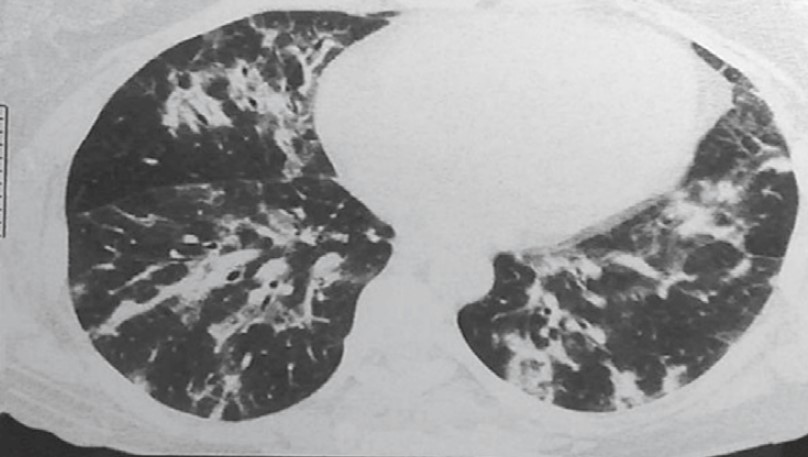
45-летняя женщина с 10-летней историей курения, работает в школе. Без каких-либо других существенных прошлых медицинских историй при плановой флюорографии ОГК выявлен узелок в левой нижней доле легкого. Во время клинического наблюдения в нашем учреждении обнаружен легочный узелок левой нижней доли размером 1 см в наибольшем измерении с нерегулярными границами и центральным ослаблением интенсивности тени, что наводит на мысль о наличии кистозного компонента. При КТ (рис. 34) не было обнаружено уровня жидкости, что указывало бы на кавитацию или некроз. Это образование тесно связано с межлобулярной перегородкой. Никаких определенных дренирующих сосудов не выявлено. Этот легочный узелок оказался стабильным по размеру и внешнему виду в течение 9 месяцев. Не было никаких клинических или рентгенологических данных, свидетельствующих о легочной гипертензии.
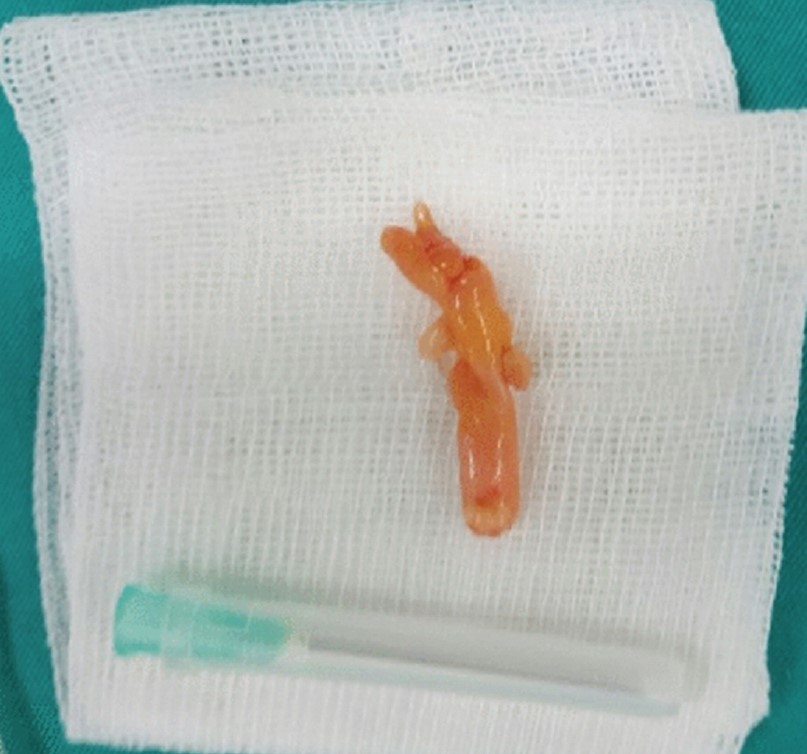
Принимая во внимание нерегулярные границы этого узла на КТ и историю курения, была проведена трансторакальная биопсия легкого под контролем КТ, чтобы исключить возможность злокачественного процесса. Исследование осложнилось значительным, но быстро прошедшим кровохарканьем (рис. 35).
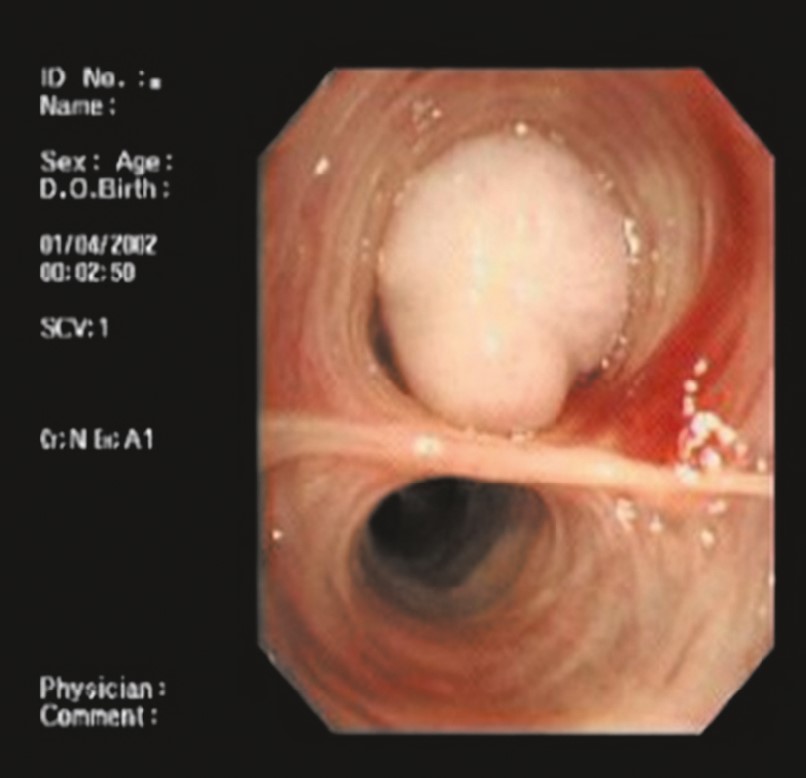
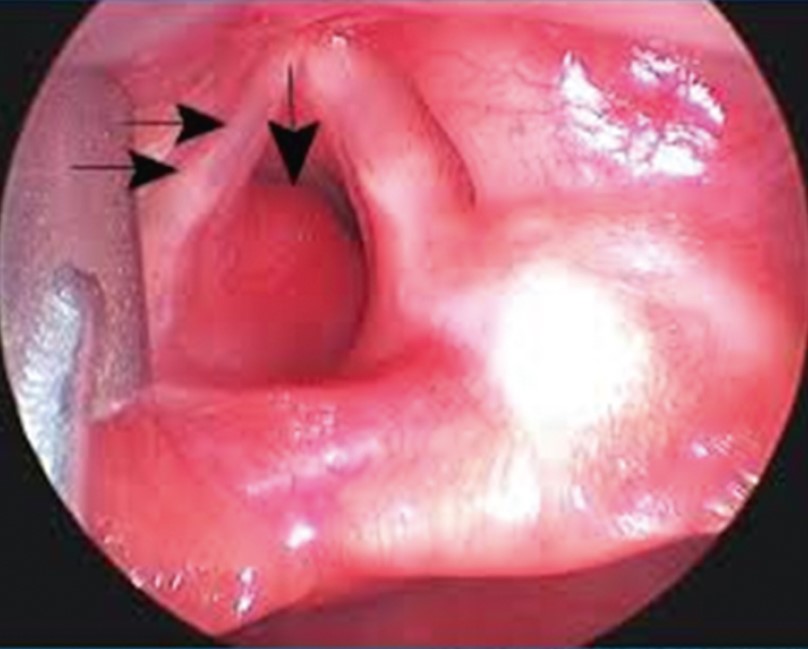
На основании гистоморфологических особенностей и ФБС (рис. 36), наряду с клиническими и рентгенологическими данными, был поставлен диагноз «одиночная легочная капиллярная гемангиома».
Рис. 34. КТ-изображения в саггитальной (А) и фронтальной (В) плоскостях показывают одиночный легочный узелок нижней доли левого легкого, длиной 1,0 см, с нерегулярными границами и центральным ослаблением интенсивности тени (стрелка)
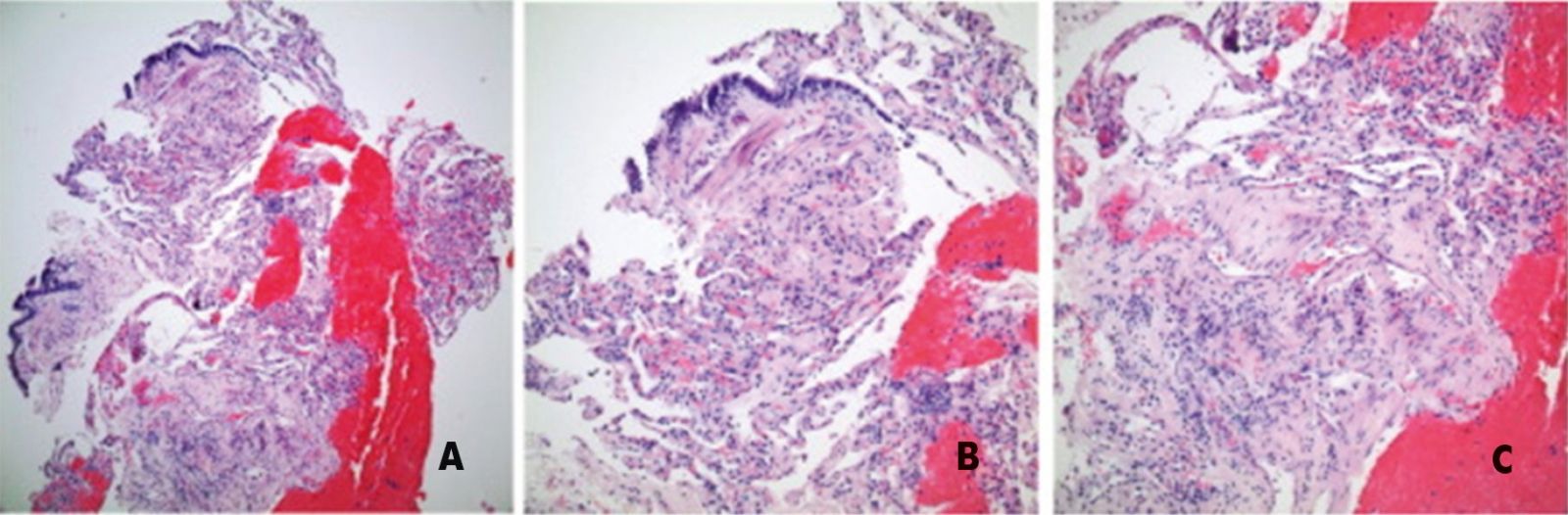
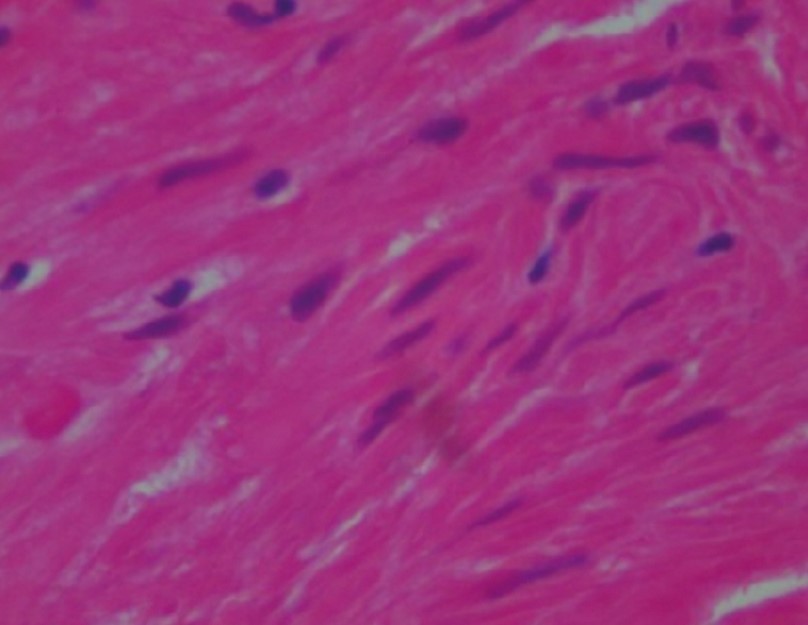
Рис. 35. Капиллярные разрастания примыкают к бронховаскулярным пучкам (A). Очевидной вовлеченности или инвазии бронхиальной (B) или сосудистой (C) стенки не выявляется
Рис. 36. Эндоскопически бронхиальная гемангиома
Нейрогенные опухоли легких, бронхов и грудной стенки развиваются из клеток оболочек нервов [38]. В легких наблюдаются невриномы и нейрофибромы (шваннома, нейринома и др.). Могут одновременно располагаться в обоих легких и имеют периферическую локализацию (рис. 37).
Растут нейрогенные (неврогенные) опухоли легких обычно медленно. Макроскопически представляют собой округлые плотные узлы с выраженной капсулой. На разрезе имеют серовато-желтый цвет. Структура ткани изменена за счет наличия опухолевых разрастаний. Опухоль состоит из фасцикулярных структур, представленных шванновским синтицием (леммоциты). Наблюдается беспорядочное расположение клеток, наличие веретенообразных клеток с палочковидными ядрами, между которыми расположены тонкие аргирофильные волокна (тельца Верокаи) (рис. 38). Процесс распространен. Заключение: невринома легкого.
На рентгенограммах и при КТ ОГК невриномы обычно имеют субплевральную локализацию и могут быть доброкачественными (нейрофиброма) и злокачественными (нейробластома) (рис. 39).
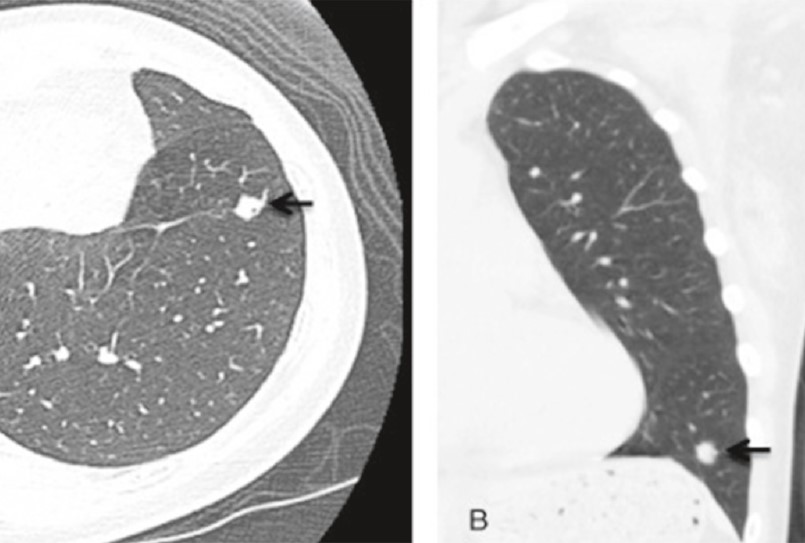
К редким ДОЛ, состоящим из гладкой мышечной ткани, относится лейомиома [39]. Чаще всего лейомиомы локализуются в легочной паренхиме, чрезвычайно редко – казуистические случаи – эндобронхиально (рис. 40) [40]. На рентгенограммах лейомиома легкого дает тень с четкими контурами, однородной структуры, форма и размеры которой весьма вариабельны. При КТ грудной клетки лейомиома выглядит как солидный очаг мягкотканной плотности с однородной структурой (рис. 41).
То есть по данным рентгенографии и КТ легких нельзя достоверно дифференцировать лейомиому с периферическим раком легкого, необходима биопсия и гистологическое исследование (рис. 42, 43).
Рис. 37. Невринома верхнего средостения справа
Рис. 38. Гистологически невринома легкого
Рис. 39. КТ ОГК, легочное электронное окно. Невринома грудной стенки справа.
Визуализируется объемное образование с закругленным краем, однородной плотности, исходящее из тканей грудной стенки. Гистологически диагноз невриномы подтвержден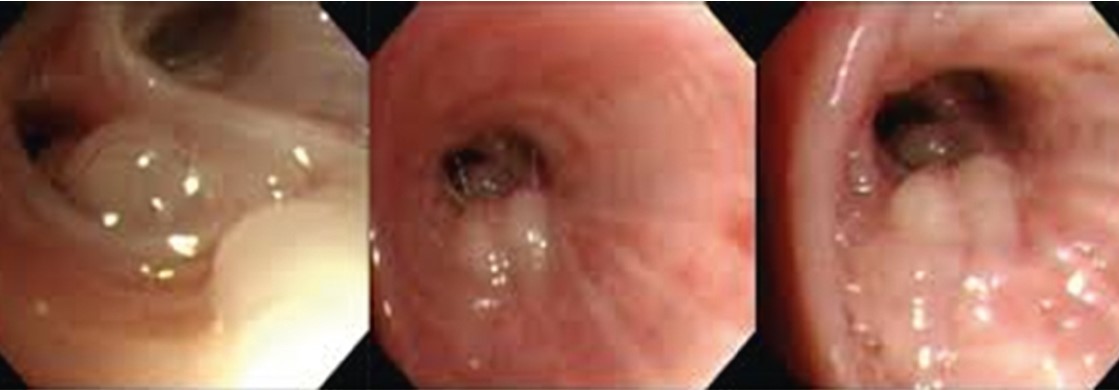
Рис. 40. Редкая доброкачественная опухоль бронхиального дерева: эндобронхиальная лейомиома
Рис. 41. Лейомиома верхней доли справа
Рис. 42. В нижних долях обоих легких центрилобулярные (фиброзы) и утолщение межальвеолярных перегородок; снижение воздушного пространства в виде матовых затемнений
Рис. 43. Подслизистая опухоль, состоящая из клеток, расположенных в виде пучков, мономорфных клеток с веретенообразными ядрами. Общая гистопатология соответствует лейомиоме
К доброкачественным сосудистым образованиям легких относят и артериовенозную мальформацию (АВМ), которая характеризуется патологической связью между венами и артериями. Эта патология, обычно врожденная, широко известна из-за ее возникновения в центральной нервной системе, но она может сформироваться в любом месте организма, например между легочным стволом и аортой (открытый артериальный проток) [41].
Генетическая предрасположенность к АВМ и факты передачи ее по наследству неизвестны. Считается, что АВМ – не наследственное заболевание. В АВМ чаще всего отсутствует капиллярная сеть, вследствие чего осуществляется прямое шунтирование крови из артериального бассейна в систему поверхностных и глубоких вен.
Артериовенозные мальформации легких (АВМЛ) являются аномальными соединениями между артериями и венами в легких. Они вызывают серьезные осложнения, такие как инсульт, абсцесс мозга, легочное кровотечение и ухудшение оксигенации, и относятся к висцеральной форме врожденных ангиодисплазий с поражением сосудистой системы легких эмбриона. Принципиально важным является тот факт, что процесс формирования порока развития может происходить на всех этапах эмбрионального развития легкого. Морфологические критерии пороков развития легкого определяются степенью и уровнем недоразвития элементов легкого, в том числе и сосудов малого круга кровообращения, а также развивающимися на этом фоне патологическими изменениями.
АВМЛ – это персистирующие раннеэмбриональные связи легочной артерии и вены на уровне прекапиллярного кровотока, существовавшие в рамках эмбрионального легочного сосудистого сплетения. Сочетание АВМЛ с болезнью Ослера-Рандю-Вебера лишний раз свидетельствует в пользу ее врожденного генеза. Так, С.Н. Hodson и H.B. Burchell среди 91 больного с болезнью Ослера-Рендю-Вебера обнаружили АВМЛ у 15% пациентов, причем 6% являлись членами одной семьи. Ряд авторов отметили множественность мальформаций в легких и печени, так называемый гепато-пульмональный синдром, а также – в мозге, поджелудочной железе, почках и других органах (рис. 44-47).
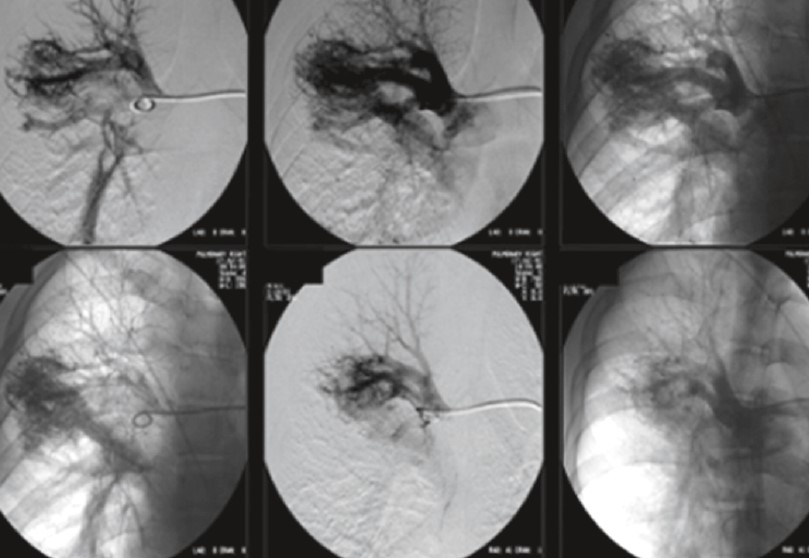
Рис. 44. АВМ верхней доли правого легкого с сосудистой дорожкой к правой легочной артерии
Рис. 45. АВМ верхней доли справа с сосудистой дорожкой к правой легочной артерии
Рис. 46. АВМ нижней доли слева с сосудистой дорожкой в нижнюю полую вену
Рис. 47. КТ ОГК: АВМ нижней доли слева с сосудистой дорожкой в нижнюю полую вену
Гломусная опухоль (гломангиома, гломусная ангиома) развивается из артериовенозных анастомозов гломусного типа (уха, шеи, ногтевой фаланги, луковицы яремной вены и др.). Первое сообщение о гломусной опухоли принадлежит W. Wood, описавшему в 1812 г. своеобразные подкожные образования («бугорки»), отличающиеся выраженной болезненностью. Позднее, в 1920 г., невропатолог J. Barre и в 1924 г. морфолог P. Masson подробно изучили гистологическое строение и клиническую картину новообразования, которое впоследствии получила название «опухоль Барре-Массона». В легких она встречается крайне редко и описывается лишь в виде единичных наблюдений. Опухоль, как правило, доброкачественная и представляет собой четко отграниченный капсулой мелкий узелок или узел диаметром до нескольких сантиметров, от мягкой до плотной консистенции, на разрезе розоватого или серовато-белого цвета. Гистологически представлена в основном узкими кровеносными сосудами и разрастающимися между ними диффузно или в виде периваскулярных муфт мономорфных клеток эпителиоидного типа, напоминающих гломусные клетки, входящие в состав кожных гемогломусов, главным образом эпителиоидного эндотелиального утолщения (канала Суке-Гойера). Наряду с сосудами в состав опухоли могут входить и пучки мышечных волокон, а также многочисленные нервные стволики.
Большая группа неопухолевых или сомнительных опухолевых поражений, представляющих для хирургов практический интерес вследствие их сходства с истинными новообразованиями легких и необходимости в ряде случаев выполнения больным оперативного лечения, представлена опухолеподобными образованиями. Гистологическая классификация ВОЗ включает в эту группу отграниченные поражения легких, возникающие при ряде воспалительных, лимфопролиферативных, диссеминированных процессов, пневмомикозах, паразитарных и других заболеваниях [42].
Из всех опухолеподобных поражений наиболее сходны с ДОЛ по клиническим проявлениям, течению заболевания, применяемым методам диагностики и лечения воспалительные псевдоопухоли и склерозирующая гемангиома [43].
Воспалительные псевдоопухоли – это опухолевидные образования неизвестной этиологии, описываемые в литературе под названиями плазмоклеточная гранулема, гистиоцитома, ксантома, ксантогранулема и др. Возникают, как правило, в очагах длительно существующего воспалительного процесса. Встречаются редко, чаще у женщин, чем у мужчин, в любом возрасте. Локализуются обычно в периферических отделах легких, реже – в прикорневой области, иногда достигают значительных размеров. Часто протекают бессимптомно, а при наличии симптомов последние, как правило, не отличаются какой-либо специфичностью. Рентгенологически выявляется четко отграниченное округлое затемнение. Значительно реже псевдоопухоль бывает расположена в бронхе. Диагноз обычно ставится при гистологическом исследовании биоптата.
Гистологическая картина воспалительных псевдоопухолей характеризуется разрастанием различных элементов соединительной ткани с диффузной или очаговой инфильтрацией плазматическими клетками и разнообразным соотношением лимфоцитов, гистиоцитов, лаброцитов. Для гистиоцитом и ксантом характерно наличие значительного количества гистиоцитов, которые согласно современным представлениям возникают в костном мозгу из особых клеток – предшественников. Последние, попадая в кровь, превращаются в моноциты. Из крови они проникают в ткани, где и становятся гистиоцитами. В особых функциональных условиях эти клетки превращаются в макрофаги. Обилие сосудов, гистиоцитарных и фибробластоподобных клеток, а также гигантских клеток Тутона, находящихся в различных количественных взаимоотношениях и разном функциональном состоянии, и обусловливает микроскопическую картину гистиоцитом и ксантом.
Гистиоцитома состоит преимущественно из гистиоцитов, фибробластов и многочисленных сосудов. Встречаются гигантские клетки Тутона.
Ксантома – понятие собирательное, включающее в себя группу соединительнотканных, реже эпителиальных, образований, клетки которых содержат холестеринэстеры, нейтральные жиры, железосодержащий пигмент, что придает им желтовато-бурый цвет. Микроскопически состоят из заполненных жиром гистиоцитов, клеток воспаления и коллагеновых волокон.
Плазмоцитарная гранулема является наиболее обычной разновидностью воспалительной псевдоопухоли. Развитие ее связывают с иммунными нарушениями, расстройствами белкового обмена. Микроскопически образование представлено разрастанием фиброзной ткани с инфильтрацией типичными плазматическими клетками, часто с отложением амилоида. Могут встречаться очаги некроза, обызвествления и оссификации, наличие полостей. Плазмоцитарную гранулему следует дифференцировать от первичной легочной плазмоцитомы, отличающуюся инфильтративным ростом и склонностью к генерализации процесса.
Склерозирующая гемангиома (СГ) – редкое опухолевидное образование, встречающееся в возрасте 20-60 лет, у женщин чаще, чем у мужчин, в соотношении 2:1. Название было предложено A.A. Liebow и D.S. Hubbel (1956), которые полагали, что в основе морфогенеза СГ лежит первичная сосудистая пролиферация. Однако в настоящее время установлено, что традиционное название не соответствует сущности процесса. Единых взглядов на гистогенез СГ нет. Высказываются мнения о том, что она является гамартомой, эпителиоидной формой мезотелиомы легкого, развивается из легочного эпителия и др. [44].
Опухоль, как правило, располагается в периферических участках легкого, выступая иногда над поверхностью легкого или в междолевой щели. Может иметь «ножку», связывающую ее с поверхностью легкого. Очень редко вовлекает стенку бронхов. Чаще локализуется в правом легком. Макроскопически представляет собой плотный или очень плотный узел диаметром 2-4 см, на разрезе серовато- или розовато-белого, иногда темно-красного цвета, часто с участками кровоизлияний (рис. 48).
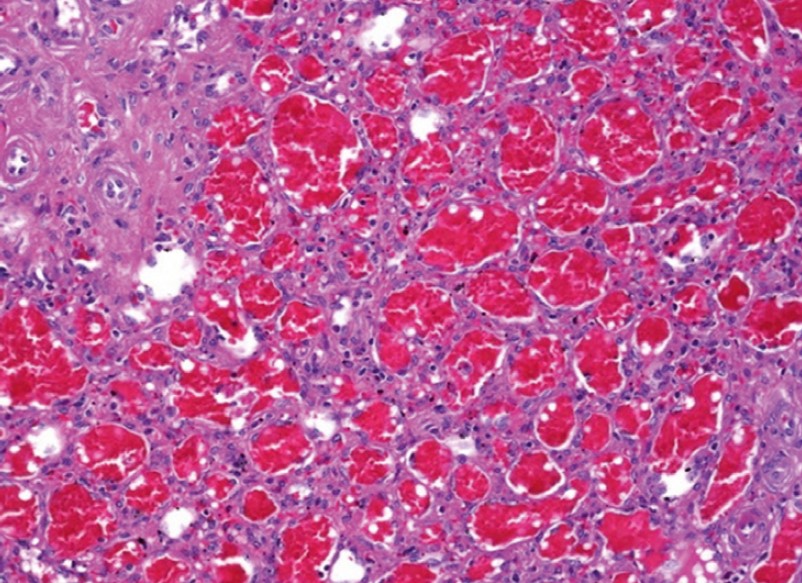
Гистологическая картина СГ на ранних стадиях ее развития обычно бывает представлена разрастанием недифференцированных мезенхимных клеток межальвеолярных перегородок в виде сосочковых выступов, покрытых кубическим альвеолярным эпителием. В них содержатся капилляры и сосуды синусоидного типа. Позднее развивается фиброз сосочковых структур с увеличением их в размерах, сдавлением капилляров и атрофией покрывающего эпителия. Коллагеновые волокна могут подвергаться гиалинозу. Иногда встречается ангиоматоз, часто сопровождающийся кровоизлияниями, рассеянные лимфоциты и плазматические клетки, кристаллы холестерина (рис. 49). Могут наблюдаться очаги некроза и обызвествления.
Хемодектомы, или нехромаффинные (т.е. гормонально неактивные) параганглиомы, – доброкачественные опухоли, развивающиеся из клеток хеморецепторов или хеморецепторных телец. В легких встречаются чрезвычайно редко – в литературе имеются лишь единичные описания наблюдений хемодектом легких. Впервые опубликовал наблюдение внутрилегочной хемодектомы в 1958 г. A. Heppleston. Микроскопически опухоль представляет собой железистые дольки, крупные полигональные клетки которых содержат ацидофильную протоплазму с нежными зернышками. Между дольками имеются соединительнотканные перегородки, в которых проходят многочисленные сосуды.
ДОЛ встречаются редко и могут быть диагностически сложными. Обычно они протекают бессимптомно и не представляют серьезной проблемы для здоровья и прогноза. Большинство ДОЛ требует только наблюдения. В этом случае врач, скорее всего, посоветует больному выжидательную тактику и динамическое наблюдение в течение месяцев или лет за формой и размером образования. Однако при современных методах диагностики (трансбронхиальная биопсия, трансторакальная биопсия, позитронно-эмиссионная томография, фибробронхоскопия и др.) выжидательная тактика неоправданна, так как ни один из лучевых методов диагностики не говорит об этиологии. Поэтому цель указанных методов диагностики, да и хирургического вмешательства в случае ДОЛ – не пропустить потенциально злокачественных поражений.
Рис. 48. КТ и прицельная рентгенограмма ОГК нижних отделов легких. Множественные полиморфные очаговые тени преимущественно в нижних долях обоих легких
Рис. 49. Ангиоматоз – это избыточное разрастание кровеносных сосудов различного калибра
Литература
- Keith R.L. MD, Overview of Lung Tumors. Division of Pulmonary Sciences and Critial Care Medicine, Department of Medicine, Eastern Colorado VA Healthcare System, University of Coloradо Last full review/revision Mar 2018| Content last modified Mar 2018.
- By Lynne Eldridge, MD, Medically reviewed by Doru Paul, MD Multiple Lung Nodules: Causes and Diagnosis Multiple pulmonary nodules can be benign or malignant. Updated on November 10, 2019.
- Cecilia Pacheco, Hans Dabo, Gabriela Fernandes, Pedro Bastos, Adriana Magalhaes. Benign lung tumors: Presentation, diagnosis, and outcome. European Respiratory Journal 2013 42: P4522.
- Крутько В.С., Потейко П.И., Ходош Э.М. Рак легких: наружные симптомы /В.С. Крутько, П.И. Потейко, Э.М. Ходош / Учебное пособие. – Х.: Новое слово, 2010. – 64 с.
- Abraham J., Allegra C.J. Handbook of Clinical Oncology. – Bethesda. By Lippincott Williams & Wilkins. – 2001 p. 3. Lieberman M.W., Lebovitz R.M. Neoplasia.
- Khouri N.F., Meziani M.A., Zerhouni E.A. et al. The solitary pulmonary nodule. Assessment, diagnosis and management. Chest. 1987;91:128-133.
- Тюрин И.Е. Одиночные очаги в легких: возможности лучевой диагностики [Текст]/ И.Е. Тюрин. – Атмосфера, 2* 2008. – С. 15-22.
- Ходош Э.М. Солитарные опухоли легких: возможности этиологической диагностики / Э.М. Ходош / Consilium Medicum, 2013, № 3. – С. 41-46.
- Leef J.L., Klein J.S. The solitary pulmonary nodule. Radiol Clin North Am 2002; 40:123-143.
- Diederch S., Hansen J., Wormanns D. Resolving small pulmonary nodules: CT features. Eur Radiol 2005; 15: 2064-2069.
- Павлов Ю.В., Рыбин В.К. Впервые выявленные очаговые образования легких малого размера (до 2 см в диаметре). Динамическое наблюдение или операция? Хирургия. Журнал им. Н.И. Пирогова. 2016; (10): 57-60.
- Льнянова З.И. Компьютерная томография высокого разрешения в диагностике туберкулеза легких. Автореферат диссертации на соискание ученой степени кандидата медицинских наук, 2006.
- Маневич В.Л., Стоногин В.Д., Богданов А.В., Макарова К.А., Ципельзон А.М. Аденомы бронхов, 2012, РМС. – С. 12 – 16.
- Рulmonary Carcinoid Tumorlets: A Rare Cause of Chronic Intractable Cough Tariq Sharman , Jeffrey Song American Journal of Medical Case Reports. 2019, 7(8), 173-175. DOI: 10.12691/ajmcr-7-8-6 Received May 17, 2019; Revised June 24, 2019; Accepted July 11, 2019.
- An Overview of Carcinoid Tumors of the Lung Symptoms, causes, diagnosis, and treatment By Lynne Eldridge, MD Medically reviewed by Doru Paul, MD Updated on June 24, 2019.
- Лукомский Г.И., Шелутко М.Л. и др. Бронхология [Текст]/Г.И. Лукомский, М.Л. Шелутко и др. М.: Медицина, 1973. – 360 с.
- Лукомский Г.И., Шелутко М.Л., Виннер М.Г., Овчинников А.А. Бронхопульмонология [Текст]/Г.И. Лукомский, М.Л. Шелутко, М.Г. Виннер, А.А. Овчинников. М.: Медицина, 1982. – 400 с.
- Крутько В.С., Потейко П.И., Ходош Э.М. Пульмонология: наружные симптомы /В.С. Крутько, П.И. Потейко, Э.М. Ходош/. – Харьков: НТМТ, 2011. –186 с.
- Marchevsky A.M., Walts A.E. Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia (DIPNECH). Semin Diagn Pathol. November 2015; 32(6):438-444. https://www.ncbi.nlm.nih.gov/pubmed/26472691.
- Wirtschafter E., Walts A.E., Liu S.T, Marchevsky A.M. Diffuse Idiopathic Pulmonary Neuroendocrine Cell Hyperplasia of the Lung (DIPNECH): Current Best Evidence. Lung. 2015 Oct;193(5):659-67. October 2015; 193(5):659-667. https://www.ncbi.nlm.nih.gov/pubmed/26104490.
- Rossi G., Cavazza A., Spagnolo P., Sverzellati N., Longo L., Jukna A., Montanari G., Carbonelli C., Vincenzi G., Bogina G., Franco R., Tiseo M., Cottin V., Colby TV. Diffuse idiopathic pulmonary neuroendocrine cell hyperplasia syndrome. Eur Respir J. June 2016; 47(6):1829-1841. http://erj.ersjournals.com/content/47/6/1829
- Chassagnon G., Favelle O., Marchand-Adam S., De Muret A., Revel MP. DIPNECH: when to suggest this diagnosis on CT. Clin Radiol. March 2015; 70(3):317-325. https://www.ncbi.nlm.nih.gov/pubmed/25465294.
- Seemal Mumtaz, MB, Maha Alkhuziem, MB, Jennifer Chow Grace Lin, MD, PhD James H. Harrell, MD Patricia A. Thistlethwaite, MD, PhD Multifocal Endobronchial Fibromas Presenting as Unilobar Emphysema doi:https://doi.org/10.1016/j.athoracsur.2014.11.011
- Трахтенберг А. Х., Чиссов В. И. Гамартома // Клиническая онкопульмонология. – М.:ГЭОТАР МЕДИЦИНА, 2000. – С. 86. – 600 с. – (Высокие технологии в медицине). – 1500 экз. – ISBN 5-9231-0017-7.
- Галански М. Лучевая диагностика. Грудная клетка /Михель Галански, Забине Деттмер, Марк Кеберле, Ян Патрик Оферк, Кристина Ринге; пер. с англ. – М.: МЕДпресс-информ, 2013. – 384 с. : ил.
- Oguma T., Takiguchi H., Niimi K., Tomomatsu H., Tomomatsu K., Hayama N., Aoki T., Urano T., Nakano N., Ogura G., Nakagawa T., Masuda R., Iwazaki M., Abe T., Asano K. Endobronchial Hamartoma as a Cause of Pneumonia (англ.) // The American Journal of Case Reports. – США: International Scientific Literature, Inc., 2014. – Vol. 15. – P. 388-392.– ISSN 1941-5923. – doi:10.12659/AJCR.890869. — PMID 25208559.
- Lee S. Y., Park H J., Lee C. S., Lee K. R. Giant pulmonary hamartoma (англ.) // European journal of cardio-thoracic surgery. — Великобритания: Elsevier Science, 2002. — Vol. 22, no. 6. – P. 1006. – ISSN 1010-7940. — doi:10.1016/S1010-7940(02)00579-1. – PMID 12467828.
- Dimitrakakis G., Challoumas D., Rama Rao Podila S., Mainwaring A. M., Kolettis T., Kornazewska M. The challenge of pulmonary endobronchial chondromatous hamartomas (англ.) // Journal of Balkan Union of Oncology. — Греция: Zerbinis Medical Publications, 2014. — Vol. 19, no. 1. – P. 60-65. – ISSN 1107-0625. – PMID 24659644
…
44. Потейко П.І., Шевченко О.С., Ходош Є.М. Склерозіруюча гемангіома легень ТУБЕРКУЛЬОЗ, ЛЕГЕНЕВІ ХВОРОБИ, ВІЛ-ІНФЕКЦІЯ № 3 (22) 2015.
Полный список литературы находится в редакции.
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (52), 2020 р.