12 листопада, 2020
Післяопераційні легеневі ускладнення
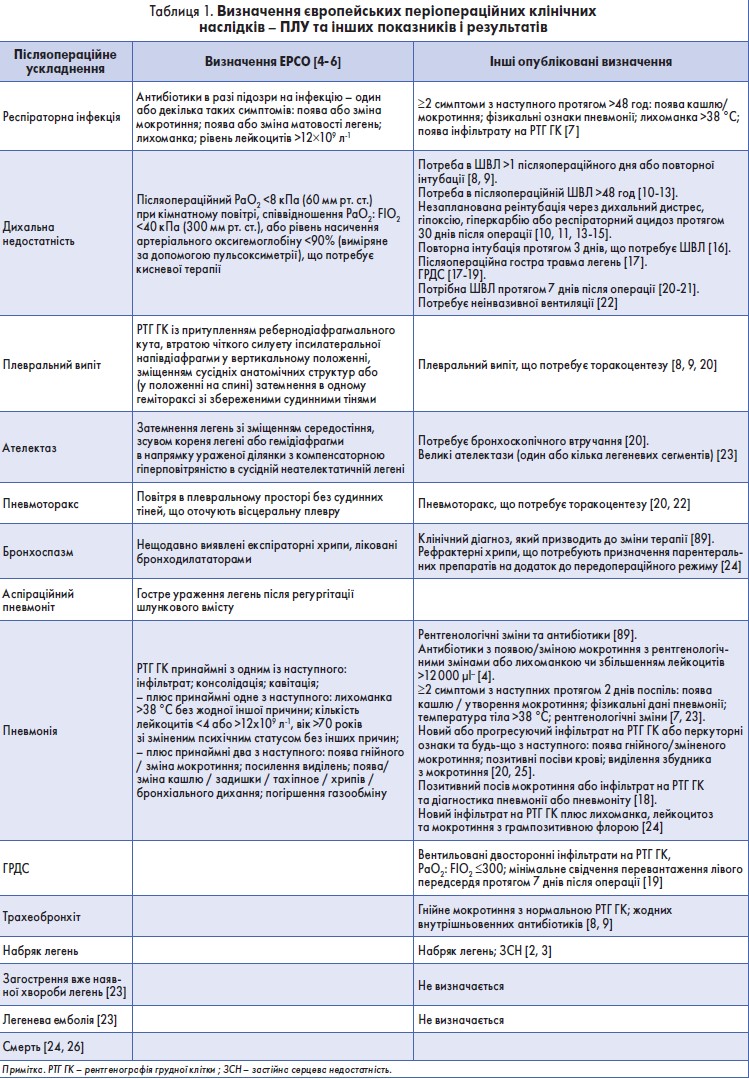
Термін «післяопераційне легеневе ускладнення» (ПЛУ) охоплює майже будь-яке ускладнення, яке вражає дихальну систему після наркозу та операції. Європейська робоча група періопераційного клінічного результату (EPCO) розглядає респіраторну інфекцію, дихальну недостатність, плевральний випіт, ателектаз, пневмоторакс, бронхоспазм та аспіраційний пневмоніт як багатокомпонентні події та визначають пневмонію, гострий респіраторний дистрес-синдром (ГРДС) і легеневу емболію як окремі несприятливі наслідки.
Для визначення ПЛУ також використовують Міжнародну класифікацію хвороб 9-го перегляду (МКХ‑9).
За даними медичної статистики, щороку у світі проводять >230 млн основних операційних втручань. Частота виникнення ПЛУ після великих хірургічних операцій коливається від 1 до 23%. Декілька досліджень показали, що легеневі ускладнення виникають частіше, ніж серцеві, а післяопераційна дихальна недостатність є найпоширенішим ПЛУ (табл. 1).
Смертність збільшується як у короткостроковій, так і в довгостроковій перспективі в пацієнтів, в яких розвивається ПЛУ. Кожен 5-й пацієнт (14-30%) із ПЛУ помирає протягом 30 днів після серйозної операції проти 0,2-3% хворих без ПЛУ. Показано, що 90-денна смертність значуще зросла в осіб із ПЛУ: 24,4 проти 1,2%. Спостережне дослідження двох великих баз даних показує довгострокові суттєві відмінності в показниках смертності з/без ПЛУ: 45,9 проти 8,7% за рік або 71,4 проти 41,1% за 5 років. Унаслідок ПЛУ росте також захворюваність. Крім того, доведено, що тривалість перебування в лікарні збільшується на 13-17 днів.
Патофізіологія виникнення ПЛУ
Інтраопераційні зміни дихальної системи
Негативні легеневі ефекти загальної анестезії (ЗА) починаються відразу після втрати пацієнтом свідомості. Інтенсивність сигналу дихального центру пригнічена, що спричиняє тривале апное з подальшим поверненням спонтанної вентиляції з дозозалежним зменшенням хвилинної вентиляції. Вентиляційна реакція на гіперкапнію та гіпоксію суттєво погіршується навіть при низьких дозах знеболювальних препаратів. Як результат, гіперкапнія є нормою, якщо не застосовується штучна вентиляція легень (ШВЛ), і тяжка гіпоксемія виникає, якщо вентиляція порушена, наприклад, обструкцією дихальних шляхів (ДШ).
Функція дихальних м’язів змінюється відразу після ввідного наркозу. Відбувається обструкція ДШ, збільшення кривизни хребта, зміщення купола діафрагми і зменшення площі поперечного перерізу грудної стінки. Ці зміни кінцевого експіраторного тонусу м’язів відбуваються незалежно від того, чи отримує пацієнт нейро-м’язеві блокатори (НМБ), і призводять до зменшення функціональної залишкової ємності (ФЗЄ) на 15-20%, якщо порівняти з об’ємом у положенні лежачи на спині. Зниження ФЗЄ, паралельно з аномальним розподілом вентиляції під час переривчастої вентиляції з позитивним тиском та зменшенням серцевого викиду, веде до змін взаємозв’язку перфузії-вентиляції (V/Q). Хоча загальна вентиляція та перфузія особливо не змінені, є збільшені зони як високих, так і низьких коефіцієнтів V/Q. Перші ведуть до альвеолярного мертвого простору та подальшого погіршення виведення вуглекислого газу, другі – до порушення оксигенації.
Більш значущим ефектом зменшення об’єму легень як прояву ПЛУ є розвиток ателектазів. Це відбувається в більш як 3/4 пацієнтів, які отримують ЗА із залученням НМБ [40], і це можна помітити на комп’ютерній томографії (КТ) незалежно від положення пацієнта. Фізіологічні фактори, що спричинюють формування ателектазів, включають пряме здавлення легеневої тканини, наприклад зміщеною діафрагмою, закриття ДШ, коли ФЗЄ зменшується нижче закриваючого об’єму, і швидке всмоктування газів з альвеол у легенях, де ДШ звужені або закриті. Останній із цих факторів посилюється в разі використання високофракційного вдихуваного кисню (FIO2), особливо при значеннях 1,0. Наприклад, преоксигенація з FIO2 1,0; 0,8 або 0,6 призводить до 5,6%, 1,3% та 0,2% ателектазів відповідно на КТ через кілька хвилин після ввідного наркозу. Незважаючи на ці різкі зміни при ввідному наркозі, немає жодних доказів того, що використання «гіпероксії» (зазвичай FIO2 0,8) протягом ЗА провокує збільшення ателектазів після операції. Це свідчить про те, що навіть 20% азоту у вдихуваному газі допомагає запобігти альвеолярному колапсу. Стратегії, які можуть бути використані для мінімізації ателектазів, передбачають уникання застосування 100% кисню та підтримання помірного рівня позитивного тиску в ДШ під час видиху для забезпечення їх прохідності. Після того як відбувся ателектаз, для його повторного розширення потрібні відновні маневри. Ці фізіологічні зміни функції дихання в більшості випадків легко піддаються регулюванню під час звичайної ЗА. Однак цілком імовірно, що зміни на ранніх стадіях ЗА становлять патофізіологічну основу для подальших ПЛУ в пацієнтів із групи ризику, зокрема в осіб старшого віку із супутньою серцево-респіраторною патологією, яким проведено «велике» оперативне втручання (major surgery).
Післяопераційна патофізіологія органів дихання
Зміни у відділенні післяопераційного догляду
Гіпоксія – це поширена проблема відділень післопераційного догляду (ВПД). Причинами епізодів десатурації може стати безліч взаємодіючих факторів:
- Обструкція ДШ, яка виникає в багатьох пацієнтів.
- Продовження седації через залишкові анестетики та опіоїдні препарати або гіперкапнію, пов’язану з продовженням депресії центрального дихання.
- Залишкові наслідки НМБ. Навіть коли звичайний клінічний та кількісний моніторинг нервово-м’язових з’єднань свідчить про адекватне відновлення, НМБ все ще можуть погіршити дихальну функцію.
- Порушення вентиляторної відповіді на гіперкапнію та гіпоксію.
Знижена ФЗЄ та порушення оксигенації, які часто спостерігаються під час анестезії, зазвичай повертаються до норми протягом декількох годин після незначних оперативних втручань. Але не після «великих» операцій. Ателектаз все ще присутній в пацієнтів ВПД. Ателектаз на КТ через 24 год після операції також частіше спостерігається в пацієнтів з ожирінням [50]. Подальші непрямі докази ателектазу можна отримати шляхом вимірювання оксигенації, найлегше це зробити за різницею альвеолярного-до-артеріального кисню (Alveolar-arterial gradient – A-aO2), яка залишається значуще підвищеною через годину після екстубації в пацієнтів, що перенесли велику операцію.
Зміни дихання за межами ВПД
Після великої операції на відновлення нормального градієнту A-aO2 може потребуватися кілька днів, і епізоди гіпоксемії є частими. Після операцій в епігастрії ФЗЄ зазвичай досягає найнижчого значення через 1-2 дні після операції, а через 5-7 днів повільно повертається до нормальних значень. Як уже зазначалося, ателектаз, що спостерігався на КТ під час анестезії, зберігається принаймні протягом 24 год у більшості пацієнтів після великих оперативних втручань.
Залежні від зусиль функціональні показники легень, такі як форсована життєва ємність легень (ФЖЄЛ), форсований об’єм видиху за 1-шу секунду (ФОВ1) та пікова швидкість видиху, значно зменшуються після операції, особливо якщо пацієнт відчуває біль. Після великих операцій порушується нормальна активність більшості груп дихальних м’язів, зокрема м’язів ДШ, живота та діафрагми. Фактори, які призводять до цієї дисфункції, включають анестетики та НМБ, післяопераційні знеболювальні препарати (особливо опіоїди), біль, порушення режиму сну та запальну реакцію на операцію. Етіологія є більш комплексною, ніж звичайна м’язова слабкість, і включає також погану координацію між групами м’язів, порушення нормальних фізіологічних рефлексів та механізмів контролю, від яких залежить їх діяльність.
Після операції часто спостерігається затримка мокротиння. Загальна анестезія, зокрема використання трахеальної трубки, спричиняє порушення мукоциліарного транспорту в ДШ, яке може зберігатися і в післяопераційному періоді.
Ця комбінація зниженого ФЗЄ, залишкових ателектазів, неефективного кашлю та ненормального дихального контролю створює ідеальну ситуацію для розвитку ПЛУ.
Передопераційне визначення ризику розвитку ПЛУ
За останні 5 років було опубліковано багато моделей прогнозування ПЛУ, більшість з яких мають обмеження, оскільки є ретроспективними, зосередженими на якомусь одному ускладненні. Тому єдиної моделі для визначення ризику розвитку ПЛУ немає.
Серед проспективних багатоцентрових досліджень ми виділимо 3 пов’язані моделі прогнозування ризику.
ARISCAT (оцінка респіраторного ризику в хірургічних пацієнтів у Каталонії) – модель регресії із 7 змінними, поділ пацієнтів на групи з низьким, середнім та високим ризиком. Незалежними змінними є низька передопераційна периферична насиченість киснем (SpO2; <96%), респіраторна інфекція за останній місяць, вік, передопераційна анемія (<100 г дл/1), операція в грудній порожнині або епігастрії, тривалість операції (>2 год) і стан її ургентності.
PERISCOPE (проспективна оцінка ризику розвитку післяопераційних легеневих ускладнень в Європі), на базі ARISCAT. Однак незалежні змінні дещо відрізняються від тих, що знайдені в ARISCAT: низький передопераційний SpO2, принаймні один передопераційний респіраторний симптом, хронічне захворювання печінки, ЗСН, операція в грудній порожнині або епігастрії, тривалість операції (>2 год) і стан її ургентності.
Інше проспективне багатоцентрове дослідження з невеликим обсягом вибірки зосередилося саме на стратифікації пацієнтів з операціями в епігастрії [28]. Ці дослідження підкреслюють складність вибору відповідної моделі прогнозування ризику. Але, попри те що вони, безсумнівно, удосконалили наше розуміння того, які групи пацієнтів сприйнятливі до розвитку ПЛУ, відсутність спільних результатів та складність бальних систем роблять згадані випробування непрактичними для рутинного клінічного використання.
Кому загрожує розвиток ПЛУ?
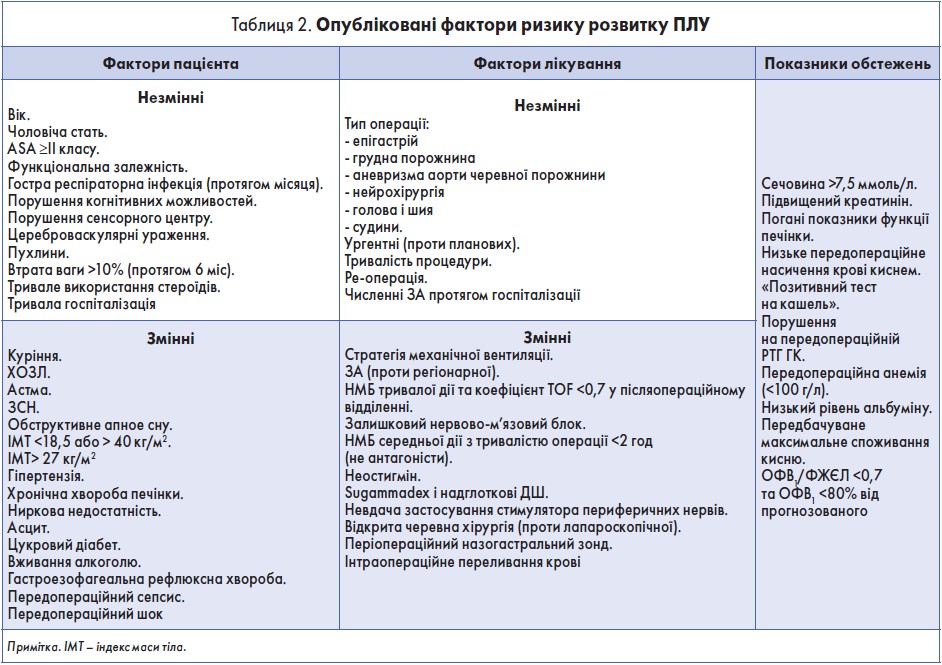
Численні опубліковані фактори ризику, які можуть спричинити розвиток ПЛУ, наведені в таблиці 2. Одні з них пов’язані з пацієнтом, інші – з тою чи іншою процедурою або лабораторним тестуванням (Smetana et al.). У нашому огляді більш детально обговорюються лише найбільш клінічно значущі та незалежні чинники.
Вік
Більш старший вік, особливо за умови супутньої патології. У результаті численних досліджень фактор віку становить понад 60 або 65 років. Більш детальна вікова стратифікація показує – зі збільшенням віку ризик розвитку ПЛУ підвищується.
Тип хірургічного втручання
Високим є ризик розвитку ПЛУ після певних типів операцій, наприклад на черевній порожнині та судинах. Лапаротомія з розрізом верхньої частини живота може мати до 15 разів більший ризик ПЛУ, якщо порівняти з розрізом нижньої частини. Екстрена хірургія призводить до збільшення ризику розвитку ПЛУ у 2-6 разів проти планової хірургічної операції. Хоча сам тип хірургічного втручання не піддається модифікації, лапароскопічна хірургія як для верхніх, так і для нижніх відділів шлунково-кишкового тракту сприяє меншій кількості ПЛУ порівняно з відкритими операціями.
Передопераційні обстеження
Систематичний аналіз літератури показав, що пацієнтів із високим ризиком ПЛУ за результатами спірометрії можна легко ідентифікувати лише за допомогою клінічної оцінки; спірометрія та визначення газів крові не є надійною базою прогнозованого ризику ПЛУ для пацієнтів некардіоторакальної хірургії. Корисність передопераційного рентген-обстеження грудної клітки також мала суперечливі результати. Національний інститут здоров’я і досконалості допомоги (National Institute for Health and Care Excellence, NICE) – виконавчий позавідомчий державний орган Департаменту охорони здоров’я Великої Британії – вважає, що спірометрію та вимірювання газів крові треба проводити лише на прохання старшого анестезіолога для пацієнтів ASA III або IV класу (оцінка фізичного стану пацієнта перед хірургічним втручанням за класифікацією ASA – Американського товариства анестезіологів) з підтвердженим або підозрюваним респіраторним захворюванням і що рентген грудної клітки для планової операції процедура не обов’язкова. Нещодавно було виявлено, що низький передопераційний SpO2 (оцінюється в положенні лежачи, дихаючи кімнатним повітрям) є суттєвим незалежним чинником ризику ПЛУ.
Супутні захворювання
Оцінка ASA II класу або вище або діагноз: хронічне обструктивне захворювання легень (ХОЗЛ), ЗСН або хронічна хвороба печінки є незалежними факторами ризику ПЛУ. ХОЗЛ та астму необхідно оптимально лікувати бронходилататорами та інгаляційними або пероральними стероїдами. Респіраторна інфекція протягом останнього місяця пов’язана з більшим шансом на розвиток ПЛУ, тому планова операція має бути відкладена доти, доки симптоми й тести функції легень не повернуться до вихідного рівня, якщо хірургічна операція не є терміновою. Періопераційну заміну стероїдів для тих, хто отримує високі дози оральних стероїдів, варто застосовувати відповідно до місцевих рекомендацій. ЗСН може бути фармакологічно оптимізована кардіологом для мінімізації симптомів та максимізації функціональних можливостей. Настанови Європейського кардіологічного товариства щодо лікування ЗСН були оновлені у 2016 році. Пацієнтам із тяжкою формою синдрому обструктивного апное сну, яким показана планова операція, необхідно починати лікування постійним позитивним тиском у ДШ (continuous positive airway pressure) та оцінювати їх на відповідність до проведення планової операції.
Куріння
Куріння – ще один вагомий фактор ризику ПЛУ. Час відмови від куріння представляє інтерес. Відмова на термін >4 тиж зменшує ризик ПЛУ на 23%, а на >8 тиж – на 47%. Побоювання, що збільшення виділення мокротиння після відмови від куріння призводить до більш тяжких легеневих ускладнень, спростоване. Потрібні подальші дослідження, де були б оцінені будь-які переваги відмови від куріння за 1-2 тиж до операції. Доведено, що серед пацієнтів, які перенесли великі оперативні втручання, спонтанно високий відсоток тих, хто вирішив повністю відмовитися від цієї звички. Це дало підстави Shi та Warner заявити, що операція має розглядатися всіма залученими до неї клініцистами як свого роду «навчальний момент» для курців.
Передопераційна анемія
Приблизно в третини європейських пацієнтів під час обстеження в лікарні виявляється анемія. У пацієнтів із передопераційною анемією (гемоглобін <100 г/л‑1), які перенесли будь-який тип операції, ризик ПЛУ збільшується втричі. Доведено, що й переливання крові також є незалежним фактором розвитку ПЛУ, і цей факт потребує розглянути альтернативні засоби лікування передопераційної анемії. Передусім важливо встановити причину цього синдрому. Якщо це залізодефіцитна анемія, варіанти лікування включають дієтичні добавки, зокрема вітамін В12, фолієву кислоту та пероральне або внутрішньовенне введення заліза (при пероральній непереносимості або якщо до операції залишилося <4 тиж). Еритропоетин також може бути варіантом лікування, але він пов’язаний з періопераційними ускладненнями.
Загальна анестезія
ЗА порушує багато аспектів дихальної функції, і тому може здатися очевидним, що частота ПЛУ зменшується в пацієнтів, які замість цього отримують центральну або периферичну регіонарну анестезію (РА). Характер хірургічних втручань, що потребують ЗА, самі по собі містять високий ризик розвитку ПЛУ. Однак дослідження показали, що навіть для тієї самої процедури ЗA є незалежним фактором ризику ПЛУ, якщо порівняти з РA. Тривалість хірургічного втручання та анестезії понад 2 год незалежно асоційовані з розвитком ПЛУ.
Стратегії інтраопераційної вентиляції
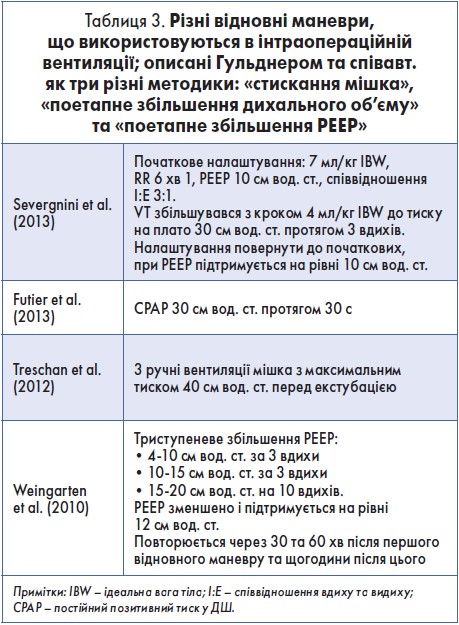
Механічна вентиляція під час ЗА відіграє неабияку, на жаль – негативну, роль у розвитку ПЛУ. Переваги ШВЛ у пацієнтів із ГРДС добре відомі. Сьогодні вже доведено, що частота ПЛУ значно зменшується, коли в пацієнтів із не-пораненими під час операції легенями застосовують стратегію захисної вентиляції, яка передбачає врахування дихального об’єму, рівня PEEP (позитивний тиск у кінці видиху – Positive End-Expiratory Pressure) та використання відновних маневрів (ВМ) (табл. 3). Є докази того, що низький рівень ВМ захищає від ПЛУ; однак ідеальний рівень PEEP є більш суперечливим, оскільки в багатьох дослідженнях не оцінюють PEEP незалежно від низького дихального об’єму та є занепокоєння щодо гемодинамічного компромісу з високим рівнем PEEP. Крім того, PEEP найбільш ефективний в оптимізації функції легень, коли ВМ виконуються перед застосуванням PEEP, але ВМ не оцінювалися незалежно від рівня PEEP. У пацієнта без ожиріння та зі здоровими легенями плато «тиску відкриття» 40 см вод. ст) протягом 7-8 с ефективно розкриває всі альвеоли.
Захисна вентиляція для пацієнтів із ожирінням
Є неоднозначні дані щодо того, чи мають пацієнти з ожирінням, як окрема когорта, підвищений ризик ПЛУ. Однак через змінену фізіологію дихання при ожирінні, особливо під час ЗА, рекомендується спеціальна стратегія захисної вентиляції, головним чином для зменшення ателектазів. Дихальний об’єм має становити 6-8 мл/кг (залежно від передбачуваної маси тіла), PEEP – 5 см вод. ст. із застосуванням відповідних ВМ. Цим пацієнтам може знадобитися вищий тиск відкриття – до 55 см вод. ст. Частоту дихання необхідно використовувати для контролю концентрації вуглекислого газу та підтримки нормального рН.
Отже, маючи такий «багаж» часто суперечливих доказів, ідеальне налаштування дихального апарату під час операції залежить від конкретного пацієнта. Думка авторів полягає в тому, що малий дихальний об’єм 6-8 мл/кг, заснований на ідеальній масі тіла, необхідно застосовувати в усіх пацієнтів. Однак в останніх нерідко виникають ще якісь респіраторні проблеми, і тоді, імовірно, знадобляться додаткові захисні компоненти вентиляції. Спочатку можна застосовувати більш високі рівні PEEP для спроби запобігти розвитку ателектазів та невідповідності V/Q – до такої міри, що оксигенація погіршується навіть при незначно підвищеному FIO2 (до 0,6). Нарешті, коли рівень PEEP досягає рівня, пов’язаного із серцево-судинними проблемами (10 см вод. ст.), перед подальшим збільшенням FIO2 або PEEP треба проводити ВМ.
Післяопераційна підтримка дихання за допомогою назального потоку кисню
Високопотоковий трансназальний кисень стає популярною формою добре переносимої неінвазивної вентиляції при дихальній недостатності і вивчається стосовно її місця в профілактиці ПЛУ. Профілактичний високопотоковий трансназальний кисень може бути корисним пацієнтам із кардіологічними проблемами та супутніми захворюваннями органів дихання. Однак це не покращує оксигенацію або дихальну функцію та не зменшує рівень ускладнень після операції шунтування коронарних артерій.
Нейро-м’язеві блокатори
Встановлено, що післяопераційний залишковий параліч спричиняє порушення дихання. Продемонстровано дозозалежний приріст розвитку ПЛУ із застосуванням НМБ середньої тривалості. Неостигмін, у разі його призначення пацієнтам із низькою активністю НМБ, має власні респіраторні ефекти, імовірно, унаслідок надлишку ацетилхоліну, що спричиняє слабкість. Коли неостигмін вводять без НМБ, спостерігається порушення функції геніоглоссу та координації м’язів глотки й зменшення співвідношення тесту «train of four» (TOF) у периферичних м’язах.
Ці зміни можуть спровокувати клінічні проблеми. Нещодавно отримані дані свідчать про те, що неостигмін призводить до ПЛУ, що асоційовано або з надлишком ацетилхоліну, або з тривалістю дії неостигміну, коротшою, ніж час елімінації НМБ у певних умовах. Шанси розвитку післяопераційного набряку легень і реінтубації збільшуються в разі застосування неостигміну без нервово-м’язового моніторингу. Стимуляція периферичних нервів водночас із застосуванням неостигміну може зменшити залишковий блок, а отже – ПЛУ. Нещодавно в США та Великій Британії закликали збільшити використання обов’язкового кількісного моніторингу нервово-м’язової функції щоразу, коли вводять НМБ.
Назогастральний зонд
У ході декількох досліджень було встановлено, що застосування назогастрального зонда є фактором ризику ПЛУ. З огляду на це, використання назогастрального зонда можна вважати доцільним лише для полегшення конкретних симптомів або в певних хірургічних ситуаціях.
Передопераційна фізіотерапія
Систематичний огляд 12 контрольованих досліджень показав, що передопераційна аеробіка та тренування м’язів вдиху знижують ризик ПЛУ та тривалість перебування в стаціонарі в пацієнтів, які перенесли хірургічні втручання на серці та черевній порожнині, за виключенням операції із заміщення суглобів. Автори рекомендували визначати пацієнтів із високим ризиком розвитку ПЛУ, щоб стимулювати передопераційне тренування м’язів вдиху. Огляд Cochrane 2015 року підтвердив застосування передопераційного тренування м’язів вдиху як асоційоване зі зменшенням післяопераційного ателектазу та пневмонії після серцевих і великих операцій на черевній порожнині. Водночас підкреслюється, що якість доказів є недостатньою. Ці методи трудомісткі та дорогі, зазвичай потребують постійного безпосереднього спостереження за пацієнтом з боку фізіотерапевта, тому, доти не буде отримано надійніших доказів ефективності їх використання, вони мають призначатися лише в пацієнтів із дуже високим ризиком ПЛУ.
Післяопераційна фізіотерапія
I COUGH – це післяопераційна програма респіраторної допомоги, яка знижує частоту пневмонії та незаплановану реінтубацію в загальних та судинних пацієнтів. Програма починає діяти ще перед операцією – з навчальних листівок та у відеоформаті. Стимулююча спірометрія призначається 10 разів на кожну годину пішої прогулянки до моменту виписки. Пацієнти глибоко дихають і кашляють кожні 2 години. В ідеалі пацієнти сидять на стільці або лежать у ліжку з піднятим на висоту >30° підголівником, з активізацією тричі на день. Гігієна порожнини рота полягає в чищенні зубів двічі на день та ополіскуванні рота. Не було вказано, що лише стимулююча спірометрія знижує частоту ПЛУ після операцій на грудному відділі, серці або черевній порожнині. Комбінація фізіотерапії, активізації та гігієни порожнини рота видається найбільш ефективною.
Знеболення
Додаткове застосування епідуральної аналгезії до ЗА суттєво зменшує ризик розвитку післяопераційної пневмонії в загальній когорті хірургічних пацієнтів проти одних лише системних опіоїдів. Це стосується передусім пацієнтів із тяжкою формою ХОЗЛ, яким проводять операції на черевній порожнині, імовірно, завдяки поліпшенню знеболення та зменшенню споживання опіоїдів. Епідуральна аналгезія покращує дихальну функцію і знижує частоту пневмонії, післяопераційну вентиляцію та незаплановану реінтубацію.
Висновок
Післяопераційні легеневі ускладнення є поширеним явищем, і хоча є багато систем для кількісної оцінки ризику ПЛУ, вони залишаються занадто складними для клінічного використання. Передопераційні дослідження, за винятком SpO2 під час вдиху, погано передбачають розвиток ПЛУ. Фактори ризику включають більшість супутніх захворювань серцево-легеневої системи, і їх треба оптимізувати до операції, якщо є час. Відмова від куріння перед операцією зменшує частоту розвитку ПЛУ, як і корекція тяжкої передопераційної анемії. В інтраопераційному періоді уникнення ЗА на користь РА теж зменшить ризик ПЛУ. У пацієнтів, які отримують ЗА, слід застосовувати захисну вентиляцію, особливо невеликий VТ 6-8 мл/кг ідеальної маси тіла, доповнений, у разі потреби, RMs і PEEP. Ідеальний рівень PEEP залишається суперечливим, оскільки <5 см вод. ст. прийнятний у пацієнтів із низьким ризиком, але для більш складних випадків потребуватимуться більш високі рівні. Використання НМБ асоціюється з ПЛУ, тому їх потрібно уникати, якщо це можливо, а при їх використанні потрібно контролювати кількісно та антагонізувати з неостигміном лише за потреби. Післяопераційна неінвазивна вентиляція може бути корисною для невеликої групи пацієнтів із високим ризиком, але в інших випадках уникнення ПЛУ після великих операцій потребує ефективного знеболення та комплексних заходів фізіотерапії, мобілізації та гігієни порожнини рота. Сподіваємось, що відповідно до того, як ці стратегії надалі поширюватимуться, рівень ПЛУ та пов’язана з ними смертність зменшуватимуться.
Miskovic A., Lumb A.B. Postoperative pulmonary complications.
British Journal of Anaesthesia, 118 (3): 317-34 (2017).
doi: 10.1093/bja/aex002
Переклад з англ. Назара Лукавецького
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (52), 2020 р.