15 червня, 2021
Ліраглутид у дітей та підлітків із цукровим діабетом 2 типу
У дітей та підлітків із цукровим діабетом (ЦД) 2 типу основним препаратом вибору є метформін, але за монотерапії цим цукрознижувальним засобом спостерігається досить швидка втрата глікемічного контролю. Мета цього рандомізованого плацебо-контрольованого дослідження – підтвердити перевагу ліраглутиду над плацебо в контролі глікемії у дітей та підлітків із ЦД 2 типу при додаванні до метформіну (з інсуліном або без нього).
Стрімке зростання частоти ожиріння серед дітей та підлітків зумовлює збільшення розповсюдженості ЦД 2 типу в цій віковій групі. Метформін схвалений регуляторними органами для лікування ЦД 2 типу в дітей та підлітків і є основним методом терапії для більшості пацієнтів на початку захворювання. Проте швидке зниження функції β-клітин у поєднанні з тяжкою резистентністю до інсуліну сприяє ранній втраті глікемічного контролю за монотерапії метформіном. Для дорослих пацієнтів із ЦД 2 типу схвалено значну кількість пероральних та ін’єкційних цукрознижувальних препаратів різних класів, але в дітей та підлітків, які не мають адекватної відповіді на монотерапію метформіном, донедавна єдиним дозволеним лікарським засобом був інсулін. Регуляторні органи вимагають, щоб ліки, схвалені для використання в дорослих із ЦД 2 типу, обов’язково проходили випробування на ефективність і безпеку в дітей та підлітків із цим захворюванням.
Раніше за допомогою дослідження II фази було продемонстровано, що затверджені для дорослих діапазони доз агоніста рецепторів глюкагоноподібного пептиду‑1 – ліраглутиду підходять також для дітей із ЦД 2 типу. Клінічне випробування III фази з вивчення ефективності та безпеки тривалого застосування ліраглутиду в дітей та підлітків розпочато у 2012 році й успішно завершено у 2018 році. У цьому огляді наводимо результати дослідження (рис. 1).
Матеріали та методи
Мета випробування – підтвердити перевагу ліраглутиду над плацебо в контролі глікемії у дітей та підлітків із ЦД 2 типу при додаванні до лікування метформіном (з інсуліном або без нього). Це рандомізоване плацебо-контрольоване дослідження в паралельних групах проводилося на базі 84 медичних центрів у 25 країнах світу та включало 26-тижневий подвійний сліпий період і 26-тижневий відкритий період подальшого спостереження.
Критерії залучення до випробування: діагноз ЦД 2 типу; вік від 10 до 17 років; рівень глікованого гемоглобіну (HbA1c) від 7,0 до 11,0% на тлі лише дієти та фізичних вправ або від 6,5 до 11,0% за попереднього лікування метформіном (з інсуліном або без нього); індекс маси тіла (ІМТ), що перевищував 85-й процентиль (з урахуванням віку та статі).
Критерії виключення з дослідження: ЦД 1 типу; діабет дорослого типу в молодих (MODY); рівень С‑пептиду натще <0,6 нг/мл; виявлення антитіл, асоційованих із діабетом; використання будь-якого протидіабетичного засобу, крім метформіну чи базального інсуліну, протягом 90 днів до скринінгу; панкреатит в анамнезі; рівень кальцитоніну в сироватці крові ≥50 нг/л; особистий або сімейний анамнез медулярного раку щитоподібної залози чи множинної ендокринної неоплазії 2 типу; рівень аланінамінотрансферази, що є в ≥2,5 разу вищим за верхню межу норми; рівень креатиніну в сироватці крові, вищий за верхню межу норми для віку; нещодавно перенесене захворювання серця; проліферативна ретинопатія або макулопатія; періодична тяжка гіпоглікемія чи нечутливість до гіпоглікемії.
Усі пацієнти, котрі відповідали критеріям включення, розпочинали ввідний період дослідження загальною тривалістю 11-12 тиж, який передбачав збільшення дози метформіну до максимально переносимої (від 1000 до 2000 мг/день) протягом перших 3-4 тиж і подальший прийом такої дози впродовж 8 тиж. У хворих, які отримували базальний інсулін, його доза також мала бути стабільною протягом щонайменше 8 тиж. До подальшої участі у випробуванні допускали хворих, які мали на тлі терапії стабільною дозою метформіну рівень глюкози в плазмі натще від 7,0 до 12,2 ммоль/л.
Надалі пацієнтів було рандомізовано на дві групи, одна з яких на додачу до метформіну (з або без інсуліну) отримувала підшкірні ін’єкції ліраглутиду, інша – плацебо (за допомогою ідентичних шприц-ручок). Лікування розпочинали з дози 0,6 мг/день, яку збільшували в обох групах із кроком 0,6 мг щотижня, якщо середній рівень глюкози в плазмі натще протягом 3 днів поспіль перевищував 6,1 ммоль/л. Максимальна добова доза складала 1,8 мг. Після 2-3-тижневого періоду збільшення дози пацієнти підтримували стабільну дозу ліраглутиду чи плацебо. Тривалість рандомізованого періоду лікування становила 26 тиж.
Після завершення подвійного сліпого періоду пацієнти, яким було призначено ліраглутид, продовжували лікування без змін, тоді як учасники контрольної групи припиняли застосування плацебо, але продовжували прийом метформіну (з базальним інсуліном або без нього). Тривалість цього відкритого періоду лікування складала 26 тиж.
Для забезпечення прийнятного глікемічного контролю в обох групах лікування дозволялося додаткове призначення базального інсуліну (як окремо, так і в комбінації з інсуліном швидкої дії).
Первинною кінцевою точкою ефективності була зміна показника HbA1c від вихідного рівня на 26-му тижні. Вторинні кінцеві точки ефективності – відсоток пацієнтів, які досягли рівня HbA1c <7,0%, а також зміна від вихідного рівня до 26 тиж таких показників: глюкоза в плазмі крові натще; zІМТ (кількість стандартних відхилень, на які відрізняється ІМТ від середнього показника в референтній сукупності за статтю й віком); маса тіла; ліпіди крові; систолічний і діастолічний артеріальний тиск. Водночас обов’язково протягом усього дослідження проводили моніторинг небажаних явищ (НЯ), вимірювали рівні ліпази, амілази та кальцитоніну.
Результати
Із 307 обстежених пацієнтів до подвійного сліпого етапу були допущені 135 учасників, з яких 134 отримали щонайменше одну дозу ліраглутиду (n=66) або плацебо (n=68). Повністю завершили 26-тижневий рандомізований період 118 пацієнтів (87,4%), у т. ч. 60 (90,9%) у групі ліраглутиду та 58 (84,1%) у групі плацебо. Повний 52-тижневий курс лікування отримали 109 пацієнтів (80,7%), у т. ч. 56 (84,8%) у групі ліраглутиду та 53 (76,8%) у групі плацебо.
Наприкінці 3-го тижня 55,6% пацієнтів у групі ліраглутиду та 72,7% у групі плацебо досягли дози 1,8 мг. Значна частка хворих протягом випробування не отримувала максимальної дози ліраглутиду чи плацебо, оскільки цільового рівня глюкози в плазмі натще вдавалося досягти за допомогою меншої дози. Лише 6 пацієнтів у групі ліраглутиду та 4 хворих у групі плацебо не змогли збільшити дозу через неприйнятні побічні ефекти.
Додаткове призначення інсуліну для відновлення контролю глікемії за 26 тиж рандомізованого етапу не знадобилося 86,4% пацієнтів у групі ліраглутиду та 66,7% у групі плацебо, за 52 тиж – 71,2 та 50,7% відповідно.
Ефективність
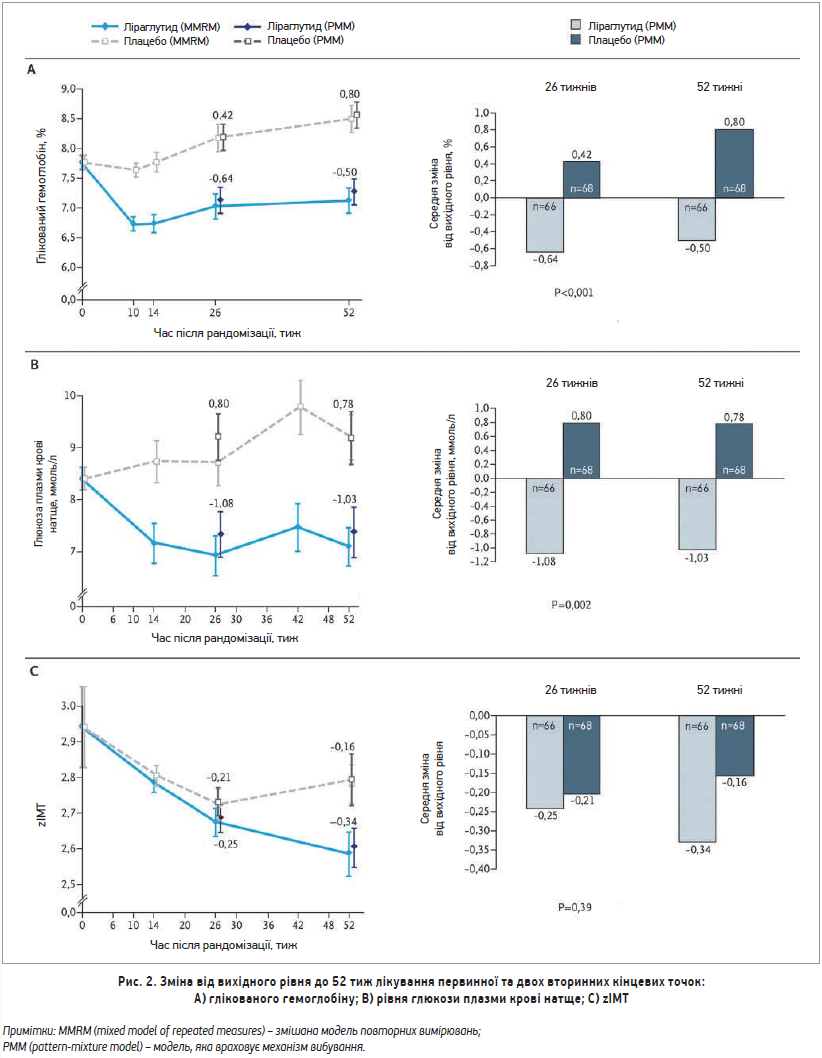
Середній рівень HbA1c на 26-му тижні (первинна кінцева точка ефективності) знизився від вихідного рівня на 0,64% у групі ліраглутиду та зріс на 0,42% у групі плацебо (різниця -1,06%; 95% довірчий інтервал (ДІ) від -1,65 до -0,46; р<0,001). Отже, було чітко продемонстровано перевагу ліраглутиду над плацебо. Різниця ще більше зросла на 52-му тижні (-1,30%; 95% ДІ від -1,89 до -0,70) (рис. 2А). Усі 6 аналізів чутливості підтвердили відмінності в лікуванні, отримані під час первинного аналізу.
Водночас продемонстровано перевагу ліраглутиду над плацебо в зниженні рівня глюкози в плазмі крові натще через 26 і 52 тиж (рис. 2В).
Цільового рівня HbA1c (<7,0%) досягли 63,7% пацієнтів у групі ліраглутиду порівняно з 36,5% у групі плацебо (р<0,001).
Що стосується зниження показника zІМТ, то різниця між групами становила -0,05 на 26-му тижні (95% ДІ від -0,15 до 0,06), не досягнувши статистичної значимості. До 52 тиж різниця зросла до -0,18 (95% ДІ від -0,33 до -0,03) (рис. 2С). Середня маса тіла зменшилася на 26-му тижні в обох групах (-2,3 кг у групі ліраглутиду та -0,99 кг у групі плацебо), але на 52-му тижні ефект зберігся лише в групі ліраглутиду (-1,91 та +0,87 кг відповідно).
На 26-му тижні в групі ліраглутиду суттєвіше знизилися (порівняно з групою плацебо) рівні холестерину ліпопротеїдів дуже низької щільності (відношення змін 0,82; 95% ДІ 0,72-0,94) і тригліцеридів (відношення змін 0,83; 95% ДІ 0,72-0,95), хоча на 52-му тижні відмінностей не виявилося. Не спостерігалося відмінностей між групами за зміною систолічного та діастолічного артеріального тиску.
Безпека
Частка пацієнтів із НЯ була схожою в групах ліраглутиду та плацебо (84,8 та 80,9% відповідно). Водночас частота НЯ в розрахунку на 1 пацієнто-рік була дещо вищою в групі ліраглутиду (7,144 vs 5,425 відповідно) здебільшого через частіші НЯ з боку шлунково-кишкового тракту (особливо протягом перших 8 тиж лікування). Найпоширеніше НЯ – нудота. Більшість випадків НЯ були легкими за ступенем тяжкості, минали без відміни лікування й були розцінені дослідниками як такі, що не пов’язані з ліраглутидом або плацебо.
У групі ліраглутиду більший відсоток пацієнтів (порівняно з групою плацебо) мав серйозні НЯ (13,6 та 5,9% відповідно), але жодного випадку смерті зафіксовано не було.
Частка хворих з епізодами гіпоглікемії та частота гіпоглікемії були вищими в групі ліраглутиду (порівняно з групою плацебо). Натомість тяжких епізодів гіпоглікемії в групі ліраглутиду не спостерігалося, а в групі плацебо вона відзначалася в 1 пацієнта, який отримував інсулін.
Більшість хворих в обох групах лікування мали нормальні показники ліпази й амілази, хоча рівні ліпази були дещо вищими в групі ліраглутиду. Всі пацієнти мали нормальний рівень кальцитоніну протягом 52 тиж.
Обговорення
Результати цього подвійного сліпого рандомізованого випробування III фази продемонстрували перевагу ліраглутиду над плацебо в поліпшенні глікемічного контролю на 26-му тижні лікування в дітей та підлітків із ЦД 2 типу, які не мали адекватної відповіді на метформін (з інсуліном або без нього). Водночас ліраглутид суттєвіше знижував рівень глюкози в плазмі крові натще. Майже вдвічі більше хворих у групі ліраглутиду (порівняно з групою плацебо) досягли рівня HbA1c <7,0%. Протягом 52 тиж середнє значення HbA1c знизилося на 0,5% при застосуванні ліраглутиду, а в групі плацебо спостерігалося збільшення на 0,8%. Така різниця схожа на ту, що раніше повідомлялася для метформіну в цій віковій групі.
Несподіваний результат дослідження – відсутність достовірної різниці між групами в зміні показника zІМТ на 26-му тижні лікування, що не відповідає результатам випробувань за участю дорослих пацієнтів. Середня різниця у втраті маси тіла між групами лікування була схожою на таку в дослідженнях за участю дорослих; імовірно, вона не досягла статистичної значимості через порівняно невелику кількість пацієнтів у поточному дослідженні та той факт, що чимало дітей ще росли протягом випробування. Ще одним поясненням може бути доза ліраглутиду в цьому дослідженні, адже лише ≈50% учасників групи ліраглутиду отримували повну дозу (1,8 мг/добу).
Основною причиною збільшення частоти НЯ при застосуванні ліраглутиду були легкі побічні ефекти з боку шлунково-кишкового тракту (як і у випадку з дослідженнями за участю дорослих пацієнтів із ЦД 2 типу). Частота гіпоглікемії в групі ліраглутиду була низькою порівняно з раніше повідомленою частотою клінічно значимої гіпоглікемії в дітей із ЦД 1 типу. Чимало зареєстрованих епізодів гіпоглікемії виявлені при вимірюванні рівня глюкози в плазмі крові та не супроводжувалися жодними симптомами.
Потенційним обмеженням цього дослідження є графік нарощування дози. Ескалація могла бути занадто швидкою, оскільки лише ≈50% пацієнтів отримували в результаті найвищу дозу ліраглутиду. Той факт, що майже половина хворих не отримувала найвищої дози, може обмежувати збір даних щодо профілю безпеки ліраглутиду. Ще одне обмеження – тривалий набір пацієнтів (через проблеми, притаманні клінічним випробуванням за участю дітей та підлітків із ЦД 2 типу), що потребувало внесення деяких поправок до протоколу. Через дещо обмежене різноманіття дослідної сукупності результати не можуть бути однозначно екстрапольовані на всі інші групи населення.
Висновки
Поточне дослідження продемонструвало перевагу ліраглутиду над плацебо при додаванні до метформіну (з базальним інсуліном або без нього) щодо контролю глікемії у дітей та підлітків із ЦД 2 типу. Шлунково-кишкові побічні явища були поширенішими в групі ліраглутиду.
Довідка «ЗУ»
17 червня 2019 року Управління з контролю якості продуктів харчування та лікарських засобів США (FDA) на основі результатів наданого дослідження схвалило застосування препарату Віктоза® (ліраглутид) для лікування педіатричних пацієнтів віком від 10 років із ЦД 2 типу. Віктоза® стала першим неінсуліновим препаратом, затвердженим для лікування ЦД 2 типу в дітей із 2000 року, коли був схвалений для педіатричного застосування метформін.
Невдовзі (28 червня 2019 року) препарат Віктоза® було затверджено для використання в дітей та підлітків віком від 10 років із ЦД 2 типу Європейським агентством із лікарських засобів (ЕМА).
Наприкінці минулого року FDA, а у квітні цього року ЕМА затвердили препарат Віктоза® для контролю маси тіла в пацієнтів віком від 12 років з ожирінням.
В Україні з початку 2021 року офіційно зареєстроване показання для застосування препарату Віктоза® – недостатньо контрольований ЦД 2 типу в підлітків і дітей віком від 10 років як доповнення до дієти та фізичних вправ.
Tamborlane W.V. et al. Liraglutide in children and adolescents with type 2 diabetes. N. Engl. J. Med. 2019 Aug 15; 381 (7): 637-646.
Скорочений переклад з англ. Наталі Александрук