2 липня, 2023
Нові потенційні антикоагулянти на основі інгібіторів фактора згортання XIa
Продовження. Початок у № 9.
Відмінність між гемостазом і тромбозом
Гемостаз і тромбоз пов’язані між собою здебільшого через ферментативні реакції, але зрештою надають різні результати. В гемостазі кровотеча з ушкоджених судин зупиняється шляхом утворення гемостатичного корка в стінці судини. За тромбозу утворення тромбу відбувається всередині кровоносної судини, що частково чи повністю перекриває кровоток та зумовлює ушкодження органів (рис. 3). Розуміння схожості та відмінності, які відбуваються за цих процесів, необхідні для раціональної розробки лікарських препаратів.
Рис. 3. Утворення гемостатичного корка при гемостазі та обструкція кровотоку за тромбозу
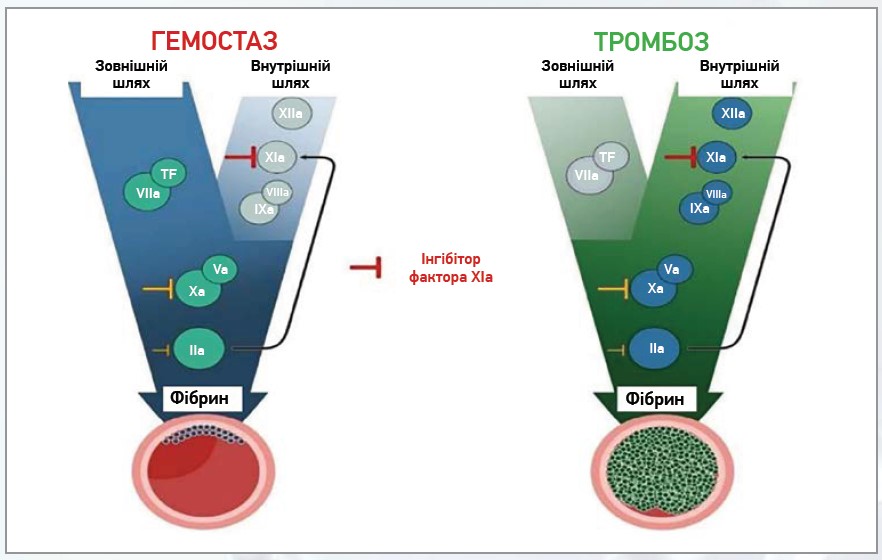
Схематичне зображення основних відмінностей між гемостазом і тромбозом, що показує шляхи активації факторів згортання крові, представлено на рисунку 4. Це два пов’язані, але різні процеси коагуляції, один з яких характеризується утворенням згустку для герметизації ушкодження стінки судини (гемостаз), а при іншому шляху формується внутрішньосудинний згусток, що спричиняє обструкцію кровотоку (тромбоз). Тканинний фактор ініціює обидва процеси, але FXI відіграє допоміжну роль у гемостазі. За тромбозу FXI необхідний для зростання тромбу в просвіті судини. Відносна важливість компонентів шляху означає інтенсивність затемнення.
Рис. 4. Схематичне зображення основних відмінностей між гемостазом і тромбозом
Примітки: РР – поліфосфати; NETa – нейтрофільні позаклітинні пастки; DNA/RNA – ДНК/РНК.
Гемостаз
Метою гемостазу, фізіологічної відповіді на ушкодження стінки кровоносної судини є герметизація ушкодження та зупинка кровотечі з мінімальним порушенням нормального кровотоку в судинах. Гемостатичний процес ініціюється, коли FVII або його активована форма FVIIa в крові зв’язується з екстраваскулярним тканинним фактором (TF), експонованим на ділянці кровоносної судини. Комплекс FVIIa/TF активує FX і переводить його в активну форму FXa, який потім конвертує обмежену кількість протромбіну в ключовий фермент згортання – тромбін. Ця рання генерація тромбіну ініціює утворення фібрину та разом із FXa забезпечує позитивний зворотний зв’язок для активації ключових білків-кофакторів, а саме FV та FVIII. Обмеженої кількості тромбіну, що утворюється на початку гемостазу, достатньо тільки для ініціації реакції при ушкодженні. На додаток до активації FX комплекс FVIIa/TF перетворює FIX на FIXa. Фактор IXa разом із кофактором VIIIa підтримує утворення тромбіну протягом декількох годин або днів після травми через стійку активацію FX. Порушення цих процесів у гемостазі спостерігається за тяжких патологій згортання крові, пов’язаних зі спадковим дефіцитом FVIII (гемофілія А) або FIX (гемофілія В) [17]. FXI має відносно обмежену роль у гемостазі [18].
Тромбоз
Тромбоз – патологічний процес, за якого утворюються згустки в просвіті кровоносної судини з порушенням кровотоку. Здебільшого формування тромбу спричинено порушенням ендотелію судин (наприклад, розрив атеросклеротичної бляшки). Однак для поширення внутрішньосудинного зростання тромбу участь комплексу FVIIa/TF може бути обмежена. У цьому випадку FXI сприяє стимулюванню зростання тромбу. Епідеміологічні дані та дослідження на тваринах підтверджують важливість FXI за тромбозів. У людей з дефіцитом FXI спостерігається зниження захворюваності на венозну тромбоемболію (ВТЕ) та ішемічний інсульт порівняно з населенням загалом, тоді як люди з високим рівнем FXI мають ризик ВТЕ в >2 рази [19, 20]. Було показано, що тромбоз знижений на моделях різних тварин із дефіцитом FXI та при інгібуванні FXI у відповідь на травму [21-24]. Отже, незалежно від механізму активації FXI фактор XIa є важливішим для тромбозу, ніж для гемостазу.
Фармакологічні стратегії пригнічення фактора XI
З огляду на значну роль, яку FXI має у тромбозі, ніж у гемостазі, підходи для пригнічення його утворення та активності вивчаються як нові терапевтичні стратегії з використанням різних сполук [25].
До них належать:
- антисмислові олігонуклеотиди (АСО), що діють для нокдауну синтезу FXI у печінці;
- невеликі молекули, спрямовані на активний сайт FXI або алостеричний сайт гепарину на FXIa;
- моноклональні антитіла, які блокують активацію чи інгібування активності;
- аптамери.
На додаток до різних механізмів дії ці стратегії також відрізняються за своїм характером, а саме шляхом введення (пероральний або парентеральний), початком дії та тривалістю ефекту. Парентеральне введення є обов’язковою вимогою для АСО, аптамерів і моноклональних антитіл, тоді як для низькомолекулярних агентів є можливість парентерального чи перорального введення. Різний початок і тривалість дії можуть представляти широкий набір варіантів лікування залежно від наявної патології. Наприклад, гострі тромботичні події, які потребують невідкладної допомоги, або інші варіанти для тривалішої дії, а також для профілактичних та запобіжних заходів. Це стосується ситуацій, що становлять високий ризик геморагічних ускладнень, як-от травма чи хірургічне втручання. У цьому випадку пріоритетами є агенти короткої дії.
Фактор XI як терапевтична мішень
Інгібітори FXI можуть бути корисними для запобігання згортанню крові за контакту з медичними інструментами чи екстракорпоральними контурами. Відмінності в механізмі дії та фармакологічні властивості, включаючи пероральну біодоступність, надають різним інгібіторам FXI як переваги, так і недоліки. Наприклад, AСO, антитіла, похідні природних інгібіторів потребують парентерального введення, тоді як невеликі молекули можна призначати перорально (табл.). Хоча для АСО, які вводяться підшкірно, потрібно від 3 до 4 тиж, щоб знизити рівні FXI в терапевтичному діапазоні, антитіла, що інгібують, мають швидкий початок дії, особливо при внутрішньовенному, а не підшкірному введенні. АСО та інгібувальні антитіла мають тривалий період напіврозпаду, що дозволяє вводити препарат 1 р/міс після досягнення цільового рівня інгібування. Отже, AСО та інгібувальні антитіла ідеально підходять для пацієнтів із високим ризиком кровотечі, наприклад, із термінальною стадією ниркової недостатності.
Висновки
Фактор FXIa чи серинова протеаза внутрішнього шляху згортання крові є багатообіцяльною лікарською мішенню для безпечнішої антикоагулянтної терапії щодо наслідків кровотечі. Епідеміологічні дані в пацієнтів зі спадковим дефіцитом фактора XI та доклінічні дослідження підтверджують думку про те, що інгібітори фактора XIa можуть бути ефективною, але потенційно безпечнішою альтернативою наявним антикоагулянтам, ґрунтуючись на їхній здатності запобігати тромбозу безпосередньо внутрішнім шляхом. Різні типи інгібіторів фактора XIa були вивчені в ранніх клінічних дослідженнях, включаючи АСО, антитіла, поліпептиди, пептидоміметичні інгібітори, полімерні глікозаміноглікани, нецукрові міметики, аптамери. За останні 3 роки реалізовано значну кількість патентних заявок, у яких представлено досягнення у відкритті нових інгібіторів FXI/FXIa.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 10 (546), 2023 р.