30 жовтня, 2017
Нове слово в антигістамінній терапії алергічних захворювань
Ні для кого не секрет, що алергічні захворювання – одна з найпоширеніших патологій сучасності. Проте лікарів
та науковців усього світу непокоїть не лише високий рівень поширеності алергічних захворювань, а й темпи зростання цієї патології. Результати відомого дослідження GA2LEN свідчать про те, що наразі кожна третя дитина на планеті має те чи інше алергічне захворювання. При цьому близько 40% європейців протягом життя хоча б один раз стикалися з хворобою алергічного походження. Відтак, зважаючи на сумні тенденції, пошук нових засобів профілактики та лікування алергії наразі є неабияк актуальним завданням, особливо в дитячій практиці. Антигістамінні засоби — клас препаратів, значення яких переоцінити неможливо, адже саме вони допомагають мільйонам людей щороку, щомісяця, щодня усувати симптоми алергії, долати дискомфорт, покращуючи якість життя.
Сьогодні світова фармацевтична промисловість має у своєму арсеналі доволі широкий спектр антигістамінних засобів останньої – другої генерації. Та чи всі вони однаково ефективні й безпечні? Саме питання вибору «ідеального» антигістамінного засобу стало ключовим на сателітному симпозіумі «Нові перспективи лікування алергії у дорослих та дітей: біластин», який відбувся 18 червня в м. Гельсінкі (Фінляндія). Організатором заходу виступила Європейська академія алергії та клінічної імунології (European Academy Of Allergy & Clinical Immunology – ЕААСІ). В симпозіумі взяли участь провідні алергологи, дерматологи, отоларингологи, терапевти та імунологи з Фінляндії, Німеччини, Угорщини, Польщі тощо.
 Наукову частину симпозіуму відкрив професор Петр Куна (відділ внутрішніх хвороб, астми та алергії Медичного університету м. Лодзь, Польща) з доповіддю «Сучасні настанови з лікування алергічного риніту: пошук ідеального антигістамінного засобу».
Наукову частину симпозіуму відкрив професор Петр Куна (відділ внутрішніх хвороб, астми та алергії Медичного університету м. Лодзь, Польща) з доповіддю «Сучасні настанови з лікування алергічного риніту: пошук ідеального антигістамінного засобу».
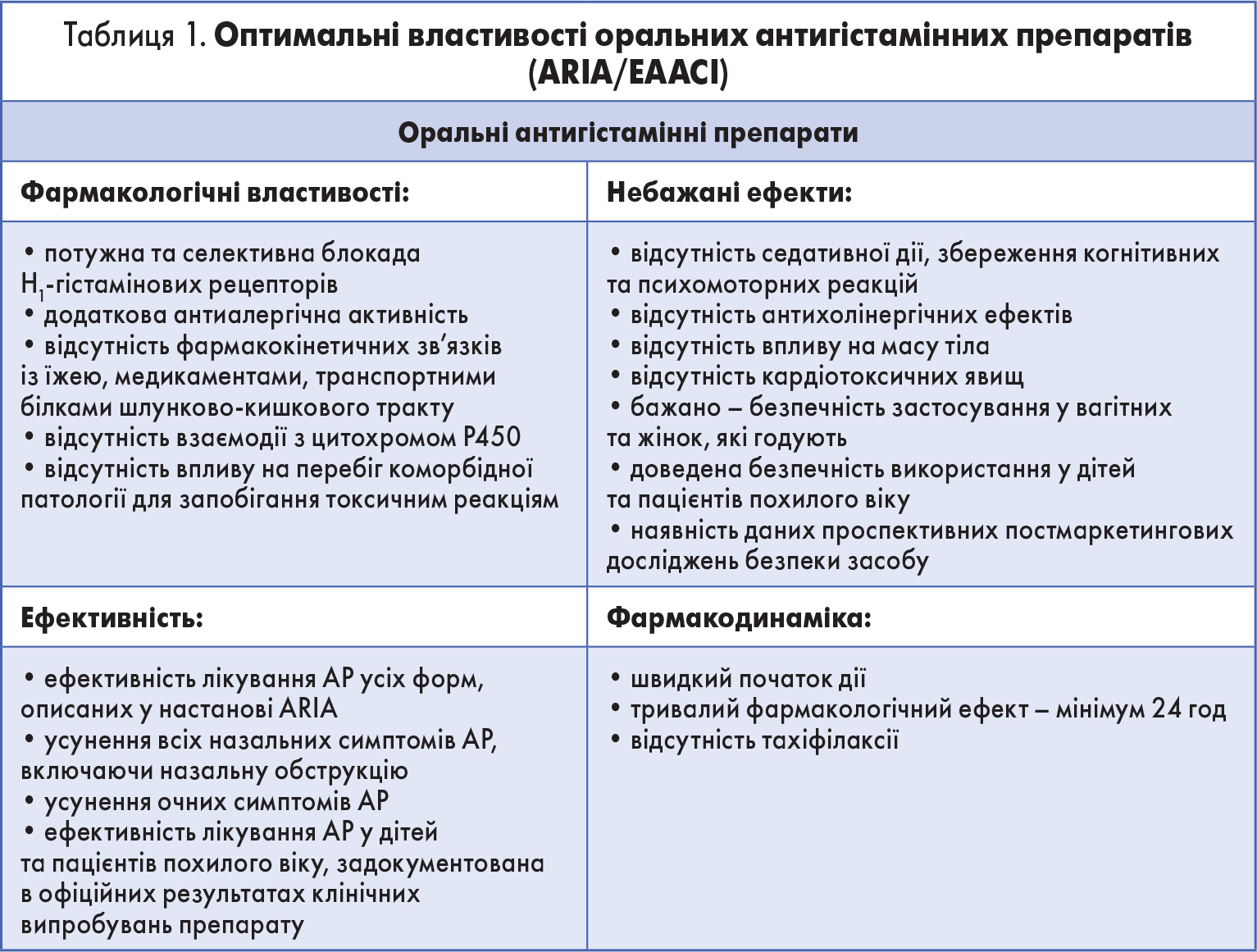
– Якщо уважно поглянути на рекомендації з менеджменту алергічного риніту (АР) й астми ARIA (Allergic Rhinitis and its Impact on Asthma), то можна побачити, що для кожної групи пацієнтів, розподілених за характером АР (інтермітуючий чи персистуючий) і тяжкістю його перебігу (легкий, середньотяжкий, тяжкий) серед препаратів першої лінії, безумовно, рекомендовані саме антигістамінні засоби для перорального застосування. Проте сучасні світові рекомендації містять не лише клас препаратів, у них іще й наводяться критерії, яким має відповідати «ідеальний» антигістамінний препарат для адекватного контролю за перебігом АР. У роботі J.L. Brozek і співавт. (2017) подано таблицю критеріїв антигістамінних засобів, що її підготував колектив авторів рекомендацій ARIA/ЕААСІ (табл. 1).
Спробуємо з’ясувати, чи відповідає наведеним критеріям новий антигістамінний засіб біластин. По-перше, біластин виявляє високий рівень спорідненості з Н1-гістаміновими рецепторами, що в 3 рази перевищує таку в цетиризину та в 5 разів – у фексофенадину. При цьому біластин не виявляє афінності, що реєструється в ході експериментів in vitro, до 30 інших видів рецепторів (R. Corcostegui et al., 2005). Біластин не взаємодіє із ферментативно активними ізоензимами системи цитохрому Р450 (M.L. Lucero et al., 2012). У цьому ж дослідженні було продемонстровано відсутність печінкового метаболізму біластину в організмі людини. Після вимірювання концентрації незмінного біластину в сечі та екскрементах людини автори дослідження встановили, що концентрація речовини зростає у зазначених біоекскретах протягом 72 год після прийому препарату, після чого рівномірно виводиться упродовж наступних 96 год. Схожа картина спостерігається у групах пацієнтів, які приймали терапевтичну дозу препарату, а також у тих, що отримували 2-, 4- і навіть 5-кратну його дозу.
Розглядаючи питання ефективності біластину, насамперед слід навести дані нового дослідження K. Hashiguehl і співавт. (2017), у якому взяли участь 126 пацієнтів. Їх було розподілено на 4 групи: учасники першої групи отримували плацебо, другої – біластин у дозі 10 мг, третьої – у дозі 20 мг, четвертої – фексофенадин у дозі 120 мг (2×60 мг) на добу. Критеріями ефективності було обрано: вплив на всі симптоми АР; ефективність протягом 22-26 год; швидкість початку дії; задоволеність пацієнта.
Було встановлено, що максимальне усунення симптомів виникає в середньому через 60 хв прийому фексофенадину та біластину в дозі 10 мг і через 45 хв – біластину в дозі 20 мг. Ефективність усунення назальних симптомів АР була найвищою в групі пацієнтів, що приймали біластин у дозі 20 мг (68,5 бала за оцінювальною шкалою total nasal symptom scores, TNSS), дещо нижчою – у групі біластину (10 мг) – 70,3 бала, ще нижчою – у групі фексофенадину (72,7 бала).
Сумарні висновки авторів дослідження такі:
• біластин у дозі 20 мг/добу – безпечний засіб, що добре переноситься хворими та ефективно усуває обидві групи симптомів АР – назальні та очні;
• біластин у дозі 20 мг/добу має швидкий початок дії, максимальна ефективність досягається протягом 45 хв після прийому;
• біластин у дозі 20 мг/добу є більш ефективним, ніж фексофенадин у дозі 60 мг 2 рази на добу.
За даними нашого власного масштабного багатоцентрового рандомізованого подвійного сліпого дослідження (P. Cuna еt al., 2009), у якому взяв участь 681 пацієнт віком від 12 до 70 років, частота всіх пов’язаних із застосуванням антигістамінних засобів, що вивчалися, небажаних явищ виявилася значно нижчою в групі біластину (14,5%), ніж у групі цетиризину (24,6%; p≤0,01). Суттєві відмінності між групами були відмічені за частотою таких побічних ефектів, як сонливість (1,8% у групі біластину проти 7,5% у групі цетиризину) та втома (0,4 проти 4,8% відповідно).
У ході нового рандомізованого подвійного сліпого плацебо-контрольованого паралельного дослідження III фази (K. Okubo et al., 2017) оцінювали ефект 2-тижневого лікування біластином (20 мг 1 раз на добу), фексофенадином (60 мг 2 рази на добу) або плацебо у пацієнтів із персистуючим АР. Усім пацієнтам запропонували щодня записувати індивідуальні назальні та очні симптоми у своєму щоденнику. Первинною кінцевою точкою була середня зміна загальної оцінки симптомів носа (TNSS) від вихідного рівня до другого тижня (10-13 днів). Загалом 765 пацієнтів були випадково розподілені для прийому біластину, фексофенадину або плацебо (відповідно 256; 254 та 255 осіб). Середня зміна TNSS від вихідного рівня на 2-му тижні була значно виражена у групі біластину (-0,98) порівняно з плацебо (-0,63; p=0,023).
Біластин і фексофенадин не показали істотної різниці в показниках первинної кінцевої точки. Проте середня зміна TNSS від базової лінії на 1-й день була більш виражена в групі біластину (-0,99), аніж у плацебо (-0,28; p<0,001) або фексофенадину (-0,62; p=0,032). Досліджувані препарати добре переносились. Автори дослідження дійшли висновку, що у разі прийому не менш ніж 2 тиж біластин виявляє більш виражений ефект проти всіх симптомів АР у пацієнтів із персистуючою формою захворювання порівняно з фексофенадином. Крім того, біластин забезпечує швидкий початок дії та належну безпечність застосування.
Питання безпеки, як зазначалося, є одним із найважливіших у виборі антигістамінного препарату. S. Bachert і співавт. (2010) провели цікаве масштабне дослідження щодо кардіологічної безпеки використання біластину. В дослідженні взяли участь 774 пацієнти, які приймали біластин у дозі 20 мг щодня протягом року. Результати засвідчили, що препарат виявляє кардіотоксичність на рівні плацебо, тобто абсолютно безпечний для осіб, які мають серцево-судинні ризики.
Загалом питанню безпеки застосування біластину присвячено десятки досліджень, зокрема, з вивчення рівня седації після прийому біластину (Ole D. Wolthers, 2013; Akiko Yagami, 2017; Ralph Mоsges, 2016 та ін.), окупації Н1-рецепторів головного мозку (I. Jburegui et al., 2016; Magі Farrе et al., 2014 та ін.).
Проте науково-доказова база, що її за багато років накопичено за результатами вивчення ефективності та безпечності застосування біластину, є достатньою, щоб зробити такі висновки:
• біластин у дозі 20 мг – ефективний і безпечний антигістамінний засіб;
• біластин у дозі 20 мг забезпечує швидке настання клінічного ефекту;
• біластин у дозі 20 мг не виявляє тахіфілаксії навіть за тривалого застосування;
• біластин відповідає всім критеріям ARIA/ЕААСІ щодо «ідеального» антигістамінного засобу.
 Про значення антигістамінних засобів для тих, хто страждає на алергічні захворювання, розповів у своїй доповіді «Кропив’янка: огляд світових рекомендацій та нові дослідження ефективності та безпечності використання біластину» професор Торстен Цубербір (відділ дерматології та алергії Алергологічного центру мережі клінік Шаріте, м. Берлін, Німеччина).
Про значення антигістамінних засобів для тих, хто страждає на алергічні захворювання, розповів у своїй доповіді «Кропив’янка: огляд світових рекомендацій та нові дослідження ефективності та безпечності використання біластину» професор Торстен Цубербір (відділ дерматології та алергії Алергологічного центру мережі клінік Шаріте, м. Берлін, Німеччина).
– Згідно з рекомендаціям EAACI/GA2LEN/EDF/WAO з визначення, класифікації, діагностики та менеджменту кропив’янки (T. Zuberbier, W. Aberer et al., 2013) хронічну кропив’янку поділяють на 2 підтипи: спонтанну та індуковану. Спонтанна кропив’янка проявляється пухирями і/чи ангіоедемою протягом шести чи більше тижнів через невідому причину. Поняття індукованої хронічної кропив’янки включає в себе такі стани, як симптоматичний дермографізм, холодова, сонячна, теплова, холінергічна, контактна, тискогенна, аквагенна кропив’янка, вібраційна ангіоедема. Для визначення активності захворювання наразі використовують класифікацію UAS7 (Urticaria Activity Score, Індекс активності кропив’янки), яка передбачає сумарну оцінку основних симптомів захворювання (кількість пухирів та інтенсивність свербіння) самим пацієнтом кожні 24 год упродовж 7 днів (табл. 2). Ця оцінка зручна для пацієнтів та лікарів, дає змогу об’єктивно оцінити стан пацієнта та його індивідуальну відповідь на проведену терапію.
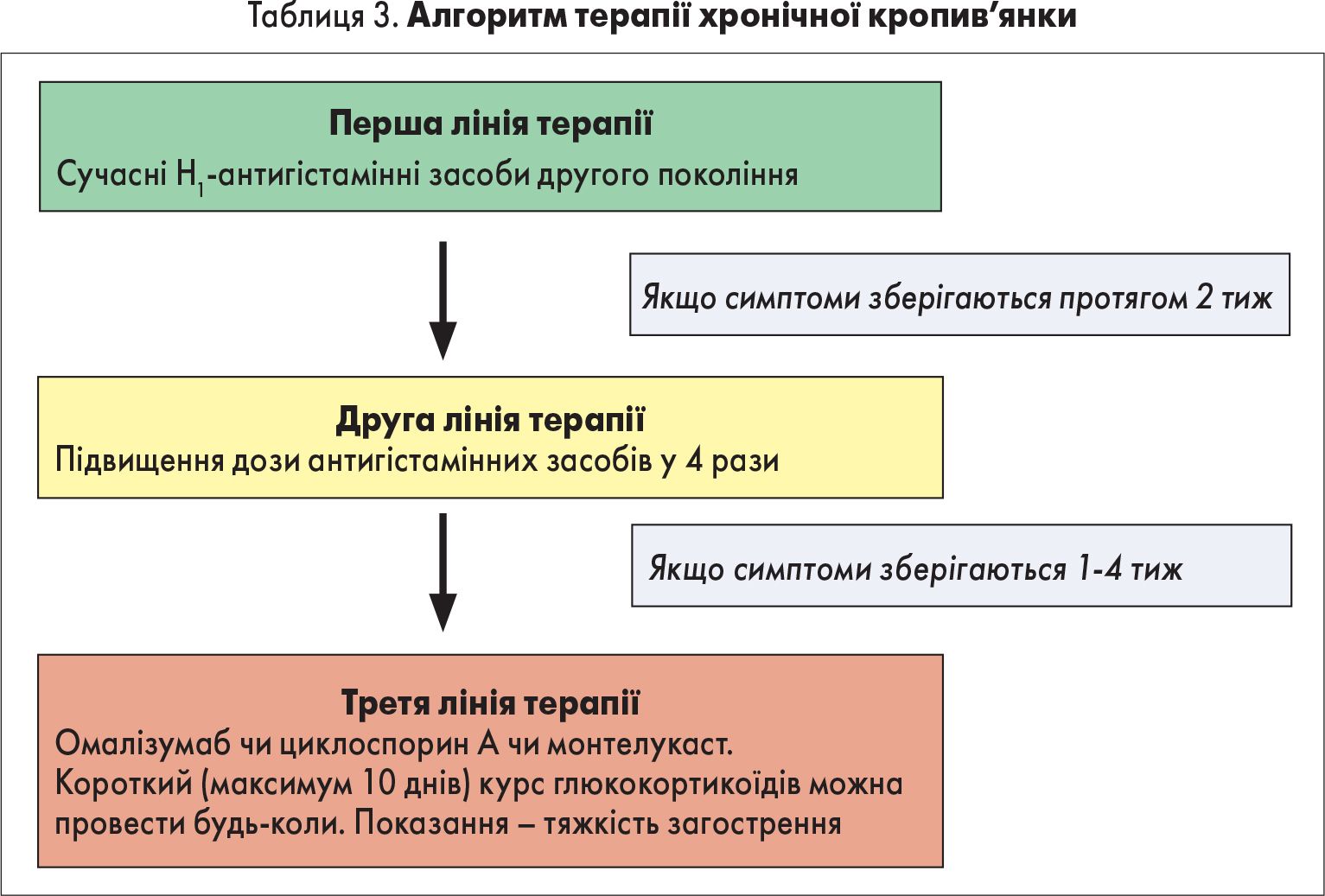
Наразі докладно не спинятимемося на методах діагностики кропив’янки: вони загалом відомі кожному практикуючому лікареві. Проте нагадаємо про сучасні принципи менеджменту цього захворювання, які коротко можна викласти в одній таблиці (табл. 3).
Отже, провідне місце в алгоритмі лікування хронічної кропив’янки належить антигістамінним засобам. При цьому препарат, який обирають, має бути високоефективним і, безумовно, безпечним, що пов’язано з можливістю збільшення дози у разі недостатньої ефективності стандартних дозувань. Нещодавно про себе гучно заявив новий антигістамінний препарат біластин. Проведені на сьогодні численні дослідження дають змогу говорити про високий рівень ефективності та належну безпечність цього засобу. Так, у ході відомого порівняльного дослідження M.K. Church (2011) було доведено, що біластин демонструє більш швидкий початок дії порівняно з цетиризином: біластин (у дозі 20 мг) швидше, ніж цетиризин гальмував появу пухирів (89±3 vs 44±14%; p=0,011) та висипань (85±4 vs 45±14%; p=0,016) після провокації гістаміном. Через 1,5 години основні симптоми кропив’янки були інгібовані на 70% чи більше у 11/12 добровольців, що приймали біластин, та у 3/11, що приймали цетиризин (p=0,003). Автори дослідження зазначають, що біластин у дозі 50 мг мав більшу тривалість дії, ніж біластин у дозі 20 мг.
Іще одне цікаве дослідження R. Antonijoan і співавт. (2017) було проведене з метою порівняння ефективності біластину, дезлоратадину та рупатадину в усуненні симптомів кропив’янки, індукованої підшкірним введенням гістаміну здоровим добровольцям. На підставі результатів було встановлено, що біластин найкраще гальмував утворення нових пухирів, аніж дезлоратадин і рупатадин, в часовому проміжку 1-12 год (обидва р<0,001). Рупатадин і дезлоратадин виявилися кращими, ніж плацебо, і відрізнялися між собою. Максимальне інгібування симптомів спостерігалося через 6 год (біластин – 83%; дезлоратадин – 38%; рупатадин – 37%). Початок дії становив 1 год для біластину й 4 год – для дезлоратадину та рупатадину. Біластин значно перевершував дезлоратадин і рупатадин при інгібуванні симптомів через 1-24 год (обидва р<0,001) з початком дії протягом 30 хв. Біластин був значно кращим, аніж дезлоратадин (2-12 год; принаймні р<0,05) і рупатадин (2-9 год; принаймні р<0,01) щодо зменшення проявів свербіння. Ані дезлоратадин, ані рупатадин не зменшували свербіння порівняно з плацебо.
Всі активні методи лікування добре переносилися пацієнтами. Автори дослідження дійшли висновку, що біластин у дозі 20 мг набагато краще гальмує появу пухирів та висипу в провокованих гістаміном хворих порівняно із дезлоратадином у дозі 5 мг і рупатадином у дозі 10 мг упродовж 24-годинного періоду дослідження. До того ж біластин характеризувався найшвидшим початком дії. Відтак порівняно із плацебо тільки біластин спроможний достовірно знизити прояви свербіння.
Наше власне дослідження (T. Zuberbier et al., 2010) показало схожі результати. Ми порівнювали біластин у дозі 20 мг із левоцетиризином у дозі 5 мг під час лікування хронічної ідіопатичної кропив’янки. В дослідженні взяли участь 525 хворих із діагностованою хронічною кропив’янкою віком від 18 до 70 років. Критеріями включення були підтверджена хронічна кропив’янка в анамнезі, що спостерігається ≥3 разів на тиждень протягом 6 тиж скринінгового періоду та на момент рандомізації. Симптоми кропив’янки підраховували за допомогою шкали симптомів TSS (total symptom scores). Результати продемонстрували статистично значущу ефективність біластину у дозі 20 мг і левоцетиризину у дозі 5 мг при щоденному оцінюванні впродовж 28 днів, при цьому обидва препарати достовірно були кращими за плацебо. Вторинними кінцевими точками, що характеризували ефективність, були загальні клінічні враження, які повідомляли лікарі. Біластин і левоцетиризин виявилися достовірно ефективнішими за плацебо за цими кінцевими точками, при цьому різниця між двома активними препаратами була статистично незмінною.
M. Hide і співавт. (2017) у своєму дослідженні вивчали ефективність та безпечність біластину в лікуванні спонтанної кропив’янки в японських хворих. Загалом 304 пацієнти були рандомізовані на 3 групи: учасники першої групи приймали біластин у дозі 20 мг (101 пацієнт), другої – біластин у дозі 10 мг (100 пацієнтів) і третьої – плацебо (103 пацієнти). Зміни TSS протягом 2 тиж були суттєво виражені в групах хворих, які приймали біластин (у дозах 10 і 20 мг) порівняно із плацебо. Зміни TSS у групах біластину спостерігалися вже від 1-го дня і далі протягом усього періоду терапії. Лікування біластином було безпечним і добре переносилося, не виявляючи різниці із групою плацебо. Автори дійшли висновку, що лікування спонтанної кропив’янки біластином, навіть у невеликих дозах (10 мг), більш ефективне; при цьому спостерігається ранній початок дії.
Наразі існує велика кількість досліджень, що демонструють безпеку використання біластину, навіть в умовах тривалого застосування чи збільшеного режиму дозування. Наприклад, дослідження K. Krause і співавт. (2013) демонструє ефективність та безпечність застосування біластину в більших дозах при холодовій кропив’янці. В це рандомізоване подвійне сліпе плацебо-контрольоване 12-тижневе дослідження було залучено 20 пацієнтів із холодовою кропив’янкою. Вони отримували плацебо, біластин у дозі 20; 40 або 80 мг щоденно протягом 7 днів із наступною 14-денною перервою. Основною кінцевою точкою було обрано зміну критичних температурних порогів (КТП).
Вторинними кінцевими точками були зменшення свербіння, динаміка рівнів гістаміну, цитокінів IL‑6, IL‑8 і фактора некрозу пухлин альфа (TNF-α), безпечність та переносимість біластину. Біластин у дозі 20 мг виявився високоефективним (p<0,0001) засобом для зниження КТП. Збільшення дози до 80 мг ще більше (p<0,04) підвищило ефективність препарату. При цій дозі 19 із 20 (95%) пацієнтів відреагували на лікування. Рівні гістаміну, IL‑6 та IL‑8 оцінювали через 1-3 год після холодової провокації: ці показники значно (p<0,05) зменшувалися при застосуванні 80 мг біластину. Автори зазначають, що всі дозування біластину пацієнти добре переносили, і випадків підвищеної седації з ескалацією дози встановлено не було.
З огляду на результати вищенаведених, поки що не озвучених, проте дуже цікавих досліджень, можна зробити такі висновки:
• біластин – високоефективний антигістамінний засіб останньої генерації, який ефективний у пацієнтів із шкірними проявами алергії;
• біластин не поступається в ефективності усунення таких симптомів кропив’янки, як шкірний висип та свербіння, іншим антигістамінним засобам другого покоління, при цьому багато досліджень демонструють значні переваги ефективності лікування саме біластином;
• біластин – безпечний засіб; наразі серйозних побічних явищ не встановлено в жодному з відомих масштабних досліджень. При цьому біластин залишається безпечним навіть в умовах збільшеного дозування (до 4-кратного – 80 мг), що надзвичайно важливо в умовах необхідності застосування другої лінії терапії хронічної кропив’янки.
 Наукову частину сателітного симпозіуму доповіддю «Біластин у дитячій практиці: нові дослідження ефективності та безпеки в педіатрії» завершував професор Золтан Новак (відділ педіатрії та здоров’я дитини Клінічного центру Святого Георгія, Медичний факультет університету м. Сегед, Угорщина).
Наукову частину сателітного симпозіуму доповіддю «Біластин у дитячій практиці: нові дослідження ефективності та безпеки в педіатрії» завершував професор Золтан Новак (відділ педіатрії та здоров’я дитини Клінічного центру Святого Георгія, Медичний факультет університету м. Сегед, Угорщина).
– АР – найбільш поширений прояв алергії в дитячому віці. Особливо небезпечно те, що АР доволі часто є предиктором нападів бронхіальної астми (БА). При цьому більшість пацієнтів із уже встановленим діагнозом БА мають ті чи інші прояви АР. У загальній дитячій популяції поширеність АР наразі надзвичайно висока. Так, глобальне дослідження ISAAC (International Study of Asthma and Allergies in Childhood) продемонструвало, що поширеність алергічного ринокон’юнктивіту наразі сягає серед дітей віком 13-14 років 14,6%, 6-7 років – 8,5%. Сьогодні чимало науковців вивчають поширеність шкірних проявів алергії дитячого віку. Так, згідно з даними M.V. Greaves (2000) загальна поширеність серед дітей усіх форм кропив’янки у Великій Британії становить 3,4%, при цьому хронічна кропив’янка діагностується у 0,1-0,3% дітей. C.E. Grattan (2000) зазначає, що кропив’янка трапляється у 4,4% німецьких дітей, а N.F. Kjaer (2008) стверджує, що від неї потерпають 5,4% дітей Данії. S.J. Lee (2017) нещодавно опублікував статистику, згідно з якою 13,9% південнокорейських дітей стикаються із будь-якою формою кропив’янки, при цьому в 1,8% від загальної дитячої популяції діагностують хронічні форми захворювання.
Більшості практикуючим європейським лікарям відомі сучасні рекомендації з ведення хворих на АР. Не секрет, що провідна роль у лікуванні майже всіх форм захворювання належить Н1-антигістамінним засобам для перорального застосування. Легкі інтермітуючі форми захворювання потребують монотерапії зазначеним класом препаратів, більш тяжкі форми потребують номінативної терапії. Схожі схеми використовують і в лікуванні шкірних проявів алергії. Важливо наголосити, що останні можуть потребувати 4-кратного підвищення дозування антигістамінних препаратів, а будь-яка форма алергічного захворювання може вимагати тривалого застосування. Відтак важливим параметром антигістамінного препарату, що використовують у дитячій практиці, є його безпека.
Проте, як свідчать сучасні дослідження, багато хто з лікарів ігнорують цю вимогу. Так, за даними дослідження GA2LEN (M.K. Church et al., 2010), кожній третій дитині з алергічним захворюванням в Європі сьогодні призначають антигістамінний засіб першого покоління. Жахливо, що більшість із цих призначень є первинними. Неможливо зрозуміти, що примушує лікарів іти на цей крок, адже антигістамінні засоби другого покоління загалом не поступаються за своєю ефективністю препаратам першої генерації, при цьому не викликають седативних ефектів і вважаються набагато безпечнішими. Автори дослідження GA2LEN наголошують, що наразі немає жодних передумов призначення антигістамінних препаратів першої генерації в дитячій практиці, особливо при дебюті захворювання.
На щастя, сьогодні існує чимало сучасних протиалергічних засобів, дозволених до застосування в дитячій практиці. В інструкції більшості антигістамінних препаратів другої генерації повідомляється про такий дозвіл. Проте не кожний із цих засобів може «похвалитися» наявністю великої кількості досліджень саме в дитячій практиці. Крім того, не всі вони є однаково безпечними. Водночас багато лікарів та науковців звертають увагу на новий антигістамінний засіб останньої генерації – біластин. Цей препарат у ході багатьох досліджень виявив себе як ефективний та безпечний засіб. Зрозуміло, що його безпечність привернула увагу педіатрів. Наразі завершено кілька доволі масштабних досліджень із вивчення безпеки біластину саме для використання в дитячій практиці, і ще декілька цікавих досліджень тривають.
Ми провели власне дослідження, результати якого вперше опублікували в 2016 році. Слід зауважити, що це не перше наше дослідження вивчення безпечності біластину – у попередньому було встановлено, що біластин у дозі 10 мг у дітей віком від 2 до 12 років забезпечує еквівалентну 20 мг для дорослого організму системну експозицію препарату. В новому дослідженні оцінювали безпечність та переносимість біластину у дозі 10 мг у дітей з алергічним ринокон’юнктивітом та хронічною кропив’янкою. В останньому нашому мультицентровому подвійному сліпому дослідженні III фази пацієнтів було рандомізовано на 2 групи: учасники першої (n=260) протягом 12 тиж щодня отримували біластин у дозі 10 мг, другої групи (n=249) – плацебо. Оцінка безпеки включала вивчення побічних ефектів лікування, лабораторні дослідження, серцеву безпеку (записи електрокардіограми, ЕКГ) і сонливість / седативну дію (використовували анкету для педіатричного сну PSQ).
В результаті дослідження вдалося підтвердити еквівалентність біластину у дозі 10 мг дорослій 20-грамовій дозі. Відмінностей у кількості побічних явищ, параметрах ЕКГ, лабораторних показниках чи рівнях седації в обох групах достовірно виявлено не було. Кількість побічних явищ у групах біластину та плацебо виявилася приблизно однаковою (31,5 vs 32,5% відповідно). При цьому побічні явища були здебільшого легкими або середніми за тяжкістю, потреба у припиненні лікування виникла у двох пацієнтів із групи біластину та в одного – з групи плацебо, відмінності між цими параметрами не є достовірними. Було зроблено висновок, що параметри безпеки 10 мг біластину на добу як лікування АР чи кропив’янки у дітей віком від 2 до 12 років є схожими з такими у плацебо. Сподіваємося, що отримані дані дадуть змогу вже найближчим часом внести в інструкцію до біластину дозвіл на застосування засобу в дітей із 2 років (наразі препарат дозволено приймати дітям із 12 років).
З огляду на вищезазначене можна зробити такі висновки:
• біластин – безпечний засіб для лікування дітей принаймні з 2 років;
• біластин у дозі 10 мг для дітей (2-12 років) є еквівалентним дозі 20 мг для дорослого організму;
• біластин – ефективний у лікуванні як назальних, так і шкірних симптомів алергії дитячого віку.
Програма цьогорічного симпозіуму була дуже цікавою та насиченою, а участь у заході найавторитетніших європейських експертів – авторів та керівників сучасних наукових і клінічних досліджень – забезпечила отримання найновішої інформації з перших вуст.
У представлених доповідях було продемонстровано ефективність та безпечність нового антигістамінного засобу останньої генерації – біластину, який має широкі перспективи в лікуванні алергічної патології. Слід зауважити, що наразі біластин на світовому фармацевтичному ринку представлений єдиним оригінальним препаратом Ніксар® виробництва компанії Берлін-Хемі (Німеччина).
Підготувала Олександра Мєркулова
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 3 (40), жовтень 2017 р.