16 січня, 2018
Случай необычного роста злокачественной опухоли левого предсердия
 В литературе злокачественные опухоли сердца подразделяют на первичные (изначально поражающие структуры сердца) и вторичные (метастатические) новообразования [2, 4-9].
В литературе злокачественные опухоли сердца подразделяют на первичные (изначально поражающие структуры сердца) и вторичные (метастатические) новообразования [2, 4-9].
Около 75% всех первичных сердечных новообразований являются по своему гистологическому строению доброкачественными [4, 6, 7].
Первичные злокачественные сердечные новообразования встречаются крайне редко, что объясняется, по-видимому, особенностями метаболизма миокарда, коронарным кровотоком и ограниченностью лимфатических соединений внутри сердца [6, 7, 9]. На аутопсии они выявляются намного чаще, чем при клинических исследованиях. Вторичные опухоли сердца встречаются в 13-40 раз чаще, чем первичные [8]. Метастазирование в сердце или прорастание опухоли в миокард и перикард регистрируют, по различным данным, у 0,3-27% умерших от злокачественных новообразований. Метастазы в сердце чаще всего возникают на фоне развернутой клинической картины основного заболевания. При этом обычно обнаруживают первичный опухолевый очаг или уже имеющееся метастатическое поражение где-либо в грудной или брюшной полости. Наиболее часто такое вторичное поражение сердца наблюдается при раке легкого, пищевода, молочной или щитовидной железы, почек, а также при меланомах, лимфомах, миеломах, лимфогранулематозе [1, 3-5].
У большинства больных опухолевое поражение сердца служит причиной клинических проявлений, связанных с препятствием прохождения крови в полостях сердца. Поражая миокард, злокачественная опухоль может негативно влиять на его контрактильную способность. При этом клинические симптомы могут быть самыми различными. Чаще всего это одышка, появление систолического шума, признаки острого перикардита, тампонады сердца, быстрое увеличение сердечного контура при рентгенологическом исследовании, внезапно появившиеся нарушения ритма сердца, атриовентрикулярная блокада, застойная сердечная недостаточность и др. При опухолях сердца клинические проявления больше зависят от локализации и размеров опухоли, чем от ее гистологического типа. Многие из этих признаков и симптомов могут наблюдаться также при миокардитах, перикардитах, кардиомиопатиях или быть результатом лучевой терапии либо химиотерапии [3, 6-9].
В постановке правильного диагноза опухоли сердца и для визуализации новообразования неоценимую помощь оказывает эхокардиография (ЭхоКГ). Для уточнения диагноза дополнительно применяют такие диагностические инструментальные методы, как компьютерная и магнитно-резонансная томография для определения распространенности опухолевого процесса, а также в некоторых случаях для определения характера новообразования. Ангиография может выявить форму отдельных частей опухоли и ее влияние на гемодинамику [7].
Несмотря на применение представленных методов исследования, иногда определить распространенность и конфигурацию опухолевого процесса крайне сложно. Об этом свидетельствует случай необычного роста злокачественной опухоли сердца, который наблюдался в Национальном институте сердечно-сосудистой хирургии (НИССХ) им. Н.М. Амосова НАМН Украины.
В НИССХ им. Н.М. Амосова НАМН Украины с 1970 г. по настоящее время наблюдалось 60 больных с различными видами и локализацией злокачественных опухолей сердца, что составило 6,8% от общего количества поступивших пациентов с сердечными опухолями (889). Локализация злокачественной опухоли сердца в правом предсердии отмечена у 7 (11,7%) больных, что является третей по частоте локализацией изолированного выявления в камерах сердца данной патологии (наиболее часто – в левом предсердии (ЛП) – 23, или 38,3%).
Цель работы – представить случай поражения ЛП злокачественным новообразованием, характер и размер которого были распознаны только во время операции, а также особенности хирургического лечения такого поражения. Случай интересен в связи со сложностью диагностики и выявленной во время операции необычной конфигурацией опухолевого процесса.
Изучали особенности клинического течения заболевания. Применяли как лабораторные, так и инструментальные методы исследования, среди которых ведущая роль принадлежала трансторакальной и чреспищеводной двухмерной допплер-ЭхоКГ с цветным допплеровским картированием, позволившей выявить новообразование.
Клинический случай
Пациент Г., 22 года, история болезни № 878, поступил в НИССХ им. Н.М. Амосова НАМН Украины 17.02.2017 г. с диагнозом «миксома ЛП». Предварительный диагноз миксомы ЛП поставлен при комплексном обследовании в областной больнице по месту жительства, куда больной был госпитализирован 2 нед ранее по поводу кровотечения из язвы пилорического отдела желудка, остаточных явлений двусторонней нижнедолевой пневмонии. После проведенного лечения наступило улучшение. Однако при плановом проведении ЭхоКГ-исследования в полости ЛП было обнаружено подвижное новообразование. В связи с этим для уточнения диагноза и проведения кардиохирургической операции пациент был направлен в НИССХ им. Н.М. Амосова НАМН Украины.
Согласно данным анамнеза считает себя больным с апреля 2016 г., когда впервые возникли признаки острого нарушения мозгового кровообращения, проявившиеся преходящим ограничением движения правых конечностей и нарушением речи. Такие же преходящие нарушения повторно возникли в августе и ноябре 2016 г., сопровождались потерями сознания. При этом отмечались постоянные жалобы на одышку и утомляемость, связанные с физической нагрузкой, периодически возникающие боли в области сердца. Клинических признаков выраженной застойной сердечной недостаточности не было. Артериальное давление – 120/80 мм рт. ст. Семейный анамнез, анамнез жизни – без особенностей. При объективном обследовании отмечены бледность кожных покровов и слизистых, небольшой цианоз губ.
Со стороны других органов и систем, а также в результате лабораторных исследований патологических изменений не отмечено. Аускультативно определяется систолический шум малой интенсивности в проекции верхушки. Рентгенологическое исследование выявило незначительное увеличение сердца, отмечалось некоторое ослабление легочного рисунка. На электрокардиограмме – синусовый ритм с частотой сердечных сокращений 70 уд/мин. Признаков перегрузки желудочков сердца, коронарной недостаточности не выявлено. Общие клинические анализы крови и мочи, а также биохимический анализ крови были в пределах нормы.
При проведении двухмерной ЭхоКГ в ЛП лоцировалось крупное, хаотически подвижное, значительно фрагментированное бесформенное образование, пролабирующее в левое атриовентрикулярное отверстие, перемещаясь в систолу и диастолу, проникая в полость левого желудочка, достигая его верхушки. Опухоль не имела четких контуров, изменяя свою форму в процессе движения, с большой степенью вероятности отрыва ее фрагментов с угрозой эмболии. При этом место прикрепления четко уточнить не удалось, хотя было высказано предположение о ее возможном прикреплении в области правых легочных вен и купола ЛП. Согласно признакам, выявленным при проведении ЭхоКГ, дифференцировать характер опухоли не представлялось возможным. Сократимость и размеры левого желудочка были в пределах нормы (конечно-диастолический индекс – 117, фракция выброса – 55%). Определялась умеренная (до 1,5+) недостаточность митрального клапанного аппарата.
Заключение обследования невропатолога: смешанная энцефалопатия (посттравматическая – интоксикационная по анамнезу), четыре синкопальных пароксизма (начиная с апреля 2016 г.), чувствительная правосторонняя болевая гемигиперестезия.
Электроэнцефалография: низкоамплитудная, слегка дезорганизованная активность без локальной патологии. Функциональная реактивность ослаблена.
Эхоэнцефалоскопия: патологических изменений не выявлено.
Учитывая значительный риск фрагментации новообразования, больному предложено безотлагательное оперативное лечение, которое было проведено 17.02.2017 г. в условиях искусственного кровообращения. Предполагаемым объемом операции было удаление новообразования из ЛП и реконструктивная коррекция поражения митрального клапана.
По стандартной методике налажено искусственное кровообращение. Канюлированы аорта и полые вены. Операцию выполняли при умеренной гемодилюции и гипотермии (28 °C). Защита миокарда включала применение раствора «Кустодиол» и местное охлаждение сердца ледяной крошкой.
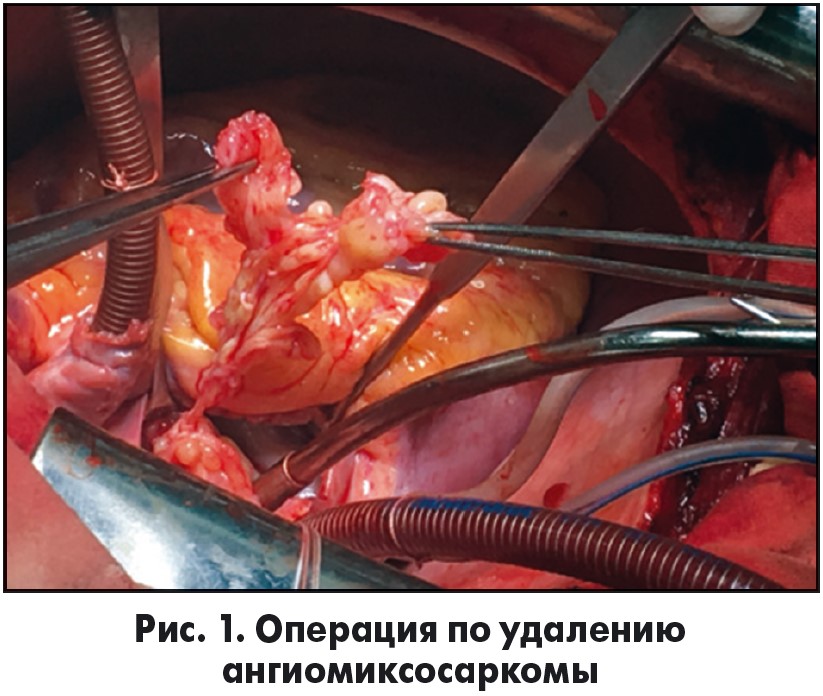
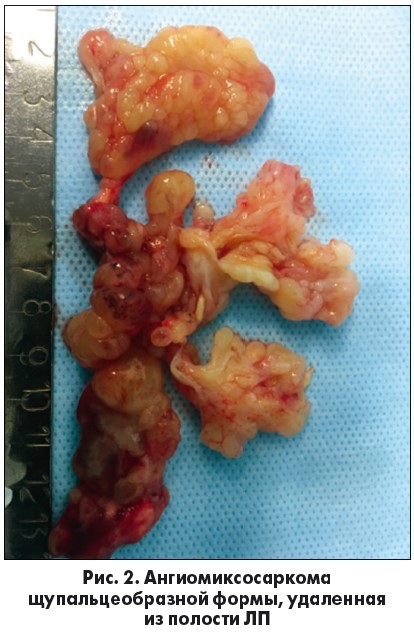
После продольного рассечения правого предсердия и межпредсердной перегородки в полости ЛП обнаружено белесоватое образование, плотноэластической консистенции и крайне необычной формы (рис. 1). Из просвета ЛП в полость правого предсердия извлечена опухоль, представленная множеством щупальцеобразных отростков, длина которых достигала 15 см (рис. 2). При этом наиболее длинные отростки располагались в просвете митрального клапана.
После удаления опухоли из ЛП осуществлена попытка удаления основания новообразования, которое распространялось от устьев левых легочных вен по куполу ЛП до устья правой нижней легочной вены. После удаления сращений опухоли с задней стенкой ЛП и самой опухоли иссечено основание опухоли с участком стенки ЛП размером 5×3 см. Иссечение задней стенки ЛП от устьев левых легочных вен до устья нижней легочной вены позволило полностью освободить полость ЛП от новообразования, достигнув радикальности операции. Подлежащие ткани обработаны диатермокоагуляцией. Края образовавшегося дефекта удалось сблизить и сшить двухрядным швом (пролен 4-0). Учитывая наличие митральной недостаточности за счет отрыва хорд от передней створки в сегментах АII и AIII, выполнена пластика митрального клапана: реимплантированы хорды в данные сегменты передней створки. При выполнении гидропробы и последующего ЭхоКГ-исследования зарегистрирована адекватная компетентность митрального клапана. При помощи экспресс-биопсии определена низкодиффенцированная ангиомиксосаркома. Диагноз был уточнен при более детальном гистологическом и иммуногистохимическом исследовании.
Послеоперационный период проходил без особенностей. В общеклиническое отделение пациент переведен на 2-е сутки. В удовлетворительном состоянии больной выписан на 12-е сутки после операции и направлен на дальнейшее лечение в онкологический стационар по месту жительства.
Обсуждение
Описанный случай является неординарным примером поражения злокачественным опухолевым процессом полости сердца. Ранее в нашей практике встречались пациенты со злокачественным поражением ЛП опухолью, прорастающей через просвет легочных вен, особенно из левой верхней легочной вены. Составляет определенные трудности проведение дифференциальной диагностики злокачественной опухоли с миксомой ЛП, тем более что миксома в 80% случаев локализуется именно в этой камере сердца и чаще всего имеет круглую или овоидную форму с короткими, подвижными отростками.
Выводы
Представленный случай демонстрирует возможность большого разнообразия форм и конфигураций злокачественного поражения ЛП, еще раз подтверждает реальность наличия опухолей, форму которых трудно дифференцировать без визуализации. При этом клинические проявления поражения сердца и магистральных сосудов, несмотря на наличие большого объема новообразования, могут быть крайне скудными.
Литература
1. Кипренский А.Ю., Нечаенко М.А. и др. Диагностика и хирургическое лечение немиксоматозных опухолей сердца // Казанский мед. журн. – 2014. – Т. 95, № 6. – С. 821-830.
2. Кнышов Г.В., Витовский Р.М., Захарова В.П. Опухоли сердца. – К., 2005. – 256 с.
3. Anvari M.S., Naderan M., et al. Clinicopathologic review of non-myxoma cardiac tumors: a 10-year single-center experience // Cardiology. – 2014. – Vol. 129. – P. 199-202.
4. Diaz А., Di Salvo C., et al. Left atrial and right ventricular myxoma: an uncommon presentation of a rare tumour // Interact. Cardiovasc. Thorac. Surg. – 2011. – Vol. 12, № 4. – P. 622-623.
5. Hoffmeier A., Sindermann J.R., Scheld H.H., et al. Cardiac tumors – diagnosis and surgical treatment // Deutsches Arzteblatt International. – 2014. – Vol. 111 (12). – P. 205-211.
6. Neragi-Miandoab S., Kim J., Vlahakes G.J. Malignant tumours of the heart: a review of tumour type, diagnosis and therapy // Clin. Oncol. (R. Coll. Radiol.). – 2007. – Vol. 19 (10). – P. 748-756.
7. Shanmugam G. Primary cardiac sarcoma // Eur. J. Cardiothorac Surg. – 2006. – Vol. 29 (6). – P. 925-932.
8. Simpson L., Kumar S.K., Okuno S.H., et al. Malignant primary cardiac tumors: review of a single institution experience // Cancer. – 2008. – Vol. 112 (11). – P. 2440-2446.
9. Yuan S.M., Shinfeld A., Lavee J., et al. Imaging morphology of cardiac tumours // Cardiol J. – 2009. – Vol. 16 (1). – Р. 26-35.
Статья была напечатана в журнале
«Кардіохірургія та інтервенційна кардіологія»,
№ 3, 2017.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (55) грудень 2017 р.