19 квітня, 2018
Антифосфоліпідний синдром: сучасний погляд на добре відому проблему
Огляд найбільш цікавих доповідей, представлених у рамках школи-семінару «Школа жіночого здоров’я «Гармонія гормонів – основа здоров’я жінки», яка відбулася в м. Києві 9-10 лютого, продовжимо з’ясуванням сучасного стану проблеми антифосфоліпідного синдрому (АФС) – клініко-лабораторного симптомокомплексу, що характеризується венозними та артеріальними тромбозами, патологією вагітності та деякими іншими клінічними проявами та порушеннями, патогенетично пов’язаними з синтезом антифосфоліпідних антитіл.

Програма наукового семінару передбачала обговорення не тільки проблем, з якими щодня стикаються акушери-гінекологи у своїй практичній діяльності, а й менш поширених патологічних станів, які часто перебувають поза увагою лікарів-клініцистів. Одній з таких проблем був присвячений виступ на тему «Антифосфоліпідний синдром очима лікаря акушера-гінеколога» завідувача кафедри акушерства, гінекології та перинатології факультету післядипломної освіти ДЗ «Дніпропетровська медична академія МОЗ України», доктора медичних наук, професора Юліанни Олександрівни Дубоссарської.
– Тромбофілія – це патологічний стан, який виникає при зміні якісних та кількісних властивостей крові, що призводить до розвитку тромбоемболії (переважно венозних судин) і рецидивуючих тромбозів. АФС як основну причину набутої тромбофілії описав британський вчений G. Hughes у 1983 році, який назвав цей стан «синдромом липкої крові».
АФС характеризується хронічним вазооклюзивним процесом, який супроводжується розвитком поліорганної ішемії, а в низці випадків – поліорганної недостатності, внаслідок рецидивуючого тромбоутворення у дрібних судинах внутрішніх органів на тлі циркуляції в крові вовчакових чи антифосфоліпідних антитіл (АФА). У 20% випадків АФС є причиною невиношування вагітності.
АФА у 2-5 разів частіше зустрічаються у жінок, проте їх наявність у сироватці крові не завжди свідчить про АФС. Клінічні прояви цього синдрому спостерігаються у 30% хворих із вовчаковими антитілами і 30-50% пацієнтів із помірним або підвищеним рівнем АФА. Тому однократне виявлення АФА у крові не є підставою для встановлення остаточного діагнозу.
Окрім хворих із АФС, АФА виявляють також у пацієнтів з інфекційними захворюваннями (за рахунок вірусно-бактеріальної мімікрії), на тлі медикаментозного лікування (при прийомі метилдофи, комбінованих оральних контрацептивів) і навіть у здорових людей.
Для пояснення патогенезу АФС актуальною є гіпотеза «подвійного удару». Її суть полягає у тому, що наявність АФА розглядається лише як фоновий чинник розвитку гіперкоагуляції. Подальша активація патогенетичного механізму залежить від низки пускових факторів (травми, інфекційних агентів, оперативного втручання та ін.).
Відповідно до наказу МОЗ України від 08.10.2007 № 626 «Про затвердження клінічних протоколів надання медичної допомоги хворим з імунними захворюваннями», АФС поділяють на: первинний (виникає за відсутності фонової аутоімунної патології, зустрічається у 7-12% випадків) та вторинний (ідентифікують у 88-93% хворих із АФС, розвивається на тлі аутоімунних захворювань, хронічної інфекції, онкологічної патології та у результаті прийому деяких медикаментів).
У 2006 році на конгресі Міжнародного товариства з вивчення тромбозів і гемостазу (ISTH) у м. Сідней були представлені клінічні критерії АФС, які умовно можна розділити на дві великі групи: тромботичний АФС – судинний тромбоз вен та артерій будь-якої локалізації, окрім поверхневих венозних тромбозів; акушерський АФС – патологія вагітності (внутрішньоутробна загибель морфологічно нормального плода в терміні 10 тижнів і більше, передчасні пологи до 34-го тижня вагітності, яка перебігала з тяжкою прееклампсією, еклампсією чи вираженою плацентарною дисфункцією, а також 3 і більше самовільних викиднів у терміні до 10 тижнів вагітності за умови виключення гормональних, анатомічних причин та хромосомних аномалій).
Згідно з цими критеріями плацентарну дисфункцію на тлі АФС слід діагностувати за наявності дистресу плода (за результатами ареактивного нестресового тесту при проведенні кардіотокографічного дослідження, нульовий кровотік за даними доплерометрії артерії пуповини), маловоддя (при індексі амніотичної рідини <5 см) та затримки росту плода (маса тіла при народженні менше 10-го перцентиля відповідно до гестаційного віку). Лабораторним критерієм АФС є наявність одного з трьох маркерів, яка визначається принаймні двічі з інтервалом не менше 12 тижнів після появи клінічних ознак (вовчакових антитіл, антитіл до кардіоліпіну та β2-глікопротеїну‑1).
Раціональний підхід у діагностиці АФС відповідно до вказаних критеріїв можна умовно описати як «1+1»:
- АФС діагностують тільки за наявності одного клінічного та одного лабораторного критеріїв;
- діагноз АФС не підтверджується, якщо інтервал між періодом, протягом якого спостерігалися клінічні ознаки, і позитивним тестом на АФА становить менше 12 тижнів або більше 5 років.
Відповідно до клінічного протоколу з акушерської та гінекологічної допомоги «Невиношування вагітності» (наказ МОЗ України № 624 від 03.11.2008) лікування АФС передбачає використання комбінованого підходу. У жінок із невиношуванням вагітності на тлі АФС лікування комбінаціями ацетилсаліцилової кислоти (75 мг/добу) та гепарину (низькомолекулярний гепарин (НМГ) – у середньопрофілактичній дозі чи препарати нефракціонованого гепарину (НФГ) – 5 000 ОД підшкірно кожні 12 год) достовірно знижує ризик самовільного викидня на 54% (рівень доказовості А).
Відповідно до рекомендацій Американської колегії торакальних лікарів (ACCP, 2012) жінкам зі звичним невиношуванням вагітності (≥3 випадків до 10-го тижня вагітності) рекомендовано проведення скринінгу на наявність АФА (рівень доказовості 1В).
Жінкам, які мають клінічні та лабораторні ознаки АФС, рекомендовано допологове призначення профілактичних чи середніх доз НФГ або профілактичних доз НМГ у поєднанні з низькими дозами ацетилсаліцилової кислоти по 75-100 мг 1 раз/добу (рівень доказовості 1В).
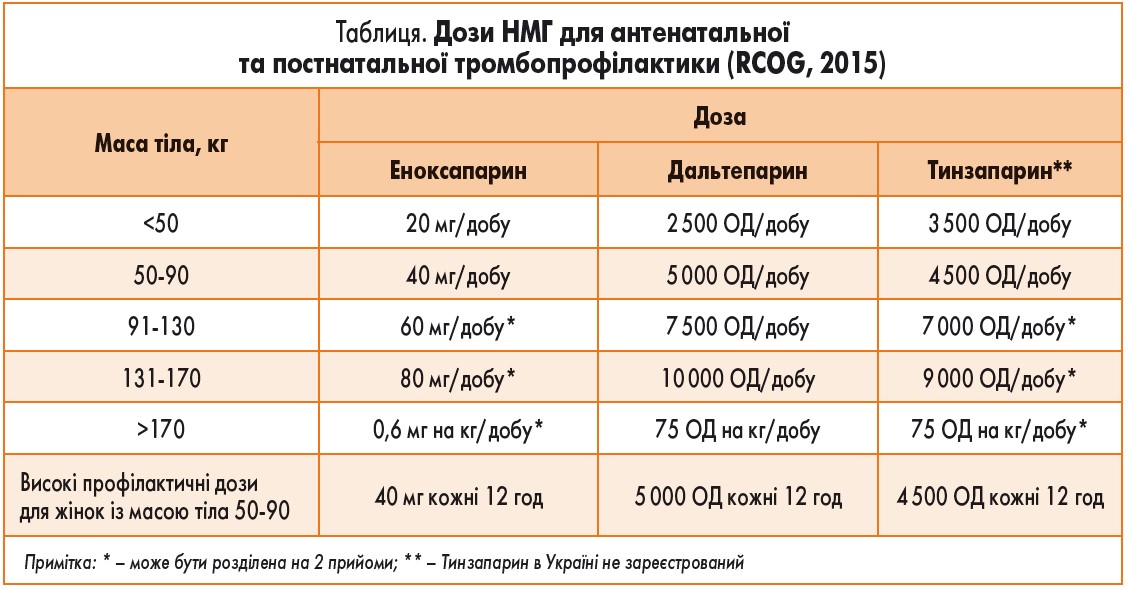
Рекомендовані протоколами Королівського коледжу акушерства та гінекології (RCOG, 2015) дози НМГ для антенатальної та постнатальної тромбопрофілактики наведені у таблиці.
Для підвищення ефективності комбінованої терапії АФС важливе значення має її своєчасне проведення. Відповідно до клінічного протоколу з акушерської та гінекологічної допомоги «Невиношування вагітності» (наказ МОЗ України від 03.11.2008 № 624) терапію низькими дозами ацетилсаліцилової кислоти слід розпочинати відразу після отримання позитивного результату тесту на вагітність та продовжувати до терміну пологів. НМГ або НФГ доцільно призначати у разі зареєстрованої за даними ультразвукової діагностики серцевої діяльності ембріона.
Якщо при попередніх вагітностях були випадки тромбозів, терапія НМГ або НФГ може бути подовжена до терміну пологів, а післяпологову тромбопрофілатику слід проводити протягом 6 тижнів (наказ МОЗ України від 15.06.2007 № 329 «Про затвердження клінічних протоколів надання медичної допомоги з профілактики тромботичних ускладнень у хірургії, ортопедії і травматології, акушерстві та гінекології»).
Окремим пунктом слід розглянути недостатність синтезу прогестерону на тлі АФС.
Відомо, що це порушення виникає внаслідок пригнічення АФА продукції хоріонічного гонадотропіну людини (ХГЛ), тобто АФА знижують продукцію прогестерону жовтим тілом та плацентою, що призводить до недостатньої інвазії трофобласта у децидуальну оболонку та активації імунних механізмів ініціації запалення і мікротромбоутворення. Саме тому у вагітних з АФС вкрай важливою є корекція рівня прогестерону починаючи з етапу прегравідарної підготовки (А.Д. Макацарія, В.О. Біцадзе, 2008; 2009).
При цьому не менш важливим є вибір найбільш ефективного засобу корекції рівня прогестерону, форма випуску якого дозволяє підібрати не тільки необхідну для кожної конкретної пацієнтки дозу, а й спосіб його застосування. У зв’язку з цим особливої уваги заслуговує мікронізований прогестерон, який представлений на фармацевтичному ринку України препаратом Лютеіна (таблетки сублінгвальні 50 мг, таблетки вагінальні 50, 100, 200 мг) компанії ТОВ «АДАМЕД» (Польща).
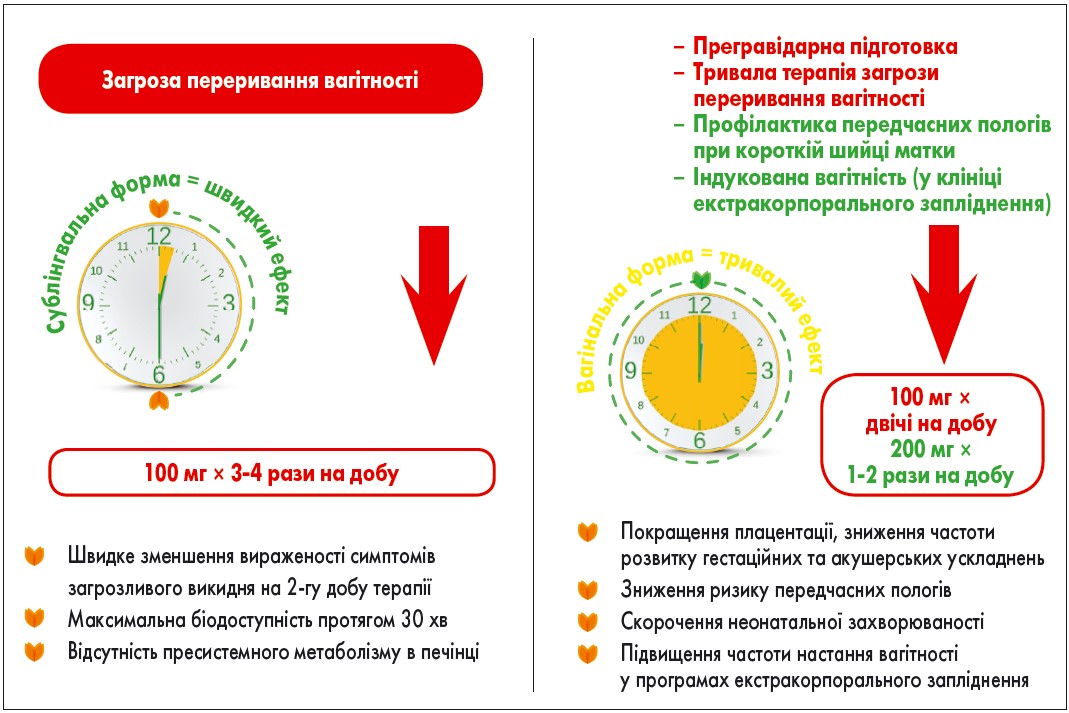
Сучасні форми мікронізованого прогестерону (Лютеіна) характеризуються високою біодоступністю для максимально швидкого ефекту та надають можливість вибору оптимальної схеми лікування за рахунок широкого діапазону дозувань і способів введення (рис.).
Рис. Схеми та переваги застосування мікронізованого прогестерону (Лютеіна) залежно від лікарської форми
Препарат Лютеіна 200 мг у формі вагінальних таблеток забезпечує стабільну концентрацію прогестерону протягом 24 год, що робить цю форму унікальною та зручною у використанні.
Отже, актуальність проблеми АФС в акушерсько-гінекологічній сфері полягає у тому, що цей стан, провокуючи такі ускладнення, як невиношування вагітності, гіпертензивні стани, передчасне відшарування плаценти, плацентарну дисфункцію, тромбози і тромбоемболії у матері, а також тромбози у плода і новонародженого, становить загрозу для здоров’я та життя матері, плода і новонародженого (B. Myers, S. Pavord, 2011). Тому в акушерській практиці раціональний підхід у веденні пацієнток з АФС має враховувати такі положення:
1) клініко-лабораторна діагностика відповідно до наявності критеріїв «1+1»;
2) профілактика акушерських ускладнень і тромбозів під час вагітності:
- фолієва кислота, мікронізований прогестерон (Лютеіна), ацетилсаліцилова кислота + НМГ/НФГ (терапія АФС);
- лікування рефрактерного АФС off-label;
- лікування основного захворювання на тлі вторинного АФС;
3) післяпологова тромбопрофілактика протягом 6 тижнів.
Що стосується АФС у гінекологічній практиці, лікар має враховувати те, що у разі виявлення у пацієнтки АФА призначення естрогенів, комбінованих оральних контрацептивів та проведення менопаузальної гормональної терапії протипоказано!
Підготували Антон Вовчек та Ілона Цюпа