23 січня, 2019
Ацетилцистеин как антиоксидант и дисульфидразрушающий агент
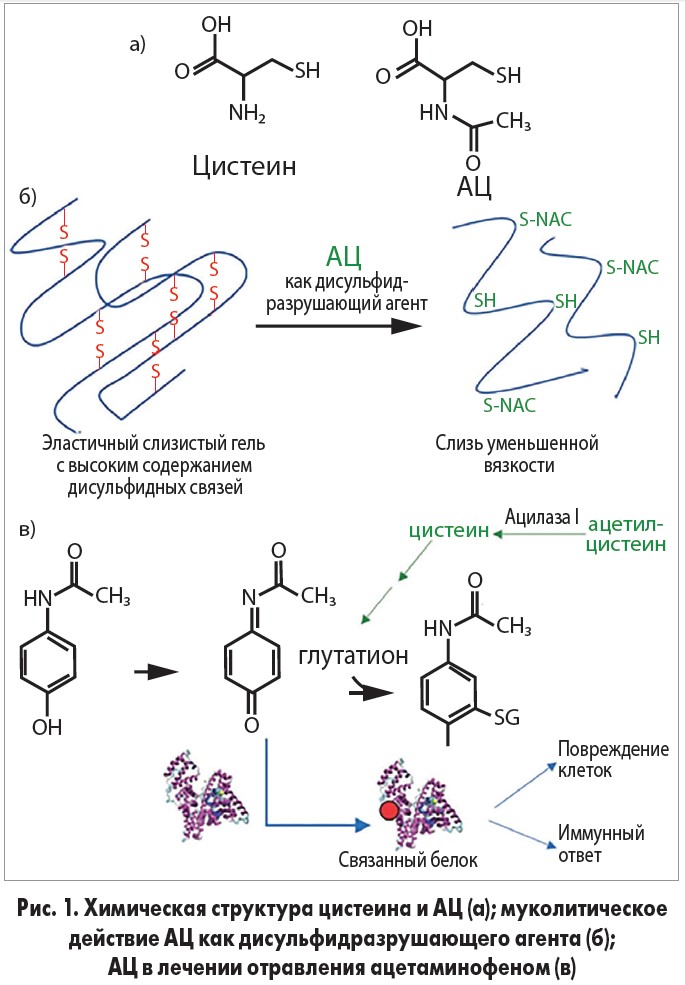 С 1960-х гг. ацетилцистеин – N-ацетиловое производное природной аминокислоты L-цистеина (рис. 1а) – широко назначается как муколитик [1], а с 1970-х гг. – как средство для лечения отравления ацетаминофеном [2]. Молекулярные механизмы этих терапевтических эффектов хорошо изучены.
С 1960-х гг. ацетилцистеин – N-ацетиловое производное природной аминокислоты L-цистеина (рис. 1а) – широко назначается как муколитик [1], а с 1970-х гг. – как средство для лечения отравления ацетаминофеном [2]. Молекулярные механизмы этих терапевтических эффектов хорошо изучены.
Муколитическое действие ацетилцистеина (АЦ) – результат свойства разрушать дисульфидные мостики между высокомолекулярными гликопротеинами слизи, что ведет к снижению ее вязкости (рис. 1б). [3]. Противодействие отравлению ацетаминофеном, в свою очередь, является следствием увеличения печеночных запасов восстановленного глутатиона – главного эндогенного пептида, способного нейтрализовать опасные метаболиты ацетаминофена (рис. 1в) [4]. С 1980-х гг. ацетилцистеин также предложено применять для лечения заболеваний, в патогенезе которых задействован оксидативный стресс [5].
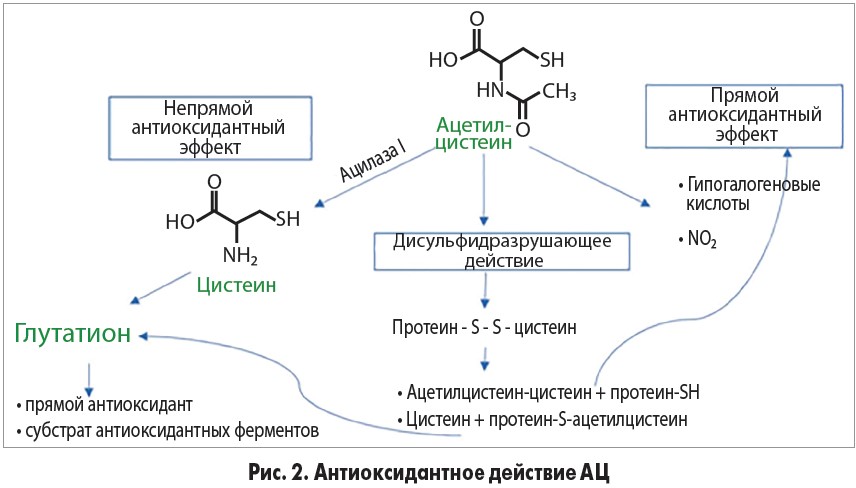
Антиоксидантное действие ацетилцистеина было показано в нескольких исследованиях in vitro и in vivo [5-10]. Преимущества АЦ – это не только хорошо описанное противодействие свободным радикалам, но и высокая стабильность молекулы, а также отличный профиль безопасности. Антиоксидантный эффект ацетилцистеина in vivo может быть связан как минимум с тремя различными механизмами: прямым антиоксидантным воздействием на некоторые оксиданты; непрямым антиоксидантным влиянием вследствие свойств ацетилцистеина выступать предшественником цистеина – важного элемента синтеза глутатиона, являющегося прямым антиоксидантом и субстратом нескольких антиоксидантных ферментов; разрушением дисульфидных связей и восстановлением пула тиоловых молекул, регулирующих редокс-процессы.
Антиоксидантное и восстанавливающее действие ацетилцистеина
Прямое антиоксидантное влияние ацетилцистеина
В лабораторных условиях АЦ, как тиоловое соединение, реагирует с большинством окислителей радикальной и нерадикальной природы. Однако для антиоксидантного действия в условиях живого организма скорость реакции экзогенно вводимого антиоксиданта (например, АЦ) с оксидантом должна превышать скорость взаимодействия последнего с эндогенными антиоксидантами, тем более с субстратами окисления. Скорость реакции рассчитывается как произведение концентрации молекул анализируемого антиоксиданта в месте продукции оксидантов и константы скорости реакции этого антиоксиданта со специфическим оксидантом. Для АЦ константы скорости реакции уже определены, а данные касательно концентрации в тканях известны [17]. Учитывая эти данные, можно определить, что, например, для пероксида водорода скорость реакции с ацетилцистеином и другими тиолами (цистеин, глутатион) намного меньше (примерно в 5 625 106 раз), чем скорость реакции с эндогенными антиоксидантными ферментами. Супероксид анион также не восстанавливается ацетилцистеин и другими тиоловыми соединениями, независимо от их концентрации. Таким образом, ацетилцистеин не способен противодействовать неблагоприятному влиянию пероксида водорода, супероксид аниона, пероксинитрита, однако для NO2 и гипогалогеновых кислот результаты являются более благоприятными [17] (рис. 2). К группе гипогалогеновых кислот относятся хлорноватистая кислота (HClO), гипобромная кислота (HOBr), родановатистая кислота (HOSCN), производимые в активированных нейтрофилах и моноцитах при воздействии миелопероксидазы [22]. Эти оксиданты – мощные бактерицидные и дезинфицирующие агенты, которые, однако, неспецифичны и реагируют также со многими биологически важными молекулами, индуцируя цитотоксичность и опосредуя такие болезни, как атеросклероз, рак, промиелоцитарная лейкемия, нейродегенеративные патологические состояния (болезнь Альцгеймера, рассеянный склероз) [22]. Миелопероксидаза и гипогалогеновые кислоты также задействованы в патофизиологии некоторых заболеваний легких. O’Donnell и соавт. [23] сообщили о наличии 3-хлортирозина (продукта реакции хлорноватистой кислоты с тирозином) в мокроте пациентов с хроническими обструктивными заболеваниями легких, а также о прямой корреляции концентрации этого вещества с активностью миелопероксидазы в мокроте. Было также показано, что высокие уровни активности миелопероксидазы, возрастание концентрации галогенированных белков, увеличение оксидативных связей и дисульфидных мостиков между белками отмечаются в слизи дыхательных путей пациентов с муковисцидозом. Это свидетельствует о том, что окислительные процессы, возникающие вследствие воспаления дыхательных путей, участвуют в образовании патологической гелеобразной слизи [24]. Гипогалогеновые кислоты достаточно активно реагируют с тиолами; исходя из константы скорости реакции, очевидно, что ацетилцистеин потенциально способен противодействовать этой группе оксидантов, если его относительная концентрация превышает таковую глутатиона и цистеина. Такое соотношение концентраций может возникать при воспалении респираторной системы [25].
Ацетилцистеин способен также улавливать молекулы оксида азота (NO2) – важного компонента как уличного, так и бытового загрязнения воздуха, поражающего эпителий легких. Оксид азота – это токсический газ, который продуцируется многими источниками (автомобили, сгорание топлива, табачный дым, газовые плиты). NO2 также образуется при воспалительных процессах [26]. Антиоксидантами, наиболее вероятно воздействующими на оксид азота, являются тиолы, восстановленные пурины (мочевая кислота), аскорбиновая кислота, фенолы [27]. Назначение ацетилцистеина вдыхавшим NO2 лабораторным крысам имело протекторное воздействие на дыхательную систему согласно показателям промывных бронхоальвеолярных вод и защищало пневмоциты 2 типа от повреждения [28]. Хотя ацетилцистеин является самым слабым из эндогенных тиоловых антиоксидантов, его молекула наиболее стабильна в водном растворе. Уровень деградации АЦ на протяжении суток составляет лишь 0,89% при комнатной температуре и 0,48% при хранении в холодильнике [29].
Известно, что в некоторых условиях каждый антиоксидант может выступать прооксидантом [30-32]. Это касается и АЦ [33-35], например в присутствии витамина В12 или ионов меди [37, 38]. Однако следует отметить, что прооксидантное воздействие ацетилцистеина в условиях in vivo маловероятно в связи с необходимостью соблюдения для этого многих специфических предпосылок.
Непрямое антиоксидантное действие ацетилцистеина
Глутатион – это трипептид, служащий субстратом или кофактором множества детоксицирующих клеточных ферментов, в т. ч. глутатионредуктазы, глутаредоксина, глутатионпероксидазы, пероксиредоксина, глиоксалаз 1 и 2, глутатионтрансферазы и др. [40]. В частности, глутатион участвует в восстановлении внутри- и межмолекулярных дисульфидных связей между протеинами и низкомолекулярными соединениями. Также глутатион задействован в процессах удаления из клетки пероксида водорода и других гидропероксидов, детоксификации 2-оксоальдегидов (глиоксаль, метилглиоксаль). 2-оксоальдегиды активируют образование конечных продуктов гликирования – важных участников воспалительного и профибротического ответа, что обусловливает необходимость их детоксификации [41-43].
В случае тяжелого и/или длительного оксидативного стресса по нескольким причинам может развиваться истощение запасов глутатиона [44]. Обзор литературы 1980-2016 гг., проведенный Asher и Guilford [45], показал, что многие оториноларингологические заболевания (ринит, аллергический ринит, хронический риносинусит, в т. ч. с полипами, средний отит c выпотом, хронический средний отит, в т. ч. с холестеатомой, склероз барабанной мембраны, тонзиллит, болезнь Меньера, болезни гортани, хронический кашель) ассоциируются с оксидативным стрессом и сниженным уровнем глутатиона как в пораженных тканях, так и системно [45]. Уменьшение концентрации глутатиона ассоциируется с типичными признаками старения и характеристиками многих болезней, в частности болезнью Паркинсона, аутизмом, шизофренией, биполярным расстройством, болезнью Альцгеймера [46-48]. Снижение уровня глутатиона в жидкостях дыхательной системы сопровождает прогрессирующие болезни легких (идиопатический фиброз), хотя в некоторых случаях наблюдается компенсаторное повышение уровня этого вещества [49].
Таким образом, если оксидативные состояния или воздействие ксенобиотиков снижают содержание глутатиона, ухудшая природные защитные механизмы организма, рациональной терапевтической стратегией является повышение его уровня. Ацетилцистеин увеличивает пул глутатиона, будучи предшественником цистеина – важного фактора клеточного биосинтеза этого вещества (рис. 2). В исследованиях in vivo продемонстрировано, что лечение ацетилцистеином повышало содержание глутатиона в тканях и соотношение глутатиона и его окисленного варианта в различных тканях организма (печень, почки, кожа, мозг), что сопровождалось уменьшением оксидативного повреждения [14, 52, 53]. В испытании с участием людей установлено, что пероральное назначение ацетилцистеина в дозе 800 мг/м2 сопровождается значительным повышением уровня глутатиона в лимфоцитах периферической крови [55]. Zembron-Lacny и соавт. сообщили, что применение 1200 мг ацетилцистеина здоровыми добровольцами на протяжении 8 дней достоверно повышает кровяной уровень глутатиона [15]. Kasperczyk и соавт. отметили повышение уровня глутатиона в эритроцитах при назначении 400-800 мг ацетилцистеина рабочим, контактировавшим со свинцом [15]. При внутривенном введении больным интерстициальным фиброзом легких ацетилцистеин достоверно повышал концентрацию глутатиона в промывных бронхоальвеолярных водах [56]. Подобные результаты были получены при пероральном лечении ацетилцистеином (3×600 мг/сут на протяжении 5 дней) пациентов с идиопатическим фиброзом легких [25].
Таким образом, истощение пула глутатиона сопровождается взаимодействием оксидантов и электрофильных соединений с биомакромолекулами, что ведет к повреждению последних. Назначение ацетилцистеина восстанавливает пул глутатиона, предупреждая деструктивные эффекты.
АЦ как дисульфидразрушающий агент
АЦ является эффективным восстановителем дисульфидов молекул белка путем взаимообмена тиоловыми и дисульфидными группами [57]. Скорость обменной реакции тиол-дисульфид для ацетилцистеина превышает аналогичные показатели для цистеина и глутатиона [58].
N-ацетильный остаток и карбоксилированная группа стабилизируют электронную плотность тиолата, усиливая нуклеофильный характер, что обеспечивает высокую активность в разрушении дисульфидных мостиков.
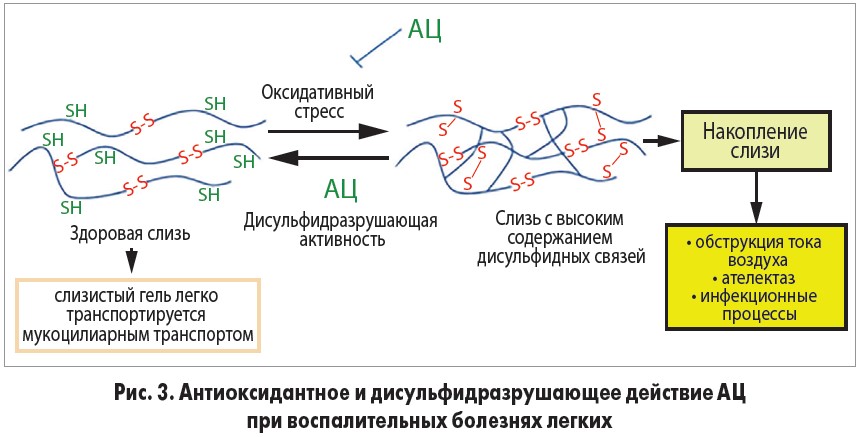
Ликвидация АЦ дисульфидных связей связана с муколитической активностью этого вещества. Полимеры муцина – главные гелеобразующие протеины слизи – характеризуются богатыми цистеином доменами в N- и C-терминальных участках, которые опосредуют удлинение полимеров путем соединения муциновых мономеров. Муцинам также присуще наличие богатых цистеином участков во внутренних доменах, которые образуют перекрестные связи при окислении [60]. В здоровых легких наблюдается малая доля перекрестных связей полимеров муцина, поэтому подобные гели легко передвигаются с помощью мукоцилиарного транспорта. При воспалительных заболеваниях легких т. н. оксидативный взрыв вызывает окисление внутренних молекул цистеина, что модифицирует биофизические свойства муциновых белков путем образования дисульфидных связей между этими молекулами. В результате формируется слизь с высоким содержанием перекрестных связей, которая плохо эвакуируется из дыхательных путей, накапливается и ведет к обструкции, ателектазу и созданию среды для развития инфекционных агентов (рис. 3) [24]. Способность АЦ разрывать перекрестные дисульфидные связи была подтверждена in vitro и in vivo [1, 61]. При пероральном приеме ацетилцистеина этот эффект несколько слабее, чем при непосредственном аэрозольном или бронхоскопическом введении, однако повышение уровней цистеина и/или глутатиона, вызванное пероральным приемом АЦ, также способно предупреждать образование перекрестных связей полимеров слизи. При инкубировании плазмы крови с ацетилцистеином на протяжении часа было обнаружено достоверное повышение свободного цистеина на фоне снижения связывания цистеина плазмы с белками [63].
Кроме того, циркулирующий ацетилцистеин влияет на содержание меркаптоальбумина в человеческом сывороточном альбумине – основном белке плазмы крови. Последний содержит лишь один цистеиновый остаток – Cys34, составляющий наибольший пул тиолов в системе кровообращения (около 80%) [65]. У здоровых взрослых примерно 70-80% альбуминового Cys34 содержит свободную сульфгидрильную группу (меркаптоальбумин), а остальная часть формирует дисульфидные связи с цистеином, гомоцистеином, глутатионом [66]. Сывороточный альбумин выступает главным антиоксидантом плазмы и внеклеточной жидкости; этот эффект в первую очередь опосредован остатком Cys34, способным улавливать такие оксиданты, как гидроксильный и пероксильный радикалы, пероксид водорода, пероксинитрит, а также блокировать продукты окисления липидов [67, 68]. Оксидативный стресс сопровождается уменьшением количества меркаптоальбумина и дальнейшим нарастанием проокислительных веществ [69-71]. Harada и соавт. [72] сообщили, что ацетилцистеин реагирует с дисульфидной связью цистеина в альбумине, приводя к диссоциации этой связи и образованию меркаптоальбумина. Свойство ацетилцистеина восстанавливать тиоловые белки и меркаптоальбумин крайне важно и требует дальнейшего изучения.
Выводы
АЦ – известный антиоксидант и дисульфидразрушающий агент, что было подтверждено многими исследованиями in vitro и in vivo с участием лабораторных животных и людей. В биологических организмах прямой антиоксидантный эффект АЦ не так важен, как роль предшественника глутатиона – известного антиоксиданта и субстрата антиоксидантных ферментов. АЦ способен пополнять пул глутатиона при его истощении, параллельно осуществляя функции прямого антиоксиданта для некоторых соединений. Недавно был открыт новый механизм влияния ацетилцистеина – способность разрушать тиолизированные белки. При этом высвобождаются свободные тиолы, обладающие более высокой антиоксидантной активностью, чем сам ацетилцистеин, и усиливающие синтез глутатиона, а также восстановленные белки, которые в некоторых случаях также могут противодействовать окислительным процессам. Это свойство особенно важно, поскольку белково-тиоловые смешанные дисульфиды могут являться участниками патогенетических механизмов некоторых болезней и в наше время рассматриваются как цели для создания направленных на них медикаментов. Moreno и соавт. сообщили, что дисульфидный стресс можно рассматривать как особенный тип оксидативного стресса при остром воспалении. Важно, что, разрушая дисульфидные связи между гликопротеинами слизи, АЦ осуществляет муколитическое действие.
Статья печатается в сокращении.
Aldini G., Altomare A., Baron G. et al. N-Acetylcys
teine as an antioxidant and disulphide breaking agent: the reasons why, Free Radical Research, 2018 Jul, 52:7, 751-762, doi: 10.1080/10715762.2018.1468564
Перевела с англ. Лариса Стрильчук
Информация для специалистов сферы здравоохранения
4-19-АЦЦ-ОТС-1018