18 липня, 2019
Огляд оновлених клінічних рекомендацій щодо ведення побічних реакцій при імунотерапії онкологічних захворювань
В останні роки імунотерапія раку стрімко розвивається. Ведуться дослідження уже відомого класу моноклональних антитіл і впроваджується в клінічну практику терапія модифікованими аутологічними Т-клітинами. Пропонуємо увазі читачів огляд оновлених рекомендацій National Comprehensive Cancer Network (NCCN) стосовно імунних побічних ефектів вищезгаданих препаратів.
Розвиток імунотерапії онкологічних захворювань
Перші стратегії імунотерапії раку були спрямовані на посилення протипухлинної відповіді імунної системи шляхом впливу на цитокіни й інші молекули, що регулюють імунну активність клітини. До цієї групи належать інтерлейкін (IL)‑2 та інтерферон (IFN) α‑2b, які використовували для терапії меланоми та нирковоклітинного раку. Імуномодулятори леналідомід і помалідомід, які раніше застосовували у лікуванні множинної мієломи, мають інший механізм дії. Він полягає, зокрема, у костимуляції Т-клітин та натуральних кілерів (NK-клітин), підвищенні продукції IL‑2 та IFN-γ та зниженні рівнів IL‑6 та фактора некрозу пухлини (TNF).
Нещодавно Управлінням з контролю якості харчових продуктів і лікарських препаратів США (FDA) були схвалені препарати для лікування онкологічних захворювань нового покоління: інгібітори імунних контрольних точок (immune checkpoint inhibitors, ICI) та Т-клітини з химерними рецепторами до антигенів (CAR-Т).
Інгібітори контрольних точок (ІКТ) впливають на такі контрольні точки імунних клітин, як білок запрограмованої клітинної смерті‑1 (PD‑1: ніволумаб, пембролізумаб), ліганд PD‑1 (PD-L1: атезолізумаб, авелумаб, дурвалумаб), а також цитотоксичний Т-лімфоцитасоційований антиген‑4 (CTLA‑4: іпілімумаб, тремелімумаб). Нині показання до застосування ІТК включають: рак легенів (дрібноклітинний та недрібноклітинний), голови та шиї, сечового міхура, нирки, шлунка, яєчника та печінки, а також меланому, лімфому Ходжкіна, карциному клітин Меркеля та пухлини із порушенням механізмів репарації. IКТ, які раніше застосовували для терапії пізніх стадій раку, зараз призначають на більш ранніх етапах лікування.
Найновішим доповненням до арсеналу засобів боротьби з онкологічними захворюваннями стала терапія CAR-T-клітинами. Зараз використовують методику генетичної модифікації рецепторів С19 аутологічних Т-клітин, що дозволяє імунній системі пацієнта розпізнавати та знищувати ракові клітини. На сьогодні FDA схвалені такі препарати цієї групи: axicabtagene ciloleucel для лікування дифузних В-великоклітинних лімфом (DLBCL) та tisagenlecleucel – для терапії DLBCL і гострого лімфобластного лейкозу, що походить із прекурсорів В-клітин.
Інгібітори контрольних точок
Активація Т-клітин є ключовим компонентом протипухлинного захисту. Проте неконтрольована активація може призводити до запуску аутоімунних процесів. Для підтримання імунологічної толерантності існують регуляторні імунні клітини, імуносупресивні цитокіни та хемокіни і контрольні точки імунної відповіді. Білки контрольних точок – це рецептори, що експресуються Т-клітинами і при зв’язуванні із відповідним лігандом запускають сигнальний каскад, який пригнічує Т-активацію. Злоякісні клітини можуть використовувати інгібувальні молекули для уникнення розпізнавання імунною системою та елімінації. ІТК – це препарати моноклональних антитіл, які блокують рецептори Т-клітин. Таким чином, супресія імунних клітин не відбувається, і активується протипухлинна відповідь.
CTLA‑4 – це негативний регулятор Т-клітинної активації, який експресується Т-хелперами (CD4+), Т-кілерами (CD8+) і Т-регуляторними клітинами (Treg). CTLA‑4 модифікує реакцію Т-лімфоцитів на активацію антигеном. Блокування CTLА‑4 призводить до збільшення кількості активних і проліферувальних Т-ефекторних клонів, а також до зниження імуносупресивної активності Т-регуляторів.
Рецептор PD‑1 міститься на мембрані багатьох імунних клітин, наприклад, Т- та В-лімфоцитів і NK-клітин. Ліганди цього рецептора експресуються у різних тканинах: PD-L1 характерний для більшості типів тканин і також продукується пухлинними клітинами, тоді як PD-L2 виробляється гемопоетичними клітинами. Цей сигнальний шлях інгібує вже активовані Т-клітини, пригнічує їх поділ через зниження рівнів IL‑2, IFN-γ, TNF. Блокується апоптоз ракових клітин, розвивається виснаження Т-клітин і переродження Т-ефекторів на Т-регулятори із супресивною активністю. Терапевтичний потенціал інгібіторів PD/PD-L1 полягає у реактивації Т-клітинних популяцій, виснажених тривалим впливом антигенів.
Імунна дисфункція, спричинена ІКТ
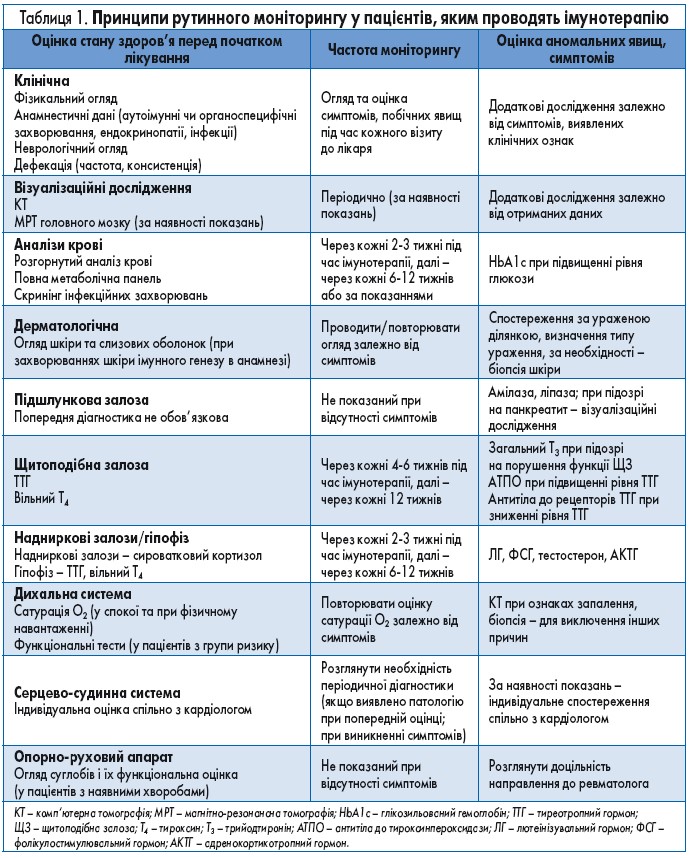
Фармакодинаміка та фармакокінетика ІТК значно відрізняються від таких цитотоксичної хіміотерапії та таргетної терапії. Розвиток токсичності при імунотерапії ІКТ так само різниться від побічних явищ під час традиційної терапії онкологічних захворювань, хоча певні симптоми можуть збігатися. Тоді як цитотоксична хіміотерапія часто супроводжується гострими побічними ефектами, такими як блювання та мієлосупресія, побічні явища при терапії ІКТ є більш віддаленими у часі і мають запальну чи аутоімунну природу (табл. 1).
Патофізіологія імунних побічних реакцій на введення ІКТ повністю не досліджена, проте наявні дані про вплив імунних чекпойнтів на розвиток аутоімунних захворювань. Багато аутоімунних хвороб пов’язані з порушенням Т-клітинної толерантності та неконтрольованою активацією імунних ефекторних клітин. Мутації у генах, що кодують білки імунних контрольних точок, можуть викликати аутоімунні захворювання. Так, поліморфізми CTLA‑4 та PD‑1 мають зв’язок із такими хворобами, як целіакія, цукровий діабет 1 типу, системний червоний вовчак, ревматоїдний артрит, аутоімунний тиреоїдит. Імунні побічні реакції, які виникають при блокаді імунних чекпойнтів, є дуже подібними до захворювань, спричинених мутаціями CTLA‑4 та PD‑1.
Існують докази того, що імунні побічні явища лікування ІКТ виникають унаслідок поєднаної дії аутореактивних Т-клітин, аутоантитіл і/або прозапальних цитокінів (наприклад, ІL‑17). Одним із потенційних механізмів може бути активація Т-клітин проти антигенів, які зустрічаються і в пухлинних, і в здорових клітинах. Наслідком Т-клітинної активації може бути запальна реакція в нормальних тканинах. Крім того, пряме зв’язування антитіл до імунних чекпойнтів із мішенями, що експресуються у нормальних тканинах (наприклад, експресія CTLA в епіфізі) може призвести до запалення, опосередкованого системою комплементу. Врешті, імунотерапія ІКТ може викликати підвищення рівнів уже існуючих аутореактивних антитіл.
Ранні та відкладені імунні побічні реакції можуть бути зумовлені певними механізмами, які ще не описані. Типові, поширені ранні побічні реакції, такі як висип, коліт і пневмоніт, спричинені генералізованим епітеліальним запаленням і накопиченням нейтрофілів у нормальних тканинах. Відкладені побічні ефекти, які є зазвичай менш поширеними, можуть включати неврологічні явища і запалення гіпофіза. Ці явища є загалом більш локалізованими й органоспецифічними. Нині проводяться дослідження, які допоможуть встановити зв’язок між терапією певними ІКТ та окремими імунними побічними реакціями.
Побічні явища при лікуванні ІКТ
- Інфузійні реакції: гіпертермія, озноб, головний біль, нудота, гіпер-/гіпотензія, задишка, свербіж (тяжкі <1%).
- Дерматологічні: макулопапулярний висип, свербіж, бульозний дерматит.
- З боку шлунково-кишкового тракту: діарея, коліт.
- З боку печінки: підвищення рівнів аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ); аутоімунний гепатит.
- З боку підшлункової залози: підвищення вмісту амілази, ліпази; гострий панкреатит.
- Ендокринні: аутоімунне запалення ЩЗ, гіпофіза, цукровий діабет 1 типу, первинна недостатність надниркових залоз.
- З боку легенів: пневмоніт.
- З боку нирок: піурія, імунне ураження нирок.
- Офтальмологічні: увеїт, епісклерит, блефарит, периферичний виразковий кератит.
- Неврологічні: міастенія, синдром Гієна – Барре, периферичні нейропатії, асептичний менінгіт, енцефаліт.
- З боку серцево-судинної системи: міокардит, кардіоміопатія, серцева недостатність, інфаркт міокарда.
- З боку опорно-рухового апарату: міозит, міалгії, артралгії, ураження суглобів.
Поширеність побічних явищ
Дані про поширеність токсичних ефектів, пов’язаних із застосуванням ІКТ, іще не повні. Більша частина інформації отримана із клінічних досліджень іпілімумабу, пембролізумабу та ніволумабу, тоді як дані про новіші препарати перебувають у процесі збору й обробки. Існує імовірність того, що реальна поширеність побічних явищ більша, ніж це показано у результатах досліджень. За даними різних авторів, поширеність побічних явищ при монотерапії становить від 15 до 90%, залежно від препарату. Серйозні побічні явища, які призводять до відміни препарату і потребують імуносупресивного лікування, під час монотерапії фіксували в межах 0,5-13%. Щодо комбінованої терапії, існують дані про відміну лікування ніволумабом та іпілімумабом через побічні реакції у 43% пацієнтів. Найчастішою причиною для відміни терапії був розвиток небажаних явищ з боку шлунково-кишкового тракту.
Побічні реакції при монотерапії CTLA‑4
За даними метааналізу 22 досліджень, що включали 1265 пацієнтів, які отримували інгібітори CTLA‑4 (Bertrand, 2015), загалом побічні явища були зафіксовані у 72% хворих, у 24% вони були серйозними. Найчастіше спостерігались дерматологічні та шлунково-кишкові побічні реакції, за ними йшли печінкові та ендокринні. Результати рандомізованого подвійного сліпого дослідження ІІІ фази у пацієнтів із меланомою, що не підлягає видаленню, та метастатичною меланомою показали дозозалежний ефект виникнення імунних побічних реакцій при терапії іпілімумабом у дозі 3 мг/кг маси тіла (n=362) або 10 мг/кг (n=364). Серйозні побічні явища були описані у 18% пацієнтів першої групи та 30% пацієнтів другої групи; у першій групі було задокументовано 2 летальні випадки, спричинені терапією, у другій – 4 випадки. Найпоширеніші серйозні побічні реакції, такі як діарея, коліт, підвищення рівнів печінкових ферментів і гіпофізит, із більшою частотою виникали у групі, яка отримувала вищу дозу іпілімумабу.
Побічні реакції при монотерапії PD‑1/PD-L1
За даними досліджень ІІІ фази, загальна частота побічних явищ будь-якого ступеня тяжкості під час лікування інгібіторами PD‑1/PD-L1 становила 30%. Зараз дані літератури свідчать про меншу дозозалежність побічних явищ при лікуванні інгібіторами PD‑1/PD-L1 порівняно з іпілімумабом. Нещодавно виконаний метааналіз показав, що поширеність усіх побічних реакцій під час терапії анти-PD‑1/PD-L1 становить 26,8%, а серйозні побічні явища виникають у 6,1% хворих. Частота побічних явищ тяжкого ступеня була подібною для пембролізумабу, ніволумабу й атезолізумабу і коливалась від 5 до 8%.
У публікації De Velasco та співавт. наведені дані метааналізу 21 рандомізованого дослідження ІІ/ІІІ фази, проведеного з 1996 по 2016 р. Загалом у нього були включені 6528 пацієнтів, які отримували монотерапію атезолізумабом (n=751), іпілімумабом (n=721), ніволумабом (n=1534) та пембролізумабом (n=1522), а також 4926 пацієнтів, що отримували плацебо або стандартне лікування – хіміотерапію та біологічні агенти. Через недосконалу діагностику та документацію рідкісних імунних побічних явищ у ході досліджень цей метааналіз був зосереджений на 5 найчастіших і добре описаних типах побічних явищ: коліт, ураження печінки (підвищення рівня АСТ), висип, гіпотиреоїдизм і пневмоніт. Порівняно з контрольною групою, пацієнти з групи ІКТ мали підвищений ризик розвитку цих ускладнень будь-якого ступеня тяжкості. У цій когорті частота серйозних побічних явищ була такою: коліт – 1,5%, ураження печінки – 1,5%, висип – 1,1%, гіпотиреоїдизм – 0,3%, пневмоніт – 1,1%. Тяжкий коліт і висип значно частіше розвивались у пацієнтів, які проходили терапію іпілімумабом, порівняно з інгібіторами PD‑1/PD-L1. У публікації Kumar та співавт. порівняно ризик розвитку імунних побічних явищ під час застосування різних класів ІКТ. Так, введення іпілімумабу асоціювалося з більшою частотою розвитку коліту, висипу, свербежу та гіпофізиту, інгібітори PD‑1/PD-L1 спричинювали вищий ризик розвитку вітиліго (частіше у пацієнтів із меланомою), дисфункції ЩЗ, гепатотоксичності та пневмоніту.
De Velasco та співавт. порівняли ризик розвитку специфічних імунних побічних ефектів залежно від типу пухлини (меланома, рак легенів тощо) та не виявили значних відмінностей у розвитку небажаних явищ. Khoja та співавт. також виконали систематичний огляд 48 досліджень, проведених у 2003-2015 рр., у якому аналізували імунні побічні реакції залежно від класу ІКТ та типу пухлини у 6869 пацієнтів. Більшість отриманих результатів були подібними до тих, що опублікували De Velasco та співавт., проте дані щодо інгібіторів PD‑1 дещо відрізнялися. Так, пацієнти з меланомою мали вищий ризик розвитку уражень шкіри та шлунково-кишкового тракту (ШКТ) і нижчу частоту пневмоніту порівняно із хворими на недрібноклітинний рак легенів. У пацієнтів з меланомою частіше розвивались артрит і міалгії, а з нирковоклітинною карциномою – пневмоніт і порушення дихання. Проте порівняння ризику розвитку побічних явищ залежно від типу пухлини було проведене без урахування таких факторів, як вік пацієнтів і куріння в анамнезі.
Стосовно показників безпеки анти-PD‑1-препаратів дані є неповними. Порівняння частоти виникнення імунних побічних явищ при призначенні інгібіторів PD‑1 та PD-L1 здебільшого ґрунтується на даних пацієнтів із недрібноклітинним раком легенів. Так, у метааналізі 2018 р., який охоплював 23 дослідження, порівняли показники токсичності інгібіторів PD‑1 (n=3284) та PD-L1 (n=2460). При цьому імунні побічні явища фіксували частіше у групі інгібіторів PD‑1 порівняно із групою PD-L1 (відповідно 16 та 11%; р=0,07). Тим не менше, не виявлено значної різниці у частоті виникнення серйозних небажаних явищ (5 та 3%; р=0,4). Під час призначення інгібіторів PD‑1 пневмоніт розвивався удвічі частіше (4 та 2%; р=0,01). Гіпотиреоїдизм також частіше спостерігався у групі PD‑1 (6,7 та 4,2%; р=0,07). Подібні результати були описані в метааналізі 2017 р. стосовно виникнення пневмоніту внаслідок терапії анти-PD‑1 (12 досліджень, n=3232) та анти-PD-L1 (7 досліджень, n=1806). Поширеність пневмоніту у цих двох групах становила відповідно 3,6 та 1,3% (р=0,001); пневмоніт тяжкого ступеня зустрічався в 1,1 та 0,4% випадків (р=0,02).
Комбінована терапія
Нині проводяться численні дослідження, метою яких є оцінка комбінованих терапевтичних режимів, що поєднують різні ІКТ, хіміотерапевтичні та біологічні агенти. Комбінована терапія є потенційно більш ефективною, та водночас токсичність протоколів ІКТ у поєднанні з іншими препаратами вища, ніж монотерапії ІКТ. Застосування комбінації інгібіторів PD‑1 та CTLA‑4 спричиняє значно вищий ризик виникнення імунних побічних реакцій, ніж тільки анти-PD‑1: серйозні побічні явища при комбінації препаратів виникають у 55-60% пацієнтів, тоді як при монотерапії анти-PD‑1 цей показник становить 10-20%.
На сьогодні FDA ухвалений тільки один режим комбінованої терапії ІКТ – ніволумаб + іпілімумаб для лікування пізніх стадій меланоми, нирковоклітинного раку та пухлин із мікросателітною нестабільністю. Комбінація ніволумабу й іпілімумабу порівняно з монотерапією іпілімумабом забезпечує вищу виживаність пацієнтів з меланомою.
Імуносупресивна терапія
Для купірування серйозних побічних явищ найчастіше використовують кортикостероїди. Важливо, що їх короткочасний прийом не знижує протипухлинну ефективність препарату. Для лікування вкрай тяжких і стероїдорезистентних реакцій застосовують також інші засоби (інгібітори TNF, мікофенолати, імуноглобуліни для внутрішньовенного введення, циклоспорин, метотрексат). При розвитку аутоімунних явищ можна проводити плазмаферез.
Оскільки інгібування контрольних точок активує імунну систему, пацієнти із аутоімунними захворюваннями, імунореактивними побічними реакціями та трансплантацією органів в анамнезі належать до групи особливого ризику. Дані про перебіг терапії та побічних реакцій у таких пацієнтів обмежені. У пацієнтів із обтяженим анамнезом щодо аутоімунних реакцій відповідь на терапію становить 20‑40%. У разі загострення основного захворювання застосовують терапію кортикостероїдами або іншими імуносупресантами; описані летальні випадки. Перед початком терапії ІКТ рекомендовано досягти дози кортикостероїдів <10 мг на добу. Хворі з неврологічними аутоімунними захворюваннями або тими, що становлять загрозу для життя, ймовірно, не є кандидатами для терапії ІКТ. При розвитку тяжких імунних побічних явищ необхідно припинити лікування, проте можна розглянути застосування іншого класу імунотерапевтичних препаратів.
Питання призначення ІКТ у хворих із трансплантатами потребує роботи мультидисциплінарної команди. Реципієнти солідних органів, для яких можлива альтернативна терапія у випадку відторгнення трансплантата (наприклад, діаліз у разі пересадки нирки), можуть бути кандидатами для ІКТ за умови підтримання стабільного режиму імуносупресії. На сьогодні не описано реакцій відторгнення у таких пацієнтів. У пацієнтів з алогенним трансплантатом кісткового мозку наявний підвищений ризик розвитку ускладнень, зокрема реакції трансплантата проти хазяїна.
Ведення імунних побічних реакцій при терапії ІКТ
Загалом при виникненні побічних явищ рекомендована консультація відповідних спеціалістів вузького профілю. Може знадобитися госпіталізація до високоспеціалізованого закладу, особливо у складних випадках або при виникненні мультисистемних побічних явищ. У зв’язку з особливостями імунної відповіді побічні реакції при ІКТ-терапії можуть розвинутися у будь-який момент під час лікування або навіть після його завершення. Описані випадки повторного виникнення імунних побічних ефектів під час зниження дози кортикостероїдів.
Питання відновлення терапії ІКТ після токсичної реакції потребує особливої уваги. Перед повторним призначенням лікування необхідно провести оцінку статусу пухлини. Якщо отримана терапевтична відповідь (повна або часткова), призначення ІКТ може бути не рекомендованим через ризик повторних імунних реакцій. Перед рестартом терапії ІКТ лікарі мають обговорити із пацієнтом співвідношення ризику та користі лікування.
Інфузійні реакції
Найчастіше інфузійні реакції описували під час застосування інгібітора PD‑1 авелумабу. Згідно із загальними даними щодо безпеки препарату, 25% (439/1738) пацієнтів мали інфузійні реакції; у 0,7% (12/1738) хворих розвинулись тяжкі побічні явища. Більшість із них виникла під час першої інфузії препарату, майже усі реакції розвинулися під час перших 4 інфузійних циклів. Премедикація може знизити частоту виникнення інфузійних реакцій тяжкого ступеня. В інструкції для застосування авелумабу регламентоване введення ацетамінофену та дифенгідраміну під час перших 4 циклів лікування.
Більшість асоційованих із використанням ІКТ інфузійних реакцій є легкими: незначні підвищення температури тіла, озноб, головний біль і нудота. Серйозні побічні явища виникають у менш ніж 1% пацієнтів. Інфузійні реакції будь-якого ступеня тяжкості розвиваються в 1,3% випадків застосування атезолізумабу, 2,2% – дурвалумабу, <10% інгібіторів PD‑1 та <1% – монотерапії іпілімумабом.
Перед призначенням ІКТ необхідно ознайомитися з інструкціями до препаратів щодо рекомендацій до премедикації. За відсутності специфічних показань, таких як імунні інфузійні реакції в анамнезі чи одночасна хіміотерапія, рутинна премедикація кортикостероїдами не рекомендована через потенційне зниження ефективності імунотерапії.
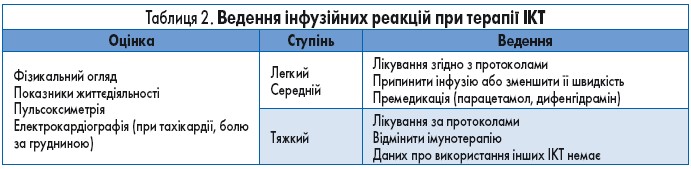
Алгоритм дій у разі виникнення інфузійних реакції поданий у таблиці 2.
Дерматологічні побічні явища
Дерматологічні прояви є найчастішими імунними побічними реакціями на терапію ІКТ. Прояви запалення на шкірі найчастіше виникають у межах перших 2 циклів лікування, тобто протягом кількох тижнів. Використання іпілімумабу асоційоване з вищим ризиком розвитку шкірних реакцій, ніж застосування інгібіторів PD‑1/PD-L1: відповідно 37-70% та 17-40% для побічних явищ усіх ступенів тяжкості. Серйозні небажані реакції з боку шкіри виникають з однаковою частотою (1-3%) при терапії усіма класами ІКТ. Загалом комбінація інгібіторів CTLA‑4 та РD‑1/PD-L1 спричиняла частіші та тяжчі побічні явища з раннім дебютом.
Найчастіше при терапії ІКТ виникає макулопапулярний висип, який може супроводжуватися свербежем. У пацієнтів із меланомою, які отримують інгібітори РD‑1, часто розвивається вітиліго, здебільшого на більш пізніх етапах лікування. Можуть також спостерігатись екзематозні, ліхеноїдні, псоріатичні елементи і прояви бульозного дерматиту, описані випадки алопеції та репігментації шкіри.
Більшість імунних шкірних реакцій є легкими і не потребують переривання введення ІКТ. Проте задокументовані окремі випадки виникнення синдрому Стівенса – Джонсона (токсичного епідермального некролізу), а також синдрому гіперчутливості з еозинофілією та системними проявами. Ці явища зазвичай потребували госпіталізації, системної імуносупресивної терапії та відміни ІКТ.
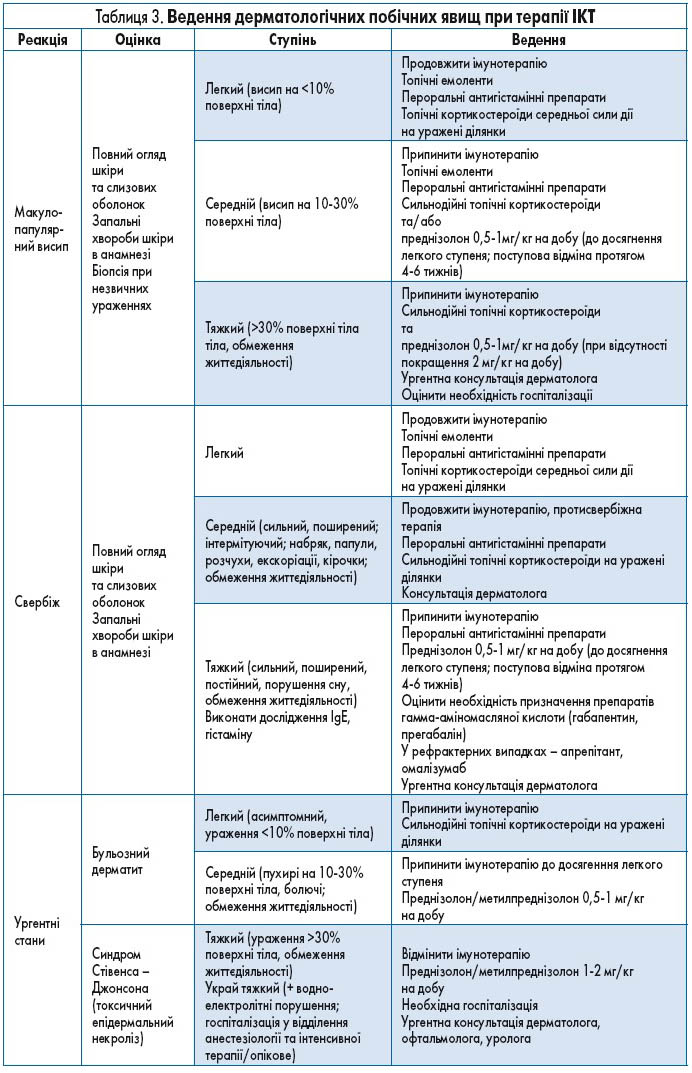
Рекомендації щодо ведення шкірних імунних реакцій подано в таблиці 3.
Побічні реакції з боку ШКТ
Діарея та коліт при терапії ІКТ найчастіше розвиваються упродовж 6-8 тижнів лікування і посідають друге місце за частотою виникнення. Гастроінтестинальні явища частіше розвиваються під час монотерапії анти-CTLA‑4 порівняно з інгібіторами PD‑1/PD-L1. При блокаді CTLA‑4 діарея виникала у 30-40% пацієнтів. Найвища частота ІКТ-асоційованих реакцій з боку ШКТ відмічалась при комбінованій терапії інгібіторами CTLA‑4 та PD‑1/PD-L1.
У метааналізі 34 досліджень (включені 8863 пацієнти із солідними пухлинами, які отримували ІКТ) проаналізовано частоту виникнення окремих імунних шлунково-кишкових побічних ефектів. Найбільша поширеність небажаних явищ з боку ШКТ спостерігалась під час комбінованого лікування іпілімумабом і ніволумабом: загальна частота коліту становила 13,6%, коліту тяжкого ступеня – 9,4%, а тяжкої діареї – 9,2%. Під час монотерапії іпілімумабом загальна поширеність коліту складала 9,1%, коліту тяжкого ступеня – 6,8%, діареї тяжкого ступеня – 7,9%. Монотерапія інгібіторами PD‑1/PD-L1 була асоційована із найнижчою частотою гастроінтестинальних побічних реакцій: загальна поширеність коліту становила 1,3%, коліту тяжкого ступеня – 0,9%, тяжкої діареї – 1,2%. Не виявлено значимої різниці щодо частоти виникнення побічних явищ у пацієнтів із різними типами пухлин.
Кортикостероїди є першою лінією терапії у разі імунних побічних реакцій з боку ШКТ. За даними ретроспективних досліджень пацієнтів з ІКТ-асоційованим ентероколітом, терапія кортикостероїдами виявилась ефективною у 40‑60% хворих. Проте тривалий прийом цих препаратів (довше 30 днів) асоційований із підвищенням ризику розвитку інфекцій порівняно із короткотривалою терапією кортикостероїдами та інфліксимабом. Наявні дані про успішне застосування інфліксимабу та ведолізумабу у терапії рефрактерного до кортикостероїдів ентероколіту.
Рекомендації щодо ведення пацієнтів із небажаними явищами з боку ШКТ наведені в таблиці 4.
Гепатотоксичність та панкреатотоксичність
Імунна гепатотоксичність при терапії іпілімумабом виникає у 3-9% пацієнтів, при лікуванні інгібіторами PD‑1/PD-L1 цей показник становить 0,7-1,8%. Комбінована терапія асоційована зі значно вищою частотою ураження печінки: загальна поширеність побічних реакцій складає 29%, частота серйозних реакцій – 17%. Середній час виникнення симптомів становить 5-6 тижнів від старту терапії, проте ознаки гепатотоксичності можуть з’явитися через кілька місяців.
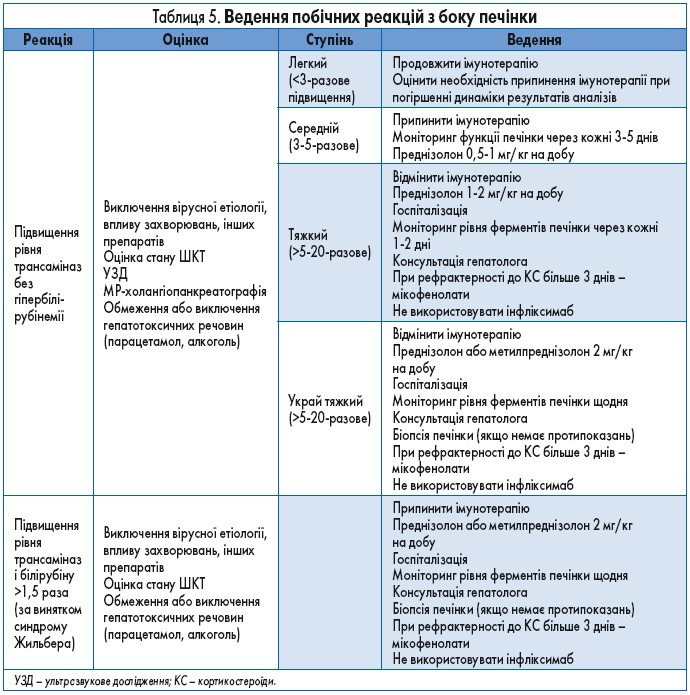
Із рекомендаціями щодо ведення пацієнтів з імунним ураженням печінки можна ознайомитись у таблиці 5.
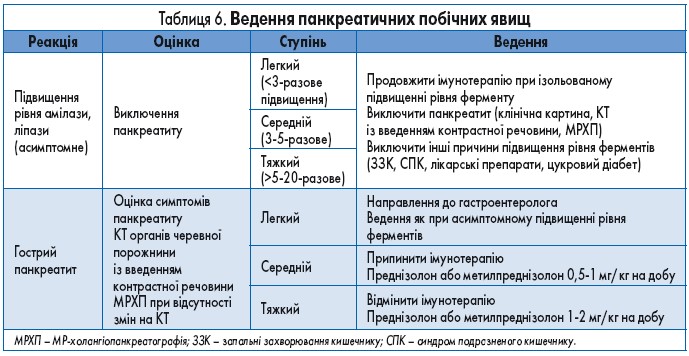
Під час терапії ІКТ може виникати підвищення рівня панкреатичної амілази та/або ліпази. Зазвичай ці зміни є асимптомними, і припинення імунотерапії у цьому випадку не рекомендоване. Описані випадки розвитку гострого панкреатиту під час імунотерапії ІКТ.
Алгоритм дій при виникненні панкреатотоксичності поданий у таблиці 6.
Ендокринна система
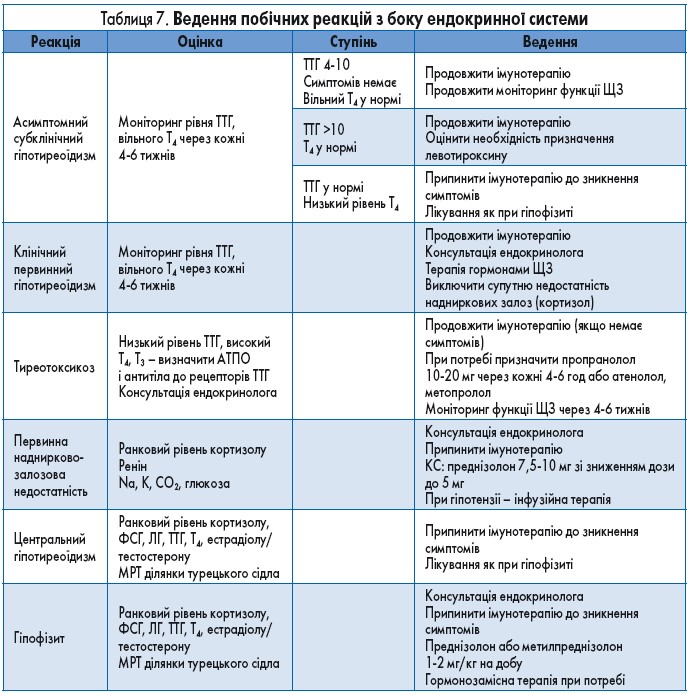
Діагностика та лікування ендокринопатій можуть становити серйозний виклик для клініциста. Багато симптомів ендокринної дисфункції є неспецифічними і можуть бути розцінені як прояви інших хвороб, у тому числі основного онкологічного захворювання. Важливо також встановити рівень ураження ендокринної системи – центральний (гіпофіз) чи безпосередньо залоз внутрішньої секреції. Терапія з приводу цих ускладнень має проводитись із обов’язковою участю ендокринолога.
Із рекомендаціями щодо ведення пацієнтів з імунними ендокринопатіями можна ознайомитись у таблиці 7.
Ураження серцево-судинної та дихальної систем
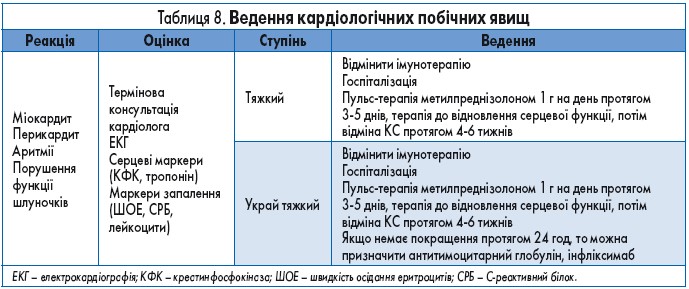
Кардіологічні побічні явища (міокардит, кардіоміопатія, фіброз, серцева недостатність, інфаркт міокарда) документували при застосуванні іпілімумабу, пембролізумабу та ніволумабу. Факторами ризику виникнення серцево-судинних імунних ускладнень є комбінована ІКТ-терапія та цукровий діабет. Ці явища можуть становити серйозну загрозу для життя пацієнта, тому у разі їх виникнення потрібна негайна госпіталізація та консультація кардіолога (табл. 8).
Із боку дихальної системи при терапії ІКТ може виникати неінфекційне запалення легенів (пневмоніт). Загальна поширеність цього явища при лікуванні препаратами анти-PD‑1/PD-L1 становить близько 5%, із яких 1% складає тяжкий пневмоніт. Введення іпілімумабу асоційоване з нижчою частотою пневмоніту (до 1%), а комбінована імунотерапія – з вищою частотою, ніж монотерапія інгібіторами РD‑1/PD-L1. У таблиці 9 подані рекомендації щодо діагностики та лікування ІКТ-асоційованого пневмоніту.
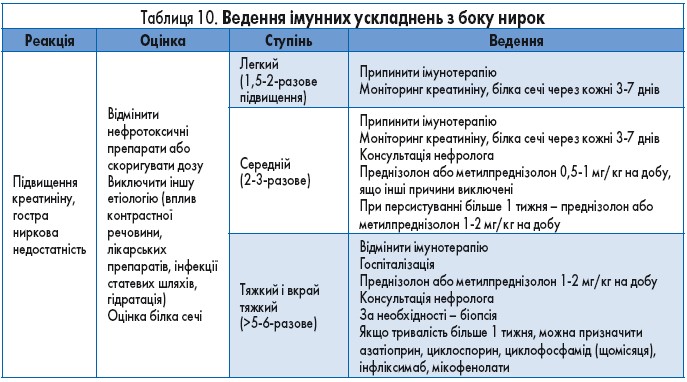
Імунні ураження нирок
Загальна поширеність побічних явищ з боку нирок оцінюється у 2% у випадку монотерапії і до 4,9% при комбінованій терапії ІКТ. За даними огляду клінічних досліджень ІІ і ІІІ фази (n=3659), частота серйозних ниркових побічних ефектів становила 0,6%. Від початку лікування іпілімумабом до появи симптомів минало 6-12 тижнів, інгібіторами PD‑1 – 3-12 міс. Ведення пацієнтів з імунними ураженнями нирок подано в таблиці 10.
Імунні ураження опорно-рухового апарату
За даними нещодавно виконаного систематичного огляду літератури (33 клінічні дослідження, 3 обсерваційні дослідження, 16 клінічних випадків), артралгії та міалгії були найчастішими імунними побічними явищами з боку опорно-рухового апарату (від 1 до 43%). У 5 клінічних дослідженнях були задокументовані випадки розвитку артриту; також описані випадки васкуліту, міозиту та вовчакового нефриту. Терапія при цих ускладненнях полягає у призначенні КС і додаткових імуносупресивних препаратів за потребою (табл. 11).
Окулотоксичність
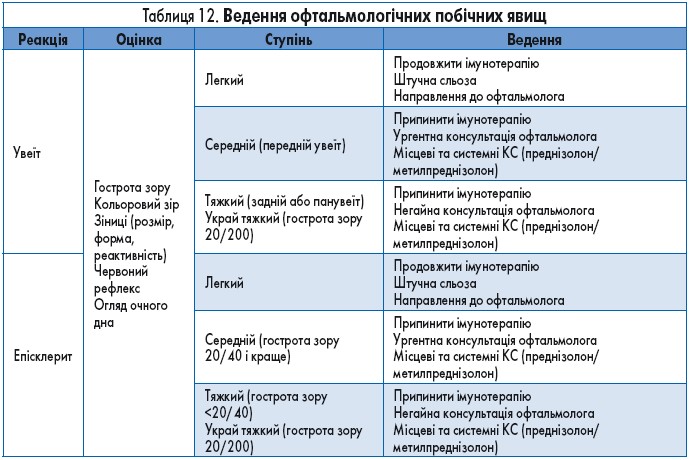
Ускладнення з боку органа зору класифікують за ділянками ураження: запалення очного яблука (увеїт, епісклерит, блефарит, периферичний виразковий кератит), запалення орбіти/орбітопатія (наприклад, ідіопатична чи тиреоїд-індукована), ураження сітківки та хоріоїду (ретинопатія, хоріоїдна неоваскуляризація) та оптична нейропатія. Найчастішими ІКТ-асоційованими ускладненнями з боку очей є синдром сухого ока та увеїт, які за різними даними зустрічаються в 1-24% хворих. Терапія при побічних реакціях легкого ступеня полягає у застосуванні топічних КС, тоді як серйозні ускладнення потребують призначення системних КС та відміни імунотерапії (табл. 12).
Нейротоксичність
Неврологічні ускладнення ІКТ-терапії можуть бути складними для діагностики через неспецифічність і варіабельність симптомів та широкий спектр диференційних діагнозів. Описані такі побічні явища, як myasthenia gravis, синдром Гієна – Барре, центральна та периферична нейропатія, асептичний менінгіт і поперечний мієліт. За винятком периферичних нейропатій усі ці реакції зазвичай бувають середнього і тяжкого ступенів. За даними систематичного огляду літератури (59 досліджень, n=9208), загальна частота неврологічних побічних реакцій становила 3,8% при терапії інгібіторами CTLA‑4, 6% – препаратами анти-PD‑1 і 12% – при комбінованій терапії. Найчастішими побічними ефектами були головний біль, енцефалопатія і менінгіт; середній час від початку терапії до появи симптомів становив 4-6 тижнів. Поширеність серйозних побічних реакцій на усі режими імунотерапії становила близько 1%.
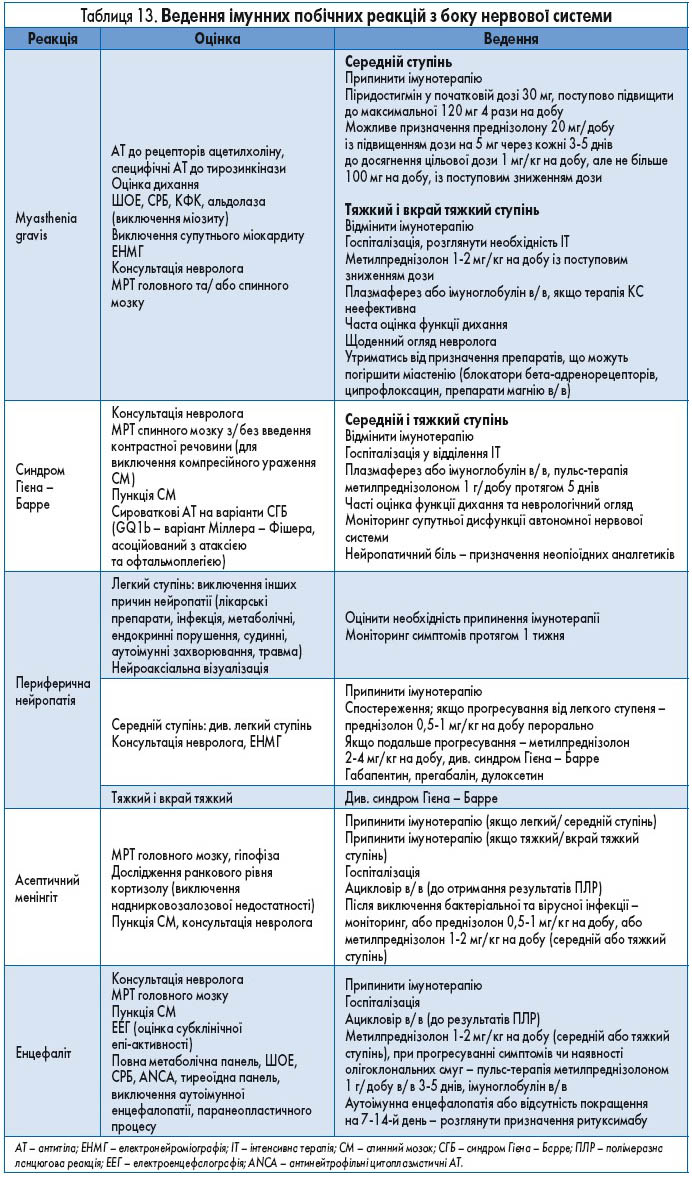
Рекомендації стосовно ведення пацієнтів з ураженням нервової системи наведені у таблиці 13.
Терапія CAR-Т
CAR-Т містять синтетичні рецептори, що перепрограмовують Т-клітини. Ці рецептори складаються з компонентів комплексу CD3 та костимулювальних доменів, і завдяки цьому слугують і для активації Т-лімфоцитів, і для підтримання їх життєздатності та персистенції. Модифіковані клітини з геном химерного рецептора можуть розпізнавати поверхневі антигени без участі головного комплексу гістосумісності.
Побічні явища, асоційовані із терапією CAR-T, згруповано в таблиці 14.
Підготувала Ганна Гаврюшенко
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 2 (58), 2019 р