5 вересня, 2019
Patient Blood Management пацієнтів із політравматичними ураженнями
17-20 квітня в Києві відбувся одинадцятий Британо-Український симпозіум «Інноваційні технології та методики в анестезіології та інтенсивній терапії». Одне із секційних засідань форуму було присвячене проблемам Patient Blood Management, інфузійної терапії, печінкової недостатності.
 Доповідь «Patient Blood Management. Хірургія. Політравма» представив учасникам заходу президент Асоціації анестезіологів України, професор кафедри анестезіології та інтенсивної терапії Національного медичного університету ім. О.О. Богомольця (м. Київ), доктор медичних наук Сергій Олександрович Дубров.
Доповідь «Patient Blood Management. Хірургія. Політравма» представив учасникам заходу президент Асоціації анестезіологів України, професор кафедри анестезіології та інтенсивної терапії Національного медичного університету ім. О.О. Богомольця (м. Київ), доктор медичних наук Сергій Олександрович Дубров.
Переливання крові та її компонентів залишається однією з найбільш поширених медичних процедур: щорічно у світі проводиться забір близько 110 млн доз цільної крові та майже стільки ж переливається. У США приблизно кожен 10-й пацієнт, якому проводяться інвазивні процедури в стаціонарі, потребує гемотрансфузії (Healthcare Cost and Utilization Project, 2011). При цьому у близько 40-60% випадків гемотрансфузія проводиться не за показаннями (Shander A. et al., 2011).
Використання препаратів крові достовірно пов’язане зі зростанням кількості післяопераційних ускладнень (безпосередньо не пов’язаних із трансфузією) та 30-денної летальності у хірургічних хворих (Beal E.W. et al., 2018). На думку більшості дослідників, кожна доза крові, що переливається, є незалежним фактором ризику ускладнень та несприятливих результатів лікування (Müller S. et al., 2018).
Професор С.О. Дубров зауважив, що останнім часом для оптимізації ведення пацієнтів у періопераційний період у медичну практику впроваджена програма Patient Blood Management. За визначенням ВООЗ (2011), Patient Blood Management – це система заснованих на доказовій медицині пацієнт-орієнтованих підходів, спрямованих на оптимізацію використання компонентів крові, що має на меті зниження їх неналежного використання та покращення якості лікування хворих.
Програма Patient Blood Management включає такі основні компоненти:
- рання діагностика й лікування передопераційної анемії у пацієнтів, які підлягають хірургічному втручанню з високою ймовірністю гемотрансфузії;
- мінімізація крововтрати та інтенсивне застосування кровозберігаючих засобів;
- раціональне використання алогенних препаратів крові відповідно до гайдлайнів.
Згідно з критеріями ВООЗ, анемія – це зниження показника гемоглобіну (Hb) крові нижче 130 г/л для чоловіків та 120 г/л для жінок. Приблизно 39% пацієнтів, яким виконується планове хірургічне втручання, мають вихідну анемію різного ступеня (Muñoz M. et al., 2017). У понад половини (62%) хворих із передопераційною анемією присутній абсолютний залізодефіцит. Анемія до операції є незалежним фактором ризику ускладнень та летальності в післяопераційному періоді, а також ймовірності гемотрансфузій. Цей факт підтверджено результатами проспективного дослідження, проведеного на базі The American College of Surgeons’ National Surgical Quality Improvement Program (n=227 425; 211 клінік). Автори дійшли висновку, що періопераційна анемія, навіть легкого ступеня, асоціюється з підвищеним ризиком 30-денної летальності після хірургічних втручань (рис. 1). За даними A.A. Kleinetal (2016), тривалість періопераційної анемії також є незалежним фактором ризику захворюваності й смертності пацієнтів.
Доповідач зазначив, що протягом останнього десятиліття було опубліковано декілька гайдлайнів щодо лікування періопераційної анемії. Проте існує цілий ряд суперечностей стосовно поширеності, наслідків, діагностики й лікування анемії та дефіциту заліза у пацієнтів хірургічного профілю, а також невідповідність термінології. Тому у 2017 році міжнародною групою експертів-анестезіологів був ухвалений консенсус, у якому, зокрема, зазначається:
- лікарями має визнаватись, що наявність передопераційної анемії та залізодефіциту потребує особливого періопераційного підходу до ведення пацієнтів від прийняття рішення про операцію до виписки;
- наявність анемії у хворого має бути встановлена при плануванні всіх хірургічних втручань з очікуваною крововтратою помірного та тяжкого ступеня (понад 500 мл);
- великі неургентні оперативні втручання слід відкласти на термін, необхідний для діагностики та лікування анемії та супутнього залізодефіциту;
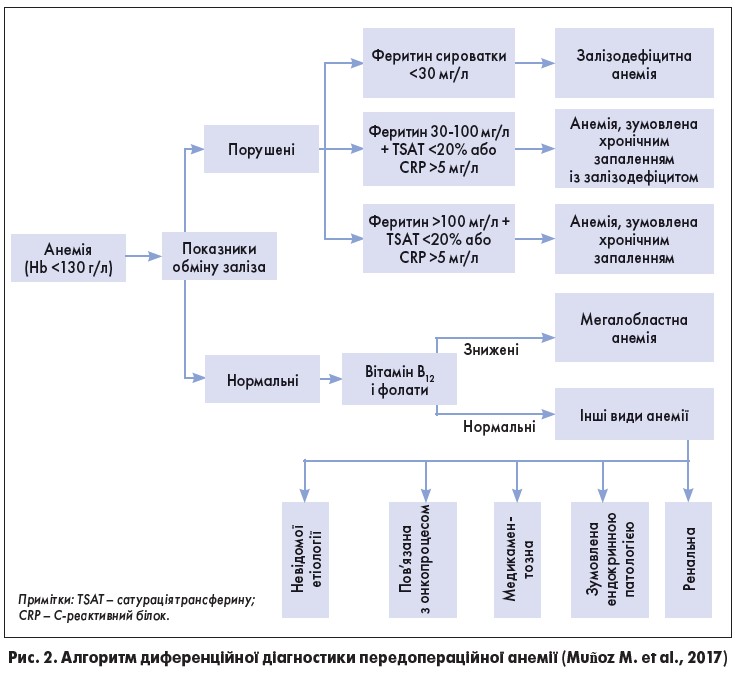
- рівень феритину сироватки <30 мкг/л є найбільш чутливим та специфічним показником абсолютного залізодефіциту, хоча значення <100 мкг/л також свідчить про залізодефіцит за наявності запального процесу (рівень C-реактивного білка [CRP] >5 мг/л);
- цільовий рівень гемоглобіну при передопераційному лікуванні анемії має складати 130 г/л для обох статей;
- пероральну замісну терапію препаратами заліза слід проводити пацієнтам із встановленим залізодефіцитом із або без анемії, якщо операція запланована через 6-8 тижнів від моменту його встановлення;
- парентеральні форми заліза також є безпечними та ефективними й використовуються у разі непереносимості/неефективності пероральних препаратів або якщо планова операція не може бути відкладена на достатній строк (<6 тижнів до планового втручання);
- діагностику та лікування анемії й залізодефіциту слід розпочинати якомога раніше (бажано з моменту прийняття рішення про операцію).
У даному документі наведено алгоритм диференційної діагностики передопераційної анемії (рис. 2).
При використанні еритроцитарної маси для лікування анемії у стабільних хворих без кровотечі історично склалися дві стратегії: ліберальна (трансфузія проводиться при зниженні показника гемоглобіну до рівня <90-100 г/л) і рестриктивна (трансфузія проводиться лише при значеннях гемоглобіну <70-80 г/л, з винятками для певних категорій хворих). Підґрунтям у виборі між цими двома підходами до лікування можуть бути результати двох незалежних метааналізів (Holst L.B. et al., 2015; Carson J.L. et al., 2016). Автори обох досліджень дійшли висновків, що рестриктивна стратегія гемотрансфузії не пов’язана з підвищенням летальності та кількості ускладнень порівняно з ліберальною; використання рестриктивної стратегії знижує ризики переливання еритроцитарної маси хворим майже вдвічі.
С.О. Дубров нагадав присутнім, що відповідно до клінічних настанов Великої Британії (National Institute for Health and Care Excellence, NICE, 2015), рестриктивна стратегія рекомендована для всіх хворих без масивної кровотечі. Експерти NICE рекомендують дотримуватися стратегії «однієї дози» препарату крові з повторною клініко-лабораторною оцінкою подальшої потреби після кожної гемотрансфузії. Категорії пацієнтів із хронічною анемією, що залежна від гемотрансфузій, та хворих онкологічного профілю не включені до рекомендацій, проте згадано, що рішення про трансфузію у таких пацієнтів слід приймати індивідуально. Особливу категорію (також не включену до настанов) складають хворі з ураженнями центральної нервововї системи, а також нейрохірургічні пацієнти; для них більшість дослідників рекомендують поріг трансфузії 90 г/л, хоча поки доказових даних недостатньо.
У дослідженні A. Salimetal (2008) вивчали вплив анемії та гемотрансфузії на розвиток ускладнень і результати лікування у пацієнтів із черепно-мозковою травмою. Встановлено, що переливання крові пов’язано зі значно гіршими наслідками у цих хворих. Крім того, переливання крові є основним фактором, що сприяє погіршенню результатів у пацієнтів з анемією та ушкодженням головного мозку. Автори дослідження не рекомендують використання ліберальної стратегії переливання крові у пацієнтів із черепно-мозковою травмою.
Доповідач зауважив, що з метою мінімізації крововтрати у програму Patient Blood Management включено застосування транексамової кислоти. Транексамова кислота є лізиноподібним інгібітором фібринолізу. За результатами Кокранівського огляду (Henry D.A. et al., 2011) введення транексамової кислоти сприяє зниженню ймовірності трансфузії, її ефективність співставна з апротиніном, проте не викликає серйозних побічних ефектів. Більшістю гайдлайнів застосування транексамової кислоти рекомендується для профілактики кровотечі при операціях з очікуваною помірною та великою крововтратою (>500 мл). На сьогодні не встановлено оптимального дозування даного препарату, проте більшість дослідників рекомендують дозу 1 г внутрішньовенно болюсно перед початком операції з наступною подовженою інфузією 1 г протягом 8 год або 1 мг/кг/год до закінчення операції. Доведено, що використання транексамової кислоти достовірно знижує крововтрату й потребу в переливанні препаратів крові при ортопедичних операціях (протезування кульшового суглоба, протезування колінного суглоба, операції на хребті), простатектомії та в кардіохірургії.
За гемостатичними властивостями транексамова кислота у 26 разів активніша за амінокапронову й у 10 разів ефективніша за етамзилат.
Із метою кількісної оцінки впливу раннього (протягом 8 год після травми) короткого курсу транексамової кислоти на частоту ускладнень і показники смертності пацієнтів із черепно-мозковою травмою було організовано масштабне клінічне рандомізоване дослідження Clinical Randomisation of an Antifibrinolytic in Significant Haemorrhage (CRASH2). Воно проводилось у 40 країнах, 274 лікувальних установах за участю загалом 20 211 пацієнтів із кровотечею після травми. Збір даних щодо розвитку ускладнень і госпітальної смертності проводили протягом 4 тижнів після травми. Згідно з результатами цього дослідження, транексамова кислота сприяє зниженню смертності внаслідок крововтрати пацієнтів із травмою. Важливо, що висока ефективність транексамової кислоти проявляється без підвищення ризику тромбозу – частота розвитку тромбоемболічних подій (тромбоз глибоких вен, тромбоемболія легеневої артерії, інфаркт міокарда, інсульт) у групах транексамової кислоти й плацебо істотно не відрізнялась. Загальна кількість випадків розвитку ускладнень склала 168 (1,63%) у групі активного лікування проти 201 (1,95%) у групі плацебо.
При операціях із великою очікуваною крововтратою (зазвичай >1 л) рекомендується аутотрансфузія (апарати Cell-savers). Ці апарати найчастіше застосовуються у кардіохірургії, при виконанні великих ортопедичних операцій тощо. Завдяки їх використанню знижується частота застосування алогенних препаратів крові під час таких операцій. Доповідач зазначив, що експерти NICE не рекомендують використання пристроїв Cell-savers для аутотрансфузії без супутнього застосування транексамової кислоти.
Професор С.О. Дубров наголосив на важливості своєчасної діагностики порушень гемостазу. Проведення діагностичних досліджень «біля ліжка хворого» дає можливість скоротити час до призначення терапії, зменшити об’єм крововтрати та необхідність введення препаратів крові. До таких методів діагностики належать віскоеластичні методи оцінки гемостазу (тромбоеластографія, TEG та ротаційна тромбоеластометрія, ROTEM) і агрегатометрія (визначення функції тромбоцитів).
Висока діагностична значущість віскоеластичних методів оцінки гемостазу доведена авторами декількох метааналізів. Так, у метааналізі A.C. Deppe et al. (2016) щодо використання тромбоеластографії/тромбоеластометрії у кардіохірургії продемонстровано зниження ризиків трансфузії в дослідній групі приблизно на третину. За даними K. Fleming et al. (2017), використання протоколів на основі тромбоеластографії дозволило знизити використання еритроцитарної маси, свіжозамороженої плазми та кріопреципітату в середньому на 40%.
Доповідач зауважив, що важливим аспектом є також зменшення фінансових витрат на лікування. Він згадав про результати дослідження G.J.A.J.M. Kuiper et al. (2019), що також підтвержують дані стосовно зменшення використання препаратів крові та скорочення витрат на лікування кардіохірургічних хворих при застосуванні тромбоеластометрії, хоча, зазначив він, суттєвого їх впливу на результати лікування встановлено не було.
Посилаючись на останній перегляд Протоколу масивної трансфузії при травмах Американської колегії хірургів (ACS), в якому додано опції таргетної терапії коагулопатії на підставі даних віскоеластичних методів, професор С.О. Дубров визначив наступні варіанти тригерів трансфузії.
За умови доступності стандартної тромбоеластографії:
- значення r >9 хв – переливання плазми;
- час k >4 хв – введення плазми та/або кріопреципітату (концентрат фібриногену);
- кут α <60° – переливання плазми та/або кріопреципітату (концентрат фібриногену);
- mA <55 мм – переливання тромбоцитів;
- LY30 >7,5% – застосування антифібринолітиків (транексамова кислота).
За умови доступності швидкої тромбоеластографії:
- ACT >128 с – переливання плазми;
- час k >2,5 хв – переливання плазми та/або кріопреципітату (концентрат фібриногену);
- кут α <60° – введення плазми та/або кріопреципітату (концентрат фібриногену);
- mA <55 мм – переливання тромбоцитів;
- LY30 >3% – застосування антифібринолітиків (транексамова кислота).
За умови доступності ротаційної тромбоеластографії (ROTEM):
- CT exTEM >100 с або CTinTEM >230 с – переливання плазми;
- MCF fibTEM >8 мм – переливання плазми та/або кріопреципітату (концентрат фібриногену);
- MCF fibTEM >10 мм та MCF exTEM <45 мм – переливання тромбоцитів;
- ML exTEM >15% – застосування антифібринолітиків (транексамова кислота).
Доповідач зауважив, що порівняно зі стандартною коагулограмою віскоеластичні методи оцінки коагуляції мають суттєві переваги, а саме:
- короткий час виконання (часткові результати отримують вже за 5-10 хв);
- для дослідження використовується цільна кров (враховується внесок клітин у процес);
- досліджуються всі етапи гемостазу в динаміці;
- можливість проводити персоналізовану таргетну гемостатичну терапію, впливаючи на порушену ланку коагуляції;
- можливість виконання досліджень «біля ліжка хворого» (без витрат часу на транспортування зразків до лабораторії).
Говорячи про недоліки віскоеластичних методів, С.О. Дубров звернув увагу на відносно високу вартість обладнання й досліджень, що частково компенсується зниженням частоти використання компонентів крові. Крім того, зазначив він, за їх допомогою також неможливо встановити деякі причини порушень коагуляції.
Таким чином, широке застосування програми Patient Blood Management у лікуванні пацієнтів із політравмою сприяє швидкому відновленню хворих за мінімального ризику ускладнень.
Підготувала Вікторія Лисиця
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 2 (36), травень 2019 р.