18 жовтня, 2019
Валсартан 2019: от «скрытой угрозы» к «новой надежде»
 – Не мне судить…
– Не мне судить…
– Но судишь ты!.. Суждение твое открыто.
Мастер Йода, к/ф «Звездные войны»
Медицина кажется совершенно прагматичной и прямолинейной отраслью, в которой не должно, не может быть места «приключенческому жанру». Тем не менее медицина является, пожалуй, одним из самых захватывающих «романов», написанных человеком за многотысячелетнюю его, человечества, историю, и отдельные его главы не менее занимательны, круты на повороты сюжета.
При всей внешней размеренности бытия блокаторов рецепторов ангиотензина (БРА) развитие этой группы препаратов не лишено интриги, а последний год был и вовсе непростым, особенно для валсартана. Причиной тому стал отзыв ряда партий сартанов, контаминированных примесями N-нитрозодиметиламина (NDMA) и N-нитрозодиэтиламина (NDEA), признанных потенциальными канцерогенами, среди которых в первую очередь речь шла о валсартане, выпускаемом компанией Zhejiang Huahai Pharmaceuticals (Китай). Это сообщение и суматоха, вызванная изъятием препаратов нескольких компаний, а также беспокойство пациентов, которые не могли приобрести ставшие привычными лекарства, привели к некоторой дискредитации и группы сартанов в целом, и валсартана в частности.
Что же происходит на самом деле? Нужно ли избегать назначения сартанов/валсартана? Чего сегодня больше в перспективах использования валсартана, выражаясь терминологией культовых хроник «Звездных войн»: «призрачной угрозы» или «новой надежды»? Давайте разберемся с этими вопросами.
Эпизод первый: пробуждение Силы
Многие из нас помнят, как группа БРА приходила в жизнь нашу и наших пациентов с артериальной гипертензией (АГ) и другими патологическими состояниями сердечно-сосудистой (СС) системы. Вначале это были в какой-то степени второстепенные позиции – цена препаратов в разы превышала стоимость ингибиторов ангиотензинпревращающего фермента (иАПФ), да и период врабатывания не увеличивал популярность группы БРА. Было принято, что по основным эффектам БРА не отличаются в целом от иАПФ, а рациональной причиной перевода пациента с иАПФ на БРА является фактор развития сухого кашля, характерный для иАПФ. Поэтому при лечении АГ БРА, хоть и относились к категории терапии первой линии, все-таки фактически занимали второстепенные роли. В последнее время позиция сартанов значительно укрепилась и, благодаря накопленной доказательной базе, существенно сниженной цене за счет выхода на рынок генериков, БРА надежно заняли равноценные позиции с иАПФ в лечении СС-заболеваний.
Валсартан был запатентован в 1990 г., а в 1996 г. стал доступен на фармацевтическом рынке [1]. Примерно в это же время была разработана концепция СС-континуума, обосновывающая активное применение блокады ренин-ангиотензин-альдостероновой системы (РААС) (рисунок) [2].
Концепция СС-континуума открыла путь ингибиторам РААС не только в области лечения АГ, но и сердечной недостаточности (СН), профилактики фибрилляции предсердий (ФП), терапии поражения коронарных артерий [3]. Группа БРА активно разрабатывалась, появлялись новые препараты, росла доказательная база и представленность БРА в руководствах (табл. 1).
По нескольким причинам одним из наиболее востребованных БРА является валсартан. Так, согласно некоторым данным, в 2008, 2009 и 2010 гг. валсартан стал самым часто назначаемым препаратом для лечения АГ в мире. В частности, в США валсартан выписывали 18,9‑21,4 млн раз в год за этот период, а в 2016 г. он занял 92-е место общего рейтинга предписанных в этой стране лекарств (8,4 млн выписанных рецептов за год) [4].
Валсартан – довольно универсальный БРА. Фактически только кандесартан и валсартан изучены при СН со сниженной фракцией выброса левого желудочка сердца и, соответственно, имеют преимущества перед другими БРА в лечении этой категории больных. Однако кандесартан является пролекарством, в то время как валсартан – уже активная, готовая к действию субстанция [11]. При этом валсартан обладает чрезвычайно высокой аффинностью к АТ1- по сравнению с АТ2-рецепторами (в 24 тыс. раз) [11].
Общая база по применению валсартана в клинических контролируемых исследованиях исчисляется в пределах 100 тыс. изученных случаев. Несомненно, это позволяет относиться к полученным результатам с доверием (табл. 2). Таким образом, к концу 2000-х валсартан обрел отличный портфель доказательной базы и ассоциировался с многообещающими перспективами.
Эпизод второй: скрытая угроза
Лето 2018 г. стало для некоторых сартанов и их производителей поистине «холодным». В некоторых препаратах, среди которых был и валсартан, было обнаружено наличие NDMA и NDEA – веществ, признанных потенциальными канцерогенами. Однако и тут нужно расставить все точки, запятые и акценты корректно.
Во-первых, и Европейским агентством лекарственных средств (ЕМА), и Управлением по контролю за пищевыми продуктами и медикаментами США (FDA) отмечено, что данные примеси в «пострадавших» препаратах ранее отсутствовали, и их появление связано с особенностями технологии производства определенных сартанов на некоторых заводах [31]. Возникновение указанных примесей происходит в процессе образования тетразольного кольца, которое содержится в лозартане, ирбесартане, кандесартане, валсартане и олмесартане. При этом ничего плохого в наличии данного кольца в препаратах не было и нет. О.А. Шемякина и соавт. (2011) так описывают причины интереса к введению тетразольного кольца в молекулы медикаментов [32]: «…лекарственные препараты с тетразольными структурами менее подвержены разрушению в процессах метаболизма. В результате обеспечивается более надежная и длительная межклеточная коммуникация, то есть более точная и адресная доставка молекулы лекарства к соответствующему рецептору (биологической мишени).
Уже известны функционально замещенные производные тетразола, являющиеся антибиотиками, туберкулостатиками, анальгетиками, фунгицидами. Ряд производных тетразола проявляют гипотензивную, противовоспалительную и противоязвенную активности. Некоторые из них изучаются как препараты для лечения диабета и заболеваний нервной системы (церебральная ишемия, шизофрения)». Однако особенности некоторых новаций технологий изготовления препаратов с тетразольным кольцом могли включать растворители, реагенты и прочее сырье, которые стали причиной контаминации NDMA и NDEA. Сегодня эти технологии пересмотрены, а содержание потенциально канцерогенных примесей чрезвычайно внимательно контролируется.
Во-вторых, наибольшая контаминация NDMA и NDEA была характерной для препаратов Zhejiang Huahai Pharmaceuticals (Китай). Сегодня эта компания фактически исключена из производственных процессов поставщиков сартанов (и валсартана) на отечественный фармацевтический рынок. МЗ Украины жестко контролирует качество сырья, используемого для БРА, и запрещает к реализации препараты, не прошедшие проверку.
В-третьих, NDMA и NDEA являются именно потенциальными канцерогенами [31]. Приводятся данные о том, что на 100 тыс. пациентов, получающих валсартан производства Zhejiang Huahai Pharmaceuticals (с наиболее высоким уровнем NDMA и NDEA) ежегодно в течение шести лет в наивысшей дозе, может возникнуть 22 дополнительных случая рака на протяжении жизни 100 тыс. таких больных, вызванного NDMA. Наличие же примеси NDEA может спровоцировать восемь дополнительных случаев на 100 тыс. пациентов, получавших контаминированный препарат в течение четырех лет в максимальной дозе [31]. Не умоляя важности крайне внимательного отношения к рискам для здоровья лекарственных средств и их составляющих, следует все же отметить, что данные оценки были получены в результате экстраполяции из исследований, проведенных на животных. При этом в посвященных проблеме сообщениях отмечено, что такой показатель в целом следует рассматривать как очень низкий в сравнении с риском развития рака в Европейском Союзе [31]. И, разумеется, далеко не все пациенты получают валсартан в максимальной дозе.
Таким образом, если отложить эмоции и рассмотреть возникшую ситуацию прагматично, то «угроза» действительно представляется, скорее, «призрачной». И ЕМА, и FDA довольно регулярно публикуют сообщения об отзыве той или иной партии лекарственных средств в связи с различными нарушениями технологического процесса, контаминацией нежелательными примесями и т.д. Это нормальный рабочий процесс защиты пациента от потенциальных рисков. В данном случае реакция ЕМА и FDA продиктована не реальными негативными результатами, полученными для человека (например, досрочно законченные исследования по причине роста заболеваемости раком или серия сообщений о неблагоприятных событиях по сведениям служб фармаконадзора), а экстраполяцией данных исследований на животных. В сообщениях ЕМА в информации для пациентов значится: «существует очень низкий риск того, что примеси нитрозаминов на уровне, который ранее обнаружили в некоторых сартанах, мог бы вызывать рак у человека». Массовое же беспокойство связано с тем, что Zhejiang Huahai Pharmaceuticals была поставщиком субстанции сартанов для других компаний, что вызвало отзыв не отдельных партий препарата одной компании, а множество партий препарата ряда компаний – эффект домино. Это привело к замешательству на фармацевтическом рынке: врачи беспокоились по поводу качества назначаемых средств, пациентов тревожило отсутствие привычных лекарств в аптеке. Так, валсартан из фактически лидера группы БРА превратился в «нехороший препарат», избегать его назначения и применения стали многие.
Эпизод третий: новая надежда
Говорят, что «проблема» – это ситуация, окрашенная эмоциями. Как только они отступили, стало понятно, как поступать. Сначала были отозваны все подлежащие сомнению партии препаратов. Далее установлены потенциальные причины появления примесей NDMA и NDEA, а также других нитрозаминов.
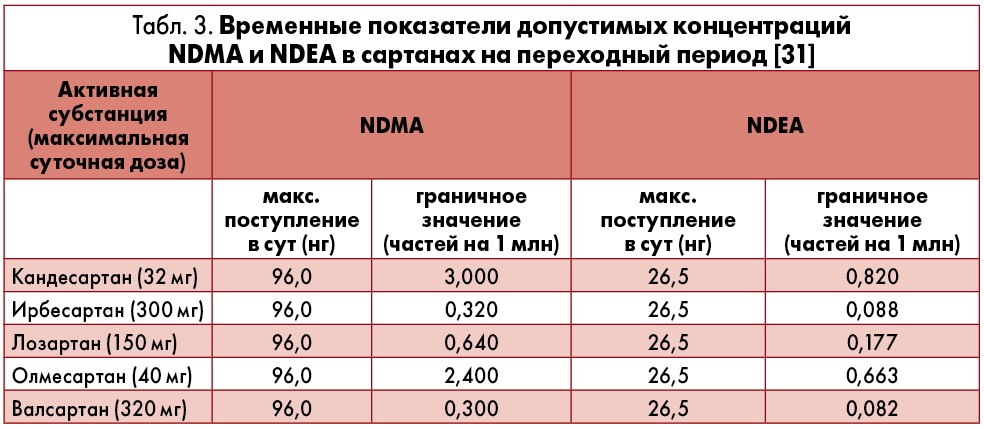
В начале февраля 2019 г. ЕМА выступило с заявлением к производителям с требованием в течение переходного периода (2 года) полностью изменить производственный процесс таким образом, чтобы он исключал появление потенциально опасных примесей. Были разработаны граничные показатели нитрозаминов для различных сартанов, содержащих тетразольное кольцо, на переходный период (табл. 3) [31]. По его окончании примеси NDEA или NDMA в сартанах фактически должны отсутствовать (<0,03 части на 1 млн) [31].
Луч «новой надежды» для содержащих тетразольное кольцо БРА забрезжил со стороны США. Несмотря на некоторую неловкость момента, весной 2019 г. FDA довольно неожиданно одобряет для продажи на территории США новый генерик валсартана. Уполномоченный представитель FDA, доктор S. Gottlieb так объяснил необходимость данного шага [33]: «Нам известно, что продолжающиеся отзывы для предотвращения доступа к пациентам многих известных валсартанов, содержащих недопустимое количество примесей, привело к недостатку этих важных препаратов. Поэтому, с пониманием последствий для здравоохранения такого дефицита, мы считаем приоритетным рассмотрение заявок для генерических продуктов, содержащих валсартан. Столкнувшись с ситуацией дефицита данных препаратов, FDA применило ряд стратегий, направленных на устранение неудобств для пациентов, связанных с такой недостачей. В качестве одной из составляющих проделанной работы мы ищем возможности для приоритетного рассмотрения заявок генерических форм недостающих препаратов или аналогичных продуктов. Мы надеемся, что сегодняшнее одобрение представленного нового генерика поможет уменьшить дефицит валсартана, однако по-прежнему обязуемся осуществлять меры по недопущению указанных примесей в производственном процессе существующих и будущих препаратов. Мы будем продолжать работу с производителями, направленную на то, чтобы больше препаратов, таких как валсартан, принадлежащий к группе БРА и не содержащий примесей нитрозаминов, могли быть одобрены для решения проблемы этого сохраняющегося дефицита».
В этом заявлении примечательны два момента – приоритетный характер рассмотрения заявок для производителей, готовых представить качественный и безопасный валсартан, и собственно тот факт, что первым после ситуации с примесями нитрозаминов FDA был одобрен именно валсартан, а не другой представитель класса, содержащий тетразольное кольцо.
В Украине рынок также восстанавливается после пережитых тревог – количество запрещенных к реализации сартанов, в том числе и валсартана, стремительно сокращается [34]. Компании перестраиваются, выбирая проверенных поставщиков безопасного сырья, и уже через два года, когда производственный процесс полностью перейдет на новые рельсы, все тревоги, связанные с гипотетической безопасностью сартанов, останутся позади. Сартаны снова будут востребованными и популярными.
Но другой вопрос, как и положено хорошему блокбастеру, оставляет место для фантазии, сомнений и сиквелов – а что же с другими препаратами (не сартанами), содержащими тетразольное кольцо? Проверено ли их производство на потенциально опасные примеси? Конечно, большинство таких средств не предназначены для постоянного/пожизненного применения, но все-таки…
Продолжение следует?..
Справка «ЗУ»
ACINO обеспечивает пациентов качественными лекарственными средствами более чем в 80 странах мира, способствуя развитию доступной медицины. ACINO взяла на себя обязательства отвечать всем требованиям действующего законодательства и нормативно-правовой базы, положениям внутренних политик и установок компании, созданным для обеспечения качества, эффективности и безопасности продукции.
Сообщаем, что производственный завод ACINO – «Фарма Старт» (г. Киев) продолжает производство и реализацию лекарственных средств ДИОКОР 80, ДИОКОР 160, ДИОКОР СОЛО 80, ДИОКОР СОЛО 160, ДИФОРС 80, ДИФОРС 160 и ДИФОРС XL исключительно с использованием субстанций, которые разрешены к применению в мире, а также зарегистрированы и разрешены к использованию в Украине в соответствии с требованиями действующего законодательства.
Так, компания подтверждает, что валсартансодержащие лекарственные средства ACINO в Украине разрешено назначать и отпускать в аптечных сетях.
Список литературы находится в редакции.
UA-DIOC-PUB-082019-009
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 4 (65) вересень 2019 р.