21 жовтня, 2019
EULAR уполномочена заявить: обсуждение новых рекомендаций Европейской противоревматической лиги 2018 года по менеджменту пациентов с остеоартритом кисти
 Остеоартрит суставов кисти (ОАСК) – часто встречающееся заболевание опорно-двигательного аппарата, распространенность которого резко повышается с возрастом [1]. ОАСК характеризуется болями в суставах кистей, скованностью, ограничением функции, уменьшением силы в кистях, затруднением сжатия, невозможностью выполнять повседневные манипуляции [2]. Такие симптомы, как боль, скованность и снижение функции кистей являются отличительными признаками заболевания и ухудшают качество жизни [3, 4]. Среди клинических проявлений ОАСК – разрастания костной ткани (остеофитоз) и деформации, иногда сопровождающиеся отеком мягких тканей [5].
Остеоартрит суставов кисти (ОАСК) – часто встречающееся заболевание опорно-двигательного аппарата, распространенность которого резко повышается с возрастом [1]. ОАСК характеризуется болями в суставах кистей, скованностью, ограничением функции, уменьшением силы в кистях, затруднением сжатия, невозможностью выполнять повседневные манипуляции [2]. Такие симптомы, как боль, скованность и снижение функции кистей являются отличительными признаками заболевания и ухудшают качество жизни [3, 4]. Среди клинических проявлений ОАСК – разрастания костной ткани (остеофитоз) и деформации, иногда сопровождающиеся отеком мягких тканей [5].
Принято выделять три основных варианта ОАСК [6]:
- ОА межфаланговых суставов кистей – проксимальных (ПМФС) и дистальных (ДМФС), который может сопровождаться или не сопровождаться формированием узелков;
- ОА запястно-пястного сустава I пальца (I ЗППС, в англоязычной литературе – basal thumb osteoarthritis);
- эрозивный ОА.
Реже встречаются поражения пястно-фаланговых суставов кистей. Наиболее типичным объективным признаком ОА межфаланговых суставов кистей является формирование плотных на ощупь узелков, связанных с пролиферацией тканей в области ДМФС (узелки Гебердена) и ПМФС (узелки Бушара). Они могут длительное время оставаться безболезненными, но часто сопровождаются болью, парестезиями, скованностью и функциональной недостаточностью, а также вызывают косметические проблемы, особенно у женщин.
Первые рекомендации Европейской противоревматической лиги (EULAR) по менеджменту пациентов с ОАСК были опубликованы в 2007 г. [7]. В 2012 г. Американский колледж ревматологов (ACR) также представил рекомендации по ведению лиц с ОА кисти, бедренного и коленного суставов [8]. В 1990 г. были опубликованы классификационные критерии ОАСК, разработанные ACR, которые актуальны и сегодня.
Выделяют две группы суставов (по 10 в каждой), вовлечение которых наиболее типично для ОАСК. Первая обозначается как «10 избранных суставов». В эту группу входят ДМФС и ПМФС II и III пальцев, а также I ЗППС обеих кистей. Вторая включает все ДМФС. При этом ДМФС II и III пальцев входят как в первую, так и во вторую группу. В качестве признака, позволяющего исключить наличие воспалительного заболевания суставов, используется число припухших ПФС. Оно должно быть >3.
Диагноз ОАСК может быть подтвержден при выявлении у больного трех обязательных и одного дополнительного критериев:
- обязательные критерии: наличие боли или скованности в суставах кисти, плотных узелков в области ≥2 из 10 избранных суставов, число припухших ПФС <3;
- дополнительные критерии: наличие плотных узелков в области ДМФС (узелки Гебердена) и деформация ≥2 из 10 избранных суставов; выявление узелков Гебердена в области II и III ДМФС позволяет зафиксировать наличие сразу двух критериев (обязательного и дополнительного).
Долгое время ОАСК был «забытым заболеванием», что приводило к нехватке клинических исследований для создания рекомендаций, поэтому многие из предыдущих документов были основаны главным образом на мнении экспертов. Однако в последние годы ОАСК уделяется все больше внимания, появились новые данные по нескольким фармакологическим и нефармакологическим методам лечения: самообучению, образовательным программам, самопомощи, применению ортезов, прежде всего, на основание большого пальца, местным нестероидным противовоспалительным препаратам (НПВП), пероральным глюкокортикоидам (ГК), различным типам внутрисуставной терапии и лечению с помощью синтетических и биологических болезнь-модифицирующих противоревматических препаратов (sDMARDs, bDMARDs), например гидроксихлорохина и ингибиторов фактора некроза опухоли (ФНО). Эти более свежие данные представили новое понимание болезни и открыли неизвестные ранее возможности лечения. Как результат изысканий – обновленные рекомендации EULAR (2018) для менеджмента пациентов с ОАСК.
Общие принципы
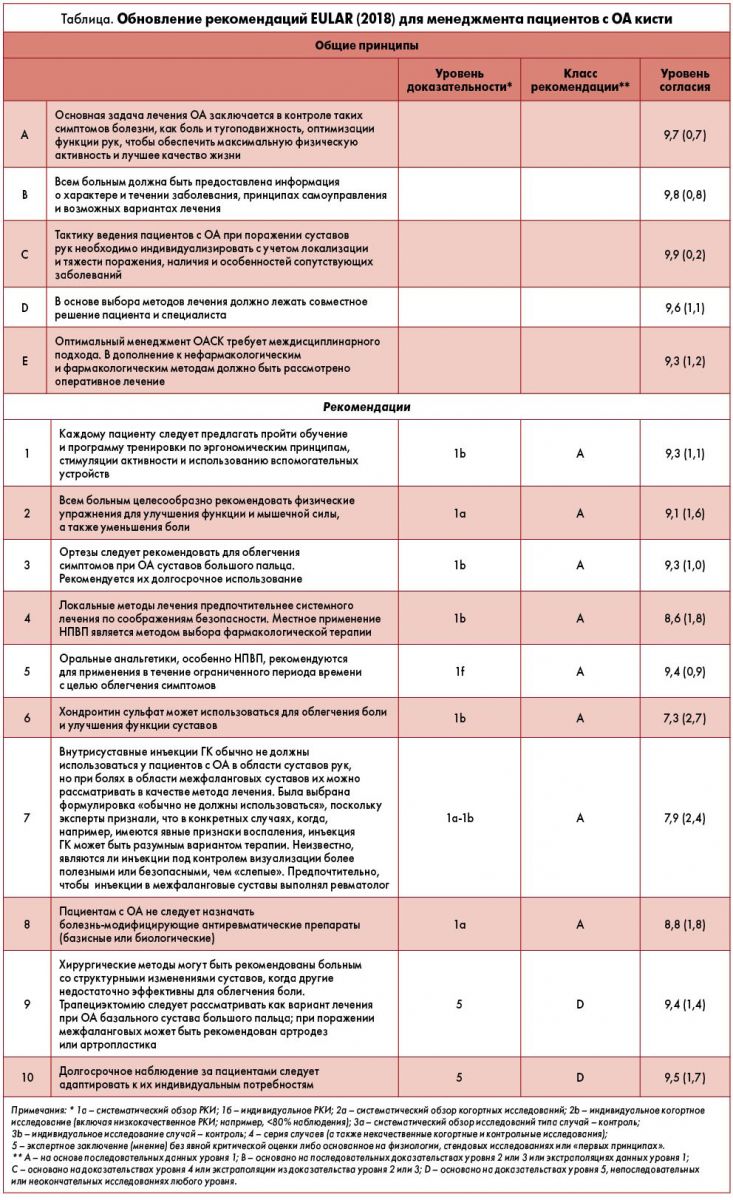
! Основная цель менеджмента пациентов с ОАСК – контроль симптомов, таких как боль и скованность, оптимизирование функции суставов кистей с целью увеличения активности и улучшения качества жизни.
Лечение необходимо направлять на максимальное увеличение возможности участия больного во всех сферах жизни и активности, ее оптимизирование. Формулировки «оптимизирование» и «максимизирование» выбраны для отражения того, что менеджмент лиц с ОАСК должен быть более масштабным, чем просто стремление к приемлемому для пациента состоянию симптомов.
! Всем больным следует предоставить информацию о характере, диагностике и течении заболевания, аспектах самоконтроля и самопомощи, целях и возможностях лечения, принципах защиты суставов и терапии хронической боли.
Образование считается одним из основных методов терапии лиц с ОАСК и должно быть предложено всем пациентам [4]. Больного важно ознакомить с информацией о характере патологии, существующих на сегодняшний день медикаментозных и немедикаментозных методах лечения, факторах риска и способах их коррекции. Лицам с хроническими жалобами, которые регулярно обращаются к врачу, предоставление сведений и образование следует сделать непрерывным процессом, включающим стимулирование, подкрепление и расширение знаний [9]. Врач должен объяснить, что ОА не является результатом исключительно старения и износа суставов, симптомы могут быть уменьшены, и важно противодействовать заболеванию [10].
Стратегии самоконтроля, используемые пациентами с ОАСК, продемонстрировали свою эффективность в ряде исследований. Результаты подтверждены несколькими систематическими обзорами, обобщающие данные которых касаются различных хронических скелетно-мышечных болевых синдромов, в том числе при ОАСК [11‑13]. Тем не менее явные доказательства, подтверждающие эффективность и содержание предоставленной информации в образовательных программах именно по ОАСК, имеют незначительный вес.
! Менеджмент пациентов с ОАСК должен быть индивидуализирован с учетом локализации и тяжести течения заболевания, а также наличия коморбидных состояний.
В предварительном опросе >75% медицинских работников было отмечено, что важными характеристиками пациента с ОАСК, являются: возраст, тип ведущих жалоб (боль или нарушение функции), механические факторы, его пожелания и ожидания, воспаление, тяжесть структурных повреждений и наличие эрозий [14]. В ходе опроса большинство специалистов сферы здравоохранения также поддерживали различные подходы к лечению в зависимости от локализации заболевания (особенно ОА I ЗППС) или подгруппы ОАСК (особенно эрозивного или «воспалительного» ОА). Хотя многие из этих факторов, как известно, являются детерминантами худшего исхода (например, наличие воспаления связано с прогрессированием заболевания), доказательные данные по эффективности лечения от модификации большинства из этих факторов отсутствуют [15, 16].
К числу факторов, способствующих возникновению и прогрессированию ОАСК, относятся профессиональная нагрузка на кисть, наследственная предрасположенность, ожирение и гипермобильность. Действие некоторых из них может быть модифицировано. Однако пока нет убедительных данных о том, в какой степени такое вмешательство повлияет на течение болезни. На сегодняшний день существует дискуссия относительно того, изменит ли лечебное воздействие на модифицируемые факторы исходы патологии. Так, например, нет доказательств, что терапия воспаления снижает прогрессирование заболевания. Локализация ОАСК (2‑4 пальцев по сравнению с большим), степень тяжести ОАСК (количество вовлеченных в патологический процесс суставов или острое их воспаление вследствие ОАСК) и наличие сопутствующих состояний – единственные аспекты, которые в настоящее время могут влиять на принятие решения о тактике лечения.
! Принципы менеджмента ОАСК должны быть основаны на совместном решении пациента и медицинского работника.
Совместное принятие решений – подход, при котором медицинские работники и пациенты обмениваются информацией для достижения консенсуса относительно предпочтительной стратегии лечения, должен быть основой менеджмента лиц с ОАСК [17]. Этот всеобъемлющий принцип подразумевает, что при принятии решений по лечению заболевания важно учитывать не только наилучшие имеющиеся доказательные данные, но также пожелания и ожидания пациентов. Все зависит от установки и поддержания взаимоотношений между больным и медицинским работником, так называемого комплаенса обмена лучшими фактическими и доказательными данными для приятия обоснованного решения. Это относится ко всем этапам лечения, включая, например, постановку его цели, выбор наилучшей стратегии для ее достижения или рассмотрение других тактик, когда цель терапии не достигнута.
! Оптимальный менеджмент ОАСК требует междисциплинарного подхода.
ОАСК является гетерогенным и хроническим заболеванием, приводящим к различным признакам и симптомам, в связи чем такие пациентам часто требуется многопрофильная помощь. Кроме того, в дополнение к нефармакологическим и фармакологическим методам лечения должно быть рассмотрены и оперативные вмешательства.
Медицинские специальности, занимающиеся менеджментом пациентов с ОАСК, охватывают семейного врача, ревматолога, специалиста по реабилитации, физиотерапевта, хирурга, ортопеда, что позволяет формировать так называемую междисциплинарную помощь [18]. В некоторых клиниках уже предоставлены структурированные междисциплинарные программы или интегрированные пути оказания помощи таким пациентам.
Однако доказательные данные в отношения положительного эффекта от комбинированных программ, включая образование, в настоящий момент отсутствуют [18, 19].
Рекомендации
Нефармакологические методы лечения
! Каждому пациенту должны быть предложены обучение и тренинги в рамках эргономических принципов, стимуляция физической активности и использование вспомогательных устройств.
Эти принципы являются важным аспектом менеджмента лиц с ОАСК, эффективность которых была доказана в исследованиях [19]. Ранее часто используемый термин «защита суставов», подразумевавший воздержание от движения и иммобилизацию суставов, в рекомендациях EULAR (2018) рассматривался целевой группой как устаревшая концепция и был заменен более четким указанием, что образование, обучение и движение с применением вспомогательных устройств является важной и широко используемой стратегией для улучшения состояния пациента с ОАСК. При этом акцентируется, что эта помощь может быть оказана любым специалистом в области здравоохранения (например, физиотерапевтом или квалифицированной медсестрой).
! Для каждого пациента должны быть рассмотрены упражнения с целью улучшения функции и мышечной силы, а также уменьшения боли.
Хотя определенная физическая активность была одобрена в предыдущих рекомендациях EULAR (2007), в то время подтверждающие доказательные исследования этого нефамакологического подхода отсутствовали. За последние 10 лет проведено несколько испытаний, результаты которых обобщены в кокрановском обзоре [20]. Продемонстрировано, что упражнения для суставов кисти оказывают положительное влияние на самооценку боли, увеличение функции и силы захвата, уменьшение скованности и ригидности суставов. Обнаруженные эффекты характеризовались клинически значимым улучшением в отсутствии серьезных побочных эффектов. Тем не менее изученные вмешательства были гетерогенными, их эффективность варьировала в зависимости от упражнений в домашних условиях после одного сеанса обучения с инструктором до нескольких контролируемых занятий в неделю в течение нескольких недель, а также различались частота занятий, количество повторений и подходов в упражнениях и их тип (например, укрепление или растяжение). Кроме того, авторы обзора акцентировали, что положительные эффекты лечебной физкультуры и упражнений не удерживались при прекращении занятий.
Упражнения должны быть направлены на улучшение подвижности суставов, увеличение мышечной силы и стабильности основания большого пальца. Режимы упражнений, нацеленные на I ЗППС, отличаются от таковых для межфаланговых. Показаны упражнения, направленные на повышение силы мышц предплечий и расширение объема движений в суставах кисти. Они позволяют улучшить пинцетный хват и усилить сжатие кисти, а также способствуют стабилизации I ЗППС и увеличению объема движений.
! Для пациентов с ОА основания большого пальца должны быть рассмотрены ортезы с целью облегчения симптомов.
Существуют ортезы для кисти, позволяющие стабилизировать пораженные суставы и существенно уменьшить интенсивность боли. Наиболее широко применяются разные модификации ортезов для I ЗППС. После опубликования рекомендаций EULAR (2007) были проведены многочисленные исследования, посвященные эффекту ортезов, сравнению их действенности с обычным уходом или немедикаментозными видами лечения [21‑25]. Получены доказательства положительного влияния использования ортезов на основание большого пальца в течение длительного периода (не менее трех месяцев), в большей степени для уменьшения боли, в меньшей – повышения функции. Не было отмечено увеличения мышечной силы сжатия и улучшения при применении ортезов в течение более коротких периодов. Таким образом, рекомендуется долгосрочное использование ортезов.
В рекомендациях EULAR (2007) было указано на целесообразность использования ортезов для «предотвращения/коррекции латеральной девиации и сгибательной контрактуры у пациентов с ОА основания большого пальца», но на сегодняшний день доказательства, подтверждающие влияние ортезов на эти деформации, отсутствуют. Нет рекомендаций и в отношении более эффективных типов ортезов (короткий/длинный, изготовленный на заказ или заводской, из неопрена, термопласта либо другого материала) и по длительности применения (например, днем, ночью или постоянно). Есть единичные исследования, демонстрирующие долгосрочные благоприятные эффекты при использовании длинных ортезов, изготовленных индивидуально из термопласта, который пациенты носили ежедневно, и выполненных на заказ, длинных ортезов из неопрена – их нужно носить ночью [23, 25].
Важно обращать внимание на применение именно правильно подобранного ортеза, предпочтительно на заказ, выполненного в специализированных медицинских центрах. Это улучшает приверженность больных и увеличивает шанс долгосрочного использования. Большинство исследований проводили при участии пациентов с ОА основания большого пальца, и только в одном изучали ночные ортезы для дистальных межфаланговых суставов, которые оказались неэффективными и поэтому не рекомендовались [26].
Таким образом, первый шаг при проведении менеджмента пациентов с ОАСК – сосредоточение на немедикаментозной терапии, которая может дополняться фармакологической и/или хирургической, хотя и не обязательно для всех лиц с ОА, а в зависимости от выраженности симптомов.
Фармакологические методы лечения
! Местные методы лечения предпочтительнее системных по причинам безопасности.
Локальные НПВП рекомендуются в качестве фармакологического лечения первой линии благодаря их достаточно высокому профилю безопасности по сравнению с пероральными анальгетиками, а также благоприятному влиянию на боль и функции [27‑29]. Местное применение геля на основе диклофенака продемонстрировало уменьшение боли и улучшение функционирования через восемь недель применения по сравнению с плацебо [29]. Кроме того, местные НПВП демонстрируют облегчение боли, аналогичное приему пероральных НПВП [27]. Объединенные данные по безопасности рандомизированных клинических исследований, где сравнивали местный гель диклофенак с плацебо у лиц с ОА кисти и коленного сустава, показали одинаково меньшую частоту побочных эффектов в подгруппах пациентов с низким и высоким риском (возраст ≥65 лет, при коморбидной гипертонии, сахарном диабете 2-го типа, цереброваскулярных или сердечно-сосудистых заболеваниях) [30]. В настоящее время нет убедительных сведений о долгосрочных эффектах местных НПВП [31]. При поражении большего количества суставов системное фармакологическое воздействие является предпочтительным.
Еще одним рекомендуемым средством для местного применения является капсаицин. Это алкалоид, содержащийся в различных видах стручкового перца Capsicum. Он обеспечивает облегчение боли за счет раздражения, вызывая возбуждение сенсонейронов и повышая чувствительность (воспринимается как жжение или зуд), что приводит к обратимой дегенерации нерва с последующим понижением его чувствительности. Однако применение такого лечения часто связано с местными побочными эффектами (ощущение жжения и покалывания) [32]. Результаты рандомизированного плацебо-контролируемого испытания при участии 59 пациентов с ОАСК показывают, что местный капсаицин (0,025%) превосходит плацебо после 3 и 9 недель лечения [33]. Систематический обзор исследований данных лиц, страдающих от боли вследствие ОАСК и ревматоидного артрита, указывает на среднюю частоту ответа на лечение (~50% уменьшение боли) через 38 недель в группе с капсаицином по сравнению с таковой на плацебо (25%) [34].
Местное применение тепла целевая группа EULAR рассматривала как стратегию самопомощи, которую пациенты могут применять дома, при слабых и противоречивых данных о возможном положительном эффекте [35,36]. Поэтому использование тепла не было включено в отдельную рекомендацию. Холодные компрессы в случае воспаления во время обострения ОА могут также обеспечить симптоматическое облегчение, хотя исследования для ОАСК не проводились [37].
! Оральные анальгетики, особенно НПВП, следует рассматривать для лечения ОАСК в течение ограниченного периода времени для облегчения симптомов.
В трех высококачественных исследованиях пероральные НПВП эффективно уменьшали боль и увеличивали функцию через 2‑4 недели приема при ОАСК [38‑40]. Однако хорошо известны побочные действия этих препаратов, особенно у пожилых людей. Рекомендовано назначать НПВП в наименьшей эффективной дозе в течение ограниченного периода времени (предпочтительно по требованию), с особым вниманием на соотношение риск/польза, особенно у пациентов с высоким риском нежелательных явлений со стороны желудочно-кишечного тракта, сердечно-сосудистой системы или почек.
! Пациентам с ОАСК часто назначают парацетамол, однако, согласно данным исследований, эффективность его достаточно переменная.
Если раннее применение парацетамола считали безопасным вариантом лечения, то в последнее время, исходя из профиля риска и пользы, это утверждение было оспорено и привело к полемике о включении его в рекомендации по ОАСК [41]. В трех исследованиях изучали эффективность парацетамола в дозе 1000‑3900 мг/сут при ОАСК [42‑44]. Парацетамол не показал превосходство над плацебо или препаратом сравнения. В результате двух больших метаанализов данных пациентов с ОА коленного и тазобедренного суставов обнаружено небольшое влияние на боль с сомнительной клинической значимостью: применение парацетамола ассоциировалось с повышенным риском нарушения функции печени и кардиоваскулярных событий [45, 46]. Наблюдательные исследования в общей взрослой популяции обнаружили дозозависимый повышенный риск смертности, развития сердечно-сосудистых, желудочно-кишечных и почечных побочных эффектов при приеме препарата [47]. Парацетамол также является наиболее частой причиной лекарственного поражения печени, связанного в основном с непреднамеренной передозировкой.
Таким образом, эффективность парацетамола при ОАСК по-прежнему остается неопределенной и, вероятно, крайне сомнительной. Кроме того, этот препарат также имеет ряд побочных действий. Назначение парацетамола предпочтительно в течение ограниченного периода времени у отдельных пациентов при ОАСК, например, когда противопоказаны пероральные НПВП.
Трамадол (с/без парацетамола) также рассматривался целевой группой в качестве альтернативного орального анальгетика. Однако в настоящее время нет никаких доказательств о целесообразности его назначения больным ОАСК.
! Хондроитина сульфат может использоваться у пациентов с ОАСК для облегчения боли и улучшения функции.
В комплексной терапии ОА также могут быть использованы медленнодействующие симптоматические средства – глюкозамин и хондроитина сульфат. По данным контролируемых испытаний, они достоверно превосходили по эффективности плацебо. Хондроитина сульфат и глюкозамин – одни из наиболее широко применяемых безрецептурных нутрицевтических препаратов для лечения ОА. В ряде исследований показано, что хондроитина сульфат проявляет достаточную эффективность в улучшении клинических симптомов при ОАСК [48‑50]. Согласно плацебо-контролируемым испытаниям, есть доказательства по поводу структурно-модифицирующих эффектов хондроитина сульфата при ОАСК [51].
Хондроитина сульфат не предотвращал появление ОА в ранее интактных суставах. Однако у пациентов, получавших препарат, наблюдали меньшее рентгенографическое прогрессирование, уменьшение симптомов и степени выраженности эрозий в течение двух лет приема, улучшение функции суставов кисти и силы сжатия по истечении шести месяцев непрерывного использования [51‑53].
Таким образом, данные указывают на то, что хондроитина сульфат может быть эффективен в облегчении симптомов и снижении прогрессирования патологического процесса при ОАСК, в частности эрозий, хотя для окончательного заключения о его эффективности необходимы более качественные исследования. Плацебо-контролируемых испытаний глюкозамина у пациентов с ОАСК не проведено.
К симптоматическим лекарственным средствам медленного действия при остеоартрозе (SYSADOAs) также относят неомыляемые соединения авокадо и сои, диацерин и внутрисуставную гиалуроновую кислоту (ВСГК). Однако доказательная база для этих препаратов пока весьма ограниченна [54].
Стоит отметить 9 исследований, инициированных для изучения эффективности ВСГК при ОА I ЗППС, данные которых суммировались в систематическом обзоре [55]. Число инъекций варьировало от 1 до 5 в неделю; в большинстве испытаний лечение продолжалось шесть месяцев. В пяти открытых исследованиях установлено значительное уменьшение боли, в четырех – улучшение функции и в одном – силы захвата. В целом существует недостаточно данных для заключения об эффективности ВСГК для ОА основания большого пальца. Целевая группа согласилась с тем, что в настоящее время нет лекарственных средств с модифицирующими заболевание свойствами при ОАСК, и, следовательно, эти вещества также не должны рассматриваться как таковые для лечения.
! Внутрисуставные инъекции ГК, как правило, не следует использовать у пациентов с ОАСК, но можно рассматривать у таковых с болезненными межфаланговыми суставами.
Данные, подтверждающие положительный эффект внутрисуставных ГК по сравнению с плацебо у пациентов с ОА I ЗППС, отсутствуют [56]. Однако в исследовании лиц с болезненным ОА межфаланговых суставов внутрисуставные инъекции ГК были более эффективны, чем плацебо, для облегчения боли, увеличения движения и уменьшения периартикулярного отека [57]. Тем не менее динамика воспаления, по данным МРТ, была минимальной [58]. Результаты не подтвердились и при сонографии: положительного эффекта такой терапии в отношении гипертрофии синовии и воспаления не зафиксировано [59]. По мнению исследователей, необходимо уточнение противовоспалительного действия внутрисуставного использования ГК при ОАСК, особенно учитывая их влияние на развитие сахарного диабета и сердечно-сосудистых заболеваний.
Целевая группа EULAR отметила, что в конкретных случаях, к примеру, при наличии явного воспаления суставов и выраженного болевого синдрома, инъекции ГК могут быть единственным терапевтическим вариантом. Однако доказательства, касающиеся конкретных подгрупп, которые могли бы извлечь пользу из внутрисуставного введения ГК, например, у пациентов с активным воспалением суставов вследствие обострения заболевания, отсутствуют. Таким образом, на сегодняшний день существует недостаточно данных для заключения об эффективности внутрисуставного введения ГК для лиц с ОАСК.
! Пациенты с ОАСК не должны лечиться болезнь-модифицирующими антиревматическими препаратами.
Эта рекомендация была добавлена после проведения нескольких исследований, демонстрирующих недостаточную эффективность sDMARD/bDMARD. Есть данные о применении данной группы препаратов в клинической практике при тяжелых случаях воспалительного и эрозивного ОАСК. Испытания, в которых изучали действие гидроксихлорохина, различных ингибиторов ФНО, антител к интерлейкину 1, не продемонстрировали эффективность этих препаратов у пациентов с ОАСК [60‑66]. Рандомизированные исследования по оценке влияния метотрексата, сульфасалазина или колхицина не проводили.
В нескольких работах изучали низкие дозы пероральных ГК (3‑5 мг/сут), но полученные результаты достаточно противоречивы [58, 67]. В основной группе при сравнении с плацебо отмечали уменьшение боли и значительное улучшение функции, но, как и при внутрисуставном введении ГК, при выполнении инструментальных методов исследования (МРТ и УЗИ) не выявлено какого-либо положительного влияния ГК на синовиальную гипертрофию и признаки воспаления [58, 59]. Таким образом, эффективность системных ГК в качестве анальгетиков для пациентов с ОАСК неясна. Более того, воспалительные процессы как цель для лечения ГК требуют дальнейшего изучения.
! Хирургическое лечение должно рассматриваться для пациентов с ОАСК с постоянными симптомами и структурными нарушениями, если другие методы лечения, включая нефармакологическую и фармакологическую терапию, не были достаточно эффективны для уменьшения боли и улучшения функции.
Для пациентов с ОА основания большого пальца используют трапезиэктомию, межфаланговых суставов – артродез или артропластику. Плацебо-контролируемые исследования этих методов лечения не проводили, и эта рекомендация основана на экспертном мнении. Обновленный кокрановский обзор доказательств хирургического вмешательства при ОА I ЗППС не выявил последовательных преимуществ определенной хирургической операции [68]. Осложнения, о которых сообщалось в испытаниях, включали боль, нестабильность, нервную дисфункцию, поверхностные раневые инфекции, ощущение натяжения сухожилия и хронический регионарный болевой синдром. Артропластика (как правило, силиконовые имплантаты) является предпочтительной хирургической техникой для проксимальных межфаланговых (ПМФ) суставов, за исключением второго, для которого лучше рассмотреть артродез. Артродез рекомендован при ОА дистальных межфаланговых суставов. Важно, чтобы пациенты получали реабилитацию после операции. Остеотомия была исключена из рекомендаций как устаревший метод лечения ОА.
! Долгосрочное врачебное наблюдение за пациентом с ОАСК должно быть адаптировано к его индивидуальным потребностям.
В связи с отсутствием доказательств экономической эффективности долгосрочного последующего наблюдения обоснованное заявление сделать невозможно. ОАСК является гетерогенным заболеванием, спектр симптомов и сопутствующих состояний у таких пациентов широко варьирует. Поэтому индивидуальные потребности больных, которые должны быть приняты во внимание при оценке необходимости последующего наблюдения, включают серьезность симптомов, наличие эрозий, использование фармакологической терапии, которая требует переоценки пожеланий и ожиданий пациента.
Обсуждалось, всегда ли длительное и непрерывное наблюдение показано для лиц с эрозивным ОАСК. Несмотря на доказательства того, что эти пациенты имеют значительное клиническое и структурное прогрессирование, целевая группа считает, что в настоящее время непрерывное диспансерное наблюдение не добавляет преимуществ их в ведении [69, 70]. Его цель, в отсутствие модифицирующего болезнь лечения, отличается от таковой при многих других ревматических заболеваниях. Диспансерное наблюдение, вероятно, увеличит приверженность к нефармакологическим методам терапии, таким как физические упражнения или ортезы, и обеспечит возможность ее коррекции (например, коррекция лечения ортезами, изменение режима дозирования или препаратов при фармакотерапии). Для большинства лиц с ОАСК стандартное рентгенологическое наблюдение бесполезно. Диспансерное же не обязательно должно проводиться только ревматологами, семейные врачи также должны участвовать в ведении таких больных. Семейные врачи в определенный момент болезни могут направить пациента обратно к ревматологу для дополнительных консультаций, однако этот пункт необходимо рассматривать индивидуально в каждом конкретном случае.
Выводы
В таблице просуммированы общие принципы и рекомендации EULAR (2018) по менеджменту пациентов с ОАСК.
Руководящие принципы других крупных (международных) обществ, включая ACR (2012) и Национального института здоровья и качества медицинской помощи (NICE) по менеджменту ОА фокусируются в основном на ОА крупных суставов (коленных и тазобедренных). Однако эти рекомендации нельзя экстраполировать на ОАСК из-за уникальной функциональности мелких суставов кистей по сравнению с крупными, данных об отличающихся факторах риска и даже патофизиологических механизмах ОАСК в отличие от ОА крупных суставов.
Рекомендации EULAR (2018) по ОАСК предназначены для всех медицинских работников, которые ведут пациентов с ОА. Поскольку ОАСК – распространенная патология, с которой сталкиваются различные поставщики медицинских услуг в сфере первичной и вторичной медицинской помощи, они актуальны не только для ревматологов, но и для семейных врачей, травматологов, хирургов-ортопедов, пластических хирургов, физиотерапевтов, а также реабилитационных врачей. Кроме того, эти рекомендации направлены на информирование пациентов об их заболевании для поддержки принятия общих решений с врачом. Другими целевыми заинтересованными сторонами являются фармацевтическая промышленность и компании медицинского страхования. Отсутствуют доказательства оптимальной систематической реализации, и это было подчеркнуто в программе исследований. Хотя между первым набором рекомендаций и текущим обновлением прошел относительно большой период, ожидается, что следующее обновление может потребоваться раньше, ведь данные о менеджменте пациентов с ОАСК расширяются. Достижения в изучении патофизиологии ОАСК, а также получение результатов рандомизированных клинических исследований по поводу методов лечения увеличивают вероятность поиска новых терапевтических вариантов.
Литература
- Branco J.C., Rodrigues A.M., Gouveia N. et al. Prevalence of rheumatic and musculoskeletal diseases and their impact on health-related quality of life, physical function and mental health in Portugal: results from EpiReumaPt – a national health survey //RMD Open. – 2016. – Vol. 2. – P. 000166.
- Michon M. Assessing health-related quality of life in hand osteoarthritis: a literature review / M. Michon, E. Maheu, F. Berenbaum // Ann Rheum Dis. – 2011. – Vol.70. – P. 921‑928.
- Slatkowsky-Christensen B., Mowinckel P., Loge J.H. et al. Health-related quality of life in women with symptomatic hand osteoarthritis: a comparison with rheumatoid arthritis patients, healthy controls, and normative data // Arthritis Rheum. – 2007. – Vol.57. – P. 1404‑1409.
- Kwok W.Y., Vliet Vlieland T.P., Rosendaal F.R. et al. Limitations in daily activities are the major determinant of reduced health-related quality of life in patients with hand osteoarthritis // Ann Rheum Dis. – 2011. – Vol. 70. – P. 334‑336.
- EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT / Zhang W., Doherty M., Leeb B.F., et al. // Ann Rheum Dis. – 2009. – Vol. 68. – P. 8‑17.
- Bijsterbosch J., Watt I., Meulenbelt I. et al. Clinical and radiographic disease course of hand osteoarthritis and determinants of outcome after 6 years // Ann Rheum Dis. – 2011. – Vol. 70. – P. 68‑73.
- EULAR evidence-based recommendations for the management of hand osteoarthritis: report of a Task Force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) / Zhang W., Doherty M., Leeb B.F. et al. // Ann Rheum Dis. – 2007. – Vol.66. – P. 377‑388.
- American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee / Hochberg M.C., Altman R.D., April K.T. et al. // Arthritis Care Res. – 2012. – Vol. 64. – P. 465‑474.
- Stukstette M.J., Dekker J., den Broeder A.A. et al. No evidence for the effectiveness of a multidisciplinary group based treatment program in patients with osteoarthritis of hands on the short term; results of a randomized controlled trial // Osteoarthritis Cartilage. – 2013. – Vol. 21. – P. 901‑190.
- Oppong R., Jowett S., Nicholls E. et al. Joint protection and hand exercises for hand osteoarthritis: an economic evaluation comparing methods for the analysis of factorial trials // Rheumatology. – 2015. – Vol. 54. – P. 876‑883.
- Hand management osteoarthritis. / I. Kjeken, S. Darre, B. Slatkowsky-Cristensen, et al. // Scand J Occup Ther. – 2013. – Vol.20. – P. 29‑36.
- Chodosh J., Morton S.C., Mojica W. et al. Meta-analysis: chronic disease self-management programs for older adults // Ann Intern Med. – 2005. – Vol. 143. – P. 427‑438.
- Du S., Yuan C., Xiao X. et al. Self-management programs for chronic musculoskeletal pain conditions: a systematic review and meta-analysis // Patient Educ Couns. – 2011. – Vol. 85. – P. 299‑310.
- Research in hand osteoarthritis: time for reappraisal and demand for new strategies. An opinion paper. / Kloppenburg M., Stamm T., Watt I. et al. // Ann Rheum Dis. – 2007. – Vol. 66. – P. 1157‑1161.
- Damman W., Liu R., Bloem J.L. et al. Bone marrow lesions and synovitis on MRI associate with radiographic progression after 2 years in hand osteoarthritis // Ann Rheum Dis. – 2017. – Vol. 76. – P. 214‑217.
- Report from the OMERACT Hand Osteoarthritis Working Group: set of core domains and preliminary set of instruments for use in clinical trials and observational studies / Kloppenburg M., Byesen P., Visser A.W. et al. // J Rheumatol. – 2015. – Vol. 42. – P. 2190‑2197.
- Legare F. Shared decision making: examining key elements and barriers to adoption into routine clinical practice / Legare F., Witteman H.O. // Health Aff. – 2013. – Vol. 32. – P. 276‑284.
- Stukstette M.J., Dekker J., den Broeder A.A. et al. No evidence for the effectiveness of a multidisciplinary group based treatment program in patients with osteoarthritis of hands on the short term; results of a randomized controlled trial // Osteoarthritis Cartilage. – 2013. – Vol. 21. – P. 901‑910.
- Dziedzic K., Nicholls E., Hill S. et al. Self-management approaches for osteoarthritis in the hand: a 2Å~2 factorial randomised trial // Ann Rheum Dis. – 2015. – Vol. 74. – P. 108‑118.
- Оsteres N., Kjeken I., Smedslund G. et al. Exercise for hand osteoarthritis // Cochrane Database Syst Rev. – 2017. – Vol. 1. – P. 010388.
- Adams J., Boueas S.B., Hislop K. et al. The effectiveness and efficacy of splints for thumb base osteoarthritis: a pilot randomized controlled trial // Rheumatology. – 2014. – Vol. 53. – P. 41‑42.
- Arazpour M., Soflaei M., Ahmadi Bani M. et al. The effect of thumb splinting on thenar muscles atrophy, pain, and function in subjects with thumb carpometacarpal joint osteoarthritis // Prosthet Orthot Int. – 2017. – Vol. 41. – P. 379‑386.
- Gomes Carreira A.C. Assessment of the effectiveness of a functional splint for osteoarthritis of the trapeziometacarpal joint on the dominant hand: a randomized controlled study / Gomes Carreira A.C., Jones A., Natour J. // J Rehabil Med. – 2010. – Vol.42. – P. 469‑474.
- Hermann M., Nilsen T., Eriksen C.S. et al. Effects of a soft prefabricated thumb orthosis in carpometacarpal osteoarthritis // Scand J Occup Ther. – 2014. – Vol. 21. – P. 31‑39.
- Rannou F., Dimet J., Boutron I. et al. Splint for base-of-thumb osteoarthritis: a randomized trial // Ann Intern Med. – 2009. – Vol. 150. – P. 661‑669.
- Watt F.E., Kennedy D.L., Carlisle K.E. et al. Night-time immobilization of the distal interphalangeal joint reduces pain and extension deformity in hand osteoarthritis // Rheumatology. – 2014. – Vol. 53. – P. 1142‑1149.
- Talke M. Treatment of heberden and bouchard types of finger osteoarthritis.Comparison between local etofenamate and oral indomethacin // Therapiewoche. – 1985. – Vol. 35. – P. 3948‑3954.
- Zacher J., Burger K.J., Farber L. et al. Topical diclofenac versus oral ibuprofen: A double blind, randomized clinical trial to demonstrate efficacy and tolerability in patients with activated osteoarthritis of the finger joints (Heberden and/or Bouchard arthritis) // Aktuelle Rheumatologie. – 2001. – Vol. 26. – P. 7‑14.
- Altman R.D., Dreiser R.L., Fisher C.L. et al. Diclofenac sodium gel in patients with primary hand osteoarthritis: a randomized, double-blind, placebo-controlled trial // J Rheumatol. – 2009. – Vol. 36. – P. 1991‑1999.
- Baraf H.S., Gold M.S, Petruschke R.A. et al. Tolerability of topical diclofenac sodium 1% gel for osteoarthritis in seniors and patients with comorbidities // Am J Geriatr Pharmacother. – 2012. – Vol. 10. – P. 47‑60.
- Zeng C., Wei J., Persson M.S. et al. Relative efficacy and safety of topical non-steroidal anti-inflammatory drugs for osteoarthritis: a systematic review and network metaanalysis of randomised controlled trials and observational studies // Br J Sports Med. – 2018. – Vol. 52. – P. 642‑650.
- Altman R.D. Topical therapies for osteoarthritis / Altman R.D., Barthel H.R. // Drugs. – 2011. – Vol. 71. – P. 1259‑1279.
- Schnitzer T.J. High strength capsaicin cream for osteoarthritis pain: rapid and rapid efficacy with twice daily dosing / Schnitzer T.J., Posner M., Lawrence I.D. // J Clin Rheumatol. – 1995. – Vol. 1. – P. 268‑273.
- Mason L., Moore R.A., Derry S. et al. Systematic review of topical capsaicin for the treatment of chronic pain // BMJ. – 2004. – Vol. 328. – P. 991.
- Dilek B., Gezum M., Sahin E. et al. Efficacy of paraffin bath therapy in hand osteoarthritis: a single-blinded randomized controlled trial // Arch Phys Med Rehabil. – 2013. – Vol. 94. – P. 642‑649.
- Stange-Rezende L., Stamm T.A., Schiffert T. et al. Clinical study on the effect of infrared radiation of a tiled stove on patients with hand osteoarthritis // Scand J Rheumatol. – 2006. – Vol. 35. – P. 476‑480.
- Aciksoz S. The effect of self-administered superficial local hot and cold application methods on pain, functional status and quality of life in primary knee osteoarthritis patients / Aciksoz S., Akyuz A., Tunay S. // J Clin Nurs. – 2017. – Vol. 26. – P. 5179‑5190.
- Dreiser R.L., Gersberg M., Thomas F. et al.buprofen 800 mg in the treatment of arthrosis of the fingers or rhizarthrosis // Rev Rhum Ed Fr. – 1993. – Vol. 60. – P. 836‑841.
- Grifka J.K., Zacher J., Brown J.P. et al. Efficacy and tolerability of lumiracoxib versus placebo in patients with osteoarthritis of the hand // Clin Exp Rheumatol. – 2004. – Vol. 22. – P. 589‑596.
- Seiler V. Meclofenamate sodium in the treatment of degenerative joint disease of the hand (Heberden nodes) // Arzneimittelforschung. – 1983. – Vol. 33. – P. 656‑659.
- Wise J. NICE keeps paracetamol in UK guidelines on osteoarthritis // BMJ. – 2014. – Vol. 348. – P. 1545.
- McKendry R., Thome C., Weisman M. et al. Hydroxychloroquine (HCQ) versus acetaminophen (ACM) versus placebo (PL) in the treatment of nodal osteoarthritis (NOA) of the hands // J Rheumatol. – 2001. – Vol.28. – P. 1421.
- Patru S., Marcu I.R., Bighea A.C. et al. Efficacy of glucosamine sulfate (GS) in hand osteoarthritis // Osteoporosis Int. – 2012. – Vol.23. – P. 169.
- Rovetta G. Dexketoprofen-trometamol in patients with osteoarthritis of the hands / Rovetta G., Monteforte P. // Minerva Ortop Traumatol. – 2001. – Vol. 52. – P. 27‑30.
- Bannuru R.R., Schmid C.H., Kent D.M. et al. Comparative effectiveness of pharmacologic interventions for knee osteoarthritis: a systematic review and network meta-analysis // Ann Intern Med. – 2015. – Vol. 162. – P. 46‑54.
- Machado G.C., Maher C.G., Ferreira P.H. et al. Efficacy and safety of paracetamol for spinal pain and osteoarthritis: systematic review and meta-analysis of randomized placebo controlled trials // BMJ. – 2015. – Vol. 350. – P. 1225.
- Roberts E., Delgado Nunes V., Buckner S. et al. Paracetamol: not as safe as we thought? A systematic literature review of observational studies // Ann Rheum Dis. – 2016. – Vol.75. – P. 552‑559.
- Gabay C., Medinger-Sadowski C., Gascon D. et al. Symptomatic effects of chondroitin 4 and chondroitin 6 sulfate on hand osteoarthritis: A randomized, double-blind, placebo-controlled clinical trial at a single center // Arthritis Rheum. – 2011. – Vol. 63. – P. 3383‑3391.
- Singh J.A., Noorbaloochi S., MacDonald R. et al. Chondroitin for osteoarthritis // Cochrane Database Syst Rev. – 2015. – Vol. 1. – P. 005614.
- Wandel S., Juni P., Tendal B. et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis // BMJ. – 2010. – Vol. 341. – P. 4675.
- Verbruggen G. Systems to assess the progression of finger joint osteoarthritis and the effects of disease modifying osteoarthritis drugs / Verbruggen G., Goemaere S., Veys E.M. // Clin Rheumatol. – 2002. – Vol.21. – P. 231‑243.
- Rovetta G., Monteforte P., Molfetta G., Balestra V. A two-year study of chondroitin sulfate in erosive osteoarthritis of the hands: behavior of erosions, osteophytes, pain and hand dysfunction // Drugs Exp Clin Res. – 2004. – Vol. 30. – P. 11‑16.
- Gabay C., Medinger-Sadowski C., Gascon D. et al. Symptomatic effects of chondroitin 4 and chondroitin 6 sulfate on hand trial at a single center // Arthritis Rheum. – 2011. – Vol. 63. – P. 3383‑3391.
- 2018 update of the EULAR recommendations for the management of hand osteoarthritis / Kloppenburg M., Kroon F.P., Blanco F.J. et al. // Ann Rheum Dis. – 2019. – Vol. 78. – P. 16‑24.
- Colen S., Haverkamp D., Mulier M., Van Den Bekerom M.P. Hyaluronic acid treatment // BioDrugs. – 2012. – Vol. 26. – P. 101‑112.
- Heyworth B.E., Lee J.H., Kim P.D. et al. Hylan versus corticosteroid versus placebo for treatment of basal joint arthritis: a prospective, randomized, double-blinded clinical trial // J Hand Surg Am. – 2008. – Vol. 33. – P. 40‑48.
- Spolidoro Paschoal N.O., Natour J., Machado F.S. et al. Effectiveness of Triamcinolone Hexacetonide Intraarticular Injection in Interphalangeal Joints: A 12-week Randomized Controlled Trial in Patients with Hand Osteoarthritis // J Rheumatol. – 2015. – Vol. 42. – P. 1869‑1877.
- Wenham C.Y., Hensor E.M., Grainger A.J. et al. A randomized, double-blind, placebocontrolled trial of low-dose oral prednisolone for treating painful hand osteoarthritis // Rheumatology (Oxford). – 2012. – Vol. 51. – P. 2286‑2294.
- Keen H.I., Wakefield R.J., Hensor E.M. et al. Response of symptoms and synovitis to intramuscular methylprednisolone in osteoarthritis of the hand: an ultrasonographic study // Heumatology (Oxford). – 2010. – Vol. 49. – P. 1093‑1100.
- McKendry R., Thome C., Weisman M. et al. Hydroxychloroquine (HCQ) versus acetaminophen (ACM) versus placebo (PL) in the treatment of nodal osteoarthritis (NOA) of the hands // J Rheumatol. – 2001. – Vol. 28. – P. 1421.
- Lee W., Ruijgrok L., Boxma-de Klerk B. et al. Efficacy of hydroxychloroquine in hand osteoarthritis: a randomized, double blind, placebo-controlled trial // Arthritis Care Res. – 2017. – Vol. 74. – P. 181‑188.
- Kingsbury S.R., Tharmanathan P., Keding A. et al. Hydroxychloroquine is not effective in reducing symptoms of hand osteoarthritis: Results from a placebo-controlled andomised trial // Arthritis Rheumatol. – 2016. – Vol. 68. – P. 4189‑4191.
- Aitken D., Laslett L.L., Pan F. et al. A randomised double-blind placebo-controlled crossover trial of HUMira (adalimumab) for erosive hand OsteoaRthritis – the HUMOR trial // Osteoarthritis Cartilage. – 2018. – Vol. 26. – P. 9.
- Chevalier X., Ravaud P., Maheu E. et al. Adalimumab in patients with hand osteoarthritis refractory to analgesics and NSAIDs: a randomised, multicentre, doubleblind, placebo-controlled trial // Ann Rheum Dis. – 2015. – Vol. 74. – P. 1697‑1705.
- Kloppenburg M., Ramonda R., Kwok W.Y. et al. Randomized, placebocontrolled trial to evaluate clinical efficacy and structure modifying properties of subcutaneous etanercept (ETN) in patients with erosive inflammatory hand osteoarthritis (OA) // Ann Rheum Dis. – 2016. – Vol. 75. – P. 90.
- Kloppenburg M., Peterfy C., Haugen I. et al. A phase 2a, placebo-controlled, randomized study of ABT‑981, an anti-interleukin‑1alpha and –1beta dual variable domain immunoglobulin, to treat Erosive Hand Osteoarthritis (EHOA) // Ann Rheum Dis. – 2017. – Vol. 76. – P. 122.
- Kvien T.K., Fjeld E., Slatkowsky-Christensen B. et al. Efficacy and safety of a novel synergistic drug candidate, CRx‑102, in hand osteoarthritis // Ann Rheum Dis. – 2008. – Vol. 67. – P. 942.
- Wajon A., Vinycomb T., Carr E. et al. Surgery for thumb (trapeziometacarpal joint) osteoarthritis // Cochr Database Syst Rev. – 2015. – Vol. 2. – P. 004631.
- Haugen I.K., Mathiessen A., Slatkowsky-Christensen B. et al. Synovitis and radiographic progression in non-erosive and erosive hand osteoarthritis: is erosive hand osteoarthritis a separate inflammatory phenotype? // Osteoarthritis Cartilage. – 2016. – Vol. 24. – P. 647‑654.
- Kwok W.Y., Kloppenburg M., Rosendaal F.R. et al. Erosive hand osteoarthritis: its prevalence and clinical impact in the general population and symptomatic hand osteoarthritis // Ann Rheum Dis. – 2011. – Vol. 70. – P. 1238‑1242.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 4 (65) вересень 2019 р.