26 лютого, 2020
Открытое овальное окно как возможный этиологический фактор криптогенного инсульта и мигрени
По данным литературы, в 30‑40% случаев у пациентов с ишемическим инсультом не удается установить истинную причину заболевания, что клиницистами трактуется как криптогенный инсульт, т.е. неясной этиологии. Одним из этиологических факторов криптогенного инсульта является открытое овальное окно (ООО). В этой статье обсуждаются вопросы распространенности ООО, его связь с криптогенным инсультом, транзиторной ишемической атакой (ТИА) и мигренью, а также безопасный метод диагностики ООО с помощью ультразвуковой эхокардиографии (ЭхоКГ) с проведением процедуры bubble test («контрастирование пузырьками»). Также представлены последние рекомендации по выбору вмешательств и их эффективности при ООО.
Согласно данным отчета Нeart Disease and Stroke Statistics – 2016 Update Американской ассоциации сердца (AHA), распространенность инсульта по миру составила 33 млн человек, причем 16,9 млн – впервые установленные случаи инсульта, из которых 5,2 млн – лица в возрасте <65 лет. Заболеваемость ишемическим инсультом с 1990 по 2010 гг. в странах с высоким уровнем дохода снизилась на 13%, а геморрагическим – на 19%. Однако никаких существенных изменений в странах с низким и средним уровнем дохода не наблюдалось, более того, показатели заболеваемости в этих странах геморрагическим инсультом выросли на 22% [1]. Всемирная организация здравоохранения (ВОЗ) также объявила инсульт эпидемией, распространяющейся по всему миру.
Причины возникновения инсультов во всем мире включают такие распространенные факторы риска, как артериальная гипертония, нарушения ритма сердца, гиперлипидемия, сахарный диабет, врожденные аномалии сосудов головного мозга, злоупотребление алкоголем и никотином, неправильное питание, низкая физическая активность. Однако в 30‑40% случаев у лиц с ишемическими инсультами не удается определить истинную причину заболевания, что клиницистами трактуется как криптогенный инсульт, т.е. неясной этиологии [4]. Согласно данным литературы, подобные случаи возникновения криптогенного инсульта связывают с наличием у пациентов ООО в сердце.
Прошло 133 года с тех пор, как немецкий анатомист J. Cohnheim впервые установил связь между смертью молодой женщины от негеморрагического инсульта и наличием у нее ООО [5]. Попытки определить корреляцию ООО с криптогенным инсультом проводили и ученые P. Lechat и M. Webster с 1988 г. K. Nakanishi et al. (2017) указывают, что наличие открытого овального окна связано с повышенным риском криптогенного инсульта во многих исследованиях по методу случай/контроль [6]. В тоже время D. Consoli et al. отрицали эту корреляцию (2015), в связи с чем данный вопрос по сей день остается открытым [7].
В общей популяции распространенность ООО относительна – как показали некоторые испытания, около 25% здорового населения имеет ООО [8, 9]. В исследованиях аутопсии были получены сходные результаты, а также доказан тот факт, что распространенность уменьшается с возрастом. В тоже время исследования ЭхоКГ показали, что показатель распространенности может варьировать от 3,2 до 18%. Таким образом, проанализировав медицинские базы данных по итогам испытаний за последние 20 лет, можно констатировать тот факт, что из 13 исследований по типу случай/контроль относительно распространенности ООО при инсульте среди всех возрастов в 11 была продемонстрирована положительная корреляция ООО с криптогенным инсультом, а в двух – отсутствие связи [10, 11, 12].
Существуют различные теории механизма возникновения инсульта у пациентов с ООО:
- парадоксальная эмболия, при которой венозный сгусток перемещается (например воздух, жир, инфекционные частицы) через ООО в артериальное кровообращение, минуя фильтрации через легкие и вызывая эмболию в мозге;
- первичное образование тромбов в канале ООО из-за различных анатомических особенностей;
- связанные с аритмией предсердий тромбы из-за ООО;
- сопутствующее гиперкоагуляционное состояние, предрасполагающее к образованию напрямую тромба или венозного свертывания, создавая условия для парадоксальной эмболии.
Нулевого пациента с парадоксальной эмболией впервые описал J. Cohnheim в 1877 г. Молодая женщина с инсультом, вероятно, также имела сопутствующее гиперкоагуляционное состояние [5].
Данные международной литературы свидетельствуют, что 30‑40% ишемических инсультов являются криптогенными. У значительной части больных, перенесших ишемический инсульт, причина его возникновения остается невыясненной, а значит и тактика лечения не принесет желаемого результата. Это указывает на то, что, вероятно, следует ожидать повторных инсультов или фатальных исходов. Более того, заболеваемость среди молодого населения в возрасте от 16 до 40 лет составляет около 5% от общего количества лиц с ишемическим инсультом, т.е. ежегодно только 540 человек данной возрастной категории переносят криптогенный инсульт, причиной которого, возможно, является ООО. Таким образом, предоставленные данные служат основой для инициирования эпидемиологических научных исследований этой когорты больных.
Для диагностики ООО используется классическая трансэзофагеальная и трансторакальная ЭхоКГ. Также за рубежом получил широкое распространение относительно новый эффективный и безопасный метод ультразвуковой ЭхоКГ с проведением так называемой процедуры bubble test, т.е. «контрастирования пузырьками». Суть метода заключается в перемешивании крови пациента с физиологическим раствором и введением полученных растворенных микропузырьков в венозный кровоток во время проведения трансторакальной ЭхоКГ, что позволяет обнаружить ООО [5]. Однако данная процедура не так широко распространена среди врачей УЗД.
На сегодняшний день медицинская помощь пациентам с инсультом предусматривает проведение тромболитической терапии и эндоваскулярных операций. Однако при этом обследование сердечно-сосудистой системы не является рутинным мероприятием для выявления причины криптогенного инсульта, в связи с чем больные остаются недиагностированными и имеют повышенный риск возникновения повторного инсульта.
Согласно медицинскому статистическому глобальному исследованию бремени болезней 2010 г. (Global Burden Disease), мигрень считается третьим по распространенности заболеванием в мире после зубного кариеса и головной боли напряжения и составляет от 12 до 15% [13‑15]. По международным данным, частота обнаружения ООО у пациентов с мигренью, сопровождающейся визуальной аурой, составляет около 50% против 20% в общей популяции лиц с мигренью без ауры. Процент больных мигренью без ауры ничем не отличается от частоты возникновения ООО во всей популяции [16].
Исследователи T. Nauman et al. проанализировали 34 клинических исследования, в которых оценивали связь между мигренью и ООО, в частности, распространенность мигрени у пациентов с ООО и отдельно ООО у лиц с мигренью. Общее число больных в первом виде исследований составило 2602 (диапазон выборки – от 42 до 603 участников), где распространенность мигрени у лиц с ООО колебалась от 16 до 64%. Во второй части исследований в 20 из них было обследовано 2444 пациента с мигренью в возрасте от 12 до 61 года на наличие ООО. Однако получены противоречивые результаты: распространенность ООО у лиц с мигренью без ауры составила от 15 до 90%, с аурой – от 16 до 90% [15].
Теории относительно того, почему у пациентов с ООО проявляется мигрень или наоборот, основаны на возможных механизмах субклинической эмболии и/или более высоких концентрациях серотонина, обходящих легкие, и, таким образом, непосредственно проникающих в системный кровоток. Один или оба из этих механизмов могут привести к активации тройничного нерва и сосудистой сети мозга, вызывая мигрень [15].
Обнаружение пороков сердца, то есть наличия сообщающегося отверстия между правым и левым отделами сердца, является показанием для проведения трансэзофагеальной или трансторакальной ЭхоКГ. По сравнению с трансэзофагеальной трансторакальная ЭхоКГ с использованием метода bubble test является более точным методом для выявления ООО. По данным руководства Американского общества эхокардиографии (ASE) и Американского общества анестезиологов (ASA) 2013 г., чувствительность метода bubble test по обнаружению внутрисердечного отверстия составляет 99%, а специфичность – 85% [13].
Для проведения данного диагностического исследования специальная подготовка пациентов не требуется. В качестве расходного материала на одного больного необходим периферический катетер диаметром 18G, трехходовой краник Stop-Cock и два перфузорных шприца.
В ходе проведения стандартной трансторакальной ЭхоКГ медсестра вводит катетер в локтевую вену пациента, к которому присоединяют трехходовой краник. В первый шприц набирают физиологический раствор 5 мл и подсоединяют к трехходовому кранику Stop-Cock. Второй шприц также присоединяют к трехходовому кранику и делают забор крови в объеме 2 мл. С помощью этих двух шприцов добиваются образования пузырьков, которые по команде врача вводят обратно в вену. Пациент лежит на левом боку, врач УЗИ устанавливает ультразвуковой датчик трансторакальной ЭхоКГ в области позиции верхушки сердца для лучшего выведения эхокартины в четырехкамерной проекции. В норме, если нет внутрисердечного отверстия, внутривенно введенные пузырьки из смеси крови пациента с физиологическим раствором фильтруются в легких и не появляются в левом отделе сердца. Возникновение более трех пузырьков в левом отделе сердца вскоре после помутнения правого отдела на экране эхокардиографа (в течение трех циклов) указывает на наличие ООО (рисунок) [14]. Процедура на этом заканчивается.
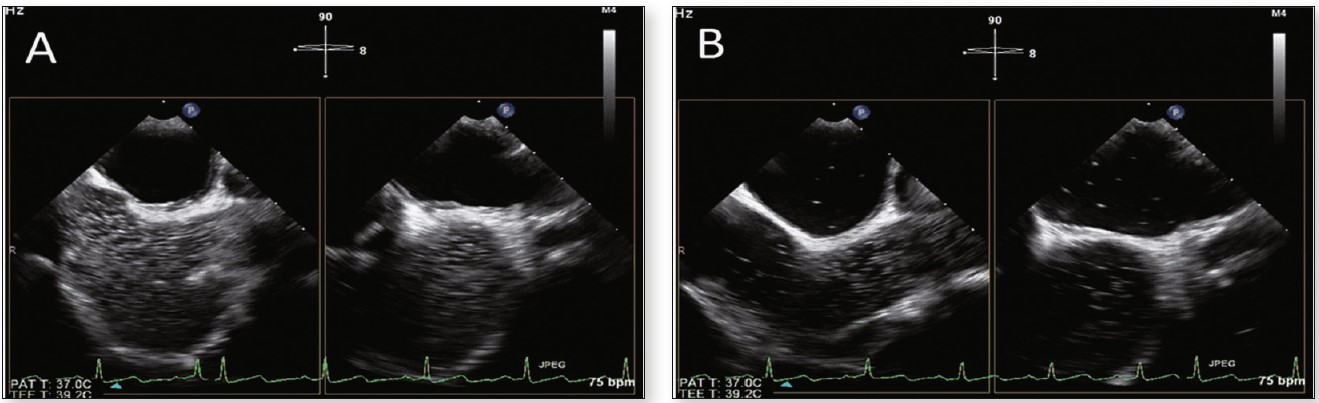 Рисунок. Исследование с пузырьковым контрастированием: после помутнения правого отдела сердца (А) появление более трех солевых пузырьков в левом отделе (B) соответствует наличию ООО
Рисунок. Исследование с пузырьковым контрастированием: после помутнения правого отдела сердца (А) появление более трех солевых пузырьков в левом отделе (B) соответствует наличию ООО
Примечание: Адаптировано по Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists, 2013.
Как известно, эффективность лечения острого инсульта с помощью реперфузионной терапии весьма ограничена ввиду узкого терапевтического окна. Однако все пациенты с инсультом могут получить эффективную вторичную профилактику, особенно в случаях высокого риска повторного инсульта или ТИА. Немедленное опознание ТИА и последующее обследование больного с непосредственным началом лечения является необходимым условием для уменьшения риска повторного инсульта. Доказательства снижения частоты рецидивов инсульта и ТИА у пациентов, в анамнезе которых имелись цереброваскулярные нарушения с последующим закрытием ООО, можно найти во многих нерандомизированных одноцентровых исследованиях. В большинстве из них частота возникновения нарушений (ТИА и инсульт) за год до закрытия сравнивается с показателем в течение года после закрытия. Процент частоты нарушений до закрытия колеблется от 2 до 26%, а диапазон повторных нарушений после закрытия составляет от 1 до 2,5% [17].
На сегодняшний день существуют различные подходы в лечении пациентов с ООО: терапевтические и хирургические. В перспективном многоцентровом рандомизированном контролируемом исследовании CLOSURE I оценивали безопасность и эффективность системы закрытия перегородкой STARFlex в сравнении с оптимальной медикаментозной терапией у пациентов с инсультом и ТИА вследствие, предположительно, парадоксального эмбола из-за наличия ООО. Полученные результаты не показали существенного преимущества закрытия ООО устаревшим устройством STARFlex в течение двух лет наблюдения.
Чрескожное закрытие ООО может быть особенно оправданным у пациентов с ООО и ассоциированной аневризмой перегородки предсердий [18]. Открытое хирургическое закрытие ООО в настоящее время уступает место чрескожному хирургическому методу закрытия ввиду развития специальных устройств.
Данные трех рандомизированных контролируемых исследований, опубликованных в 2012 г. (CLOSURE I, PC Trial и RESPECT), не подтвердили превосходства чрескожного вмешательства с установкой закрывающих девайсов в сравнении с оптимальной медикаментозной терапией. Данная процедура приводила к еще более высокой частоте рецидивов фибрилляции предсердий, а также осложнений в виде тромбообразования, связанных с устройством, что делает ее эффективность сомнительной [19].
Тем не менее, самая важная новость 2017 г. в неврологии связана с профилактикой криптогенного инсульта, доказанная тремя независимыми исследованиями, в которых сравнивали антитромботическую терапию и хирургическое закрытие ООО у пациентов в возрасте до 60 лет с криптогенным инсультом. Закрытие ООО явно превосходило антитромботическую терапию, особенно с ассоциированной аневризмой предсердной перегородки или наличием крупного межпредсердного шунта. Частота рецидива инсульта была ниже среди больных, которым было назначено закрытие ООО в сочетании с антитромботической терапией, чем среди тех, кто получал только антитромботические препараты [20‑23].
Ниже приведены основные рекомендации 2014 г. AHA и Американской ассоциации по инсульту (ASA) по профилактике инсульта и ТИА у пациентов с ООО:
- Данных, чтобы установить, является ли антикоагулянтная терапия эквивалентной или превосходит аспирин для профилактики вторичного инсульта у пациентов с ООО, недостаточно (класс IIb, уровень доказательности B).
- Для пациентов с ишемическим инсультом и/или ТИА и ООО, которым не показана антикоагулянтная терапия, рекомендуется применение антиагрегантных средств (класс I, уровень доказательности B).
- Для пациентов с ишемическим инсультом и/или ТИА и наличием в обоих случаях ООО, а также эмболии венозного происхождения показана антикоагулянтная терапия в зависимости от симптомов инсульта (класс I, уровень доказательности A). Когда такое лечение противопоказано, целесообразно проводить имплантацию кава-фильтров в нижней полой вене (класс IIa, уровень доказательности C).
Также молодых пациентов с криптогенным инсультом и/или ТИА и ООО следует дополнительно обследовать на наличие тромбоза в нижних конечностях или венозной впадины, что является показанием для назначения антикоагулянтной терапии [24].
G. Falanga et al. (2015) на основании проведенного широкого обзора литературы предлагают практическую
- учитывать только молодых пациентов (<55 лет);
- исключить фибрилляцию предсердий;
- проанализировать признаки очаговых изменений на снимках нейровизуализации;
- оценить наличие анатомических дефектов (таких как аневризма предсердной перегородки, большое ООО, шунт крови справа налево в покое, евстахиев клапан >10 мм, наличие сети Киари и длинного туннеля ООО) и клинические факторы риска повторения криптогенного инсульта: множественные ишемические поражения, повторные цереброваскулярные нарушения, историю тромбоза глубоких вен или протромботическое состояние, легочную эмболию, событие, связанное с путешествием или длительной иммобилизацией;
- использовать показатель шкалы риска парадоксальной эмболии (RoPE).
Руководствуясь этой «дорожной картой» и международными рекомендациями, далее лечение необходимо продолжать следующим образом:
- Назначить медикаментозное лечение при возникновении первых цереброваскулярных симптомов и отсутствии дополнительных факторов риска.
- Предложить чрескожное закрытие в качестве альтернативы фармакотерапии в соответствии с последними рекомендациями при криптогенном инсульте с тромбозом глубоких вен в зависимости от риска его повторного развития.
- Рассмотреть чрескожное закрытие даже при отсутствии рекомендаций для пациентов с криптогенным инсультом, у которых есть более одного фактора риска (модифицируемые и не модифицируемые) развития повторного инсульта, и в случае появления первого или повторного криптогенного инсульта на фоне адекватной медикаментозной терапии (при приеме антиагрегантов и/или пероральных антикоагулянтов) [19].
Литература
- Heart Disease and Stroke Statistics – 2016 Update. A Report From the American Heart Association // Circulation, 2015.
- Здоровье населения Республики Казахстан и деятельность организаций здравоохранения в 2016 году // Статистический сборник, 2017. – 356 с.
- World Stroke Organization. Global stroke statistics // International Journal of Stroke. – 2013. – Vol. 9.
- Senadim S., Bozkurt D., ÇCabalar M., Bajrami A., Yayla V. The Role of Patent Foramen Ovale in Cryptogenic Stroke // Arch Neuropsychiatr. – 2016. – Vol. 53. – P. 63‑66.
- Ning M., Lo E.H., Ning P.C., Xu S.Y. The Brain’s Heart – Therapeutic Opportunities for Patent Foramen Ovale (PFO) and Neurovascular Disease // Pharmacol Ther. – 2013. – Vol. 139 (2). – P. 111‑123.
- Nakanishi K., Yoshiyama M., Homma Sh. Patent foramen ovale and cryptogenic stroke PFO and stroke // Trends in Cardiovascular Medicine. – 2017. – Vol. 27 (8). – P. 575‑581.
- Consoli D., Paciaroni M., Galati F., Aguggia M., Melis M. et al. Prevalence of Patent Foramen Ovale in Ischaemic Stroke in Italy: Results of SISIFO Study // Cerebrovasc Dis. – 2015. – Vol. 39 (3‑4). – P. 162‑169.
- Hagen P.T., Scholz D.G., Edwards W.D. Incidence and size of patent foramen ovale during the first 10 decades of life: An autopsy study of 965 normal hearts // Mayo Clin Proc. – 1984. – Vol. 59. – P. 17‑20.
- Tullio D. Patent foramen ovale: Echocardiographic detection and clinical relevance in stroke // J Am Soc Echocardiogr. – 2010. – Vol. 23. – P. 144‑155.
- Handke M., Harloff A., Olschewski M., Hetzel A., Geibel A. Patent foramen ovale and cryptogenic stroke in older patients // N Engl J Med. – 2007. – Vol. 357. – P. 2262‑2268.
- Mattle H.P., Meier B., Nedeltchev K. Prevention of stroke in patients with patent foramen ovale // Int J Stroke. – 2010. – Vol. 5(2). – P. 92‑102.
- Force M., Massabuau P., Larrue V. Prevalence of atrial septal abnormalities in older patients with cryptogenic ischemic stroke or transient ischemic attack // Clin Neurol Neurosurg. – 2008. – Vol. 110 (8). – P. 779‑783.
- Hahn R.T., Abraham T., Adams M.S., Bruce C.J. et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination: recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists // J Am Soc Echocardiogr. – 2013. – Vol. 26 (9). – P. 921‑964.
- Belvis R., Leta R.G., Marti-Fabregas J., Cocho D., Carreras F., Pons-Llado G. et al. Almost perfect concordance between simultaneous transcranial Doppler and transesophageal echocardiography in the quantification of right-to-left shunts // J Neuroimaging. – 2006. – Vol. 16. – P. 133‑138.
- Tariq N., Tepper S.J., Kriegler J.S. Patent Foramen Ovale and Migraine: Closing the Debate – A Review // Headache. – 2016. – Vol. 56. – P. 462‑478.
- Tobis J.M., Azarbal B. Does Patent Foramen Ovale Promote Cryptogenic Stroke and Migraine Headache? // Texas Heart Institute Journal, Current Issues in Cardiology. – 2005. – Vol. 32.
- Salinger M.H., Cilingiroglu M. at al. Closure to Prevent Recurrent TIA and Stroke. What is the evidence base for patent foramen ovale closure? // Cardiac interventions today. – 2010.
- Meier B. et al. Secondary Stroke Prevention: Patent Foramen Ovale, Aortic Plaque, and Carotid Stenosis // European Heart Journal. – 2012. – Vol. 33.6. – P. 705‑713.
- Falanga G. et al. How to Understand Patent Foramen Ovale Clinical Significance – Part II: Therapeutic Strategies in Cryptogenic Stroke // Journal of Cardiovascular Echography. – 2015. – Vol. 25.2. – P. 46‑53.
- Diener H.C. 2017’s Biggest Breakthroughs in Neurology.: MedScape, 2017.
- Mas J.L., Derumeaux G., Guillon B. et al. CLOSE Investigators. Patent foramen ovale closure or anticoagulation vs. antiplatelets after stroke // N Engl J Med. – 2017. – Vol. 377. – P. 1011‑1021.
- Søndergaard L., Kasner S.E., Rhodes J.F. et al. Gore REDUCE Clinical Study Investigators. Patent foramen ovale closure or antiplatelet therapy for cryptogenic stroke // N Engl J Med. – 2017. – Vol. 377. – P. 1033‑1042.
- Saver J.L., Carroll J.D., Thaler D.E. et al. RESPECT Investigators. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke // N Engl J Med. – 2017. – Vol. 377. – P. 1022‑1032.
- Kernan W.N. et al. Guidelines for the Prevention of Stroke in Patients with Stroke and Transient Ischemic Attack a Guideline for Healthcare Professionals from the American Heart Association/ American Stroke Association: American Heart Association, Inc., 2014.
Статья печатается в сокращении
Нейрохирургия и неврология Казахстана. – 2018. – № 1 (50). – С. 54‑59.
Спецвипуск «Інсульт». Додаток до № 1 (52), 2020 р.


