24 травня, 2020
Проблеми діагностики та лікування синдрому пахвинного болю у спортсменів
 У статті проведено аналіз сучасних проблем діагностики та лікування синдрому пахвинного болю у спортсменів. У результаті проведеного аналізу поглиблено знання про причини розвитку й особливості перебігу синдрому пахвинного болю у спортсменів, розроблені диференційовані підходи до його лікування з використанням нових консервативних та оперативних методик, із залученням артроскопічної техніки, а також досягнень сучасних біотехнологій, зокрема застосування аутологічної плазми, багатої факторами росту. Це дозволяє підвищити ефективність лікування професійних спортсменів із синдромом пахвинного болю й прискорює їх повернення до спортивної діяльності.
У статті проведено аналіз сучасних проблем діагностики та лікування синдрому пахвинного болю у спортсменів. У результаті проведеного аналізу поглиблено знання про причини розвитку й особливості перебігу синдрому пахвинного болю у спортсменів, розроблені диференційовані підходи до його лікування з використанням нових консервативних та оперативних методик, із залученням артроскопічної техніки, а також досягнень сучасних біотехнологій, зокрема застосування аутологічної плазми, багатої факторами росту. Це дозволяє підвищити ефективність лікування професійних спортсменів із синдромом пахвинного болю й прискорює їх повернення до спортивної діяльності.
Ключові слова: синдром пахвинного болю у спортсменів, класифікація, діагностика, ушкодження суглобової губи кульшової западини, ARS-синдром, кила спортсмена, синдром внутрішнього клацаючого стегна, синдром зовнішнього клацаючого стегна, консервативне лікування, аутологічна плазма, багата факторами росту, оперативне лікування, артроскопія.
У наш час в Україні відбувається перехід від масового аматорського до високооплачуваного професійного спорту, що потребує формування якісно нового рівня функціональної готовності спортсменів. Намагання форсувати цей процес поряд із збільшенням фізичних навантажень, ускладненням технічних прийомів на тренуваннях, а також недосконалістю графіків змагань часто призводить до патологічних станів, які рідко траплялися раніше. До них належить синдром пахвинного болю у спортсменів (СПБС) [1, 2].
Отже, СПБС – це група м’якотканинних ушкоджень, які виникають у спортсменів внаслідок хронічного перевантаження й супроводжуються больовими відчуттями в паховій ділянці, що призводить до часткової або повної втрати спортсменом його професійної здатності [3]. СПБС становить 5-18% у структурі всього спортивного травматизму, частота його виникнення та локалізація безпосередньо залежать від виду спортивної діяльності [3, 4].
На сьогодні у світовій літературі зустрічається багато специфічних термінів, що характеризують синдром пахвинного болю. До них належать ARS-синдром (Adduktor-Rectus-Symphysis), osteitis pubis, athlethic pubalgia, sportsmens hernia, groin pain syndrome, Gilmore pain тощо. Слід зазначити, що жодний із цих термінів не лише не описує в повній мірі етіологію та патогенез розвитку травм даної локалізації, а й призводить до плутанини серед лікарів спортивних команд та ортопедів-травматологів стаціонарних відділень. У свою чергу, несвоєчасна й неправильна діагностика хворих із СПБС в кінцевому результаті призводить до зриву компенсаторних механізмів та спричиняє розвиток стійкого больового синдрому, що є досить частою причиною часткової або повної втрати спортсменом його працездатності [5-10].
Біомеханіка, патогенез та класифікація СПБС
За анатомічним субстратом ушкодження СПБС можна розподілити на наступні групи [6-13].
- Тендо-міогенні – ушкодження сухожилково-м’язового комплексу m. iliopsoas, mm. adductor longus et brevis, m. gracіlis, дистальної частини m. rectus abdominis та m. obliquus abdominis, передньої частини m. adductor magnus, а також проксимальної частини m. rectus femoris тощо.
- Артрогенні – ушкодження суглобової губи кульшової западини та капсульно-зв’язкового апарату кульшового суглоба.
- Симфізогенні – лобковий симфізит, нестабільність лобкового з’єднання тощо.
- Інгвінальні – кила спортсмена.
- Нейрогенні – посттравматичні нейропатії n. ilioinguinalis, iliohypogastricus, genitofemoralis тощо.
Зупинимося на кожній групі детальніше.
Тендо-міогенні ушкодження можуть траплятись у будь-якій частині м’яза або сухожилля. За анатомічними, гістологічними та біомеханічними властивостями виділяють декілька зон [11]:
– зона кістково-сухожилкового сполучення (КСС);
– власне зона сухожилля;
– зона м’язово-сухожилкового сполучення (МСС);
– власне зона м’яза.
Зона КСС, у свою чергу, складається з чотирьох зон [20]:
– зона щільної фіброзної тканини;
– зона некальцифікованої фіброзно-хрящової тканини;
– зона кальцифікованої фіброзно-хрящової тканини;
– зона кісткової тканини.
У зоні переходу некальцифікованої фіброзно-хрящової тканини в кальцифіковану наявна одна або більше добре видимих базофільних ліній (цементних або блакитних ліній), які називаються позначками рівня. Такі позначки відображають зовнішню межу кальцифікованої фіброзно-хрящової тканини. При цьому хондроцити виявляються з боку лінії сухожилля, а колагенові фібрили, що характерні для тканини сухожилля, можуть простягатися аж до КСС. Дана зона характеризується своєю слабкою васкуляризацією.
На нашу думку, слід розподілити тендо-міогенні ушкодження залежно від їх анатомічної зони. Так, тендогенні ушкодження можуть розвиватися в ділянці КСС (ентезіс) на фоні хронічного перенавантаження m. iliopsoas, mm. adductor longus et brevis, m. gracіlis, дистальної частини m. rectus та obliquus abdominis, передньої частини m. adductor magnus, а також проксимальної частини m. rectus femoris тощо [11].
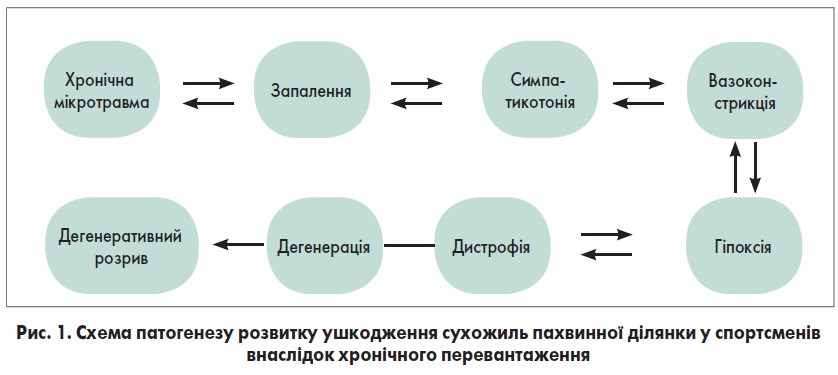
Хронічна мікротравматизація сухожиль супроводжується вивільненням медіаторів запалення, формуванням осередків запалення у сухожиллі та навколо нього, що характеризується вазодилатацією, посиленим судинним малюнком, теносиновітом та розвитком навколотканинного набряку. На цій стадії зміни в сухожиллі мають функціональний характер і в разі усунення зовнішнього подразника можуть бути зворотними. У разі якщо дія зовнішнього чинника продовжується, виникає симпатикотонія на рівні кінетичного вузла (місця прикріплення сухожиль до кісткової тканини), що викликає вазоконстрикцію, призводить до гіпоксії та зміни локального метаболізму. Такі зміни мають дистрофічний характер, при цьому спостерігається тривале переважання процесів дисиміляції над процесами асиміляції, що призводить до недостатнього надходження поживних речовин у клітину, до розвитку інтерстиціального набряку як у міофібрилах, так і у клітинних структурах. Якщо на даній стадії патогенезу дія етіологічного чинника не була усунена, то розвиваються структурні зміни дегенеративного характеру, які супроводжуються загибеллю спеціалізованих клітин із наступним заміщенням дефекту грубоволокнистою сполучною тканиною і формуванням осередків осифікатів та некрозу. Ці зміни призводять до виникнення стійкого больового синдрому, зменшення міцності самого сухожилля з наступним можливим його розривом (рис. 1) [14-18].
Ушкодження можуть також відбуватися як власне у зоні м’яза, так і в зоні МСС проксимальної частини m. adductor longus та/або m. adductor brevis, m. gracilis, дистальної частини m. rectus та m. obliquus abdominis, m. iliopsoas, а також передньої частини m. adductor magnus, при цьому ушкодження м’язів розподіляються залежно від механізму травми на забої, дисторсії та розриви [5, 14, 15]. Дисторсії найчастіше виникають у власне зоні м’яза й характеризуються частковим розривом окремих волокон, тоді як повні розриви частіше спостерігаються в ділянці МСС [15, 16].
Ушкодження м’язів можна розподілити на чотири категорії :
- дисторсія (I ступінь), при якій відбувається мінімальний підфасціальний розрив окремих м’язових волокон;
- частковий розрив (II ступінь), де має місце виражене ушкодження частини м’язових волокон зі збереженням цілісності фасції та наявністю підфасціальної гематоми, відзначається зниження сили м’яза та обмеження рухів;
- тяжке ушкодження (IIІ ступінь), коли має місце повне ушкодження м’язових волокон зі збереженням цілісності фасції та наявністю вираженої підфасціальної гематоми;
- повний розрив м’яза та фасції з поширенням гематоми за межі фасції (IV ступінь) [15, 16].
За результатами біомеханічного дослідження нами було встановлено, що максимальні показники напружень під час удару по м’ячу знаходяться в зоні прикріплення сухожиль усіх привідних м’язів до кістки (ентезіс) із максимальними значеннями 5,27 МПа (m. adductor longus) та 4,16 МПа (m. adductor brevis), при цьому спостерігається наявність зон концентрації напружень у місцях переходу механічних властивостей матеріалів «кістка –сухожилля – м’яз», а зміни механічних властивостей тканин у ділянках ентезісів на фоні дегенеративних процесів можуть призводити до зростання показників напружень із перевищенням порога міцності тканин та їх одночасного механічного ушкодження. Також біомеханічні дослідження привідних м’язів стегна (m. adductor longus, m. adductor brevis, m. adductor magnus, m. gracilis) виявили locus minoris цієї ділянки, ушкодження якого при вибуховому скороченні м’язів під час удару по м’ячу може спричинити розвиток клінічної картини синдрому пахвинного болю у футбольних гравців.
До симфізогенних ушкоджень пахвинної ділянки у спортсменів відносять лобковий симфізит, а також мікронестабільність переднього тазового напівкільця. Як відомо, таз є місцем біомеханічної рівноваги між верхньою та нижньою частинами тіла. До кісток таза прикріплюється велика кількість м’язів, які забезпечують тонку рівновагу між цими частинами для координації рухів, що передаються через таз. При цьому навколо лобкового з’єднання існує певний «люфт», що в нормі складає 2 мм у фронтальній та 3 мм у сагітальній площинах [2]. При цьому головними стабілізаторами рівноваги навколо переднього тазового напівкільця слугують потужні привідні м’язи стегна, а також прямі й косі м’язи живота [5, 6, 19].
Довготривалі однотипні навантаження, пов’язані з асиметричним скороченням вищезазначених м’язів, призводять до мікротравматизації, запальних та дегенеративних змін даної ділянки з наступним виникненням мікроскопічних або повних розривів сухожилково-зв’язкового апарату навколо лобкового з’єднання, а внаслідок цього – до порушення біомеханічної рівноваги та розвитку нестабільності переднього тазового напівкільця [5, 19].
До інгвінальних ушкоджень пахвинної ділянки відносять килу спортсмена. Даний термін вперше запропонував J. Gilmore. Він означає неускладнену пряму пахвинну килу, що виникає у спортсменів під час інтенсивних фізичних навантажень та проявляється болем у пахвинній ділянці з іррадіацією в калитку та внутрішню поверхню стегна [7, 9, 20, 21]. Даний вид ушкоджень характерний для спортсменів ігрових видів спорту, що часто виконують складнокоординовані вправи (футбол, хокей тощо). При цьому, на відміну від істинних прямої та косої пахвинних кил, при килі спортсмена не відбувається проникнення грижового мішка у структури пахвинного каналу, а лише спостерігається розтягнення задньої стінки останнього (поперечної фасції), через ділянку якої внаслідок підвищення внутрішньочеревного тиску під час виконання спортсменом фізичних вправ (удар по м’ячу) відбувається короткочасне зворотне випинання грижового мішка, що призводить до подразнення розташованих навколо нервових закінчень і супроводжується розвитком больового синдрому [21, 22].
Вищезазначені ушкодження можуть спричиняти нейропатії гілочок нервів пахвинної ділянки (n. ilioinguinalis, n. iliohypogastricus, n. genitofemoralis тощо), що виникають, як правило, на фоні інгвінальних ушкоджень [7, 9, 11, 19, 22].
Артрогенні ушкодження кульшового суглоба складають 15-21% від усіх причин СПБС [6, 23, 24] і поділяються на наступні типи:
- ушкодження суглобової губи кульшової западини;
- ушкодження суглобового хряща кульшової западини;
- ушкодження суглобового хряща головки стегнової кістки;
- ушкодження круглої зв’язки головки стегнової кістки.
Слід зазначити, що всі перераховані причини є прямими показаннями до артроскопії кульшового суглоба. Так, травматичні ушкодження суглобової губи кульшової западини є однією з найчастіших причин артроскопії кульшового суглоба (42% випадків) [25-27].
Отже, проаналізувавши та систематизувавши дані як вітчизняної, так і зарубіжної літератури, ми розробили класифікацію СПБС і виділили наступні його типи:
1) внутрішньосуглобові (ушкодження капсульно-зв’язкового апарату кульшового суглоба);
2) навколосуглобові (тендино- та ентезопатії m. ilioрsoas (внутрішнє клацаюче стегно) та m. tensor fascia latа (зовнішнє клацаюче стегно));
3) позасуглобові (тендино- та ентезопатії mm. adductor longus, magnus et brevis, m. gracіlis, дистальної частини m. rectus abdominis, проксимальної частини m. rectus femoris, лобковий симфізит);
4) інгвінальні (кила спортсмена);
5) комбіновані ушкодження.
За стадіями СПБС розподілили на гостру стадію, або стадію запалення, підгостру стадію, або стадію дистрофії, хронічну стадію, або стадію дегенерації, та стадію дегенеративного розриву (часткового або повного). Також при встановленні діагнозу згідно із запропонованою класифікацією необхідно визначити локалізацію ушкодження: лівобічне, правобічне, двобічне.
Запропонована класифікація СПБС залежно від локалізації та тривалості патологічного процесу дозволить систематизувати та своєчасно розпізнати його і виходячи з цього розпочати своєчасне та адекватне лікування.
Патогістологічні зміни при СПБС
При мікроскопічному дослідженні тонких зрізів фрагментів ушкодженого сухожилля при СПБС у хворих із гострою та підгострою стадіями спостерігаються виражені явища порушення тканинного кровопостачання, яке характеризується набряком, крововиливами, повнокров’ям і плазмостазом у розширених судинах, осередковою проліферацією фібробластів, звивистістю колагенових волокон із явищами дегенерації та некрозу. М’язові волокна, що межують із ділянками ушкодженого сухожилля, також характеризуються вираженим набряком та дегенеративними змінами у вигляді ознак гомогенізації, нерівномірного потовщення та центральним розташуванням ядер у міоцитах.
При хронічній стадії ураження сухожилля (ентезопатія) гістологічно спостерігаються однотипні патологічні зміни з боку тканинних структур ураженої нижньої кінцівки, що характеризуються дегенеративно-некротичними змінами сухожилкової та м’язової тканин, прогресування яких проявляється поширенням ділянок некрозу й наростанням атрофічних змін.. До особливостей перебігу цього патологічного процесу слід віднести формування клітин жирової тканини на ділянці сполучення сухожилля та м’яза.
Патологічна перебудова, дегенерація й некроз сухожилкової та м’язової тканин під впливом надмірного навантаження, на нашу думку, є одним із ключових чинників зниження міцності сухожилково-м’язового комплексу, який із часом на фоні виражених розладів тканинного кровопостачання й прогресуючого дегенеративно-некротичного та атрофічного процесів поширюється й на кісткову тканину, що піддається також дегенеративно-некротичним змінам, активній резорбції та рарефікації. За цих умов навіть на фоні помірного посилення навантажень можуть виникати не лише механічні порушення цілісності сухожилкових волокон і розрив сухожилля (IV стадія патологічних морфологічних змін внаслідок хронічного фізичного перевантаження), а й відрив окремих фрагментів губчастої кісткової тканини.
Крім того, надмірне раптове функціональне навантаження може призвести й до виникнення перелому кістки, особливо ослабленої внаслідок дегенеративно-некротичних змін та рарефікації, як правило, у місцях прикріплення сухожилля.
Чинниками розриву сухожилля у спортсменів є порушення методики тренування та підготовки їх до спортивних змагань, недостатнє лікування попередньої мікротравми, наявність патологічних, насамперед дегенеративно-некротичних, змін у сухожиллі.
Відновлення сухожилля відбувається за рахунок проліферації фібробластичних клітинних елементів, яке переважно обмежено кінцями його фрагментів. Слід підкреслити, що перебіг репаративних процесів відбувається на фоні відновлення тканинного кровопостачання, що проявляється локальною гіперваскуляризацією.
В умовах продовження тренування або інших функціональних навантажень внаслідок мікротравм та функціонального перевантаження можуть виникати повторні ушкодження, що порушують перебіг відновних репаративних процесів і супроводжуються формуванням атипових для даної локалізації клітинних елементів. За цих умов можуть виникати ділянки фіброзно-кісткових екзостозів або ділянки фіброзної тканини. Крім цих патологічних проявів розвиваються виражені дегенеративно-некротичні зміни із порушенням структурної організації сухожилля та м’язів.
Ушкодження, що проявляються ARS-синдромом, виникають в умовах функціонального навантаження, яке не відповідає біомеханічним властивостям, насамперед міцності сухожилля та інших органних структур нижньої кінцівки. Такі ураження при надмірному функціональному впливі спостерігаються в ділянках сполучення різних за своєю будовою та індивідуальною специфічною функцією тканин – «м’яз – сухожилля – кісткова тканина», що в нормі інтегровано виконують опорно-рухову функцію, яка забезпечує життєдіяльність організму в умовах довкілля. Найбільша концентрація механічних напружень при функціональних навантаженнях відбувається на ділянках прикріплення сухожилля до кістки.
За даними наших спостережень, вважаємо, що невідповідність функціонального навантаження міцності анатомічного комплексу «м’яз – сухожилля – кісткова тканина» призводить на ділянках прикріплення сухожилля до розвитку тендинопатії, ентезопатії, неповного або повного розриву сухожилля, надлому або перелому кістки (відривні ушкодження). Отримані нами дані підтверджують результати інших досліджень, за якими в більшості випадків розриви сухожилля трапляються, як правило, на фоні дегенеративно-некротичних змін, що розвиваються внаслідок відносного або абсолютного функціонального перевантаження.
Діагностика СПБС
Для кожного типу СПБС існують більш чи менш специфічні клінічні симптоми/тести, ультрасонографічні та МРТ-ознаки. Неможливо детально описати всю диференціальну діагностику СПБС в одній статті, тому зупинимося на найбільш важливих діагностичних ознаках.
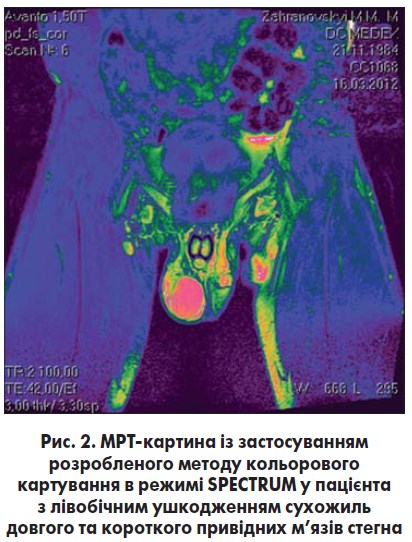 Так, ушкодження суглобової губи кульшового суглоба діагностується на підставі комплексу клінічних симптомів, з яких найбільш інформативним є FADIR-тест (Flexion, adduction, and internal rotation), та даних магнітно-резонансної томографії (МРТ). Для більшої точності МРТ-діагностики розриву суглобової губи застосовується внутрішньосуглобове контрастування або розроблена нами сумісно з діагностичним центром «Медекс» методика кольорового картування зображень (рис. 2). Остання базується на цифровій обробці стандартних МРТ-зображень у режимі PD FS, після чого отримані зображення перетворюють на кольорові за допомогою комп’ютерної програми Filmax, використовуючи протокол DICOM у трьох режимах: 1) RAINRAMP – для діагностики внутрішньосуглобових ушкоджень; 2) SPECTRUM – для діагностики навколо- та позасуглобових ушкоджень сухожиль і м’язів (рис. 2); 3) NIH – для діагностики інгвінальних ушкоджень.
Так, ушкодження суглобової губи кульшового суглоба діагностується на підставі комплексу клінічних симптомів, з яких найбільш інформативним є FADIR-тест (Flexion, adduction, and internal rotation), та даних магнітно-резонансної томографії (МРТ). Для більшої точності МРТ-діагностики розриву суглобової губи застосовується внутрішньосуглобове контрастування або розроблена нами сумісно з діагностичним центром «Медекс» методика кольорового картування зображень (рис. 2). Остання базується на цифровій обробці стандартних МРТ-зображень у режимі PD FS, після чого отримані зображення перетворюють на кольорові за допомогою комп’ютерної програми Filmax, використовуючи протокол DICOM у трьох режимах: 1) RAINRAMP – для діагностики внутрішньосуглобових ушкоджень; 2) SPECTRUM – для діагностики навколо- та позасуглобових ушкоджень сухожиль і м’язів (рис. 2); 3) NIH – для діагностики інгвінальних ушкоджень.
При цьому різні відтінки сірого кольору перетворюються на різні кольорові діапазони, що дозволяє покращити діагностику патологічного процесу на ранніх стадіях захворювання, зокрема оцінити ступінь ураження тканини сухожилля та локалізацію патологічного процесу, а також полегшити диференціальну діагностику з іншими захворюваннями. Отже, розроблений та впроваджений нами метод кольорового картування МРТ-зображень із метою діагностики тендинопатій нижньої кінцівки дозволяє покращити діагностику патологічного процесу на ранніх стадіях захворювання, знизити її вартість, а також полегшити диференціальну діагностику з іншими патологічними станами або захворюваннями.
Найбільш інформативним тестом для діагностики тендинопатії m. iliopsoas є тест внутрішнього клацаючого стегна, який має найбільш високу чутливість (98%) та специфічність (88%). Візуалізувати тендинопатію m. iliopsoas можна за допомогою МРТ.
Тендинопатія m. tensor fascia lata клінічно може бути виявлена за допомогою тесту зовнішнього клацаючого стегна, який, утім, позитивний лише в пацієнтів на 3-й стадії захворювання. У діагностиці переважно допомагає МРТ.
В усіх пацієнтів із тендино- та ентезопатіями mm. adductor longus, magnus et brevis на МРТ-зображеннях виявлено патологічні зміни в лобковому симфізі або в місцях прикріплення прямого м’яза живота до лобкової кістки. Враховуючи вищезазначене, вважаємо надалі коректним використання терміну «синдром ARS» (Adductor Rectus Symphysis). ARS-синдром діагностується найкраще за допомогою адукційного тесту та тесту локальної болючості при пальпації та МРТ, а також за допомогою методу кольорового картування МРТ-зображень (рис. 2).
Кила спортсмена діагностується клінічно (симптом розширеного пахового кільця та тест кашльового поштовху при пальпації пахвинного каналу) і підтверджується сонографічно або за допомогою УЗД чи МРТ, особливо якісно – при застосуванні розробленого методу кольорового картування. У спортсменів ширина пахвинного каналу не має перевищувати 1,5 см, а висота – 0,75 см. Діагноз «кила спортсмена» встановлюється, якщо ці показники перевищують визначені норми й супроводжуються больовим відчуттям у паховій ділянці при фізичних навантаженнях.
Лікування СПБС
Ефективність лікування хворих із СПБС на пізніх стадіях захворювання значно менша, ніж на ранніх [1, 2]. Тому важливо заохочувати спортсменів дотримуватися раціонального режиму тренування й навчати їх звертатися по медичну допомогу у разі виникнення перших симптомів захворювання, щоб запобігти розвитку його хронізації. Існують консервативні й оперативні методи лікування СПБС, застосування яких залежить від локалізації та стадії захворювання [15, 16, 23, 24].
Позасуглобові та навколосуглобові ушкодження, що пов’язані з тендинопатіями – синдроми хронічного перевантаження сухожиль (ARS-синдром, синдром зовнішнього клацаючого стегна, psoas-синдром) до стадії дегенеративного розриву, підлягають консервативному лікуванню. При цьому тактика консервативного лікування спортсменів із синдромом пахвинного болю сьогодні нe має чіткого патогенетично-обґрунтованого алгоритму й характеризується неузгодженістю застосування різноманітних методів лікування, а також їх низькою ефективністю, що пояснюється неправильним трактуванням причини та осередку виникнення патологічного процесу. Для лікування тендинопатій широко використовують різні форми електротерапії. При цьому існує дуже мало даних для підтвердження їх ефективності [7]. Ультразвукова терапія зменшує набряк у гострій стадії захворювання, а також стимулює синтез колагену тендиноцитами [20].
Слід відзначити широке використання нестероїдних протизапальних препаратів (диклофенак, целекоксиб, мелоксикам, німесулід, індометацин тощо), непрямих антикоагулянтів у низьких дозах (гепарин) та ферментативних препаратів (вобензим, флогензим), які дають позитивний ефект на початкових стадіях розвитку захворювання [28-30]. Особливо широко для лікування тендинопатій на даний час застосовуються стероїдні протизапальні препарати. Проте існують суперечливі дані щодо ефективності цієї фармакологічної групи. Так, деякими авторами було показано, що ін’єкції стероїдних протизапальних препаратів в ахіллове сухожилля піддослідних тварин призводило до зменшення його міцності з потенційним ризиком розриву останнього протягом кількох тижнів після ін’єкції [11, 31, 32], тому даний терапевтичний метод не рекомендований для лікування хворих (особливо спортсменів) із СПБС.
Через це на сьогодні одним із перспективних шляхів вирішення проблеми лікування хворих із дегенеративним ушкодженням сухожиль є залучення у медичну практику досягнень молекулярної та клітинної біології, зокрема використання збагаченої тромбоцитами плазми та аутологічних мультипотентних мезенхімальних стромальних клітин тощо.
Існування факторів, що стимулюють ріст нервових клітин, клітин шкіри [33], хряща, кістки тощо, було продемонстровано в 1950-1960 роки. Дослідження наступних десятиліть дозволили ідентифікувати значну кількість поліпептидів, що чинять виражену дію на поділ клітин, синтез позаклітинного матриксу та багато інших базових клітинних функцій. Часто ці поліпептиди діставали назву за джерелом їх отримання або за ефектом, до якого вони призводили. Це зумовило існування великої кількості найменувань факторів росту, що зустрічаються у світовій літературі – такі, як аутологічна плазма, багата факторами росту PRGF (Plazma Rich in Grows Factors), тромбоцитарний концентрат, тромбоцитарний гель, кісткові морфогенетичні білки, трансформуючий фактор росту β тощо.
Більш поглиблені дослідження аутологічної плазми, багатої тромбоцитарними факторами росту (АПБФР), призвели до виявлення набагато складнішої системи взаємодій між факторами, що складають АПБФР, та клітинами, або тканинами-мішенями, на які вони впливають [34-39]. Було встановлено, що ці фактори залежно від дози можуть посилювати ефект один одного й діяти синергічно за взаємодії з іншими факторами. Фактори росту, що складають АПБФР, відповідають за складний процес комунікацій не лише в системі міжклітинних взаємодій, а й у системі взаємодій від екзогенного стимулу до клітин, слугуючи при цьому проміжною ланкою між гормонами та цитокінами. АПБФР може пригнічувати або посилювати клітинну міграцію, проліферацію, синтез та деградацію позаклітинного матриксу, ангіогенез, мінералізацію та багато інших процесів. Дія конкретного фактора росту на клітину залежить від її типу та експресії рецепторів. Виявлено, що різні клітини по-різному відповідають на одні й ті самі фактори росту. Так, наприклад, відповідь тендиноцитів на фактор росту відрізняється від відповіді хондроцитів. Водночас і клітини одного типу можуть давати різну відповідь на фактор росту. Так, молоді, із великим проліферативним потенціалом клітини можуть давати відповідь, відмінну від зрілих клітин, що мають значно менший проліферативний потенціал або взагалі втратили його. Нарешті, існують дані, що відмінності в локальних концентраціях фактора росту й наявність інших таких факторів можуть призвести до принципово різних ефектів. Деякі фактори можуть посилювати дію інших, натомість інші фактори росту здатні призводити до інгібуючого ефекту. Зважаючи на це ми лише починаємо розуміти різноманітні ефекти факторів росту та їх складну взаємодію.
Отримати АПБФР можна на спеціальних або лабораторних центрифугах, у програму яких закладено відповідні параметри – швидкість обертання й час центрифугування, в один чи у два етапи [36, 40-42].
Таким чином, АПБФР є частиною нової біотехнології, безпеку й ефективність якої досить широко висвітлено в сучасній літературі. Тому ми вважаємо перспективним використання АПБФР для поліпшення та прискорення репаративних процесів в організмі. Сьогодні це стало одним із перспективних напрямів розвитку в лікуванні хворих із СПБС.
Ми довели ефективність, а тому вважаємо оптимальним застосування комбінації локального 3-разового введення АПБФР із 2-разовим уведенням 1,2 мл 1% гіалуронату натрію у фосфатно-сольовому буферному розчині в зону ушкодження при хронічній стадії захворювання при ARS-синдромі, тендинопатіях привідних м’язів стегна. Крім того, ми вважаємо за доцільне й також довели ефективність локального 3-разового введення АПБФР і при інших формах СПБС, у тому числі при килі спортсмена, зокрема й під час хірургічного лікування (перша ін’єкція вводиться інтраопераційно, решта – після операції).
Іншим елементом біотехнологій, що широко досліджується у світі, а також вивчався нами в аспекті лікування СПБС, є мезенхімальні стовбурові клітини (МСК). МСК мають здатність мігрувати хемотактичним шляхом у тканини, демонструючи запалення й ушкодження в організмі, мультилінійно диференціюватися, секретувати різні фактори росту та цитокіни, виявляти протизапальну активність і створювати анаболічне мікрооточення. Крім того, показана безпосередня контактна імуномодуляція клітин. Таким чином, МСК беруть участь у регенерації ушкоджених тканин по-різному. По-перше, вони безпосередньо диференціюються у тканинно-специфічні клітини й таким чином замінюють ушкоджені або втрачені клітини. По-друге, вони побічно впливають на регенерацію тканин шляхом секреції розчинних факторів. По-третє, вони здатні модулювати запальну реакцію. Таким чином, МСК можуть стимулювати васкуляризацію, клітинну проліферацію, диференціювання й модулювати запальний процес.
У раніше проведених нами дослідженнях показано, що локальне введення культивованих МСК зупиняє прогресування дегенеративних змін і сприяє відновленню ушкодженої структури сухожиль [43, 44]. Проте отримані результати змусили нас замислитися про можливість використання кріоконсервованих МСК із метою лікування дегенеративних ушкоджень сухожиль, що пояснюється можливістю їх тривалого зберігання в кріоконсервованому стані з подальшим можливим застосуванням у необхідний момент після отримання спортсменом ушкодження, не витрачаючи час на забір та культивування МСК.
Утім, внутрішньосуглобові та інгвінальні ушкодження при СПБС підлягають лише оперативному лікуванню через неефективність консервативних методів, що пов’язано зі структурними змінами, які відбуваються в ушкоджених тканинах (розрив суглобової губи кульшової западини, дефект задньої стінки пахвинного каналу тощо).
Артрогенні ушкодження кульшового суглоба складають 15-21% від усіх причин СПБС [25-27]. Усі вони є прямими показаннями до артроскопії кульшового суглоба. Так, травматичні ушкодження суглобової губи кульшової западини є однією з найчастіших причин артроскопії кульшового суглоба (42% випадків) [25-27].
Висновки
СПБС – поширений патологічний стан у спортсменів, що зазвичай характеризується недостатньо точною та своєчасною діагностикою, внаслідок чого призводить до втрати або зниження професійної придатності. Сьогодні найперспективнішим шляхом вирішення цієї проблеми є чітка діагностика осередку виникнення патологічного процесу й своєчасно розпочате адекватне, патогенетично-обґрунтоване міні-інвазивне лікування хворих із застосуванням ендоскопічної техніки та досягнень сучасної клітинної терапії (аутологічної плазми, багатої факторами росту). Такий підхід дозволяє покращити ефективність лікування спортсменів із синдромом пахвинного болю та прискорює їх повернення до професійної діяльності.
Література
- Коструб А.А. АРС-синдром: клиника, диагностика, лечение / А.А. Коструб, Р.И. Блонский // Спортивна медицина. – 2007. – № 3. – С. 90-95.
- Коструб О.О. Синдром хронічного перевантаження сухожилків: клініка, діагностика, лікування (огляд літератури) / О.О. Коструб, Р.І. Блонський // Вісник ортопедії, травматології та протезування. – 2008. – № 4. – С. 60-66.
- Holmich P. Groin pain / P. Holmich, T. Saartok, P. Renstrem // Scandinavian Textbook of Sports Medicine. – 1998 – № 15. – Р. 787-793.
- Jankovic S. The groin pain syndrome / S. Jankovic, D. Hudetz // Arh. Hig. Rada Toksikol. – 2001. – Vol. 52, № 4. – P. 421.
- Carlos A.G. Hip and pelvis injuries in sports medicine / A.G. Carlos. – Philadelphia, PA: Lippіncott, Williams & Wilkins, 2010. – Р. 5-86.
- Gilmore J. Groin pain in the soccer athlete: fact, fiction, and treatment / J. Gilmore // Sports Med. – 1998. – № 17. – Р. 787-793.
- Kemp S. The sports hernia a common cause of groin pain/ S. Kemp, M.E. Batt // Am. J.Physician and Sports Medicine. – 1998 – № 26. – Р. 36-44.
- Maffuli N. Tendom injuries / N. Maffuli, P. Renstrom. – London: Springer, 2005. – Р. 1-321.
- Gibbon G. Imaging of orthopedic sports injuries / G. Gibbon, E. Shilders. – Berlin: Springer, 2007. – P. 235-265.
- Renstrom P. Groin injuries in athletes /P. Renstrom, L. Peterson // Br. J. Sports Med. – 1980. – Vol.. 14. – P. 30-61.
- Спортивные травмы. Клиническая практика предупреждения и лечения / Под общ. ред. П. А. Ф. Х. Ренстрема. – Киев: Олимпийская лит-ра, 2003. – 471 c.
- Спортивные травмы. Основные принципы профилактики и лечения / Под ред. П. А. Ф. Х. Ренстрема. – Киев: Олимпийская лит-ра, 2002. – 378 с.
- Jozsa L. Human tendons: Anatomy, physiology and pathology / L. Jozsa, P. Kannus // Champaign I. L. Human Kinetics. – New York, 1997. – P. 76-124.
- Khan K.M. Overuse tendon injuries: Where does the pain come from? / K.M. Khan, J.L. Cook // Sports Med. Arthrosc. Rev. – 2000. – Vol. 8, № 1. – P. 17-31.
- Neuromuscular hip biomechanics and pathology in the athlete / M.R. Torry, M.L. Schenker, H.D. Martin et al. // Clin Sports Med. – 1980. – Vol. 25. – P. 179-197.
- Docinovic B. Surgical treatment of chronic groin pain in athletes / B. Docinovic, B. Sebecic // International оrthopedics. – 2012. – № 36. – Р. 2361-2367.
- Management of severe lower abdominal or inguinal pain in high-perfomence athletes / W. Mayers, D. Foley, W. Garret, B. Mandlebaum // Am. J. Sports Med. – 2000. – № 28. – Р. 2-8.
- McCrory P. Nerve entrapment syndromes as a cause of pain in the hip, groin and buttock / P. McCrory, S. Bell // Sports Med. – 1999. – № 27. – Р. 261-274.
- Boyd K.T. Common hip injuries in sport / K.T. Boyd, N.S. Peirce, M.E. Batt // Sports Med. – 1997. – № 24. – Р. 273-288.
- Byrd J. Operative hip arthroscopy / J. Byrd. – New York: Springer, 2005. – Р. 18-64.
- Arthroscopic labral repair in the hip. surgical technique and review of the literature / B.T. Kelly, D.E. Weiland, M.L. Schenker, M.J. Philippon // Arthroscopy. – 2005. – № 21. – Р. 1496-1504.
- Kelly B.T. Hip arthroscopy. current indications, treatment options, and management issues / B.T. Kelly, M.J. Philippon // Am. J. Sports Med. – 2003. – № . – Р. 1020-1037.
- Injuries to the acetabular labrum. classification, outcome, and relationship to degenerative arthritis / J. McCarthy, S. Wardell, J. Mason et al. // American Academy of Orthopedic Surgeons 64th Annual Meeting. – San Francisco: American Academy of Orthopedic Surgeons, 1997.
- Засаднюк І.А. Вплив мезенхімальних стовбурових клітин на регенерацію суглобового хряща (експериментальне дослідження): Автореф. дис. на здобуття ступеня канд. мед. наук: спец. 14.01.21 «Травматологія та ортопедія» / І.А. Засаднюк. – Київ, 2009. – 16 с.
- Outerbridge R. The cause of chondromalacia patellae / R. Outerbridge // J. Bone Joint Surg. – 1961. – № 43. – Р. 752-754.
- Sundqvist H. A promising novel therapy for Achilles pretendinitis: double-blind comparison of glycosaminoglycan polysulfate and hight dose indomethacine / H. Sundqvist, B. Forsskahl, M. Kvist // Int. J. Sports Med. – 1987. – Vol. 8, № 4. – P. 298-303.
- Michna H. Organisation of collagen fibrils in tendon: changes induced by anabolic steroid. I. Funstional and ultrastrucrural studies / H. Michna // Virchows Arch. [B], Cell Pathol. Incl. Mol. Pathol. – 1986. – Vol. 52, № 1. – P. 75-86.
- Michna H. Tendon injuries induced by exercise and anabolic steroids in experimental mice / H. Michna // Int. Orthop. – 1987. – Vol. 11, № 2. – P. 157-162.
- Hamburger V. The history of the discovery of the nerve growth factor / V. Hamburger // J. Neurobiol. – 1993. – Vol. 24, № 7. – P. 893-897.
- Волькенштейн М.В. Биофизика /М.В. Волькенштейн. – М.: Наука, 1988. – 591 с.
- Пат. № 2305563 РФ, МПК А61М 1/36, А61К 35/16, А61К 35/14. Способ получения богатой тромбоцитами аутоплазмы / В.Л. Брехов; заявитель и патентообладатель Самодай В.Г. – № 2005125929/15; заявл. 15.08.2005; опубл. 20.02.2007. Бюл. № 25.
- Самодай В.Г. Использование богатой тромбоцитами аутоплазмы (БОТП) в хирургическом лечении дефектов костной ткани с нарушением непрерывности кости / В.Г. Самодай, В.Л. Брехов, В.Е. Гайдуков // Системный анализ и управление в биомедицинских системах. – М., 2007. – Т. 6, № 2. – С. 493-495.
- Vascular endothelial growth factor C promotes vasculogenesis, angiogenesis, and collagen constriction in three-dimensional collagen gels / S.M. Bauer, R.J. Bauer, Z.J. Liu et al. // J. Vase. Surg. – 2005. – Vol. 41, № 4. – P. 699-707.
- Efficacy of platelet-rich plasma in alveolar. Bone grafting / T. Oyama et al. // J. Oral Maxillofac. Surg. – 2004. – Vol. 62, № 5. – P. 555-558.
- Fourier and fractal analysis of maxillary alveolar ridge repair using platelet rich plasma (PRP) and inorganic bovine bone / A. Wojtowicz et al. // Int. J. Oral. Maxillofac. Surg. – 2003. – Vol. 32, № l. – P. 84-86.
- A novel approach to periodontal tissue regeneration with mesenchymal stem cells and platelet-rich plasma using tissue engineering technology: A clinical case report / Y. Yamada, M. Ueda, H. Hibi, S. Baba // Int. J. Periodontics Restorative Dent. – 2006. – Vol. 26, № 4. – P. 36.
- Vogel J.P. Platelet-rich plasma improves expansion of human mesenchymal stem cells and retains differentiation capacity and in vivo bone formation in calcium phosphate ceramics / J.P. Vogel // Platelets. – 2006. – Vol. 17, № 7. – P. 462-469.
- Antibacterial effect of autologous platelet gel enriched with growth factors and other active substances (in vitro study) / Т.M. Bielecki [et al.] // J. Bone Jt. Surg. – 2007. – Vol. 89B, № 3. – P. 417-420.
- Міцність сухожилля на розтягування після клітинної терапії його дегенеративного пошкодження в експерименті / О.О. Коструб, Р.І. Блонський, І.А. Лазарєв та ін. // Вісник ортопедії, травматології та протезування. – 2011. – № 3. – С. 23-26.
- Клітинні культури стромального походження в терапії експериментальної тендопатії / Н.О. Волкова, О.О. Коструб, Р.І. Блонський та ін. // Ортопедія, травматологія та протезування. – 2012. – № 4. – С. 40-44.
Тематичний номер «Хірургія, Ортопедія, Травматологія, Інтенсивна терапія» № 1 (39), 2020 р.