10 червня, 2020
Ураження серцево-судинної системи при системних некротизувальних васкулітах
Системні некротизувальні васкуліти (СНВ) – гетерогенна група захворювань, основними морфологічними проявами яких є запалення та некроз стінки судин, а спектр клінічних ознак залежить від типу, розміру, локалізації уражених судин і тяжкості супутніх запальних порушень. Незважаючи на деякі спільні характеристики, їхні відмінності були чітко визначені з часу розробки систем класифікації та тестування на антинейтрофільні цитоплазматичні антитіла (AНЦА). Вузликовий поліартеріїт (ВП) і АНЦА-асоційовані васкуліти (АНЦА-СВ) – мікроскопічний поліангіїт (МПА), гранулематоз із поліангіїтом (ГПА), або гранулематоз Вегенера та еозинофільний ГПА (ЕГПА), або синдром Чарга – Стросса є актуальною проблемою клінічної медицини через тяжкість перебігу, труднощі діагностики, швидку інвалідизацію та високу смертність хворих.
СНВ у більшості випадків характеризуються неспецифічністю клінічної картини на ранніх стадіях і складністю своєчасної діагностики, що призводить до затримання лікування та погіршення прогнозу. Незважаючи на те що клінічно значимі ураження серця нечасті, серцево-судинні (СС) ускладнення є провідними причинами смерті пацієнтів із системними васкулітами (СВ) [120].
Мультисистемні запальні захворювання (АНЦА-СВ) з ураженням судин малого калібру призводять до збільшення загальної смертності у 2,6 раза серед хворих порівняно з популяцією (95% довірчий інтервал [ДІ] 2,2‑3,1) [27]. Патологія серця визначається як незалежний фактор ризику летального наслідку в осіб із СНВ [36]. Це підтверджують дані досліджень, за якими приблизно у 50% пацієнтів з ЕГПА і ГПА причиною смерті була хвороба серця [33, 75].
Епідеміологія
СНВ у популяції зустрічаються рідко (від 9 до 77 випадків на 1 млн населення) [112]. Щорічна захворюваність на АНЦА-СВ становить 9,5‑16 випадків на 1 млн населення: на ГПА припадає 2/3‑3/4 нових випадків АНЦА-СВ [40]. За даними дослідження A.J. Mohammad et al. (2009), захворюваність на ГПА складала 9,8, МПА – 10,1, ЕГПА і ВП – 0,9 на 1 млн населення відповідно [69].
Визначення СНВ
СНВ класифікуються відповідно до переважного типу уражених судин: при ВП у патологічний процес залучаються здебільшого судини середнього калібру, при MPА, ГПА та ЕГПА – дрібного, визначення яких наведене у таблиці 1 [44].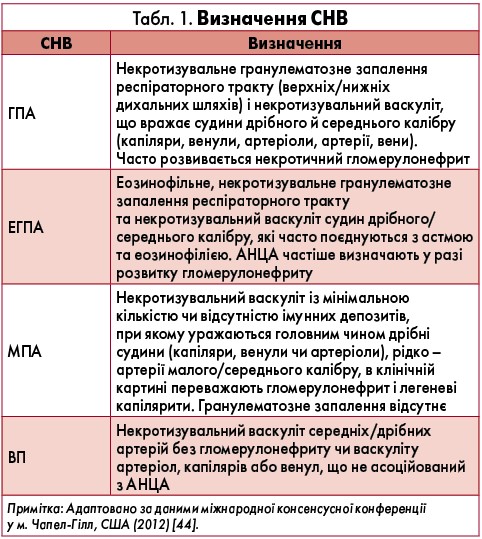
Етіологія і патогенез
Етіологія і патогенез СНВ багатофакторні й до кінця не встановлені. У деяких випадках має значення вірусна або бактеріальна інфекція [34]. У розвитку АНЦА-СВ відіграють роль екологічні фактори, інфекційні агенти, генетична схильність, приймання лікарських засобів [58, 107, 115]. Необхідно підкреслити, що у патогенезі важливе місце посідають імунні фактори [42]. Крім того, розвиток ЕГПА може бути спричинений впливом алергенів, медикаментів [107].
Відомо, що ЕГПА – автоімунне захворювання, патогенез якого пов’язаний зі зміненою імунною реакцією організму, наявністю АНЦА та інфільтрацією активованими еозинофілами тканин із пошкодженням гранульованими білками; їхній набір контролюється хемокінами, як-то еотаксин‑3 і CCL17 [42, 87, 97, 107]. ВП часто передують вакцинація, інсоляція, приймання ліків, пологи, вірусна інфекція, зокрема вірус гепатиту В [106].
Основні клінічні прояви
СНВ мають клінічні й патомофологічні особливості: для ГПА, МПА, ЕГПА притаманна наявність у сироватці крові АНЦА зі специфічністю до мієлопероксидази (МПО) або протеїнази‑3 (ПР‑3) [44, 78], що нетипово для ВП [78]. Для ЕГПА і МПА характерна продукція АНЦА зі специфічністю до МПО, а для ГПА – до ПР‑3 [9, 17]. Спільною морфологічною ознакою АНЦА-СВ є некротизувальний васкуліт із відсутністю чи незначною кількістю імунних депозитів, за якого у патологічний процес залучаються переважно судини дрібного калібру (капіляри, венули, артеріоли й артерії дрібного калібру), асоційовані з антитілами, хоча не у всіх пацієнтів виявляють AНЦA [44]. При ВП уражаються артерії середнього і дрібного калібру (за відсутності гломерулонефриту). Основні клінічні прояви СНВ наведені у таблиці 2 [36].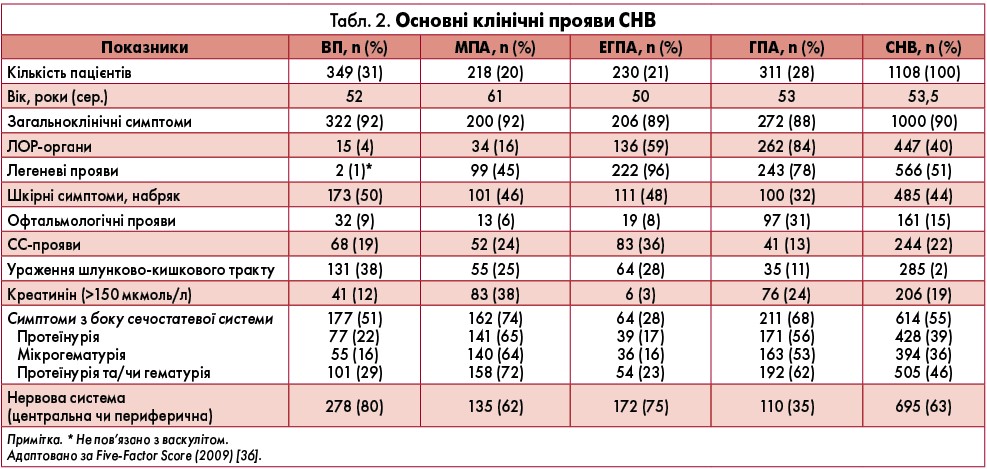 Для ВП характерні ураження шкіри (пурпура, підшкірні вузлики, сітчасте ліведо, некрози), периферичних нервів (мононеврит мультиплекс), васкуліт мезентеріальних судин, артеріальна гіпертензія (АГ) внаслідок васкуліту ниркових артерій і захворювання серцево-судинної системи (ССС) [63, 93]. Для МПА притаманні гломерулонефрит, пурпура, що пальпується, легеневі інфільтрати або геморагії. ЕГПА характеризується такими клінічними станами, як бронхіальна астма, ураження периферичної нервової системи, що спостерігають більш ніж у 2/3 пацієнтів, скелетно-м’язові симптоми і шкірна висипка – у 1/2, патологія нирок – у 1/3, застійна серцева недостатність (СН) – у 15‑30% випадків [63]. Відмінними рисами ЕГПА від інших АНЦА-СВ є наявність бронхіальної астми, еозинофілії та збільшення кількості еозинофілів у тканинах [9, 14]. При ГПА виявляють ураження верхніх дихальних шляхів (у 70‑90% випадків – патологію порожнини носа і синусити), нижніх дихальних шляхів – у 45‑87% хворих (легеневі інфільтрати, плеврит), нирок – у 11‑85% (гломерулонефрит із розвитком термінальної ниркової недостатності) та ССС [78]. За даними проспективного дослідження (97% осіб із МПА, 2,3% – ГПА, 0,7% – ЕГПА), ураження нирок діагностували у 72% пацієнтів, легень – у 67,4%, суглобів – у 26,5%, серця – у 19,7%, периферичної нервової системи – у 17,4%, шкіри – у 10,6%, центральної нервової системи – у 9,8% [94].
Для ВП характерні ураження шкіри (пурпура, підшкірні вузлики, сітчасте ліведо, некрози), периферичних нервів (мононеврит мультиплекс), васкуліт мезентеріальних судин, артеріальна гіпертензія (АГ) внаслідок васкуліту ниркових артерій і захворювання серцево-судинної системи (ССС) [63, 93]. Для МПА притаманні гломерулонефрит, пурпура, що пальпується, легеневі інфільтрати або геморагії. ЕГПА характеризується такими клінічними станами, як бронхіальна астма, ураження периферичної нервової системи, що спостерігають більш ніж у 2/3 пацієнтів, скелетно-м’язові симптоми і шкірна висипка – у 1/2, патологія нирок – у 1/3, застійна серцева недостатність (СН) – у 15‑30% випадків [63]. Відмінними рисами ЕГПА від інших АНЦА-СВ є наявність бронхіальної астми, еозинофілії та збільшення кількості еозинофілів у тканинах [9, 14]. При ГПА виявляють ураження верхніх дихальних шляхів (у 70‑90% випадків – патологію порожнини носа і синусити), нижніх дихальних шляхів – у 45‑87% хворих (легеневі інфільтрати, плеврит), нирок – у 11‑85% (гломерулонефрит із розвитком термінальної ниркової недостатності) та ССС [78]. За даними проспективного дослідження (97% осіб із МПА, 2,3% – ГПА, 0,7% – ЕГПА), ураження нирок діагностували у 72% пацієнтів, легень – у 67,4%, суглобів – у 26,5%, серця – у 19,7%, периферичної нервової системи – у 17,4%, шкіри – у 10,6%, центральної нервової системи – у 9,8% [94].
СНВ і ураження ССС
У пацієнтів із СНВ описані різні серцево-судинні захворювання (ССЗ), що несприятливі для прогнозу [35, 71, 78]. Зокрема, СН є причиною смерті у 25% хворих на ЕГПА [98]. Згідно з даними ретроспективного дослідження, за допомогою регресійного аналізу Кокса виживаності виявлено, що в осіб з АНЦА-СВ підвищений ризик СС-подій порівняно з такими із хронічною хворобою нирок: відношення шансів (ВШ) 2,23; 95% ДІ 1,1‑24,4 (р=0,017) [72].
Частота ураження ССС наведена у таблиці 3. До патологічного процесу можуть залучатися всі структури серця: епікард, міокард, перикард, ендокард, коронарні артерії (КА), провідна система серця [63, 78]. Різні, потенційно небезпечні для життя ураження ССС діагностують у пацієнтів із СНВ, як-от міокардит, ендокардит, перикардит, АГ, коронарит із розвитком стенокардії та інфаркту міокарда (ІМ), клапанні вади серця, рестриктивна й дилатаційна кардіоміопатія, порушення ритму і провідності серця, раптова серцева смерть, застійна СН [35, 63, 71, 77, 78, 108].
У ретроспективному дослідженні за участю 72 пацієнтів із ВП і МПА у 17% виявлене ураження серця під час встановлення діагнозу СВ [2]. За результатами 5-річного випробування the European Vasculitis Study Group (EUVAS), у 13,8% осіб із ГПА (11,7%) та МПА (16,1%) спостерігали такі СС-події, як ІМ, інсульт, аортокоронарне шунтування, перкутанне коронарне втручання, смерть від ССЗ. Незалежними детермінантами СС-подій були: старший вік, діастолічна артеріальна гіпертензія та наявність АНЦА зі специфічністю до ПР‑3 [100].
Необхідно зазначити, що на збільшення СС-подій при СВ впливають, зокрема, системне запалення та ендотеліальна дисфункція [84]. За даними дослідження B. Terrier et al. (2014), в якому середній період спостереження склав 7,1±2,6 року, у 42 пацієнтів із СНВ (20 – ГПА, 9 – ЕГПА, 8 – МПА, 5 – ВП) такі великі СС-події, як ІМ, інсульт, артеріальна реваскуляризація, госпіталізація із приводу нестабільної стенокардії та/або смерть внаслідок ССЗ мали місце у 18,9% випадків. Зокрема, 5-річні (9,5%) та 10-річні (26,8%) показники великих СС-подій значно перевищили очікуваний 10-річний СС-ризик за фремінгемською шкалою (9%). Наявність атеросклеротичних бляшок у черевній аорті (ВШ 7,09; 95% ДІ 1,07‑17,4; p=0,03), ожиріння, індекс маси тіла >30 кг/м2 (ВШ 4,91; 95% ДІ 1,72‑152; p=0,01) та високий ризик, визначений на основі National Cholesterol Education Program / Adult Treatment Panel III (ВШ 5,02; 95% ДІ 1,17‑27,4; p=0,03), асоційовані з великими СС-подіями. Варто зауважити, що ГК і більший вміст С-реактивного білка не підвищували вірогідності розвитку СС-подій у цій когорті [105].
За даними комп’ютерно-томографічної (КТ) ангіографії, помірний стеноз КА (20‑69%) виявлений у 29% пацієнтів з ЕГПА та 23% – із ГПА, виразний стеноз КА (≥70%) – у 24 і 13% відповідно. За результатами коронарографії (КГ), помірний стеноз КА відзначали у 14% осіб з ЕГПА та 27% – із ГПА, виразний – у 29 і 36% відповідно [38]. Стенокардію було відмічено у 19,6% хворих, ІМ – у 5,9%, міоперикардит – у 9,8% [61]. За даними іншої роботи, патологію серця виявляли у 54% пацієнтів з АНЦА-СВ при проведенні магнітно-резонансної томографії (МРТ) із пізнім підсиленням гадолінієм (у 14% – із системними захворюваннями сполучної тканини). Найбільшу поширеність ураження серця отримано в осіб з ЕГПА (67%) серед усіх хворих на АНЦА-СВ порівняно з такими із ГПА – у 30%, МПА – 33%. У пацієнтів з АНЦА-СВ у 16% спостерігали стенокардію, у 46% – задишку, у 25% – зміни на електрокардіограмі (ЕКГ), у 16% – випіт у перикарді [32].
Оскільки патологія серця є сильним предиктором СС-смертності, усім пацієнтам з АНЦА-СВ рекомендоване обстеження для раннього виявлення ураження ССС незалежно від наявності симптомів чи змін на ЕКГ [38]. У зв’язку з тим, що для ураження ССС часто притаманний безсимптомний перебіг (принаймні на ранніх стадіях), в осіб із СНВ доцільно проводити ЕКГ, ехокардіографію (ЕхоКГ), а за потреби – МРТ серця, коронарну ангіографію (КГ) тощо [38, 78]. Це підтверджено результатами роботи A. Brucato et al. (2015), за якими ураження ССС спостерігалося майже у 40% пацієнтів з ЕГПА за відсутності симптомів і змін на ЕКГ, що узгоджується з даними іншого дослідження [9, 61]. За допомогою МРТ із контрастуванням та МРТ-ангіографії у 38,2% осіб із СНВ виявлено безсимптомну патологію ССС: у чотирьох пацієнтів із МПА та у двох – із ВП виявлені фузиформні аневризми КА, а ектазії КА – у 87,5% із МПА і у 18% – ГПА. Некроз міокарда мав місце у 12,5% хворих на МПА і у 33% – ЕГПА [61]. J. Marmursztejn et al. (2013) повідомили, що у 25% пацієнтів з АНЦА-СВ, в яких були відсутні симптоми та зміни на ЕКГ, за допомогою МРТ із пізнім підсиленням гадолінієм відзначили зміни, що свідчили про ураження міокарда [60]. Це підкреслює нагальну потребу в проведенні діагностичних тестів для виявлення патології серця.
Коронарит є рідкісним, але тяжким клінічним проявом СВ, що вражає судини малого і середнього діаметра [23]. Слід відмітити, що за результатами автопсій коронарит виявлений у 50% хворих на ВП [91]. Запалення КА призводить до оклюзії, стенозу, тромбозу, дисекції, коронароспазму та формування аневризми, що може спричинити розвиток ІМ [19, 29, 47, 56, 78, 88, 114]. Своєчасна діагностика і раннє лікування глюкокортикоїдами (ГК) та іншими імуносупресивними препаратами у комбінації з антиангінальною терапією зазвичай ефективні та знижують частоту СС-ускладнень [47].
Необхідно зазначити, що причиною патології серця у пацієнтів із СВ, зокрема СНВ, може бути прискорений розвиток атеросклерозу. Так, в осіб з АНЦА-СВ у 2‑4 рази підвищений відносний ризик розвитку ішемічної хвороби серця (ІХС) порівняно з контрольною групою. Пришвидшений розвиток атеросклерозу виникає внаслідок системного запалення та імунних порушень незалежно від наявності класичних факторів СС-ризику [15]. G. Chironi et al. (2007) відмітили, що СНВ асоціюється з вищим ризиком субклінічного атеросклерозу [13]. Це підтверджують дані дослідження B. Terrier et al. (2014), за якими пацієнти із СНВ мають у 2‑3-рази більшу вірогідність прискореного розвитку атеросклерозу [105]. Крім того, терапія ГК може сприяти швидшому виникненню атеросклерозу та ІХС як безпосередньо, так і опосередковано за рахунок зростання частоти цукрового діабету та АГ – відомих факторів ризику ІХС.
При СНВ міокардит спостерігають у 25‑70% пацієнтів, який розвивається внаслідок некротизувального васкуліту із запальною інфільтрацією, формуванням гранульом, а при ЕГПА – й інфільтрації еозинофілами. Перикардит діагностований у 22% випадках ЕГПА, 8% осіб із ГПА та 0‑27% – із ВП [63].
На думку C. Pagnoux et al. (2005), ураження ендокарда вважається рідкісним при СВ. Функціональні серцеві шуми або патологія клапанів, що не асоційована із СВ, складають переважну більшість виявлених випадків. Проте специфічне ураження клапанів серця може призводити до виникнення клапанних вад серця [78]. Є дані про високу частоту розвитку клапанних вад серця, зокрема, у хворих на ЕГПА [74].
У пацієнтів із СНВ можуть розвиватися порушення ритму і провідності серця – повна атріовентрикулярна (АВ) блокада серця та блокади ніжок пучка Гіса, внаслідок міокардиту, ішемії та ураження провідної системи серця. Частіше у патологічний процес залучається синусовий, рідше – АВ-вузол [78].
Дані ретроспективного дослідження Y. Allenbach et al. (2009) за участю 1130 осіб із ГПА, МП, ЕГПА і ВП показали, що пацієнти з АНЦА-CВ мають вищий ризик венозних тромбоемболій (скориговане ВШ 2,88; 95% ДІ 1,27‑6,50) порівняно з такими із ВП (р=0,01). За середній період спостереження 58,4 місяця венозні тромбоемболії виявлені у 6,5% хворих: 2,5% – із ВП, 8,2% – ЕГПА, 8% – ГПА і 7,6% – МПА [4].
Легенева гіпертензія зустрічається рідко, причому лише поодинокі випадки описані у пацієнтів із ВП. Іноді легенева гіпертензія може бути наслідком констриктивного перикардиту, ураження легенів та/або рестриктивної кардіоміопатії, застійної СН [78].
Еозинофільний гранулематоз із поліангіїтом
При ЕГПА у патологічний процес залучаються різні органи чи системи. Типові клінічні ознаки ЕГПА включають бронхіальну астму, синусити, минущі легеневі інфільтрати та невропатії, еозинофілію крові (часто >1500/мм, або >10%), а ураження серця є основною причиною захворюваності та смертності пацієнтів з ЕГПА [9, 59].
Як зазначено вище, ЕГПА вважається захворюванням, що асоційоване з АНЦА. Залежно від їхньої наявності чи відсутності розрізняють два підтипи ЕГПА: АНЦА-позитивний і АНЦА-негативний, що може свідчити про різні патогенетичні механізми розвитку хвороби [87, 91]. АНЦА-негативність описана як фактор ризику патології серця [109]. У АНЦА-позитивних пацієнтів ураження органів відбувається власне васкулітом, частіше розвиваються пурпура, що пальпується, множинний мононеврит, серповидний гломерулонефрит, альвеолярні геморагії, а у АНЦА-негативних – кардіоміопатія чи міокардит, ексудативний плеврит і перикардит, поліпоз носа. Останні прояви розвиваються внаслідок інфільтрації тканин еозинофілами з наступним виділенням внутрішньоклітинних ферментів, що призводять до пошкодження тканин [59].
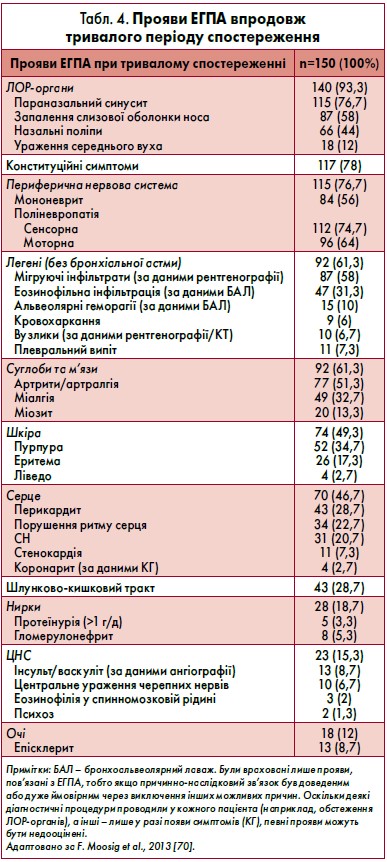 При патоморфологічному дослідженні типовою є наявність некротизувального еозинофільного васкуліту, позасудинних еозинофільних гранульом та інфільтрації тканин еозинофілами [14, 50]. За результатами досліджень F. Moosig et al. (2013), бронхіальну астму відзначали у 92,7% пацієнтів, еозинофілію в крові >10% – у 89,3%, у тканинах – 63%, екстраваскулярні гранульоми – у 16%. У таблиці 4 наведені прояви ЕГПА протягом періоду спостереження: ураження периферичної нервової системи відмічали у 76,7% хворих, серця – у 46,7%, конституціальні симптоми – у 78% [70].
При патоморфологічному дослідженні типовою є наявність некротизувального еозинофільного васкуліту, позасудинних еозинофільних гранульом та інфільтрації тканин еозинофілами [14, 50]. За результатами досліджень F. Moosig et al. (2013), бронхіальну астму відзначали у 92,7% пацієнтів, еозинофілію в крові >10% – у 89,3%, у тканинах – 63%, екстраваскулярні гранульоми – у 16%. У таблиці 4 наведені прояви ЕГПА протягом періоду спостереження: ураження периферичної нервової системи відмічали у 76,7% хворих, серця – у 46,7%, конституціальні симптоми – у 78% [70].
Патологія ССС розвивається приблизно у 16‑92% осіб з ЕГПА, характерна для АНЦА-негативного варіанта й асоційована зі значною еозинофілією [9, 16, 20, 25, 33, 70, 74, 87, 97, 101]. Це підтверджують дані дослідження R.M. Dennert et al. (2010), за якими ураження ССС було виявлене у 23% АНЦА-позитивних і 74% АНЦА-негативних пацієнтів [20]. Залучення у патологічний процес серця корелює з гіршим прогнозом, є важливим предиктором смертності та основною причиною летальних наслідків, зокрема у 50% хворих на ЕГПА [9, 16, 25, 60, 116].
До патологічного процесу при ЕГПА можуть бути залучені будь-які структури серця [9]. У пацієнтів з ЕГПА виявляють: еозинофільний міокардит, перикардит, порушення ритму і провідності серця, коронарит, стенокардію, ІМ, дилатаційну та рестриктивну кардіоміопатії, ендоміокардіальний фіброз, внутрішньосерцевий тромбоз, недостатність клапанів серця, АГ, раптову смерть, СН [9, 20, 25, 60, 74].
За даними роботи J. Vinit et al. (2010), у 22,6% пацієнтів діагностували ІХС, патологію клапанів (у 2/3 випадків – недостатність мітрального клапана, 1/4 – стеноз аортального клапана), у 19% – перикардит, у 48% – СН, у 32% – порушення ритму серця, у 22,6% – порушення провідності серця і у 3% – ендокардит [109]. Дещо різняться результати дослідження, за якими фібриляцію передсердь відмічали у 18,1% хворих, перикардит – у 45,4%, СН – у 27,2%, кардіогенний шок – у 9%, ІМ – у 18,1%, кардіоміопатію із СН – у 27% [12].
Частота розвитку перикардиту становить 15,1‑45,4% [12, 16, 33, 74, 87]. T. Yano et al. (2015) вважають, що гострий перикардит із невеликим перикардіальним випотом є типовим проявом ЕГПА, хоча іноді спостерігається значний перикардіальний випіт. Так, автори описали випадок розвитку тампонади серця як першого прояву ЕГПА [116]. За результатами випробування R. Sablé-Fourtassou et al. (2005), перикардит виявлений у 25% осіб з ЕГПА, причому в 36% – у АНЦА-негативних, а в 7% – АНЦА-позитивних хворих. У АНЦА-негативних пацієнтів із перикардитом випіт у порожнину перикарда спостерігали у 88%, серед яких тампонаду серця – у 31,8% [87].
Міокардит – один із проявів ураження серця при ЕГПА, що виявляють у 13,5% пацієнтів з ЕГПА [33, 82]. При еозинофільному ЕГПА-асоційованому міокардиті довгостроковий прогноз несприятливий [59]. У його розвитку важливу роль відіграє еозинофільна інфільтрація міокарда з вивільненням із гранул при дегрануляції еозинофілів еозинофільного катіонного білка, великого основного білка тощо [37]. Необхідно відмітити, що розвиток міокардиту потребує активнішого імуносупресивного лікування [9, 70]. L. Qiao et al. (2016) дійшли висновку, що чим молодший вік осіб з ЕГПА, тим вища частота виникнення ускладнень міокардиту та гірший прогноз. Пацієнти з ураженням серця зазвичай мають в анамнезі тяжку астму, жінки старші за чоловіків, збільшена кількість еозинофілів свідчить про потенційний діагноз ЕГПА (у разі збільшення до 20% еозинофілів відмічають інфільтрацію міокарда еозинофілами), а негативний статус АНЦА асоційований із захворюваннями серця при ЕГПА [82].
Слід зазначити, що ураження КА рідко діагностують прижиттєво, на відміну від даних автопсій, за якими у 60% відмічають коронарит [39]. При проведенні КГ у пацієнтів з ЕГПА виявляють коронароспазм, стеноз, оклюзію, тромбоз, ектазії КА [19, 29]. Описані випадки раптової серцевої смерті в осіб з ЕГПА, гострого коронарного синдрому (ГКС), вазоспастичної стенокардії [12, 19, 21, 29, 92, 109]. ГКС може розвиватися внаслідок коронариту, коронароспазму, тромбозу КА [29, 104]. За даними дослідження A.F. Cereda et al. (2017), розвиток ІМ відзначали у 18,1% хворих на ЕГПА [12]. Необхідно зауважити, що ІМ може перебігати асимптомно, тому обстеження з метою виявлення патології ССС є обов’язковим у будь-якого пацієнта з підозрою на ЕГПА [25].
У літературі є повідомлення про розвиток ГКС, що ускладнився фібриляцією шлуночків, зупинкою серця, а про проведенні КГ виявлений коронароспазм передньої міжшлуночкової гілки (ПМШГ) лівої КА (ЛКА) та правої КА (ПКА), що минув після інтракоронарного введення нітрогліцерину [6]. Крім того, описаний розвиток ГКС з елевацією сегмента ST, що ускладнився кардіогенним шоком як першим проявом ЕГПА. У пацієнтки за даними КГ (рис. 1) виявлений множинний спазм КА (ПМШГ ЛКА, першої діагональної, проміжної гілок, ПКА, задньої міжшлуночкової гілки ПКА). Після інтракоронарного введення верапамілу та нітрогліцерину значно зменшився стеноз ПКА, а ПМША та її гілок – незначно, тому проведено імплантацію елютинг-стентів у ПМШГ ЛКА і першу діагональну гілку ЛКА. Проте на тлі приймання нітратів тривалої дії та антагоністів кальцію у пацієнтки відмічали стенокардію, яка пройшла після призначення ГК [7].
У літературі наявні повідомлення про атеросклеротичне ураження КА з розвитком ІМ. Однак дослідники зазначають, що невідомо, що є причиною ІМ – атеросклероз КА чи поєднання останнього з коронаритом [31]. У пацієнтів з ЕГПА виявлене зростання сурогатних маркерів ССЗ, таких як ендотеліальна дисфункція, збільшення індексу маси тіла і змінені значення гомілково-плечового індексу [18, 26, 89].
Ураження ендокарду спостерігають при ЕГПА у вигляді еозинофільного ендоміокардиту, ендоміокардіального фіброзу з формуванням внутрішньошлуночкових тромбів [9, 16, 74]. За даними T. Neumann et al. (2009), у 59% осіб з ЕГПА діагностували еозинофільний ендоміокардит, а у 9% – внутрішньосерцеві тромби [74]. Після призначення ГК і циклофосфаміду в пацієнтів з ендоміокардіальним фіброзом спостерігали позитивний клінічний ефект [76]. Необхідно відмітити, що ендоміокардит / ендоміокардіальний фіброз із внутрішньосерцевим тромбозом (приблизно у 10% хворих) або кардіоміопатія (до 20% пацієнтів) асоційовані з високим рівнем еозинофілії, відсутністю АНЦА і потенційно гіршим прогнозом [9, 16, 74].
Встановлено, що наявність симптоматичної кардіоміопатії корелює з несприятливим прогнозом, розвиток якої є незалежним фактором ризику смерті [16, 36]. Також цей клінічний стан – причина смерті майже у 50% пацієнтів з ЕГПА, що потребує комбінованої терапії ГК і цитостатиками (зазвичай циклофосфамідом) [34]. Кардіоміопатія при ЕГПА може розвиватися внаслідок ішемії міокарда, асоційованої з васкулітом епікардіальних КА та артерій дрібного калібру міокарда чи його інфільтрації еозинофілами, інколи з формуванням фіброзу й рідше – гранулематозного ураження міокарда [39]. Аналіз обстеження 112 хворих на ЕГПА показав, що кардіоміопатію значно частіше спостерігали у АНЦА-негативних пацієнтів [78]. За даними дослідження S. Sable-Fourtassou et al. (2005), кардіоміопатію діагностували у 24% осіб з ЕГПА: в АНЦА-негативних пацієнтів – 33%, АНЦА-позитивних – 9% [87].
У пацієнтів з ЕГПА виявляють недостатність мітрального, аортального та трикуспідального клапанів [20]. Це підтверджують результати дослідження T. Neumann et al. (2009), за якими у 73% хворих на ЕГПА діагностовано недостатність клапанів (мітрального – у 27,3%, аортального – у 13,6%, трикуспідального – у 31,8%) помірного і тяжкого ступеня [74].
При ЕГПА можуть виникати надшлуночкові/шлуночкові порушення ритму і провідності серця (у 3% випадків), зокрема блокада лівої чи правої ніжки пучка Гіса [12, 19, 20, 33, 74, 101]. Описаний випадок розвитку мономорфної шлуночкової тахікардії у 66-річної пацієнтки як перший симптом ЕГПА. Він цікавий ще й тим, що серцеві прояви являли собою основні клінічні симптоми захворювання, а зміни в інших органах були слабо вираженими [10].
У пацієнтів з ЕГПА застійну СН діагностують у 15‑30% випадків, яка є причиною смерті в 25% [77, 98]. За даними роботи W. Szczeklik et al. (2011), фракція викиду (ФВ) лівого шлуночка (ЛШ) виявилася у середньому нижчою в осіб з ЕГПА в період ремісії порівняно з контрольною групою (р<0,05), а у 35% хворих ФВ ЛШ була <50% [101].
Результати випробування Т. Neumann et al. (2009) свідчать, що при проведенні ЕхоКГ у 50% пацієнтів спостерігалися порушення систолічної функції ЛШ [74]. Згідно з даними іншого дослідження, за допомогою ЕхоКГ та/або МРТ серця виявляли регіонарні порушення скоротливості ЛШ, випіт у порожнину перикарда (у 20% випадків) і внутрішньосерцевий тромбоз [9, 16].
У значної частини хворих ураження ССС може бути асимптомним [25]. Це узгоджується з результатами роботи S. Yune et al. (2016), за якими у 87,5% пацієнтів з ЕГПА, в котрих були відсутні симптоми патології серця, виявлені зміни при проведенні МРТ серця [119]. Зокрема, як вказують T. Miszalski-Jamka et al. (2013), приблизно в 81,8% осіб з ЕГПА у період клінічної ремісії мали місце зміни на МРТ серця. Ці результати свідчать, що у період ремісії частота ураження серця є достатньо високою, однак слід відмітити малу кількість хворих (n=11) [68].
За даними випробування R.M. Dennert et al. (2010), у 62% пацієнтів з ЕГПА виявлено патологію серця порівняно з 3% у контрольній групі (р<0,001) із клінічними симптомами – у 26 та 3% (р=0,009) відповідно, змінами на ЕКГ – у 66 та 3% відповідно (р<0,001), а при проведенні ЕхоКГ – у 50 та 3% відповідно (р<0,001), МРТ серця (регіонарне порушення скоротливості стінок, фокальний фіброз тощо) – у 62% хворих. Відсутність симптомів або змін на ЕКГ не виключало ураження серця, адже зміни було відзначено у 38% цих пацієнтів під час виконання ЕхоКГ чи МРТ серця. На ЕКГ зміни зубця Т та/або патологічний зубець Q діагностували у 50 та 6% випадків відповідно (у контрольній групі в 3% – зміни зубця Т). Окрім того, відмічали фібриляцію передсердь, блокади правої чи лівої ніжки пучка Гіса, а при проведенні холтерівського моніторингу ЕКГ – нестійку шлуночкову тахікардію. За виконання ЕхоКГ дисфункцію ЛШ було діагностовано у 34% пацієнтів [20].
Подібні дані отримали й інші дослідники. Так, у разі відсутності симптомів і значущих змін на ЕКГ ураження серця виявили майже у 40% пацієнтів з ЕГПА, тому всім хворим необхідно було проводити ЕхоКГ, а за показаннями – МРТ серця, КГ, ендоміокардіальну біопсію тощо [9]. У дослідженні, що включало 96 осіб з ЕГПА, 78-місячна виживаність становила 90 та 30% за відсутності й наявності симптоматичного ураження серця відповідно, підкреслюючи важливість виявлення патології серця на ранніх стадіях васкуліту [33].
Гранулематоз із поліангіїтом
ГПА – це СВ, що асоційований з АНЦА та вогнищевими, некротизувальними, гранулематозними ураженнями. ГПА зазвичай розвивається у 40-річних пацієнтів, і найчастіше у патологічний процес залучаються ЛОР-органи (92%), нирки (гломерулонефрит – у 77% випадків) та органи дихання (85%) [48].
Ураження серця спостерігають у 6‑44% осіб з ГПА [32, 53, 54, 71]. На думку G. Pugnet et al. (2017), патологія серця при ГПА, ймовірно, недооцінюється, оскільки часто її перебіг є субклінічним [81]. За даними проспективного дослідження, в 62% пацієнтів з ЕГПА та у 46% – ГПА у стадії ремісії виявляли патологію ССС за допомогою ЕКГ і ЕхоКГ порівняно з 20% у контрольній групі (р<0,001 та р<0,014 відповідно), за результатами МРТ серця – у 66% хворих на ЕГПА та у 61% – ГПА. На додаток, в осіб з ураженням серця (за даними ЕКГ і ЕхоКГ) спостерігали підвищення загальної та СС-смертності [38].
У період з 1957 по 2005 рр. група дослідників L. Guillevin et al. (2011) провела випробування, яке включало 1108 пацієнтів із СНВ, з них 311 хворих на ГПА. Ураження серця діагностовано в 13% осіб із ГПА, а за допомогою мультиваріантного аналізу виявлені несприятливі прогностичні фактори, як-то вік, ниркова недостатність та СН [36]. За даними клінічного лонгітудинального мультицентрового когортного дослідження під керівництвом наукового консорціуму з васкулітів, у якому взяли участь 517 пацієнтів із ГПА, патологію ССС діагностовано тільки у 3,3%, до того ж не виявлено зв’язку з вищою частотою рецидиву чи збільшенням смертності [64]. За результатами метааналізу чотирьох європейських клінічних випробувань, що включало 535 хворих із вперше встановленим діагнозом АНЦА-СВ, з яких 53% становили особи з ГПА, ураження ССС мало місце у 5,7% випадків і асоціювалося з підвищеним ризиком рецидиву [110].
Найчастіше при ГПА виявляють перикардит та коронарит (у 50% випадків – ураження ССС), але також описані міокардит, ендокардит із формуванням вад серця, порушення провідності й ритму серця, дилатаційна кардіоміопатія, СН [64, 66, 78]. Дещо відмінними є дані дослідження L. McGeoch et al. (2015), за якими перикардит діагностували у 35% випадків, коронарит – у 12%, кардіоміопатію – у 30%, порушення ритму серця та ураження клапанів – у 6% [64].
Перикардит є характерним проявом ураження серця при ГПА, який часто має асимптоматичний перебіг [54]. Частіше випіт у порожнину перикарда помірний, але інколи може бути масивним і призводити до розвитку тампонади серця [118]. У літературі є дані про виникнення при ГПА констриктивного перикардиту [41].
За даними автопсій коронарит відмічають у 50% хворих, який у більшості з них безсимптомний, але може призводити до розвитку ІМ і стенокардії [88]. Патологічні зміни КА мали місце в усіх випадках ГПА, але слід відмітити малу вибірку пацієнтів (n=11) [120]. За результатами дослідження O. Zimba et al. (2018), при проведенні автопсій виявлений деструктивно-продуктивний васкуліт, що вражає артерії дрібного калібру, артеріоли та капіляри міокарда. В гострій стадії ГПА відзначено зміни стінки судин від мукоїдного набряку до фібриноїдного некрозу. Хронічні пошкодження характеризувалися гіперплазією інтими, фіброзом, гіалінозом судин зі звуженням їхнього просвіту. Найпоширенішим ураженням інтерстиціального матриксу міокарда було позасудинне гранулематозне запалення [120].
Продовження у наступному номері.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 2 (69) 2020 р.



