17 червня, 2020
Лабораторія CSD підтримує сучасні тренди діагностики в онкогематології
 За останні 50 років здобутки медичної та фармакологічної наук у галузі онкогематологічних захворювань дозволили значно збільшити виживання та тривалість життя пацієнтів із цією патологією. Застосування сучасних протоколів лікування та інноваційних лікарських препаратів вимагає високої точності та своєчасності діагностики. Сучасні принципи класифікації онкогематологічних захворювань та стратифікації пацієнтів за групами ризику (в тому числі за показаннями до алогенної трансплантації кісткового мозку) здебільшого базуються на вивченні біології пухлин, тобто на генетичному підґрунті процесів, що призвели до анаплазії.
За останні 50 років здобутки медичної та фармакологічної наук у галузі онкогематологічних захворювань дозволили значно збільшити виживання та тривалість життя пацієнтів із цією патологією. Застосування сучасних протоколів лікування та інноваційних лікарських препаратів вимагає високої точності та своєчасності діагностики. Сучасні принципи класифікації онкогематологічних захворювань та стратифікації пацієнтів за групами ризику (в тому числі за показаннями до алогенної трансплантації кісткового мозку) здебільшого базуються на вивченні біології пухлин, тобто на генетичному підґрунті процесів, що призвели до анаплазії.
На сьогодні спеціалізована лабораторна діагностика онкогематологічної патології з дисемінованим ураженням (лейкемії, лейкемізації лімфом) включає комплекс досліджень, що доповнюють одне одного: морфологічні, імуноцитологічні та генетичні методи (від цитогенетичних, молекулярно-цитогенетичних до секвенування екзому). Не менш важливим після правильного та своєчасного встановлення діагнозу є контроль захворювання на всіх етапах терапії для оцінки її ефективності, здійснення своєчасної корекції та прийняття стратегічно правильних терапевтичних рішень. Це вимагає від лікарів-гематологів додаткових знань та підвищує потребу в наявності спеціалізованих онкогематологічних лабораторій для забезпечення всього необхідного діагностичного комплексу.
Фахівці нещодавно створеної лабораторії онкогематології мають великий досвід роботи у практичній сфері охорони здоров’я, володіють знаннями алгоритмів діагностики при онкогематологічній патології та постійно удосконалюють свої знання і навички, що забезпечує злагоджену роботу та порозуміння між клініцистами та лабораторною службою.
Морфологічна оцінка препаратів кісткового мозку, периферичної крові та інших матеріалів є першим етапом оцінки їх якості й ступеня ураження для визначення типу пухлини. Цей метод має високий ступінь суб’єктивності, тому результат значно залежить від підготовки та досвіду фахівця. Правильно проведена морфологічна оцінка дозволяє звузити спектр застосування більш об’єктивізованих та специфічних, але й набагато дорожчих методів.
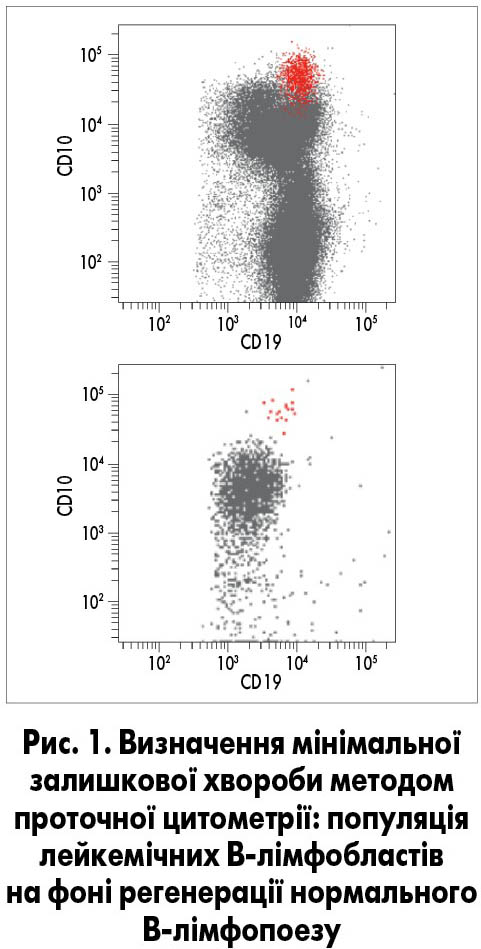 Логічним продовженням діагностичного алгоритму є застосування імуноцитологічного дослідження методом мультипараметрової проточної цитометрії, яка сьогодні є основою діагностики гострої лейкемії та хронічних лімфопроліферативних захворювань (рис. 1).
Логічним продовженням діагностичного алгоритму є застосування імуноцитологічного дослідження методом мультипараметрової проточної цитометрії, яка сьогодні є основою діагностики гострої лейкемії та хронічних лімфопроліферативних захворювань (рис. 1).
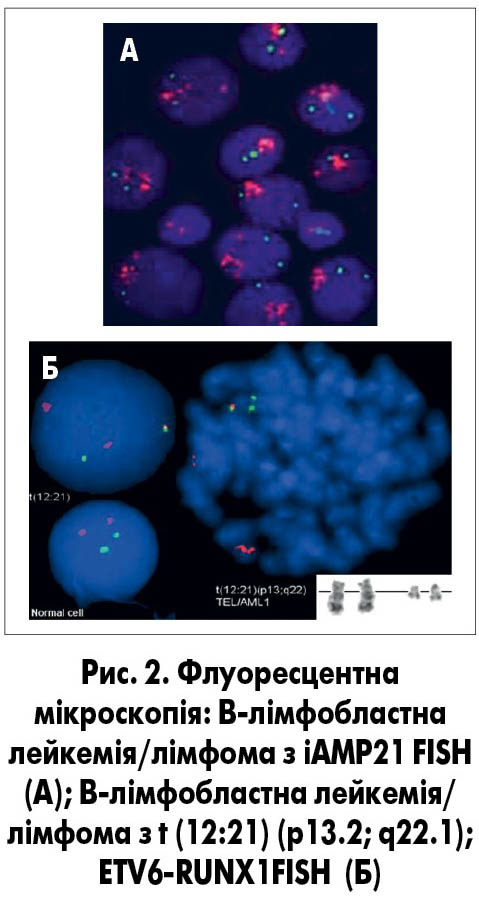
Цей метод дозволяє проаналізувати структуру антигенного комплексу (імунофенотипу) кожної окремої клітини, відрізнити нормальну від атипової та підрахувати їх співвідношення. На відміну від морфологічної оцінки, імуноцитологічне дослідження дозволяє визначити лінійну належність пухлини та її тип, що є визначальним у виборі терапевтичного протоколу. Певні зміни в імунофенотипі можуть бути прямим відображенням уже відомих генетичних реаранжувань, що дозволяє в першу чергу тестувати саме їх молекулярно-генетичними методами (рис. 2).
Визначення імунофенотипу та генетичних аберацій відіграє важливу роль не тільки в ініціальній діагностиці, але й в оцінці ефективності терапії на рівні, не доступному морфологічному дослідженню. Така оцінка називається визначенням мінімальної залишкової хвороби, тобто це виявлення однієї лейкемічної клітини в масі нормальних з рівнем чутливості 1:100 000. Враховуючи те, що тільки у 30-40% пацієнтів із гострою лейкемією на доступному нині рівні технологій вдається виявити аберацію молекулярно-генетичними методами, проточна цитометрія набуває вирішального значення у визначенні мінімальної залишкової хвороби. Точність методу цілком залежить від кількості параметрів, що одночасно детектуються на одній клітині, тобто від технічних характеристик проточного цитофлуориметра.
Наявність сучасного обладнання, такого як проточний цитофлуориметр із вісьмома параметрами флуоресценції, дозволяє визначити мінімальну залишкову хворобу з високою точністю на основі протоколів, рекомендованих міжнародними дослідницькими групами, зокрема EuroFlow та I-BFM-Flow.
 Проточна цитометрія може мати вирішальне значення при встановленні діагнозу в тих випадках, коли взяття матеріалу для гігістологічного дослідження неможливе або за життєвими показниками, або через локалізацію пухлини. Найбільш ілюстративним прикладом та частою клінічною ситуацією можуть бути агресивні пухлини середостіння та черевної порожнини, такі як Т-лімфобластна лімфома або лімфома Беркітта без ураження кісткового мозку, але з накопиченням рідини у серозних порожнинах чи ураженням периферичних лімфатичних вузлів.
Проточна цитометрія може мати вирішальне значення при встановленні діагнозу в тих випадках, коли взяття матеріалу для гігістологічного дослідження неможливе або за життєвими показниками, або через локалізацію пухлини. Найбільш ілюстративним прикладом та частою клінічною ситуацією можуть бути агресивні пухлини середостіння та черевної порожнини, такі як Т-лімфобластна лімфома або лімфома Беркітта без ураження кісткового мозку, але з накопиченням рідини у серозних порожнинах чи ураженням периферичних лімфатичних вузлів.
Класичними методами діагностики лімфом є гістологічне та імуногістохімічне дослідження, при яких необхідні інвазивні маніпуляції, часто із застосуванням загальної анестезії. Вони передбачають певний термін післяопераційного одужання та виконуються протягом 7-10 днів. Але в тих ситуаціях, коли пухлина перекриває дихальні шляхи (наприклад трахеокомпресія при лімфомі середостіння) або спостерігається олігурія внаслідок стиснення нирки пухлинною масою (наприклад при лімфомі Беркітта), і хіміотерапію необхідно почати негайно, імуноцитологічне дослідження клітин із плевральної або черевної порожнин дає змогу встановити діагноз протягом 2 годин після взяття матеріалу, що може буквально врятувати життя пацієнту. Іншим прикладом може бути імуноцитологічне дослідження кісткового мозку при метастазах нейробластоми у дітей, у яких проведення гістологічного дослідження первинної пухлини неможливе або через її недоступність (наприклад, розташування у ЦНС), або якщо вона не виявлена за допомогою візуалізаційних методів діагностики (рис. 3).
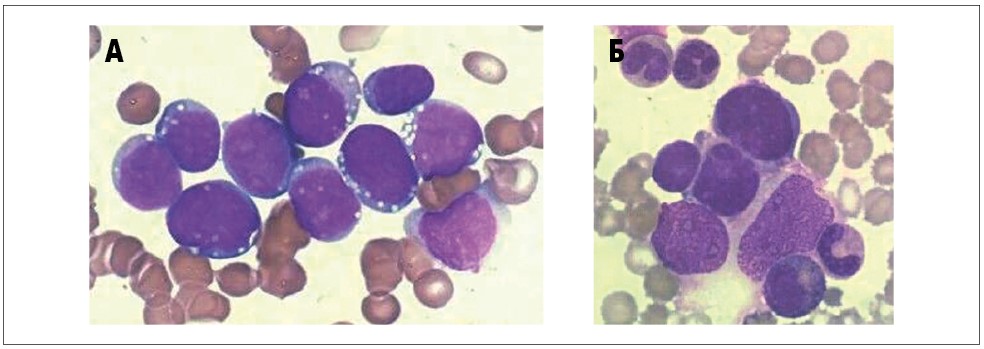 Рис. 3. Клітини лімфоми Беркітта в асцитичній рідині при ураженні черевної порожнини (А); метастаз нейробластоми (Б)
Рис. 3. Клітини лімфоми Беркітта в асцитичній рідині при ураженні черевної порожнини (А); метастаз нейробластоми (Б)
Постійний розвиток знань про нормальний та патологічний гемопоез, їх систематизація та створення сучасних класифікацій, вдосконалення діагностичної апаратури та реагентів дозволяє виводити із «сірої зони» все більше складних для діагностики або неясних випадків, що дає змогу все більшій кількості пацієнтів отримувати своєчасну адекватну та ефективну терапію.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 2 (63) 2020 р.


