30 жовтня, 2020
Ефективність імуномодуляторів III покоління у лікуванні пацієнтів з рефрактерною множинною мієломою
 Множинна мієлома (ММ) – злоякісне неопластичне захворювання, яке характеризується надмірною проліферацією моноклональних плазматичних клітин у кістковому мозку (КМ) із появою моноклонального парапротеїну у сироватці крові або сечі, зниженням рівня нормальних імуноглобулінів і деструктивними змінами у кістках.
Множинна мієлома (ММ) – злоякісне неопластичне захворювання, яке характеризується надмірною проліферацією моноклональних плазматичних клітин у кістковому мозку (КМ) із появою моноклонального парапротеїну у сироватці крові або сечі, зниженням рівня нормальних імуноглобулінів і деструктивними змінами у кістках.
ММ є другим за частотою діагностування злоякісним гематологічним захворюванням. У 2016 р. у світі було зафіксовано майже 160 000 нових випадків ММ [1]. Частка ММ складає приблизно 10% у структурі гематологічної захворюваності [2]. На відміну від інших злоякісних новоутворень, що метастазують у кістки, остеолітичні ураження при ММ супроводжуються пригніченням чи повним виключенням активності остеобластів [3]. Ураження кісток найкраще діагностується з використанням низькодозової комп’ютерної томографії всього тіла, позитронно-емісійної томографії з комп’ютерною томографією або магнітно-резонансної томографії (МРТ) [4]. Клінічно ММ часто характеризується анемією, гіперкальціємією, нирковою недостатністю та підвищеним ризиком розвитку інфекційних ускладнень.
За останні 20 років підходи до діагностики та лікування ММ зазнали істотних змін. До ХХІ ст. хворі на ММ помирали протягом кількох років після встановлення діагнозу. Донедавна діагноз множинна мієлома повинен був відповідати критеріям CRAB (гіперкальціємія, ниркова недостатність, анемія та ураження кісток). Основна складність верифікації ММ за критеріями CRAB полягала в тому, що цей підхід є клініко-патологічним. Це означає, що для встановлення діагнозу мають бути клінічні прояви тяжкого ураження органів, а саме деструкція кісткової тканини та ниркова недостатність. За таких умов хворий втрачає шанс раннього початку терапії та запобігання ушкодженню органів. Критерії CRAB були доречними в епоху, коли можливості терапії ММ були дуже обмеженими. Проте з розвитком фармакології та появою сучасних ефективних препаратів, раннє застосування яких дозволяє покращити виживаність хворих, виникла потреба в оновленні діагностичних критеріїв [5].
У 2014 р. Міжнародна робоча група з вивчення мієломи (Іnternational Myeloma Working Group, IMWG) оновила діагностичні критерії, які істотно розширили терапевтичні можливості та дозволили лікувати пацієнтів із високим ризиком прогресування захворювання ще до появи вираженої клінічної картини (табл. 1).
Раніше лікування пацієнтів з ММ обмежувалося трансплантацією стовбурових клітин, застосуванням алкілувальних агентів і кортикостероїдів. Сучасна стратегія лікування ММ доповнилася новими лікарськими засобами, які істотно покращили виживаність таких хворих. До них належать імуномодулювальні агенти, інгібітори протеасом, моноклональні антитіла, інгібітори гістондеацетилази. Так, завдяки впровадженню нових стандартів лікування ММ всього за кілька років медіана загальної виживаності (ЗВ) хворих збільшилася приблизно з 3 до 7 років [6]. По суті, ММ – це хронічне лімфопроліферативне захворювання, яке можна успішно контролювати протягом певного часу, але жоден з відомих методів терапії, включаючи трансплантацію алогенних гемопоетичних стовбурових клітин, не може забезпечити повного одужання пацієнта [7]. У процесі клональної еволюції пухлина набуває стійкості до дії препаратів, які раніше застосовувалися у конкретного хворого. Під час захворювання формується рефрактерність до лікарських препаратів, наростає кумулятивна токсичність, погіршується соматичний статус пацієнта.
Здебільшого такі пацієнти вже пройшли багато курсів терапії та накопичили медикаментозну токсичність. У них обмежені резерви кровотворення КМ і часто спостерігаються тяжкі супутні захворювання. Прогноз у разі одночасної резистентності до бортезомібу та леналідоміду абсолютно несприятливий. Можливості подальшого лікування в подібних випадках практично вичерпані, а медіана ЗВ і виживаності без прогресування (ВБП) не перевищує 9 і 5 міс відповідно [8-9].
Одним з ефективних препаратів для терапії рефрактерної/рецидивуючої ММ (РРММ) є помалідомід. Як і леналідомід, помалідомід проявляє високу активність при РРММ.
Помалідомід – імуномодулювальний препарат III покоління, схвалений Управлінням з контролю якості харчових продуктів і лікарських препаратів США в 2013 р. у комбінації з низькими дозами дексаметазону як терапія порятунку для пацієнтів з подвійною рефрактерністю. Відповідно до рекомендацій Національної онкологічної мережі США (версія 4.2020) та оновлених протоколів Європейського товариства медичної онкології (2019), схеми помалідомід + дексаметазон та помалідомід + бортезоміб + дексаметазон є пріоритетними для дорослих пацієнтів з РРММ, у яких відбулося прогресування захворювання на тлі попередніх режимів лікування.
Механізм дії помалідоміду багаторівневий і на молекулярному рівні досі повністю не вивчений. Однак відомо, що помалідомід володіє прямою протипухлинною та імуномодулювальною дією та пригнічує живлення стромальних клітин, які сприяють росту клітин ММ. Зокрема, препарат пригнічує проліферацію та індукує апоптоз пухлинних гемопоетичних клітин. Крім того, помалідомід інгібує проліферацію клітин, резистентних до леналідоміду [10]. Помалідомід здатний пригнічувати ріст пухлинних клітин як у результаті прямої цитотоксичності, так і опосередковано, через дію на T-/NK-клітинний імунітет [11]. Помалідомід також інгібує ангіогенез, блокуючи міграцію та адгезію клітин ендотелію, при цьому забезпечення пухлинних клітин поживними речовинами погіршується.
Ефективність помалідоміду підтверджена результатами 2 великих багатоцентрових рандомізованих досліджень MM‑003 і STRATUS, у які були включені 940 пацієнтів з РРММ і рефрактерністю до леналідоміду, у 772 з них відзначалася подвійна рефрактерність – до леналідоміду і бортезомібу.
Багатоцентрове рандомізоване відкрите дослідження III фази MM‑003
Дослідження MM‑003 було проведене в Австралії, Канаді, США, Європі та Росії. Основною вимогою для включення пацієнта у дослідження була наявність РРММ після терапії бортезомібом і леналідомідом. Метою дослідження було порівняти ефективність та безпеку лікування помалідомідом із низькими дозами дексаметазону та дексаметазоном у високих дозах у монорежимі. Пацієнти були рандомізовані на групи у співвідношенні 2:1. У 1-й групі (n=302) застосовували помалідомід (4 мг/добу перорально у 1-21‑й день 28-денного циклу) + низькі дози дексаметазону (40 мг/добу перорально у 1-й, 8, 15 та 22-й дні). Учасники 2-ї групи (n=153) отримували високодозовий режим гормональної терапії: дексаметазон по 40 мг/добу перорально у 1‑4‑й, 9-12-й та 17‑20‑й дні. Лікування проводилося до прогресування захворювання або розвитку неприйнятної токсичності.
Після медіани спостереження 10 міс отримано такі результати: медіана ВБП у групі помалідомід + низькі дози дексаметазону становила 4,0 міс (95% довірчий інтервал – ДІ – 3,6-4,7), у групі високодозового лікування дексаметазоном – 1,9 міс (95% ДІ 1,9-2,2; рис. 1). При фінальному аналізі медіана ЗВ була істотно більшою у групі помалідомід + дексаметазон порівняно з групою високодозового режиму з дексаметазоном (12,7 міс; 95% ДІ 10,4-15,5 та 8,1 міс; 95% ДІ 6,9-10,8 відповідно; рис. 2). Найпоширенішими гематологічними побічними явищами (ПЯ) 3-4 ступеня у групах помалідомід + низькі дози дексаметазону та високодозового режиму дексаметазону були нейтропенія (у 43 (48%) із 300 хворих та у 24 (16%) зі 150 хворих відповідно), анемія (у 99 (33%) та 55 (37%) відповідно), тромбоцитопенія (у 7 (22%) та 39 (26%)). Серед негематологічних ПЯ 3-4 ступеня були пневмонія (у 38 (13%) та 12 (8%)), біль у кістках (у 21 (7%) та 7 (5%)), втома (у 6 (5%) та 9 (6%)).
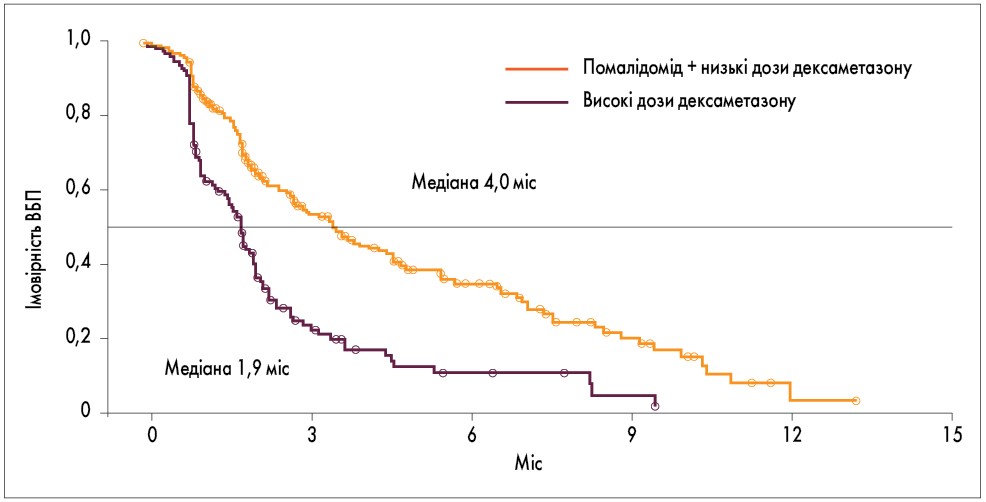 Рис. 1. ВБП у дослідженні MM‑003
Рис. 1. ВБП у дослідженні MM‑003
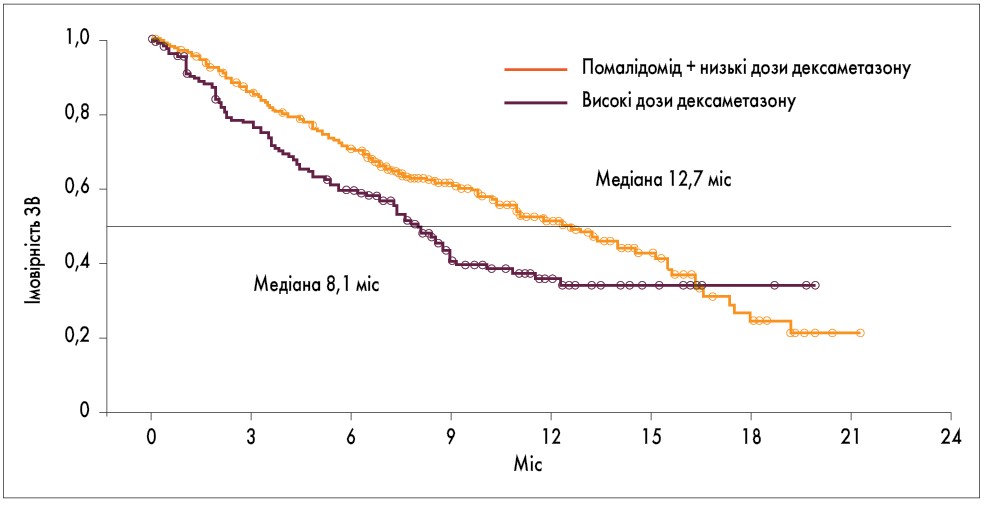 Рис. 2. ЗВ у дослідженні MM‑003
Рис. 2. ЗВ у дослідженні MM‑003
Таким чином, пероральний режим помалідомід + низькі дози дексаметазону може розглядатися як ефективний варіант лікування у пацієнтів з РРММ. Терапія була однаково ефективна при стандартному і високому цитогенетичному ризику [13].
Дослідження STRATUS
Метою дослідження STRATUS (MM‑010) було оцінити ефективність і безпеку режиму помалідомід + низькі дози дексаметазону у пацієнтів з РРММ і несприятливим прогнозом. Як і в попередньому дослідженні, критеріями включення були наявність хвороби та попереднє лікування бортезомібом і леналідомідом. Помалідомід застосовувався в дозі 4 мг/добу у 1-21-й день 28-денного циклу, дексаметазон – 40 мг/добу (у хворих старше 75 років – 20 мг/добу) у 1-й, 8, 15 та 22-й дні циклу до прогресування захворювання або розвитку неприйнятної токсичності.
Загалом у дослідження було включено 682 пацієнти. Медіана спостереження склала 16,8 міс. Медіана ВБП та ЗВ у пацієнтів досягли 4,6 та 11,9 міс, загальний рівень відповіді – 32,6%, тривалість відповіді – 7,4 міс. Найпоширенішими гематологічними ПЯ 3-4 ступеня були нейтропенія (у 49,7%), анемія (у 33,0%) та тромбоцитопенія (у 24,1%), негематологічними ПЯ – пневмонія (у 10,9%) та втома (у 5,9%). Венозна тромбоемболія та периферична нейропатія 3-4 ступеня були рідкісними ПЯ (по 1,6%).
STRATUS (MM‑010) на сьогодні є найбільшим дослідженням, у якому оцінено ефективність та безпеку режиму помалідомід + низькі дози дексаметазону у пацієнтів із РРММ. Отримані дані підтверджують, що режим забезпечує клінічно значущі переваги та, як правило, добре переноситься пацієнтами [14].
Дослідження OPTIMISMM
Окремої уваги заслуговує рандомізоване відкрите дослідження OPTIMISMM – єдине дослідження III фази, результати якого засвідчили покращення ВБП у пацієнтів з ранньою стадією РРММ, котрі мали рефрактерність до леналідоміду, на 70%. У дослідження були включені 559 пацієнтів зі 133 лікарень і дослідницьких центрів 21 країни. Попередньо пацієнти отримали щонайменше 2 курси терапії леналідомідом, у 71% хворих до нього була рефрактерність. Пацієнти були рандомізовані на 2 групи: 281 хворий отримував потрійну терапію (помалідомід 4 г/добу у 1-14-й день + бортезоміб 1,3 мг/м2 у 1-й, 4, 8 і 11-й дні 1-8-го циклу + дексаметазон 20 мг/добу), решта 278 пацієнтів – лікування без помалідоміду (бортезоміб 1,3 мг/м2 + дексаметазон 20 мг/добу). В осіб старше 75 років дексаметазон застосовувався в дозі 10 мг/добу.
У групі помалідоміду медіана ВБП була істотно вищою, ніж у пацієнтів, які його не отримували (11,2 міс; 95% ДІ 9,66-13,73 та 7,1 міс; 95% ДІ 5,88-8,48 відповідно). У групі помалідоміду також зафіксована вища частота гематологічної відповіді (табл. 2).
Найпоширенішими ПЯ 3/4 ступеня на тлі лікування помалідомідом та без нього були нейтропенія (42 проти 9%), інфекції (31 проти 18%) і тромбоцитопенія (27 проти 29%) [16]. Безпека помалідоміду залишалася керованою відповідно до профілю токсичності.
Пацієнтам з ММ, які отримують лікування помалідомідом, для запобігання виникненню тромботичних ускладнень призначається антикоагулянтна терапія (якщо вона не протипоказана). Пацієнтам з нейтропенією 3-4 ступеня, що розвинулася під час лікування помалідомідом, слід розглянути можливість профілактичного призначення препаратів колонієстимулювального фактора. Слід мати на увазі, що помалідомід, як і леналідомід, схожий за структурою з талідомідом та має тератогенний ефект. Тому при застосуванні помалідоміду пацієнтка та її партнер повинні суворо дотримуватися програми запобігання вагітності.
Отже, результати проспективних досліджень комбінованих режимів на основі помалідоміду якісно змінили алгоритм прийняття рішення щодо тактики лікування пацієнтів з рефрактерною ММ. Можливість використання імуномодуляторів III покоління як терапії порятунку з контрольованим профілем безпеки дозволить забезпечити пацієнтів тривалою гематологічною відповіддю при хорошій переносимості препаратів.
Список літератури знаходиться в редакції.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 4 (65) 2020 р.





