5 січня, 2021
Медикаментозно-індуковані ураження печінки в онкології
 У сучасному світі проведення численних клінічних досліджень не дає змоги уникнути потрапляння на фармацевтичний ринок засобів із гепатотоксичними ефектами. З одного боку, існує проблема безконтрольного вживання рослинних засобів і харчових добавок, які, як показують сучасні дані, чинять негативну дію на печінку. З іншого боку, гепатотоксичність виникає на тлі застосування необхідних для пацієнтів лікарських препаратів, зокрема протипухлинних. Проте у цьому випадку небажане явище є передбачуваним, і лікарі мають настороженість щодо його появи. Основна проблема гепатотоксичності засобів, які застосовуються в онкології, полягає в тому, що тяжке ураження органа часто є показанням до редукції дози препарату чи до припинення лікування основного захворювання.
У сучасному світі проведення численних клінічних досліджень не дає змоги уникнути потрапляння на фармацевтичний ринок засобів із гепатотоксичними ефектами. З одного боку, існує проблема безконтрольного вживання рослинних засобів і харчових добавок, які, як показують сучасні дані, чинять негативну дію на печінку. З іншого боку, гепатотоксичність виникає на тлі застосування необхідних для пацієнтів лікарських препаратів, зокрема протипухлинних. Проте у цьому випадку небажане явище є передбачуваним, і лікарі мають настороженість щодо його появи. Основна проблема гепатотоксичності засобів, які застосовуються в онкології, полягає в тому, що тяжке ураження органа часто є показанням до редукції дози препарату чи до припинення лікування основного захворювання.
Президент Української гастроентерологічної асоціації, заслужений діяч науки і техніки України, доктор медичних наук, професор Ігор Миколайович Скрипник (м. Полтава) у рамках науково-практичної конференції з онлайн-трансляцією «UkraineOncoGlobal 2020» представив доповідь «Медикаментозно-індуковані ураження печінки: аспекти доказовості, лікування та профілактики».
– Медикаментозно-індуковані ураження печінки (МІУП) є недооціненою проблемою сучасної медицини. Останні епідеміологічні дані не відображають реальної поширеності захворювання, а отримані показники є заниженими. Натомість, за даними M.A. Shapiro та співавт. (2007), пошкодження печінки становить до 10% усіх побічних ефектів лікарських засобів. Однією з причин такої статистики є те, що лікарі у діагнозі часто не зазначають МІУП (наприклад, у Швеції близько 52-68% лікарів не вказують, що захворювання печінки індуковане прийомом гепатотоксичного препарату).
Незважаючи на те що фармакологічні препарати проходять низку досліджень щодо визначення їх безпечності, усі ліки є потенційно токсичними, тому кожне призначення має бути обґрунтованим.
Виділяють такі види МІУП:
- гепатоцелюлярний: ↑ рівня аланінамінотрансферази (АЛТ) >2, лужна фосфатаза (ЛФ) – норма, АЛТ/ЛФ >5;
- холестатичний: АЛТ – норма, ЛФ >2, АЛТ/ЛФ <2;
- змішаний: АЛТ >2, ЛФ >2, 2< АЛТ/ЛФ <5.
У 2019 р. Європейською асоціацією з вивчення печінки (EASL) були розроблені нові клінічні настанови, присвячені МІУП (R. Andrade et al., 2019).
Ризик МІУП:
- лікарі можуть розглядати рослинні засоби, біологічно активні добавки як потенційні причинні фактори розвитку МІУП;
- жіноча стать є фактором ризику МІУП, що пов’язано із застосуванням певних препаратів;
- наявність компонентів метаболічного синдрому слід розглядати як фактори ризику виникнення та тяжкості медикаментозно-індукованого ожиріння печінки у пацієнтів, які отримують метотрексат і тамоксифен;
- хронічний гепатит С та В можуть розглядатися як фактори ризику МІУП у пацієнтів, котрі отримують антиретровірусну та протитуберкульозну терапію;
- пероральні контрацептиви можуть розглядатися як фактори ризику розвитку аденоми печінки;
- андрогени й андрогенні стероїди, особливо в контексті лікування недостатності кісткового мозку, можуть розглядатися як фактори ризику розвитку пухлин печінки.
Діагностика МІУП:
- стандартними дослідженнями для встановлення ураження печінки та печінкової дисфункції при МІУП є визначення рівня АЛТ, ЛФ та загального білірубіну (ЗБ);
- активність аспартатамінотрансферази (АСТ) може використовуватися як достовірна заміна АЛТ для визначення характеру ураження органа у випадку, коли дослідження АЛТ недоступне; рівень гамма-глутамілтранспептидази (ГГТП) є менш достовірною альтернативою ЛФ;
- стійке підвищення вмісту ЗБ та ЛФ через 2 міс після виявлення МІУП має використовуватися як маркер хронічного МІУП.
У настановах EASL (2019) окремі положення стосуються ураження печінки, індукованого імунотерапією раку. У значної частини хворих інгібітори контрольних точок можуть спричиняти гепатотоксичність, пов’язану з імунітетом, при цьому інгібітори глікопротеїнів цитотоксичних Т-лімфоцитів 4 (СТLA‑4), наприклад іпілімумаб, є більш гепатотоксичними, ніж анти-PD‑1 препарати, наприклад ніволумаб. Комбіноване лікування також зумовлює вищий ризик для пацієнта.
Лікування. Для різних форм МІУП EASL рекомендує застосовувати конкретні методи лікування:
- короткотривале призначення холестираміну може використовуватися для зменшення гепатотоксичності, спричиненої лише окремими препаратами (лефлуномід і тербінафін);
- карнітин можна призначати для зниження гепатотоксичності при терапії вальпроатами;
- ефективність N-ацетилцистиїну у зменшенні тяжкості ураження печінки при прийомі лікарських засобів, крім парацетамолу, не обґрунтована;
- ефективність урсодезоксихолевої кислоти (УДХК) у зменшенні тяжкості МІУП недостатньо обґрунтована.
При веденні пацієнта з МІУП насамперед необхідно визначити тип і тяжкість пошкодження печінки, виключити інші причини (аутоімунний, вірусний гепатит). Тому алгоритм обстеження пацієнтів з підозрою на МІУП включає клінічний аналіз крові, біохімічний аналіз крові (АЛТ, АСТ, лактатдегідрогеназа – ЛДГ, ЛФ, ГГТП, білірубін, альбумін, холестерин, холінестераза), коагуляційні та серологічні тести (у тому числі визначення аутоантитіл), вірусні маркери (анти-HAV IgM, HBsAg, IgM-HBc, анти-HCV, HBV‑DNA, HCV-RNA), ультразвукове дослідження, оцінку фіброзу печінки.
Тяжкість пошкодження печінки визначається за шкалою DILIN, за якою виділяють легкий, помірний, помірно-тяжкий, тяжкий і фатальний ступінь пошкодження. З метою покращення діагностики та лікування пацієнтів з МІУП були створені зручні для використання інтернет-ресурси Livertox (розроблено у США у 2012 р.) та HepaTox (розроблено в Китаї у 2014 р.), на яких зібрана актуальна інформація із цих питань.
Міжнародні стандарти фармакотерапії при МІУП та доказова база. На сьогодні існують різні точки зору щодо лікування пацієнтів з МІУП. Тактика лікування насамперед залежить від типу ураження. Китайські колеги при середньотяжкому МІУП із переходом у тяжку форму гепатоцелюлярного або змішаного типу використовують засоби на основі лимоннику китайського (X. Li et al., 2014; N.H. Chu et al., 2015). У разі холестатичного типу МІУП рекомендоване застосування адеметіоніну (P. Zhao et al., 2011; B. Vincenczi et al., 2011) та УДХК (R.A. Nathwani et al., 2006; L.D. Ni et al., 2009). У пацієнтів із гострою печінковою недостатністю з енцефалопатією, тяжкими порушеннями коагуляції та декомпенсованим цирозом може розглядатися проведення трансплантації печінки (D.G. Reuben et al., 2017).
Багатьом хіміотерапевтичним препаратам властива гепатотоксичність, яка часто стає причиною зниження дози або відтермінування хіміотерапії (ХТ). У клінічному дослідженні 50 онкологічним пацієнтам, у яких вперше виникла гепатотоксичність на тлі ХТ, додатково був призначений адеметіонін. Через 2 тижні лікування спостерігалося значне зниження рівня АСТ, АЛТ і ЛДГ. Слід зазначити, що у надалі показники печінкових ензимів були сталими, завдяки чому пацієнти змогли продовжити ХТ з мінімальною потребою у зниженні дози чи відтермінування протипухлинного лікування. Наявність метастазів не впливала на ефективність лікування адеметіоніном (D. Santini et al., 2003).
В іншому дослідженні оцінювали ефективність додаткового призначення адеметіоніну хворим на колоректальний рак, які отримували ад’ювантну ХТ за схемою FOLFOX (12 курсів). Було виділено дві групи: у 1-й групі (n=45) не було призначено адеметіонін, а у 2-й групі пацієнти (n=60) разом із основним лікуванням отримували цей гепатотропний засіб у дозі 400 мг 2 р/добу. У кінці дослідження учасники 2-ї групи мали значно нижчий рівень АЛТ (p=0,003), АСТ (p<0,001), ЗБ (p=0,04), ГГТП (p=0,002) порівняно з 1-ю групою. У пацієнтів, котрі отримували адеметіонін, був нижчий ступінь гепатотоксичності (p=0,002), у них рідше виникала потреба у зниженні дози протипухлинних препаратів (p=0,031) та відтермінуванні курсів ХТ (p<0,0001). Завдяки додатковому призначенню адеметіоніну 100% пацієнтів пройшли повний курс ХТ (B. Vincenzi et al., 2011).
Результати власного клінічного дослідження, проведеного на базі Полтавської обласної клінічної лікарні ім. М.В. Скліфосовського, продемонстрували ефективність застосування препарату Гептрал® для лікування уражень печінки у пацієнтів з гострим лейкозом у динаміці поліхіміотерапії. У дослідженні взяли участь 44 хворих на вперше встановлений гострий лейкоз: 34 – на гострий мієлоїдний лейкоз (ГМЛ) та 10 – на гострий лімфобластний лейкоз (ГЛЛ). Їх розділили на дві групи: пацієнтам 1-ї групи (n=23) призначили ХТ + адеметіонін (1000 мг/добу), 2-ї групи (n=21) – ХТ. Функцію печінки оцінювали за рівнем печінкових ензимів (АЛТ, АСТ, ЛФ, ГГТП, ЗБ, зальний білок). У пацієнтів 1-ї групи частота й тяжкість гепатотоксичності була нижчою порівняно з 2-ю групою (рис).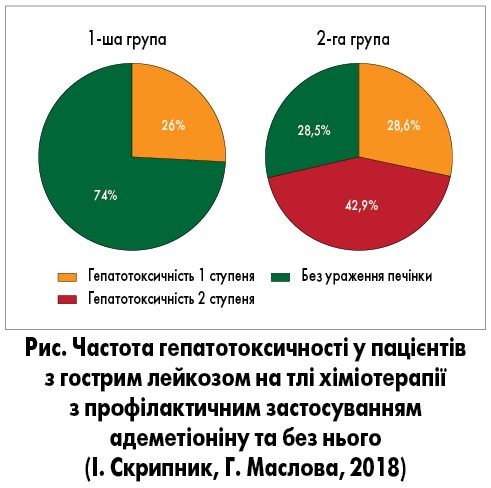
Захисний ефект адеметіоніну пов’язаний в тому числі із поліпшенням пластичності мембран гепатоцитів та активності антиоксидантної системи. Рекомендована доза препарату – 1000-1500 мг/добу для перорального застосування або 500‑1000 мг/добу парентерально.
Нині в медичній спільноті активно обговорюється проблема надлишкової маси тіла та ожиріння як фактора ризику вищої частоти та сильнішого пошкодження печінки в онкогематологічних пацієнтів на тлі ХТ. Наш досвід свідчить, що додаткове призначення хворим на гострий лейкоз препарату Гептрал® на фоні індукційної ХТ покращує показники функціонального стану печінки та запобігає розвитку МІУП.
Вивчення ролі надлишкової маси тіла й ожиріння у розвитку гепатотоксичних реакцій у хворих на хронічний лімфоцитарний лейкоз було метою ще одного вітчизняного клінічного дослідження. Учасників дослідження розділили на дві групи за індексом маси тіла (ІМТ): до 1-ї групи були включені хворі (n=47) з нормальним ІМТ
У недавньому клінічному дослідженні за участю 58 хворих на гострий лейкоз із супутнім ожирінням оцінювали ефективність препарату Гептрал® (по 1000 мг/добу протягом 28 днів) для профілактики МІУП. Хворих було розділено на групи: 1а – пацієнти з ГЛЛ, які отримували ХТ, 1б – хворі на ГЛЛ, що отримували ХТ + Гептрал®,
У результаті відзначено, що застосування адеметіоніну на фоні ХТ у пацієнтів з ГМЛ і ГЛЛ зменшує прояви цитолітичного й холестатичного синдромів та ефективно перешкоджає розвитку гепатотоксичних реакцій. Проведення ХТ у пацієнтів з ГЛЛ і ГМЛ призводить до зниження активності аргінази у 1,3 та 1,2 разу відповідно, зниження рівня орнітиндекарбоксилази – у 1,7 та 1,8 разу відповідно, а також не впливає на вміст аргініну.
Отже, у сучасних реаліях важливим напрямом медичної науки та практики є профілактика гепатотоксичних реакцій. Першим та основним кроком є ідентифікація гепатотоксичності в передреєстраційних дослідженнях нових лікарських речовин для клінічної практики. Далі лікарям необхідно проводити контроль небажаних явищ з боку печінки у конкретних хворих (моніторинг рівнів печінкових ензимів, при виявленні порушень – своєчасна відміна лікування), додатково призначати гепатотропні засоби (Гептрал®), особливо при гепатитах з внутрішньопечінковим холестазом на фоні прийому ізоніазиду, антиретровірусних чи протипухлинних препаратів.
Підготувала Ілона Цюпа
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.



