25 січня, 2021
Чи погіршує COVID-19 перебіг спадкового ангіоневротичного набряку?
Коронавірусна хвороба 2019 (COVID‑19) за короткий час розвинулася в пандемію, поширившися по всьому світу. Збудник COVID‑19 – SARS-Cov‑2 (коронавірус 2) спричинює тяжкий гострий респіраторний синдром (ГРС). Вірус потрапляє в клітину-господаря за допомогою ангіотензин-перетворювального ферменту‑2 (ACE2, АПФ2). Цей фермент бере участь у метаболізмі брадикініну (БК), що призводить до його виснаження. У результаті накопичується des-Arg (9) -БК (він грає роль агоніста рецепторів БК B2) і, можливо, сам БК. Обидва ці пептиди, зв’язуючися з рецепторами БК, ведуть до вазодилатації, пошкодження легень і запалення. Перевантажена контактна система активації і надлишковий синтез БК є ключовими механізмами запуску патогенезу спадкового ангіоневротичного набряку (САН). Є підстави припускати, що COVID‑19 може посилювати тяжкість САН і навпаки. У цьому огляді ми досліджуємо потенційну взаємодію між COVID‑19 і САН з точки зору контактної системи активації, системи комплементу, вивільнення цитокінів, збільшення пулу клітин Т-хелперів‑17 і порушень з боку кровоносної системи. Ми припускаємо, що коморбідність із САН може призводити до прогресування COVID‑19 і погіршувати його прогнози, а COVID‑19, своєю чергою, може обтяжувати САН або спровокувати його дебют у безсимптомних носіїв САН-пов’язаних генних мутацій. З огляду на патофізіологічні зв’язки, ми робимо висновок, що пацієнтам із САН, схильним до ризику зараження SARS-Cov‑2, потрібна тривала профілактика, особливо інгібіторами C1 і ланаделумабом. Таким пацієнтам варто проводити медикаментозну довготривалу профілактику нападів та мати резерв ліків на випадок гострих нападів.
COVID‑19, спровокований SARS-CoV‑2 – вірусом тяжкого ГРС, стрімко поширився в більшості країн світу. Кількість хворих на COVID‑19 і смертей унаслідок цієї інфекції в усьому світі швидко зростає. Ученими з багатьох країн було докладено неабияких зусиль, щоб розкрити патофізіологію та прогностичні фактори COVID‑19. Встановлено, що SARS-CoV‑2 проникає в клітини-господарі дихальних шляхів крізь трансмембранний білок – АПФ2 і використовує трансмембранну серинову протеазу TMPRSS2 для фіксування власного шипоподібного білка S. Після проникнення в клітину-хазяїна SARS-CoV‑2 викликає низку вроджених і адаптивних імунологічних реакцій, відповідальних за знешкодження вірусу і запальний процес. Крім того, взаємодія між SARS-CoV і контактною системою активації, системами згортання й комплементу мають значення для тяжкості перебігу та результатів COVID‑19.
САН – рідкісне генетичне захворювання (частота поширення у світі складає 1,1-1,6 випадку на 100 тис населення), яке проявляється у вигляді повторюваних нападів підшкірного і підслизового набряку. Патофізіологія САН заснована на контактній системі активації, комплементу і фібринолітичній системі, серед яких ключовою є контактна система. Певні цитокіни – інтерлейкін‑1 (IL‑1, ІЛ‑1), трансформуючий фактор росту-β (TGF-β) та інші також можуть грати роль у патофізіології САН. Отже, є підстави припустити, що між COVID‑19 і САН можливий патофізіологічний взаємозв’язок. Поки немає повідомлень про пацієнтів із САН, інфікованих SARS-CoV‑2, а значить, відсутня інформація про перебіг захворювання в таких пацієнтів. З огляду на поширеність і різноманітний спектр проявів САН, малоймовірно, що рекомендації з організації діяльності закладу з COVID‑19 і САН будуть засновані на клінічних спостереженнях або дослідженнях. Тому важливо вивчити і проаналізувати потенційний зв’язок між цими двома клінічними станами з точки зору вже відомих механізмів, які лежать в основі їхньої патофізіології, що й зроблено в даному огляді.
Роль контактної системи активації в САН і COVID‑19
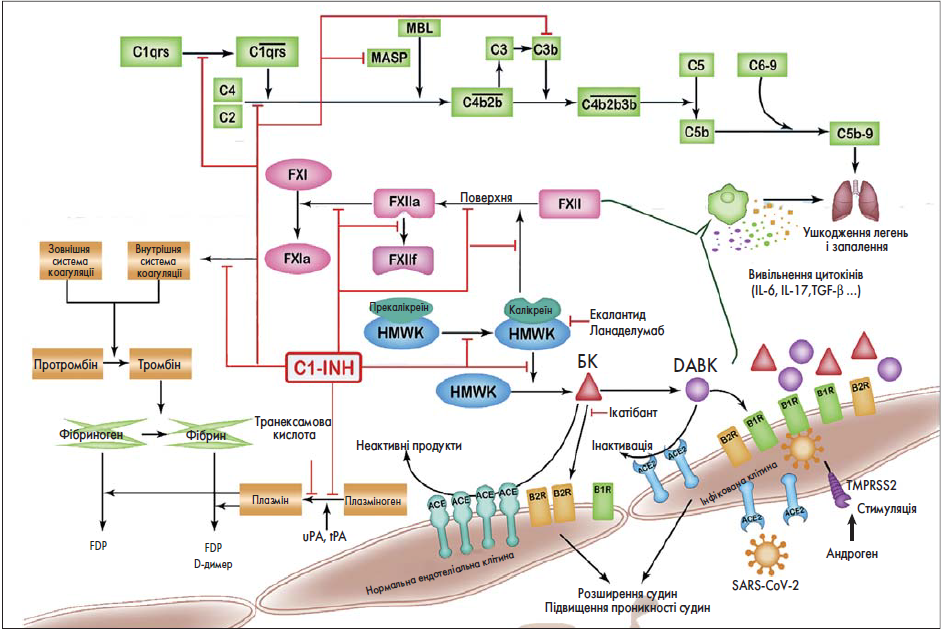
Як можна побачити на рисунку, причиною САН 1 і 2 типу є мутації в гені SERPING1, які призводять до дефіциту або синтезу нефункціонального білка-інгібітора C1 (C1-INH). Недолік функціонального C1-INH у пацієнтів із САН 1 або 2 типу стає причиною посилення активації контактної системи і її БК-формуючого каскадного механізму. Виникає гіперпродукція БК, яка, своєю чергою, спричинює напади ангіоневротичного набряку (АН). Des-Arg (9)-брадикінін (DABK) генерується дещо пізніше і не впливає на розвиток АН. Як і багатофункціональний інгібітор серинових протеаз, C1-INH має широкий спектр субстратів, зокрема прекалікреїн, калікреїн, фактори XII, XIIa, XIIf, плазміноген, плазмін, C1r, C1s і серинову протеазу, асоційовану з манозозв’язувальним лектиніном (MBL), – MASP‑1 і MASP‑2. Таким чином, крім своєї основної функції в контактній системі C1-INH також регулює систему комплементу, фібринолітичну і коагуляційну системи.
Рис. 1. Гіпотетична взаємодія у відомій патологічній системі САН і COVIID‑19
У разі САН типу 1 та 2 з дефіцитом або порушеною функцією С1-інгібітора (C1-INH) може відбуватися надмірна контактна активація протеолітичних білків плазми, зокрема фактору Ⅻ (FⅫ), прекалікреїну, калікреїну, високомолекулярного кініногену (HMWK), з утворенням надмірної кількості брадикініну (БK). ФакторⅫa (FⅫa), активована форма фактору Ⅻ, перетворює комплекс прекалікреїн-HMWK на калікреїн-HMWK, тоді як фрагмент фактору Ⅻ (FⅫf) може слабо стимулювати це перетворення. Калікреїн розщеплює HMWK до BK і за механізмом зворотного зв’язку активує фактор Ⅻ. За допомогою карбоксипептидази N/M БK утворює des-Arg (9)-брадикінін (DABK). BK зв’язується з рецептором брадикініну B2 (B2R), а DABK – з рецепторами брадикініну B1 (B1R) і B2R на поверхні ендотеліальних клітин, сприяючи розширенню судин і збільшуючи їх проникність. Ділянки-мішені доступних терапевтичних підходів при САН, у тому числі заміщення C1-INH, екалантид, ланаделумаб та ікатібант, позначені червоною лінією. При COVID‑19, тяжкому гострому респіраторному синдромі, спричиненому коронавірусом‑2 (SARS-CoV‑2), вірус потрапляє в клітину хазяїна за допомогою ангіотензинперетворювального ферменту 2 (ACE2) на клітинній поверхні та зменшує його експресію. Оскільки ACE2 є ферментом, що розщеплює DABK, виснаження ACE‑2 призводить до накопичення DABK і можливо БK за механізмом негативного зворотного зв’язку з деградацією БK, що опосередковує набряк легень і запалення. Надмірна активація контактних білків плазми при САН може поглиблювати пошкодження легень, опосередковане БK і DABK, при COVID‑19. Ділянки-мішені доступних терапевтичних підходів при САН, у тому числі заміщення C1-INH, екалантид, ланаделумаб та ікатібант, показані червоною лінією, що може бути корисним при COVID‑19. C1-INH відіграє інгібувальну роль у системі комплементу, пригнічуючи активацію C1qrs, розщеплення C4 і C2, C3b і асоційовану з манозозв’язувальним лектином (MBL) серинову протеазу (MASP). Без достатньої кількості чи функції C1-INH система комплементу може гіперактивуватись, що також спостерігалося при COVID‑19, та поглиблює пошкодження легень. У пацієнтів із САН було виявлено підвищення рівня цитокінів Т-хелперів 17 (Th17), таких як інтерлейкін‑6 (IL‑6), IL‑17, IL‑21, трансформувальний фактор росту-β (TGF-β), тоді як при COVID‑19 спостерігали посилене вивільнення прозапальних цитокінів (IL‑1b, IL‑1ra, IL‑7 та ін.) та збільшення кількості Th17. Попередньо існуючі цитокіни при САН можуть призвести до цитокінового шторму при COVID‑19. IL‑1b може посилювати експресію B1R на ендотеліальній поверхні та погіршувати опосередковане DABK запалення. При САН втрата інгібувальної функції C1-INH на фактор Ⅻ, фактор Ⅺ і плазміноген теоретично індукує підвищену коагуляцію та фібринолітичну активність, але справжній стан системи згортання в пацієнтів із САН не з’ясований. При COVID‑19 спостерігають стан гіперкоагуляції, особливо у тяжких хворих. Чи може дефіцит C1-INH впливати на гематологічні реакції при COVID‑19, треба додатково дослідити. (Для тлумачення вказівок щодо кольору в описанні до рисунка читачу пропонується ознайомитись з веб-версією цієї статті.)
За відсутності пригнічення C1-INH фактор XII аутоактивується з метою формування фактору XIIa за допомогою контакту з ініційованою поверхнею і згодом генерує фрагмент 28,5 кДа, який називається фактором XIIf. Прекалікреїн і високомолекулярний кініноген (HMWK, ВМКГ) у периферичній крові утворюють біомолекулярний комплекс у співвідношенні 1:1. Фактори XIIa і XIIf перетворюють комплекс прекалікреїн-ВМКГ у комплекс калікреїн-ВМКГ, тоді як утворення калікреїну призводить до активації фактору XII за принципом зворотного зв’язку. Потім калікреїн розщеплює ВМКГ до БК – важливого медіатора у формуванні набряку. При САН 1 і 2 типу гіперпродукція БК зумовлена надмірною активацією контактної системи плазми крові. Карбоксипептидаза N/M відчіплює C-кінцевий пептид БК і генерує DABK. БК зв’язується з БК-рецептором B2 (B2R), тоді як DABK зв’язується в основному з БК-рецептором B1 (B1R), а також із B2R на поверхні ендотеліальних клітин, що призводить до розширення судин, збільшення судинної проникності, а також до продукції вазодилататорів, у тому числі оксиду азоту і простагландину E2.
У пацієнтів із САН, особливо під час нападів, рівень БК може значуще збільшуватися не тільки локально в ділянці ураження, а й системно – в усій циркулюючій крові.
Було виявлено, що при COVID‑19 S-білок на поверхні вірусу SARS-CoV‑2 зв’язується з АПФ2 у легенях аналогічно механізму SARS-CoV‑1. Для того щоб підготувати ендотеліальні клітини для проникнення вірусу, SARS-CoV‑1 взаємодіє з АПФ2 клітинної мембрани, зливається з нею, а потім проникає всередину клітини шляхом ендоцитозу. Транслокація АПФ2 з поверхні клітини до внутрішньоклітинного простору є частиною процесу, який називається «інтерналізація». Повідомлялося, що взаємодія між SARS-CoV‑2 і АПФ2 збільшує активність металопептидазного домену 17 ADAM (ADAM17, стара назва – конвертуючий фермент ФНП-α – TACE), який може індукувати розщеплення АПФ2 і відщеплення позаклітинного його домену. Таким чином, інфекція SARS-CoV і білок S на поверхні віріона знижують мембранну експресію АПФ2 за рахунок як інтерналізації, так і відщеплення АПФ2 від клітинної мембрани. АПФ2 є гомологом АПФ і бере участь у деградації DABK, розщеплюючи його на неактивні метаболіти. Частково завдяки вивільненню хемокінів, опосередкованих віссю DABK/B1R: CX-C-мотиву хемокіну 5, макрофагального запального білка‑2 (MIP2), CX-C-мотиву хемокіну 1 і ФНП-α, АПФ2 грає значущу роль у розвитку легеневого запалення. Так, виснаження АПФ2 інфекцією SARS-CoV‑2 перешкоджає інактивації DABK. Зв’язування DABK із B1R може спричинити швидку інфільтрацію нейтрофілами, підвищену капілярну проникність, що є ключовими особливостями гострого респіраторного дистрес-синдрому (ARDS, ГРДС), і призводить до тяжкого ураження й запалення легень. Накопичення DABK може стати причиною деградації БК і більш тривалого зв’язування БК з B2R на поверхні ендотеліальних клітин. Зв’язування БК із B2R також призводить до підвищеної проникності судин і АН у тканини легень. Крім того, БК, гістамін і серотонін відомі як основні медіатори гострого запалення легень.
Імовірно, патофізіологічні зміни в пацієнтів із САН, зокрема надмірна продукція БК, і згодом – DABK, які супроводжуються підвищенням експресії B1R, можуть призвести до ще більшого пошкодження тканин, викликаного SARS-CoV‑2, унаслідок збільшення судинної проникності й локального набряку легень через кінін-калікреїнову систему і, можливо, погіршують результат COVID‑19. Тому дехто з дослідників припустив, що терапевтичні підходи, націлені на кінін-калікреїнову систему (антагоніст B2R – ікатібант, C1-INH і селективні інгібітори калікреїну плазми – екалантид, ланаделумаб), можуть бути корисними для профілактики ГРДС у пацієнтів із COVID‑19. Аналогічним чином у китайських рекомендаціях експерти припускають, що ікатібант варто розглядати як варіант лікування пацієнтів із ГРДС або АН на тлі COVID‑19. Ікатібант в якості селективного антагоніста B2R може змінювати активність БК. Препарат схвалений для лікування гострих нападів САН у США і в Європі. Також було продемонстровано, що ікатібант ефективний в терапії АН верхніх відділів травлення, індукованого інгібіторами АПФ, який опосередковується інгібуванням розпаду БК і подальшим його накопиченням. C1-INH є замісною терапією при САН і схвалений для використання в разі потреби або як профілактичний засіб.
Мультиінгібіторна функція C1-INH стосується не тільки контактної системи активації, але й системи комплементу, фібринолітичної та коагуляційної систем і може відігравати позитивну роль у веденні пацієнтів із COVID‑19. Інгібітор плазмового калікреїну – екалантид і моноклональні антикалікреїнові антитіла – ланаделумаб, які діють через інгібування активності калікреїну і активацію каскадного утворення БК, також можна вважати перспективними стратегіями лікування хворих на COVID‑19 із ГРДС або АН. Усі ці три препарати схвалено для лікування САН, вони мають добре вивчені профілі безпеки і побічних ефектів. Фармакологічне інгібування факторів згортання XIIa або FXI також демонструє багатообіцяючі ефекти захисту проти синдрому системної запальної відповіді в дослідженнях на тваринах. При цьому воно має незначний вплив на гемостаз та імунітет господаря, вказуючи на те, що система контактної активації може слугувати потенційною терапевтичною мішенню в лікуванні пацієнтів із COVID‑19.
Коагуляційна і фібринолітична системи при САН і COVID‑19
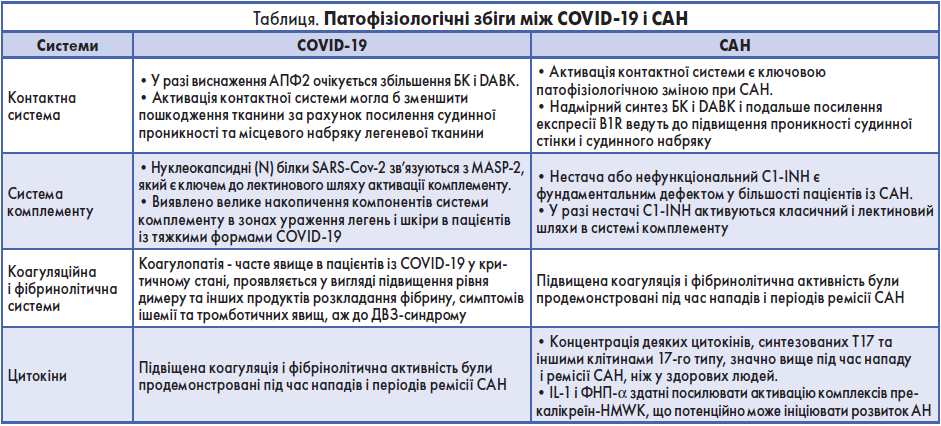
Контактна система активації тісно взаємодіє з коагуляційною і фібринолітичною системами. У пацієнтів із САН підвищена коагуляційна і фібринолітична активність були продемонстровані як під час нападів, так і в періоди ремісії.
Стурбованість порушеннями гематологічної сфери в поєднанні з COVID‑19 зростає. Відомо, що перша зміна з боку крові – це підвищення рівня D-димеру та інших продуктів розпаду фібрину за відсутності відкритих кровотеч, яке, імовірно, є результатом запальної реакції. Імунологічні та запальні реакції можуть призвести до подальшого наростання змін із боку крові, кульмінацією яких можуть стати ішемії та тромботичні події в пацієнтів у критичному стані. Рівень D-димеру >1 мг/мл у момент поступлення пацієнта в стаціонар є потенційним фактором ризику несприятливих наслідків COVID‑19. Підвищений рівень D-димеру – результат не тільки активації системи згортання, а й запальної реакції, пов’язаної з COVID‑19. Тяжка інфекція внаслідок активації коагуляції та запальної реакції може призвести до дисемінованого внутрішньосудинного згортання (ДВЗ-синдрому) в пацієнтів у критичному стані.
Варто дослідити, чи призводить підвищена коагуляція і фібринолітична активність у пацієнтів із САН до розвитку тяжких станів у разі інфікування SARS-CoV‑2, а також чи будуть стратегії, спрямовані на гематологічну відповідь, мати сприятливий ефект у пацієнтів із САН і COVID‑19.
Система комплементу на тлі САН і COVID‑19
При інфікуванні COVID‑19 спостерігалася активація системи комплементу. Нуклеокапсидні (N) білки SARS-CoV‑2, SARS-CoV і коронавірусу Близькосхідного респіраторного синдрому (MERS-CoV) зв’язуються з MASP‑2, який є ключем до лектинового шляху активації комплементу. У 5 пацієнтів із тяжкою формою COVID‑19 у мікросудинній системі легень спостерігалися великі відкладення комплексу мембранної атаки C5b‑9, білків C4d і MASP‑2, а також вірусного білка S у шкірній мікросудинній мережі, що вказує на активацію лектинового шляху в системі комплементу. Активована система комплементу порушувала механізми коагуляції та опосередковано дифузну тромботичну мікроангіопатію як в легенях, так і в шкірі. У випробуваннях на мишах C3 –/– під час інфекції SARS-CoV спостерігалося менше респіраторної дисфункції, нейтрофільної інфільтрації в легеневій тканині, а також рівня IL‑6 в кровотоці проти мишей дикого типу. Це дає можливість припустити, що активація комплементу призводить до патогенезу SARS-CoV. Усі ці дані в сукупності продемонстрували роль активації комплементу в патофізіології COVID‑19 і заклали основу для нових потенційних методів лікування COVID‑19, наприклад застосування сонцезахисних препаратів C3 та інших стратегій блокади цього метаболічного шляху.
Очікується, що в пацієнтів із C1-INH-асоційованим САН, інфікованих SARS-CoV‑2, відсутність інгібування C1r, C1s і взаємодії із C3 посилить активацію комплементу. Що разом із втратою регуляції C1-INH локально в осередках позасудинного запалення, впливом дефіциту C1-INH на систему комплементу призведе до подальшого розвитку запального процесу, пошкодження капілярів і, в кінцевому підсумку, погіршення прогнозу захворювання.
Цитокіни і Т-хелпери 17 (Th17) у пацієнтів із САН і COVID‑19
Підвищений прозапальний цитокіновий профіль дуже часто спостерігається в пацієнтів із тяжкою формою COVID‑19, що вказує на потенційно важливу роль гіперергічного запального процесу в патофізіології COVID‑19. Проти групи здорових добровольців у пацієнтів із COVID‑19 зазначалися більш високі рівні: IL‑1β, IL‑1rα, IL‑7, IL‑8, IL‑9, IL‑10; основного фактору росту фібробластів; фактору, який стимулює колонізацію гранулоцитів (GCSF), GM-CSF; IFN-γ, IFN-γ-індукованого білка 10; хемоаттрактантного білка моноцитів; запального білка макрофагів (MIP) -1α, MIP‑1β; тромбоцитарного фактору росту; ФНП-α і судинно-ендотеліального фактору росту.
Дослідження COVID‑19 виявили зростання Th17, які диференціюються з клітин Th0 шляхом стимуляції IL‑6, TGF-β, IL‑21 і IL‑23. Було зазначено, що IL‑6, який є важливим «учасником» цитокінового шторму при COVID‑19, значуще підвищується в пацієнтів із тяжкою формою захворювання, виступаючи в якості ключового учасника в гострій фазі запалення.
З огляду на всі ці дані, можна припустити, що попередній підвищений рівень цитокінів і Th17 при САН може призвести до цитокінового шторму в разі COVID‑19, хоча необхідні додаткові дослідження.
Двонаправлена взаємодія між COVID‑19 і САН
САН – це генетичне захворювання, зумовлене переважно мутаціями в гені SERPING1 і декількох інших генах, зокрема FXII, ANGPT1 і PLG. Однак клінічні прояви в пацієнтів із САН дуже різняться, навіть якщо вони є носіями тієї самої мутації. Відмінності в клініці включають вік дебюту САН, тяжкість набряку і частоту нападів. Також було зазначено, що не всі носії мутації SERPING1 мають рецидивуючі набряки.
Можливо, COVID‑19 і САН утворюють якусь область взаємодії, в якій патофізіологічні механізми кожного захворювання посилюють один одного. Патофізіологічні збіги між COVID‑19 і САН представлені в таблиці. Триваюче виснаження АПФ2 інфекцією SARS-CoV‑2 збільшує позаклітинні рівні DABK і БК через кінін-калікреїновой шлях, а також пошкодження й запалення в тканинах легень. Своєю чергою, пошкодження клітин і запалення активують вироблення B1R. Надмірне утворення БК і DABK, на додаток до активованої експресії B1R, провокує розвиток АН.
На щастя, у жодного зі 136 пацієнтів із САН, зареєстрованих у нашому Центрі САН, не був діагностований COVID‑19. Сюди входять 6 пацієнтів із провінції Хубей, з них 3 – жителі міста Ухань. Сьогодні через брак препаратів для терапії САН в Китаї цим пацієнтам були призначені різні дози даназолу в якості довгострокового профілактичного лікування. Повсюдне використання даназолу (ослабленого андрогену) під час пандемії COVID‑19 викликає занепокоєння. Поки невідомо, чи є більш несприятливі клінічні наслідки і більш висока смертність від COVID‑19 у чоловіків проти жінок випадковістю або причинно-наслідковим зв’язком. Розглядається два ймовірних механізми. Перший заснований на доказах того, що ко-рецептор SARS-CoV‑2 – TMPRSS2 – може регулюватися андрогеном у моделі клітинної лінії, похідною з легкого, хоча роль андрогену в фізіологічних умовах ще не вивчена. У пацієнтів із раком передміхурової залози андроген-деприваційна терапія може знизити рівень TMPRSS2 і частково захистити від SARS-CoV‑2. Другий можливий механізм полягає в імуномодулюючому ефекті андрогенів, який здатен пригнічувати противірусну імунну відповідь на SARS-CoV‑2. Зважаючи на той факт, що даназол залишається основним лікуванням САН у багатьох країнах, де препарати першої лінії недоступні, потенційна посилююча дія цього андрогену на перебіг COVID‑19 заслуговує на особливу увагу під час пандемії. Ми пропонуємо використовувати даназол з великою обережністю або навіть припинити його застосування в пацієнтів із САН у разі їх зараження COVID‑19.
Висновки
Ґрунтуючися на нових знаннях про потенційну участь контактної системи активації, системи комплементу, системи згортання і фібринолітичної системи, а також деяких цитокінів та Th17-клітин при інфікуванні SARS-CoV‑2, ми припускаємо, що САН може зіграти згубну роль у прогресуванні COVID‑19. Ба більше, COVID‑19 може погіршити наявний САН або спричинити його дебют у безсимптомних носіїв мутацій. Отже, пацієнтам із САН важливо вживати запобіжних заходів для зниження ймовірності зараження SARS-CoV‑2. Пацієнти із САН, які вже інфіковані, можуть мати високий ризик розвитку тяжкої форми COVID‑19 і загострення САН. Тому на час пандемії COVID‑19 ми пропонуємо подвійний підхід:
- пацієнтам із САН важливо проводити довгострокову медикаментозну профілактику нападів;
- пацієнти із САН мають бути забезпечені лікуванням гострих нападів та, за можливості, мати ці ліки при собі.
З огляду на ймовірний негативний вплив даназолу на COVID‑19, доцільно використовувати ліки, які заміщають C1-INH (Сінрайз®) або націлені на кінін-калікреїнову систему (перша лінія), зокрема ікатибант, екалантид, орланаделумаб у разі їх доступності. Терапевтичні стратегії, що їх використовують при САН, можуть бути застосовані у пацієнтів із COVID‑19. Наприклад, препарати, які впливають на кінін-калікреїнову систему, здатні принести користь як при САН, так і при COVID‑19, особливо в пацієнтів із ГРДС. Ми очікуємо подальших спостережень і експериментальних даних для перевірки цих взаємозв’язків.
Реферативний огляд статті Yingyang Xua et al. Does hereditary angioedema make COVID‑19 worse? World Allergy Organization Journal (2020) 13:100454
Підготувала Ірина Чумак
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 4 (53), 2020 р.