25 лютого, 2021
Бета-блокатори при COVID‑19: зменшення симпатичного овердрайву та його наслідків
Бета-блокатори (ББ) широко використовують у клінічній практиці для лікування артеріальної гіпертензії (АГ), ішемічної хвороби серця, серцевої недостатності та порушень серцевого ритму. Нещодавно отримано докази, що лікування ББ, порівняно з іншими антигіпертензивними препаратами (АГП), може полегшувати перебіг коронавірусної хвороби (COVID‑19). Імовірно, основним механізмом захисної дії ББ при COVID‑19 є зменшення надмірної активації симпатичної нервової системи (СНС) – т. зв. симпатичний овердрайв, з яким асоціюється сама інфекція. Крім того, ББ можуть перешкоджати потраплянню вірусу SARS-CoV‑2 до клітин, зменшувати цитокіновий шторм і запобігати розвитку аритмій. Деякі кардіоселективні ББ (наприклад, бісопролол) також здатні покращувати дихальну функцію.
ББ vs інші АГП при COVID‑19
АГ виступає обтяжувальним фактором перебігу COVID‑19 [1]. Існує думка, що це може бути зумовлено прийомом певних АГП [2]. Так, інгібітори ангіотензинперетворювального ферменту (ІАПФ) і блокатори рецепторів ангіотензину ІІ (БРА) збільшують кількість АПФ‑2 (рецептора, котрий SARS-CoV‑2 використовує для проникнення до клітин) на поверхні клітин і в такий спосіб можуть підвищувати ризик інфекції [2]; з іншого боку, АПФ‑2 шляхом зменшення ефектів ангіотензину ІІ також може захищати від тяжкого перебігу COVID‑19 [3]. Наразі не підтверджено, що ІАПФ і БРА збільшують ризик інфікування чи погіршують перебіг COVID‑19. Саме тому пацієнтам рекомендовано продовжувати приймати ці препарати, якщо вони були призначені раніше [4, 5].
Цікавим є порівняльний вплив АГП різних груп на перебіг COVID‑19. Такі дані отримано в нещодавно опублікованому дослідженні за участю пацієнтів із підтвердженим діагнозом COVID‑19 із 6 лікарень Мюнхена (Німеччина) та 4 медичних центрів Нідерландів [6].
Перебіг COVID‑19 вважали легким, якщо пацієнта виписували протягом 10 днів і він не перебував у відділенні інтенсивної терапії (ВІТ). Тяжкий перебіг визначали як будь-яке лікування у ВІТ або смерть.
У дослідженні взяли участь 880 пацієнтів, яких розподілили на групи тяжкого (n=415) та легкого перебігу (n=465). Загалом 414 (47%) хворих до госпіталізації отримували щонайменше один АГП. Виявилося, що гірший перебіг COVID‑19 спостерігався у хворих, які отримували блокатори кальцієвих каналів і (меншою мірою) діуретики чи ІАПФ. Застосування БРА було нейтральним; натомість лікування ББ асоціювалося зі значно легшим перебігом (рис. 1).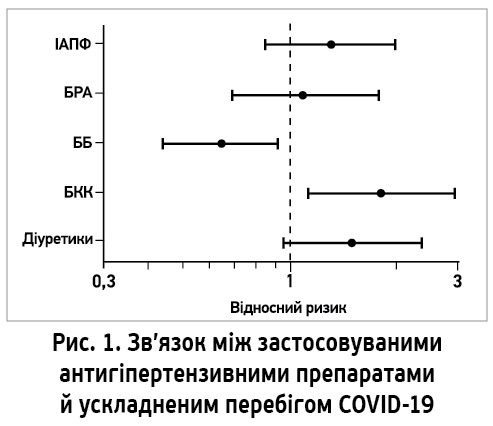
COVID‑19 і симпатичний овердрайв
1. Усі супутні захворювання, пов’язані з тяжчим перебігом і вищою летальністю COVID‑19, характеризуються симпатичним овердрайвом
Добре відомо, що підвищений симпатичний тонус асоціюється з хронічним обструктивним захворюванням легень (ХОЗЛ), синдромом обструктивного апное уві сні (СОАС), кардіоваскулярними захворюваннями (АГ, серцевою недостатністю), хворобами нирок і метаболічними розладами (діабетом, ожирінням, метаболічним синдромом) [7]. Основним механізмом стимуляції СНС при зазначених захворюваннях є підвищена периферична хемочутливість до гіпоксії [8-13], але можуть бути залучені й інші механізми.
ХОЗЛ і СОАС підвищують симпатичну активацію внаслідок хронічної інтермітувальної гіпоксії, що посилює периферичну хемочутливу відповідь [14, 15].
У разі серцевої недостатності підвищений тонус СНС зумовлений зниженим артеріальним і кардіопульмональним барорефлексом, підвищеними хемочутливістю та метаболічними рефлексами й корелює з прогресуванням і гіршим прогнозом захворювання [16-20].
Ураження нирок (наприклад, в експериментальних моделях ішемії-реперфузії) також асоціюється із симпатичним овердрайвом через активацію ниркових аферентних нервових закінчень і ренін-ангіотензинової системи [21].
Симпатичний овердрайв у разі ожиріння, цукрового діабету та метаболічного синдрому пов’язаний із високими рівнями інсуліну та лептину, що стимулюють СНС на центральному й периферичному рівнях, та/або хронічною інтермітувальною гіпоксією внаслідок СОАС [22, 23]. Надмірна симпатична активація, своєю чергою, погіршує інсулінорезистентність, що підтримує хибне коло [24].
У перших епідеміологічних дослідженнях повідомлялося про неочікувано низьку поширеність куріння серед госпіталізованих пацієнтів із COVID‑19 [25]. Згодом було доведено, що куріння асоціюється з вищою ймовірністю захворіти на COVID‑19, тяжчим перебігом і тяжчими наслідками інфекції [26, 27]. Потенційна роль автономних ефектів також заслуговує на увагу, оскільки куріння підвищує симпатичний тонус і знижує барорефлекторну активність [28-32].
2. Симпатичний овердрайв може негативно впливати на перебіг COVID‑19
У пацієнтів із коронавірусною інфекцією підвищення симпатичної активності, зумовлене супутніми захворюваннями, може погіршувати легеневий, кардіоваскулярний, нирковий, метаболічний та імунно-запальний гомеостаз.
Кардіоваскулярні ускладнення COVID‑19 (аритмії, міокардит, серцева недостатність й інфаркт міокарда) розвиваються досить часто [33]. Перелічені стани погіршуються внаслідок симпатичного овердрайву, що може пояснювати підвищення смертності від COVID‑19 унаслідок активації СНС [7].
Пошкодження міокарда, за різними даними, спостерігається у 20-40% госпіталізованих пацієнтів із COVID‑19 [34-37]. Також описані випадки синдрому такоцубо (від япон. такоцубо – пастка для восьминога) – стресової кардіоміопатії, за якої пошкодження міокарда опосередковується катехоламін-індукованим судинним спазмом та/або безпосередньою дією катехоламінів на міоцити [38-41]. Вважають, що при синдромі такоцубо в разі COVID‑19 провідну роль відіграє вивільнення катехоламінів у відповідь на цитокіновий шторм та/або метаболічний і емоційний дистрес [38-41].
Гостре пошкодження нирок визначають у >20% тяжких або летальних випадків COVID‑19, що також пов’язують із надмірною симпатичною активацією [42]. Автономна нервова система має модулювальний вплив на імунну систему; її потенційна роль у забезпеченні імунної відповіді при COVID‑19 іще вивчається. Симпатичні волокна іннервують більшість лімфатичних органів (включно з кістковим мозком) [43], а адренергічні рецептори присутні на багатьох типах імунних клітин [44]. Вплив СНС на імунну систему є досить комплексним і залежить від стану диференціації імунних клітин. Утім, є докази прозапального ефекту активації СНС, отримані в експериментальних дослідженнях. Стимуляція блукального нерва забезпечувала зворотний протизапальний вплив. Імунно-запальні ефекти симпатико-парасимпатичного дисбалансу можуть брати участь у формуванні цитокінового шторму при COVID‑19 [7].
Окрім того, підвищена симпатична активність може чинити специфічний негативний вплив на дихальну систему. Відомо, що симпатичний овердрайв відіграє провідну роль у прогресуванні легеневої гіпертензії [45-47]. Також установлено, що симпатична стимуляція підвищує проникність легеневих капілярів і спричиняє розвиток гострого респіраторного дистрес-синдрому (ГРДС) [48-51]. У разі серцевої недостатності підвищена активність симпатичних нервів зменшує легеневу функцію, ймовірно, внаслідок інтерстиційного набряку легень [52].
3. Старіння та чоловіча стать також пов’язані із симпатичною активацією
Ризик тяжкого перебігу та смерті від COVID‑19 є вищим у пацієнтів похилого віку, а також у чоловіків (так само, як і симпатична активація). Встановлено, що м’язова симпатична нервова активність підвищується з віком як у чоловіків, так і в жінок, але в останніх у віці <50 років вона є дещо нижчою [53]. Як і в жінок, у дітей COVID‑19 також має легший перебіг; очевидно, в цьому залучено декілька механізмів (зміни імунітету, що розвивається; нижча поширеність супутніх захворювань, вищий регенеративний потенціал легень), але не можна виключити й потенційну роль доволі складного симпатико-парасимпатичного балансу. Наприклад, рівень норадреналіну в плазмі, переважним джерелом якого є симпатичні нервові закінчення, підвищується з настанням статевого дозрівання в хлопчиків [54]. Також існують гендерні відмінності симпатичної активності, пов’язані з ожирінням. Наприклад, м’язова симпатична нервова активність у спокої позитивно корелює з індексом маси тіла в чоловіків, але не в жінок [55, 56]. Ця відмінність частково пояснюється тим, що симпатичний овердрайв більшою мірою залежить від абдомінального жиру, ніж від підшкірного. Отже, підвищена симпатична активація може (принаймні частково) пояснювати патофізіологічний зв’язок між старінням і чоловічою статтю, з одного боку, та тяжчим перебігом і вищою смертністю від COVID‑19 – з іншого.
4. COVID‑19 може підвищувати симпатичний овердрайв із формуванням зачарованого кола
СНС активується гіпоксичними та гіперкапнічними стимулами, характерними для дихальної дисфункції. Зокрема, доведено, що хронічна інтермітувальна гіпоксія збільшує симпатичну активність шляхом підвищення чутливості каротидних тілець. Зміни дихальної функції, спричинені COVID‑19, можуть посилювати надмірну симпатичну активність (рис. 2) [7].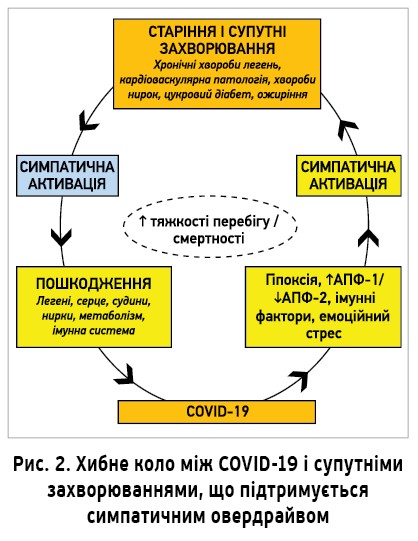
COVID‑19 також може активувати СНС унаслідок підвищення продукції та вивільнення ангіотензину ІІ. Клітинний рецептор для входу до клітини для вірусів SARS-CoV і SARS-CoV‑2 – АПФ‑2, який у нормі є мембранним гомологом АПФ. АПФ‑2 широко представлений не лише в легенях, а й в інших органах, зокрема в серці, головному мозку, нирках і кишечнику. АПФ‑1 і АПФ‑2 мають різні ензиматичні функції та чинять різні ефекти: АПФ‑1 конвертує ангіотензин І в ангіотензин ІІ; АПФ‑2 перетворює ангіотензин І на ангіотензин(1-9), який згодом конвертується в ангіотензин(1-7), і також може перетворювати ангіотензин ІІ на ангіотензин(1-7). Ангіотензин ІІ опосередковує вазоконстрикцію, фіброз, гіпертрофію та запалення, а також підвищує симпатичний тонус; натомість ангіотензин(1-7) забезпечує вазодилатацію, зменшує фіброз і гіперплазію, чинить протизапальний ефект і зменшує активність СНС [7].
Отже, всі супутні захворювання, асоційовані з тяжчим перебігом і смертністю від COVID‑19 (так само як старший вік і чоловіча стать), характеризуються надмірною активацією СНС. У пацієнтів із COVID‑19 симпатичний овердрайв може зумовлювати ускладнення через негативний вплив на легені, серце, судини, нирки, метаболізм та імунну систему. Своєю чергою, COVID‑19 може підвищувати симпатичну активність унаслідок зміни газового складу крові (інтермітувальні гіпоксія й гіперкапнія), дисбалансу АПФ‑1/АПФ‑2 і вивільнення цитокінів. Симпатичний овердрайв може бути механізмом формування хибного кола між COVID‑19 і супутніми захворюваннями, а розірвати його допомагають ББ.
Інші потенційні механізми захисної дії ББ при COVID‑19
У пацієнтів із COVID‑19 розвивається пневмонія, що в тяжких випадках може ускладнюватися ГРДС, дихальною недостатністю й септичним шоком [58]. Нещодавні дослідження свідчать, що ББ знижують смертність пацієнтів із септичним шоком [59], покращують прогноз при ГРДС і дихальній недостатності [60, 61]. Шляхом інгібіторної дії на СНС ББ зменшують вивільнення реніну в нирках. Своєю чергою, зниження рівня реніну пригнічує активність обох ланок ренін-ангіотензин-альдостеронової системи (РААС) і зменшує представленість рецепторів АПФ на поверхні клітин, що запобігає потраплянню вірусу SARS-CoV‑2 до клітин (рис. 3) [62].
 Рис. 3. Ефекти ББ на РААС і COVID‑19
Рис. 3. Ефекти ББ на РААС і COVID‑19
Шляхом інгібіторної дії на СНС ББ зменшують вивільнення реніну юкстагломерулярними клітинами в нирках; зниження рівня реніну зменшує активність обох гілок РААС і кількість АПФ-2 (А).
Зменшення кількості АПФ-2 заважає потраплянню SARS-CoV‑2 у клітини, а отже, знижує вірусну інфекційність (Б).
Кардіоселективні ББ можуть покращувати легеневу функцію. У дослідженні за участю пацієнтів із ХОЗЛ і серцевою недостатністю порівнювали бісопролол, метопролол і карведилол. Після 6 тиж лікування об’єм форсованого видиху за 1-шу секунду (ОФВ1) був найнижчим у групі карведилолу та найвищим у групі бісопрололу [63]. В іншому рандомізованому контрольованому дослідженні з порівняння бісопрололу й карведилолу в схожій популяції пацієнтів спостерігали значне (приблизно на 138 мл) покращення ОФВ1 у групі бісопрололу, але не в групі карведилолу [64]. Аналіз підгруп пацієнтів (n=2712), яким протягом 4 років періодично виконували спірометрію, продемонстрував відсутність негативного впливу на ОФВ1 та форсовану життєву ємність при довгостроковому лікуванні ББ, при цьому 88% пацієнтів отримували кардіоселективні препарати [65]. Отже, застосування кардіоселективних ББ не погіршує легеневу функцію, а бісопролол навіть може її покращувати. Утім, слід зазначити: за останніми даними, головним механізмом гіпоксемії та ГРДС при COVID-19 є вазодилатація легеневих капілярів [66, 67]. Через це небезпечним може бути призначення кардіоселективного ББ небівололу, котрий, крім системного судинорозширювального ефекту, також спричиняє вазодилатацію в легенях [68, 69] і в такий спосіб може погіршувати гіпоксемію та призводити до тяжчого ГРДС при COVID-19.
На початку пандемії протоколи лікування COVID‑19 передбачали застосування гідроксихлорохіну й азитроміцину [70, 71]. Згодом виявилося, що ці препарати підвищують ризик пролонгації інтервалу QT із подальшим розвитком життєзагрозливих шлуночкових аритмій [72]. Подовжувати QT можуть також противірусні препарати, як-от лопінавір, ритонавір і ремдесивір [73]. Останні дослідження свідчать, що й сама COVID‑19 є фактором розвитку синдрому подовженого QT (long QT syndrome, LQTS) і серцевих аритмій унаслідок гострого пошкодження міокарда, гіпоксії, метаболічних порушень, нейрогуморального й катехоламінергічного стресу, тяжкого системного запалення при гострій віремії [74]. Крім того, одним із важливих тригерів аритмії є підвищення симпатичного тонусу, котрому можуть запобігти ББ [75]. На додаток до позитивних тропних ефектів у відповідь на фізіологічні й патологічні стресори β-адренергічна стимуляція впливає на серцеву електрофізіологію та спричиняє порушення серцевого ритму (аж до фатальних аритмій) [76]. Препаратом вибору при LQTS може бути бісопролол [76].
Практичні міркування
Роль симпатичного овердрайву в патогенезі COVID‑19 і супутніх захворювань, потенційна здатність ББ знижувати вірусне навантаження шляхом запобігання потраплянню SARS-CoV‑2 до клітин, зменшувати цитокіновий шторм, аритмічні й інші ускладнення обґрунтовують застосування ББ у лікуванні COVID‑19, що вже було запропоновано багатьма авторами. В умовах пандемії COVID‑19 загострилася проблема тривожних розладів [77], тому доречним також буде потужний анксіолітичний ефект ББ [78]. Звісно, офіційні рекомендації потребують проведення відповідних досліджень. У всякому разі пацієнти, котрі вже приймають ББ за іншими показаннями та належать до групи ризику тяжкого перебігу COVID‑19, із високою ймовірністю можуть отримати додаткову користь від ББ, а лікарі, котрі обирають між різними АГП для старту чи інтенсифікації антигіпертензивної терапії, мають іще один аргумент на користь ББ.
ББ – неоднорідна група препаратів, які відрізняються за селективністю до β1-адренорецепторів, впливом на α-адренорецептори, наявністю чи відсутністю внутрішньої симпатоміметичної активності тощо. У пацієнтів із кардіоваскулярними захворюваннями корисні ефекти ББ забезпечуються блокадою β1-рецепторів, а багато з небажаних реакцій зумовлені блокадою β2-рецепторів [79]. Ось чому застосування β1-селективного (або кардіоселективного) ББ бісопрололу характеризується нижчим ризиком побічних ефектів (включно з бронхоконстрикцією). Запобігання останній є дуже важливим у пацієнтів із COVID‑19 з огляду на патогенез інфекції, а також на те, що бронхообструктивні стани, як-от ХОЗЛ, є фактором ризику тяжчого перебігу COVID‑19 [80].
Головним нейротрансмітером СНС є норадреналін [81], який має вищу афінність до β1-рецепторів порівняно з іншими β-рецепторами [82]. Отже, призначення ББ із метою зменшення симпатичного овердрайву передбачає вплив саме на β1-рецептори. Порівняно з іншими представниками класу високу β1-селективність має бісопролол [83], завдяки чому деякі автори вважають його препаратом вибору для лікування серцево-судинної патології в пацієнтів із COVID‑19 [76].
Список літератури знаходиться в редакції.
UA-CONCO-00001
Медична газета «Здоров’я України 21 сторіччя» № 2 (495), 2021 р.




