20 липня, 2021
Коінфекції та вторинні легеневі інфекції в пацієнтів із COVID-19: складнощі діагностики й лікування
Пандемія коронавірусної хвороби (СOVID-19) зумовлює виникнення великої кількості випадків коінфекцій із широким різноманіттям патогенів. Наразі виявляється й описується лише незначна частка коінфекцій у разі COVID-19. Така ситуація спричинена обмеженими можливостями доступних методів діагностики, що не завжди можуть підтвердити наявність живого патогена та схильні до значної варіабельності лабораторних даних. Водночас приєднання вторинних бактеріальних інфекцій значно погіршує стан пацієнта та підвищує ризик несприятливого перебігу COVID-19, особливо її тяжких форм. Покращити ситуацію може вчасна діагностика бактеріальних ускладнень і призначення адекватної антибіотикотерапії.
Механізми активації бактеріальної мікрофлори при вірусних інфекціях дихальних шляхів
Вірусні інфекції спричиняють бактеріальну колонізацію дихальних шляхів за допомогою різних механізмів. За даними Bakaletz (2017), вірусна інфекція залежно від збудника може зумовлювати гістологічні та функціональні зміни дихальних шляхів, включаючи ушкодження епітелію, втрату клітин, гіперплазію келихоподібних клітин, порушення секреції слизу, зниження мукоциліарного кліренсу, порушення синтезу сурфактанта, зниження поглинання кисню. Перелічені зміни призводять до порушення клітинного й гуморального факторів імунітету, спричиняючи загальну імуносупресію, котра, своєю чергою, зумовлює зміни мікробіому зі збільшенням кількості бактеріальних патогенів і призводить до вивільнення бактерій із біоплівок (Golda A. et al., 2011).
Вірусні інфекції верхніх дихальних шляхів асоційовані зі зростанням чисельності нормальної бактеріальної мікрофлори, збільшують ризик розвитку вторинних бактеріальних інфекцій середнього вуха, синусів і респіраторного тракту. Виникнення вторинних інфекцій у пацієнтів із COVID‑19 на тлі наявного вірус-індукованого запалення є очікуваним, але частота таких ускладнень може бути різною. Підвищує ймовірність виникнення вторинної бактеріальної інфекції використання стероїдів та/або імуномодулювальних препаратів (Tesoriero J. M. et al., 2021).
Тяжчий перебіг хвороби збільшує ймовірність використання інвазивних методів лікування та моніторингу, а також штучної вентиляції легень, що знову-таки підвищує ризик розвитку вторинних бактеріальних інфекцій.
У нещодавній публікації N. Cimolai, дослідивши проблемні питання діагностики та перебігу супутніх із SARS-CoV‑2 інфекцій, дійшов висновку, що ранній етап коронавірусної інфекції асоційований здебільшого з бактеріальними патогенами, які є типовими представниками мікробіому дихальної системи. Пізні коінфекції, особливо в пацієнтів із тяжким перебігом COVID‑19, частіше спричиняються нозокоміальними чи опортуністичними патогенами. Як і передбачалося, лікування в умовах стаціонара асоціюється з ризиком інфікування мультирезистентними бактеріями. Загалом ідентифікація копатогенів була пов’язана з тривалішим перебуванням у стаціонарі, тяжкістю перебігу захворювання та несприятливими подіями.
Поширеність бактеріальної коінфекції в пацієнтів із COVID‑19
Дані про частоту, мікробіологічний склад і наслідки інфекційних ускладнень COVID‑19 є обмеженими. Нижче подаємо огляд публікацій, які ставили собі за мету дослідити наявні дані щодо особливостей перебігу ко- та суперінфекцій у разі COVID‑19.
Chong і співавт. (2020) виконали огляд досліджень, у яких було описано підтверджені культуральним методом випадки вторинних бактеріальних і грибкових інфекцій, які виникли протягом 48 год після надходження пацієнта з COVID‑19 у стаціонар. Критерієм виключення було визначення супутнього патогена під час госпіталізації пацієнтів із коронавірусною інфекцією.
Огляд базувався на даних 28 обсерваційних досліджень (n=5047), 78,6% з яких були ретроспективними, а 21,4% – проспективними. Частота вторинних бактеріальних інфекцій серед госпіталізованих пацієнтів становила 16% (580/3633) і коливалася в межах 4,8-42,8% згідно з даними 14 досліджень. Частота вторинних грибкових інфекцій становила 6,3% (171/2703) і коливалася в межах 0,9-33,3% у 18 обсерваційних дослідженнях.
Переважна більшість пацієнтів, у яких розвинулася вторинна бактеріальна чи грибкова інфекція, мали тяжкий перебіг COVID‑19 і потребували штучної вентиляції легень і лікування в умовах відділення інтенсивної терапії.
За даними 24 обсерваційних досліджень, у посівах із верхніх дихальних шляхів найчастіше виділяли такі бактеріальні збудники: Pseudomonas aeruginosa – 21,1% (75/355), Klebsiella species – 17,2% (61/355), Staphylococcus aureus – 13,5% (48/355), Escherichia coli – 10,4% (37/355), Stenotrophomonas maltophilia – 3,1% (11/355). Грибкові мікроорганізми були здебільшого представлені родом Aspergillus; у всіх дослідженнях найчастіше виявляли A. fumigatus, але траплялися й A. favus, A. calidoustus, A. citrinoterreus, A. niger, A. terreus, A. versicolor. В обсерваційному дослідженні, проведеному Fekkar і співавт., було описано рідкісні знахідки: в посівах із верхніх дихальних шляхів пацієнтів із надтяжким перебігом COVID‑19 виявлено гриби роду Mucor, а також Fusarium proliferatum (Menon A. A. et al., 2020; Blanco J. L. et al., 2020; Mang S. et al., 2020).
Середній час встановлення діагнозу вторинної бактеріальної та грибкової інфекції від моменту госпіталізації дорівнював 10 (від 2 до 21) та 9 (від 4 до 18) діб відповідно. Емпірична антибіотикотерапія застосовувалася в 60-100% випадків. У більшості обсерваційних досліджень відсутні дані щодо антибіотикорезистентності виявлених патогенів; однак у деяких публікаціях було описано виявлення в культурах верхніх дихальних шляхів і крові критичних хворих на COVID‑19 таких мультирезистентних мікроорганізмів, як Klebsiella pneumoniae, що виробляє β-лактамазу розширеного спектра (ESBL); ESBL E. coli; мультирезистентна P. aeruginosa; резистентна до карбапенемів K. pneumoniae; а також резистентна до метициліну S. aureus (MRSA) (Garcia-Vidal C. et al., 2020; Yang Y. et al., 2020; Barrasa H. et al., 2020).
Метою систематичного огляду й метааналізу Musuuza та співавт. (2021) було вивчення частоти інфекційних ускладнень та особливостей їхнього перебігу в пацієнтів із COVID‑19. У цій публікації використано дані 118 досліджень, які описували клінічні ознаки та наслідки коінфекцій і суперінфекцій (SARS-CoV‑2 + інші патогенні організми) в госпіталізованих та амбулаторних хворих.
Сукупна частота коінфекцій становила 19% (95% довірчий інтервал (ДІ) 14-25%), суперінфекцій – 24% (95% ДІ 19-30%). Щодо типів патогенів, то вони розподілилися так: вірусні коінфекції – 10% (95% ДІ 6-14%), вірусні суперінфекції – 4% (95% ДІ 0-10%), бактеріальні коінфекції – 8% (95% ДІ 5-11%), бактеріальні суперінфекції – 20% (95% ДІ 13-28%), грибкові коінфекції – 4% (95% ДІ 2-7%), грибкові суперінфекції – 8% (95% ДІ 4-13%).
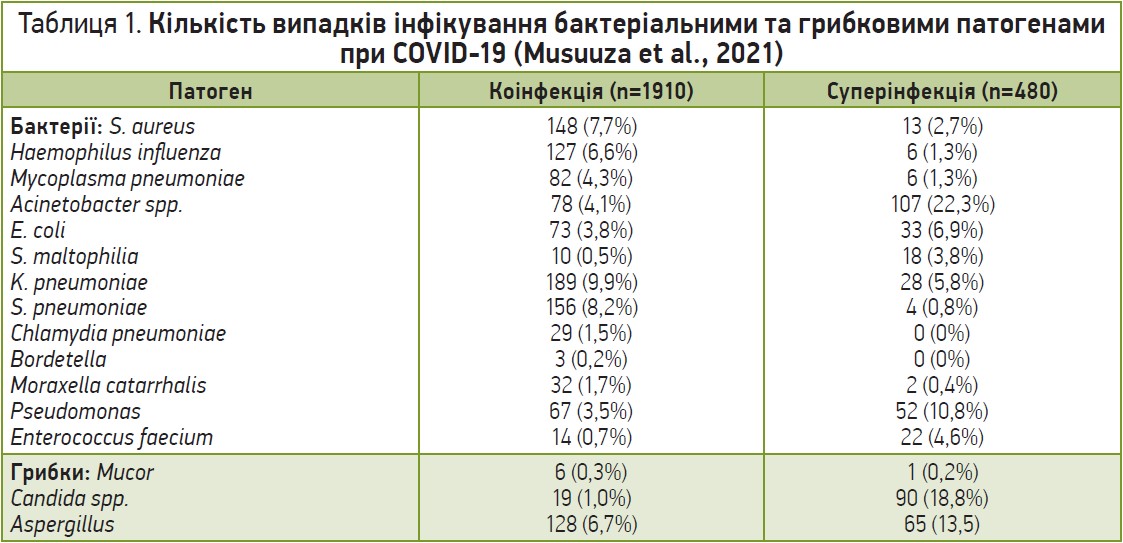
У 78 дослідженнях були наявні дані про специфічні мікроорганізми, асоційовані з ко- та суперінфекціями у хворих на COVID‑19 (табл. 1). Трьома найчастішими патогенними бактеріями серед пацієнтів із коінфекціями були K. pneumoniae (9,9%), Streptococcus pneumoniae (8,2%) та S. aureus (7,7%); найчастішими грибками, що спричиняли коінфекції, були представники роду Aspergillus. Серед пацієнтів із суперінфекціями найчастіше виділяли такі бактерії, як Acinetobacter spp. (22,0%), Pseudomonas (10,8%), E. coli (6,9%), а також грибки роду Candida (18,8%).
Загальна частота коморбідних станів серед учасників становила 42% (95% ДI 35-49%). У пацієнтів із коінфекціями коморбідні стани траплялись у 32% випадків (95% ДI 24-41%); в осіб із суперінфекціями коморбідність була наявна в 54% (95% ДI 42-65%).
Порівняно з пацієнтами, що були інфіковані лише SARS-CoV‑2, хворі з коінфекціями та суперінфекціями мали вищу смертність (співвідношення шансів 3,31; 95% ДІ 1,82-5,99). Пацієнти з коінфекціями в середньому мали більшу тривалість госпіталізації, тоді як особи із суперінфекціями частіше потребували штучної вентиляції легень і довше перебували на ній (Buehler, Zinkernagel et al., 2021).
Діагностика бактеріальних ускладнень у разі COVID‑19
Діагностика бактеріальних ускладнень у пацієнтів, інфікованих SARS-CoV‑2, пов’язана з певними труднощами. У зв’язку з перевантаженням відділень, а також із метою мінімізації генерування аерозолів і поширення інфекції посіви (харкотиння, крові тощо) та бронхоскопічні дослідження лікарі виконують досить рідко.
Крім того, клінічна підозра на бактеріальну пневмонію при COVID‑19 проблематична через феномен перекриття багатьох загальних і респіраторних симптомів, як-от гарячка, слабкість, кашель, задишка. Рентгенологічні зміни також не дають змоги відрізнити вірусний пневмоніт від вторинної бактеріальної пневмонії.
Запідозрити наявність бактеріальної інфекції можна за умови підвищення рівня прокальцитоніну та його динамічного зростання в часі, збільшення частки нейтрофілів (табл. 2). Утім, вирішальне значення має посів харкотиння, а також визначення чутливості висіяного збудника до антибіотиків.
Вибір антибіотика за підозри на бактеріальну коінфекцію
Згідно з наказом Міністерства охорони здоров’я України від 07.01.2021 «Про внесення змін до протоколу «Надання медичної допомоги для лікування коронавірусної хвороби (COVID‑19)» на сьогодні маємо такі рекомендації щодо використання антибіотиків:
- показанням до емпіричної антибактеріальної терапії у хворих на COVID‑19 є приєднання бактеріальної коінфекції та/або суперінфекція (бактеріальна негоспітальна пневмонія, вентилятор-асоційована пневмонія, інфекція сечовивідних шляхів, сепсис, септичний шок тощо). Бактеріальна коінфекція та/або суперінфекція спостерігаються менш ніж у 8-10% пацієнтів із COVID‑19. Пацієнти, які перебувають у палатах інтенсивної терапії, мають вищу ймовірність бактеріальної коінфекції та/або суперінфекції порівняно з пацієнтами в інших відділеннях;
- недоцільне застосування антибіотикотерапії може призвести до розвитку бактеріальної резистентності й інфекції Clostridioides difficile;
- у разі підозрюваної чи підтвердженої COVID‑19 із легким перебігом не призначати антибіотики з лікувальною чи профілактичною метою;
- у переважній більшості випадків призначення антибактеріальних препаратів амбулаторним пацієнтам є недоцільним.
Якщо наявне приєднання бактеріальної інфекції, то в цьому випадку можна використовувати антибіотики. Вибір антибактеріальної терапії має ґрунтуватися на етіологічному чиннику та, якщо змога, передбачати перехід із парентеральної форми введення на пероральну. Тривалість емпіричної антибактеріальної терапії має бути скорочена до мінімально прийнятного терміну (3-7 днів) із наступним призначенням етіологічно спрямованої антибактеріальної терапії після отримання результатів бактеріологічного дослідження та з урахуванням динаміки клінічного стану пацієнта.
У разі легкого перебігу захворювання перевагу варто віддавати монотерапії захищеними пеніцилінами, макролідами або цефалоспоринами ІІ покоління.
За середньотяжкого перебігу доцільне поєднання захищених пеніцилінів або цефалоспоринів ІІ-ІІІ покоління і макролідів. У разі алергії на β-лактами можна використовувати респіраторні фторхінолони.
На вітчизняному ринку відомим представником цефалоспоринів III покоління є препарат Сорцеф® (цефіксим), респіраторних фторхінолонів – Тімоксі® (моксифлоксацин) виробництва компанії «Алкалоїд АД Скоп’є» (Македонія). Слід зазначити, що Сорцеф® ефективний щодо більшості патогенів бактеріальних коінфекцій, які часто трапляються при COVID‑19, зокрема S. pneumoniae, H. influenzae, M. catarrhalis, Enterobacter spp., Klebsiella spp. та E. coli. Крім пневмонії, він показаний за інфекцій верхніх дихальних шляхів, ЛОР-органів, сечостатевої системи. Порівняно з іншими парентеральними цефалоспоринами III покоління Сорцеф® має ширший спектр протимікробної дії; високу активність до мікроорганізмів, резистентних до β-лактамаз; низький відсоток побічних реакцій. Пероральна форма препарату Сорцеф® дає можливість широко застосовувати його в схемах ступінчастої терапії. У разі прийому Сорцеф® у таблетованій формі відбувається швидке, незалежне від прийому їжі, всмоктування препарату з досягненням пікової концентрації в плазмі крові через 4 год. Пролонгований період напіввиведення дає змогу використовувати Сорцеф® 1 раз на добу.
Тімоксі® є респіраторним фторхінолоном IV покоління з бактерицидною дією. Препарат накопичується в тканинах і клітинах-мішенях (слизова оболонка бронхів, бронхіальний секрет, альвеолярні макрофаги) в концентраціях, які значно перевищують мінімально пригнічувальні рівні та концентрацію в плазмі крові. Саме це забезпечує високий рівень ерадикації внутрішньоклітинних атипових збудників, які часто спричиняють бактеріальні коінфекції у хворих на COVID‑19 (Lansbury L. et al., 2020). Іншими особливостями Тімоксі® є активність щодо 97% усіх відомих анаеробів, що значно перевищує активність інших фторхінолонів, а також висока терапевтична ефективність щодо бактерій, резистентних до β-лактамних і макролідних антибіотиків.
Допоміжна терапія
Безперечно, лікування інфекційних захворювань нижніх дихальних шляхів доцільно доповнити ефективним мукорегуляторним засобом, оскільки утворення та накопичення в’язкого мокротиння одночасно з пригніченням мукоциліарного кліренсу зумовлюють подальше прогресування запальних змін. Ефективним секретолітичним препаратом є Бронлес, до складу якого входить карбоцистеїн. Мукорегуляторний ефект карбоцистеїну пов’язаний з активацією сіалової трансферази – ферменту келихоподібних клітин слизової оболонки бронхів. Карбоцистеїн нормалізує кількісне співвідношення кислих і нейтральних сіаломуцинів бронхіального секрету, відновлює його в’язкість та еластичність, активізує діяльність миготливого епітелію й покращує мукоциліарний кліренс. Окрім того, карбоцистеїн сприяє регенерації слизової оболонки дихальних шляхів, нормалізує її структуру, зменшує гіперплазію келихоподібних клітин і продукування слизу, виявляє протизапальний ефект за рахунок кінін-інгібувальної активності сіаломуцинів, що забезпечує зменшення набряку та бронхообструкції.
Отже, бактеріальні коінфекції в пацієнтів із COVID-19 можуть бути серйозним ускладненням, особливо за тяжкого перебігу коронавірусної хвороби. Тому лікарям слід пам’ятати про можливість приєднання бактеріальної інфекції та вчасно реагувати за підозри на її розвиток. У разі легкого перебігу захворювання перевагу варто віддавати монотерапії захищеними пеніцилінами. При середньотяжкому перебігу COVID-19 виправданим є призначення цефалоспоринів ІІ-ІІІ покоління чи респіраторних фторхінолонів (за поганої переносимості β-лактамів).
Підготувала Ганна Гаврюшенко
Медична газета «Здоров’я України 21 сторіччя» № 11-12 (504-505), 2021 р.