18 січня, 2022
Антикоагулянтна терапія венозних тромбоемболій: у фокусі едоксабан
Тромбоемболія легеневої артерії (ТЕЛА) – це оклюзія основного стовбура чи гілок легеневої артерії частинами тромбу, які формуються у венах великого кола кровообігу чи порожнинах правих відділів серця і переносяться в мале коло кровообігу із плином крові. Венозний тромбоз будь-якої локалізації може ускладнитися розвитком ТЕЛА. Найбільшу загрозу становить басейн нижньої порожнистої вени, із тромбоутворенням у якому пов’язано близько 90% всіх епізодів ТЕЛА. Часта причина ТЕЛА (70%) – гострий тромбоз вен ілеофеморального сегмента та проксимальних відділів глибоких вен нижніх кінцівок, тому тромбоз глибоких вен (ТГВ) нижніх кінцівок і ТЕЛА розглядають як єдиний синдром, який отримав назву «венозний тромбоемболізм», або «венозні тромбоемболії» (ВТЕ).
За даними епідеміологічних досліджень, поширеність ВТЕ становить 1‑2 випадки на 1 тис. населення за рік, при цьому в ТГВ вона дещо вища, ніж у ТЕЛА [1]. На жаль, ТЕЛА була і лишається дуже загрозливим станом. Щорічно від ТЕЛА помирає понад 500 тис. людей у країнах ЄС та близько 300 тис. хворих у США [1, 2].
Незважаючи на відзначену останнім часом тенденцію до зниження, госпітальна летальність при цьому захворюванні досі на високому рівні – у межах від 8 до 12%. Окрім ТЕЛА, ще одним грізним ускладненням ТГВ є посттромбофлебітичний синдром, який суттєво обмежує якість життя пацієнтів, а у складних випадках може стати причиною ампутації кінцівки або смерті.
Ключові принципи лікування ВТЕ
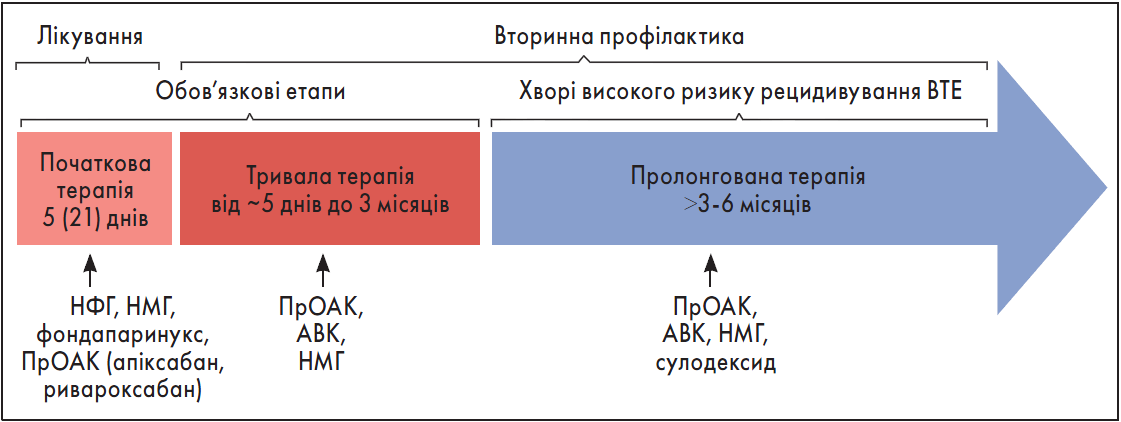
Основою лікування ВТЕ є антикоагулянтна терапія (АКТ), яку слід починати якомога раніше ще на етапі діагностики (тільки при підозрі на ВТЕ) і проводити щонайменше протягом трьох місяців (за відсутності протипоказань) [3]. АКТ має декілька етапів. Початковий (або лікувальний) триває залежно від обраного антикоагулянту від 5 до 21 дня. На цій стадії можуть застосовуватися парентеральні препарати або ж прямі оральні антикоагулянти (ПрОАК) ривароксабан чи апіксабан у терапевтичних дозах. Подальша АКТ спрямована на профілактику повторних ВТЕ. Вона включає обов’язковий для всіх пацієнтів етап тривалої терапії (до трьох місяців) та у деяких хворих – пролонгованого лікування (рисунок).
Рисунок. Фази антикоагулянтної терапії при ВТЕ
Примітки: НФГ – нефракціонований гепарин; НМГ – низькомолекулярний гепарин; ПрОАК – апіксабан, дабігатран, едоксабан, ривароксабан; АВК – варфарин, аценокумарол тощо.
У більшості пацієнтів із ТЕЛА на етапах діагностичного пошуку і первинної оцінки ступеня тяжкості захворювання доцільно призначати парентеральну АКТ. Препаратами вибору на цьому початковому етапі є низькомолекулярні гепарини (НМГ) або фондапаринукс у лікувальних дозах [4, 5]. У хворих на ТЕЛА високого ризику пріоритетним вважається застосування внутрішньовенного нефракціонованого гепарину (НФГ) під контролем активованого тромбопластинового часу, а НМГ розглядають як альтернативні препарати.
Після лікувального парентерального етапу, тривалість якого становить у середньому 5‑7 днів, більшість пацієнтів переводять на приймання пероральних антикоагулянтів. ПрОАК (апіксабан, дабігатран, едоксабан, ривароксабан) є препаратами вибору для даної фази терапії. Вони мають порівнянну з варфарином ефективність щодо попереджання повторних ВТЕ та смерті, але асоційовані з суттєво (приблизно на 40%) нижчим ризиком геморагічних ускладнень [6]. Тому антагоністи вітаміну К (АВК) для вторинної профілактики ВТЕ на даний час перейшли у категорію препаратів другої лінії.
Якщо все ж таки прийняте рішення призначити АВК, лікування слід починати паралельно з іншим антикоагулянтом (НМГ, ПрОАК тощо), відміна якого можлива тільки після досягнення міжнародного нормалізованого відношення (МНВ) у межах 2,0‑3,0 протягом принаймні двох днів поспіль. Подальша терапія АВК вважається ефективною та безпечною, лише якщо понад 70% вимірювань МНВ знаходяться у вказаному інтервалі.
Іноді може виникати потреба у подовженні застосування антикоагулянтів протягом більш ніж трьох місяців (пролонгована фаза терапії). Таке рішення приймають на підставі оцінки тромботичних та геморагічних ризиків для кожного конкретного пацієнта. Надалі доцільність призначення АКТ слід визначати що 3‑4 місяці [3].
Отже, препаратами вибору для вторинної профілактики ВТЕ (крім вагітних та деяких пацієнтів зі злоякісними новоутвореннями, особливо шлунково-кишкового тракту [ШКТ]) є ПрОАК. У межах клінічних дослідженнь були протестовані такі препарати, як:
- прямий інгібітор тромбіну дабігатран;
- блокатори Ха-фактора апіксабан, едоксабан та ривароксабан.
Зважаючи на передбачувану біодоступність та фармакокінетику цих ліків, ПрОАК можуть призначатися у фіксованих дозах та не потребують лабораторного контролю. Додатковими перевагами цих препаратів є швидкий початок/припинення дії та менш значуща взаємодія з іншими медикаментами і продуктами харчування, ніж у АВК.
Лікарі в Україні вже мали можливість впевнитися в ефективності та безпеці трьох ПрОАК апіксабану, дабігатрану й ривароксабану, які за останні 5‑6 років стали основою терапії та вторинної профілактики ВТЕ. Цьогоріч був зареєстрований ще один ПрОАК едоксабан. Які ж особливості та переваги цього препарату в осіб із ВТЕ?
Едоксабан, як і ривароксабан та апіксабан, є селективним прямим інгібітором активованого Ха-фактора згортання крові, на відміну від дабігатрану, який селективно пригнічує IIa-фактор (тромбін). Інгібування фактора Ха в каскаді згортання крові приводить до зменшення утворення тромбіну, а отже – формування та прогресування тромбів.
Пікові концентрації у плазмі крові досягаються через 1‑2 год після перорального приймання едоксабану. Біодоступність препарату становить приблизно 62%. На відміну від ривароксабану, приймання їжі суттєво не впливає на фармакокінетику едоксабану. У плазмі едоксабан циркулює переважно у незміненій формі, кількість метаболітів є мінімальною. Біля половини від прийнятої дози препарату виводиться із сечею, інша половина – через кишечник. Понад 70% едоксабану елімінує у незміненому вигляді, при цьому період напіввиведення становить 10‑14 год [7].
Порушення функції нирок збільшує плазмову концентрацію препарату в середньому на 32% при кліренсі креатиніну (КК) 51‑80 мл/хв та на 72% при КК <30 мл/хв порівняно з суб’єктами із нормальною функцією нирок. Не було виявлено істотних змін у фармакокінетиці едоксабану при печінковій недостатності легкого та помірного ступеня [7].
Приймання деяких інгібіторів Р-глікопротеїну супроводжується підвищенням концентрації едоксабану в плазмі крові, тому потребує корегування (зменшення вдвічі) дози [8]. До таких препаратів відносяться циклоспорин, кларитроміцин, дронедарон, еритроміцин, кетоконазол, ітраконазол, тамоксифен. При цьому застосування інших інгібіторів Р-глікопротеїну, як-от аміодарон, хінідин і верапаміл у терапевтичних дозах, суттєво не впливає на сироватковий вміст едоксабану, а також його ефективність та безпеку, тому не потребує корекції дози [9]. І навпаки, рифампіцин або інші індуктори P-глікопротеїну (фенітоїн, карбамазепін, фенобарбітал або звіробій звичайний) можуть спричинити зниження концентрації едоксабану в плазмі крові. Тому ці препарати слід застосовувати з обережністю при проведенні АКТ едоксабаном.
Специфічний антидот проти інгібіторів Ха-фактора згортання крові андексанет альфа на даний час в Україні не зареєстрований. Утім він схвалений для застосування у США Управлінням із контролю за якістю продуктів харчування та медикаментів США (FDA) та умовно авторизований (проходить додаткову перевірку із наявністю на фармринку) Європейським агентством із лікарських засобів (EMA) у країнах ЄС [10]. Було показано, що інфузія чотирикомпонентного концентрату протромбінового комплексу в дозі 50 МО/кг дозволяє припинити дію едоксабану через 30 хв після завершення його введення [11].
Аналіз ефективності й безпеки терапії едоксабаном у пацієнтів із ВТЕ
Ефективність та безпеку застосування едоксабану в пацієнтів із ВТЕ було показано як у рандомізованих клінічних випробуваннях, так і за даними реальної клінічної практики (реєстри). У дослідженні Hokusai-VTE проводили порівняння едоксабану з використанням традиційної терапії АВК у 8240 хворих на гостру ВТЕ (40,3% мали ТЕЛА), що пройшли первинне лікування парентеральними антикоагулянтами протягом щонайменше п’яти днів [12]. Пацієнти отримували едоксабан у дозі 60 або 30 мг/добу (при КК 30‑50 мл/хв, масі тіла <60 кг або сумісному прийманні інгібіторів P-глікопротеїну) чи варфарин. Середня тривалість лікування гепарином становила сім днів.
Серед пацієнтів, які отримували АВК, МНВ було в межах терапевтичного діапазону протягом 63,5% часу. Тривалість АКТ становила від 3 до 12 місяців, при цьому лікування протягом року отримували майже 40% хворих. Були продемонстровані такі результати:
1. За основним критерієм ефективності, як-то частота рецидиву симптомної ВТЕ або фатальної ТЕЛА, едоксабан не поступався варфарину: відносний ризик (ВР) 0,89; 95% довірчий інтервал (ДІ) 0,70‑1,13.
2. За основним показником безпеки, як-от частота великих та клінічно значущих кровотеч, у групі едоксабану показник був нижчим (ВР 0,81; 95% ДІ 0,71‑0,94; р=0,004).
3. У 938 пацієнтів із гострою ТЕЛА та підвищеною концентрацією мозкового натрійуретичного пропептиду NT-proBNP (>500 пг/мл) частота рецидивів ВТЕ становила 3,3% при застосуванні едоксабану та 6,2% – варфарину (ВР 0,52; 95% ДІ 0,28‑0,98).
Таким чином, едоксабан виявився ефективнішим, ніж стандартна терапія АВК у пацієнтів із високим ризиком розвитку ускладнень [12].
Окрім того, з-поміж учасників, які мали показання для зниження дози едоксабану (КК 30‑50 мл/хв, маса тіла <60 кг або сумісне приймання інгібіторів P-глікопротеїну – приблизно 18% від усієї популяції хворих Hokusai-VTE), повторна ВТЕ виникала у 3% пацієнтів на тлі терапії едоксабаном та у 4,2% – варфарином (ВР 0,73; 95% ДІ 0,42‑1,26) [13]. Великі та клінічно значущі кровотечі спостерігалися у 7,9 та 12,8% хворих відповідно (ВР 0,62; 95% ДІ 0,44‑0,86). При цьому кількість повторних ВТЕ (3 vs 3,2%) та клінічно значущих кровотеч (7,9 vs 8,6%) суттєво не відрізнялася в пацієнтів, які отримували едоксабан у дозі 30 та 60 мг відповідно.
Також доцільно підкреслити, що майже кожний п’ятий пацієнт (19,7%), включений у дослідження Hokusai-VTE, був віком ≥75 років. Дві третини цих хворих мали ≥3 коморбідних захворювань або станів і використовували щонайменше шість супутніх препаратів, що могло суттєво вплинути на ефективність та безпеку АКТ [14]. В учасників, які отримували варфарин, частота рецидивів ВТЕ зростала з віком із 3% у пацієнтів <65 років до 5,7% в осіб >80 років. І навпаки, у групі едоксабану не спостерігалося збільшення повторних ВТЕ у хворих старшої вікової групи.
Отже, частота рецидивів у пацієнтів ≥75 років була нижчою у групі едоксабану, ніж варфарину (2,5 та 5,0% відповідно; ВР 0,52; 95% ДІ 0,27‑1,00). Очікувано, що ймовірність кровотеч у дослідженні була вищою з віком та збільшенням кількості супутніх захворювань незалежно від обраного антикоагулянту, але переваги едоксабану перед варфарином щодо цього показника простежувалися в усіх вікових категоріях незважаючи на супутню патологію [14].
На сьогодні Hokusai-VTE є найбільшим дослідженням III фази, в якому вивчали ефективність та безпеку ПрОАК у пацієнтів із ВТЕ. Це перша робота, де дозу препарату корегували залежно від вихідних характеристик хворого на ВТЕ. Отримані результати підтверджують ефективність та безпеку едоксабану у даної категорії хворих, при цьому особливі переваги препарат демонстрував у пацієнтів із високим ризиком розвитку ускладнень (зростання рівня NT-proBNP, вік ≥75 років тощо).
Клінічну ефективність едоксабану для вторинної профілактики ВТЕ було також доведено у реальній клінічній практиці. До проспективного дослідження ETNA-VTE, яке проводили у восьми країнах Європи (Австрія, Бельгія, Велика Британія, Ірландія, Італія, Нідерланди, Німеччина, Швейцарія), було залучено 2672 пацієнти із ВТЕ (42% – ТЕЛА ± ТГВ, 58% – тільки ТГВ) [15]. Включення учасників здійснювали протягом перших двох тижнів від розвитку симптоматики ВТЕ, при цьому 84,7% до призначення едоксабану отримували гепаринотерапію.
Серед пацієнтів 63,9% мали неспровокований ВТЕ, 11,3% – онкоасоційований тромбоз та 32,8% – високий ризик розвитку кровотеч (≥2 балів за шкалою VTE-Bleed). Учасники ETNA-VTE були старшими (65 vs 57 років), із переважанням жінок (46,5 vs 39,8%) і мали більшу поширеність хронічної венозної недостатності (11,1 vs 1,6%) порівняно з європейською когортою дослідження Hokusai-VTE (n=1512).
У реальній практиці більшості хворих (87,7%) едоксабан призначали в дозі 60 мг/добу. При цьому майже у 90% пацієнтів обрана доза відповідала рекомендаціям, 6,6% вибрали більшу (60 мг), а 3,3% – меншу дозу (30 мг), ніж необхідно.
Кількість подій через три місяці лікування едоксабаном становила [15]:
- повторні ВТЕ – 0,34% (n=9);
- великі кровотечі – 0,97% (n=26);
- смерть від усіх причин – 0,79% (n=21).
Таким чином, результати дослідження підтверджують ефективність та безпеку едоксабану в реальній клінічній практиці протягом найкритичнішого періоду часу – перших трьох місяців від розвитку захворювання.
Дані іншого обсерваційного дослідження DRESDEN NOAC Registry [16] підтвердили, що в реальних умовах едоксабан призначають у коректній дозі майже у 90% пацієнтів, а найчастішим фактором для вибору зменшеного дозування є ниркова дисфункція (ШКФ – 15‑50 мл/хв).
Варто зазначити, що окремою категорією є хворі на ВТЕ зі злоякісними новоутвореннями. З одного боку, онкологічні захворювання в активній стадії є одним з основних факторів ризику рецидивування ВТЕ. З іншого ж, онкопатологія також являє собою суттєвий чинник ризику кровотеч. Дуже часто такі пацієнти мають низку супутніх патологій/станів або отримують лікування, що значно впливає на фармакокінетику багатьох ліків. Тому вибір АКТ в осіб з онкоасоційованими тромбозами суттєво ускладнений.
Протягом тривалого часу препаратами вибору для цієї категорії хворих вважалися НМГ. За даними п’яти рандомізованих клінічних досліджень, тривала терапія НМГ упродовж 3‑6 місяців при онкоасоційованому тромбозі порівняно із комбінацією НМГ (5‑10 днів) + АВК супроводжувалася зниженням ризику рецидивів ВТЕ на 40% за подібної кількості великих кровотеч на тлі двох режимів лікування [17].
Останнім часом активно вивчається використання ПрОАК у цієї когорти пацієнтів – як для початкової терапії, так і після використання НМГ. У дослідженні Hokusai-VTE Cancer (n=1046) едоксабан показав порівнянну із дальтепарином (НМГ) ефективність щодо попереджання первинної комбінованої кінцевої точки, як-то рецидив ВТЕ / велика кровотеча протягом 12 місяців спостереження (ВР 0,97; 95% ДI 0,70‑1,36) [18]:
1. Повторна венозна тромбоемболія виникла у 7,9% пацієнтів групи едоксабану та 11,3% – дальтепарину (-3,4%; 95% ДІ від -7,0 до 0,2).
2. Великі кровотечі мали місце у 6,9% хворих на тлі використання едоксабану та 4% – дальтепарину. Ця різниця була переважно зумовлена збільшенням кровотеч в осіб із раком ШКТ.
Подальший аналіз результатів дослідження продемонстрував, що розвиток первинної кінцевої точки у пацієнтів із раком ШКТ спостерігався у 19,4% тих, хто отримував едоксабан, і 15% – дальтепарин: різниця ризику (PP) 4,4%; 95% ДІ від -4,1 до 12,8%) [19]. Показники на тлі терапії едоксабаном та дальтепарином для раку легень становили 10,4 і 10,7% (PP -0,3%; 95% ДІ від -10 до 9,5%), для раку сечостатевої системи – 13,6 і 12,5% (PP 1,1%; 95% ДІ від -10,1 до 12,4), для раку молочної залози – 3,1 і 11,7% (PP 8,6%; 95% ДІ від -19,3 до 2,2), для гематологічних злоякісних пухлин – 8,9 і 10,9% (PP -2%; 95% ДІ від -13,1 до 9,1) та для гінекологічного раку – 10,4 і 17,4% (PP -7%; 95% ДІ від -19,8 до 5,7) відповідно.
Отже, у підгрупі пацієнтів із раком ШКТ едоксабан на 3,5% знижував ризик повторної ВТЕ та на 7,9% підвищував імовірність великої кровотечі. Тому в останніх рекомендаціях Європейського товариства кардіологів (ESC) щодо лікування ТЕЛА вказано не можливість призначення едоксабану (як альтернативи для НМГ) при онкоасоційованому тромбозі лише у пацієнтів, які не мають злоякісного новоутворення ШКТ [3].
Висновки
Таким чином, на фармринку України з’явився ще один ПрОАК едоксабан (Едоксакорд, 30 та 60 мг, АТ «Київський вітамінний завод»), який має потужну доказову базу щодо використання для лікування та вторинної профілактики ВТЕ, зокрема у пацієнтів з онкоасоційованим тромбозом (окрім новоутворень у ШКТ). Застосування препарату слід розпочинати після ініціальної парентеральної АКТ. Перевагами едоксабану є можливість приймання один раз на добу та проведення корекції дози (єдиний ПрОАК при терапії ВТЕ) залежно від індивідуальних характеристик хворого.
Більшість пацієнтів для вторинної профілактики ВТЕ мають отримувати едоксабан у дозі 60 мг/добу. Особи із дисфункцією нирок (КК – 15‑50 мл/хв), масою тіла <60 кг або супутнім прийманням інгібіторів P-глікопротеїну (як-то циклоспорин, кларитроміцин, дронедарон, еритроміцин, кетоконазол) потребують зниження дози едоксабану до 30 мг/добу.
Література
- Wendelboe A.M., Raskob G.E. Global burden of thrombosis: epidemiologic aspects // Circ Res. – 2016. – 118. – Р. 1340‑1347.
- Cohen A.T., Agnelli G., Anderson F.A., Arcelus J.I., Bergqvist D., Brecht J.G., Greer I.A., Heit J.A., Hutchinson J.L., Kakkar A.K., Mottier D., Oger E., Samama M.M., Spannagl M. VTE Impact Assessment Group in Europe (VITAE). Venous thromboembolism (VTE) in Europe. The number of VTE events and associated morbidity and mortality // Thromb Haemost. – 2007. – 98. – Р. 756‑764.
- Konstantinides S.V., Meyer G., Becattini C., Bueno H., Geersing G.J., Harjola V.P., Huisman M.V., Humbert M., Jennings C.S., Jiménez D., Kucher N., Lang I.M., Lankeit M., Lorusso R., Mazzolai L., Meneveau N., Ní Áinle F., Prandoni P., Pruszczyk P., Righini M., Torbicki A., Van Belle E., Zamorano J.L.; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS) // Eur Heart J. – 2020 . – 41 (4). – Р.543‑603; doi: 10.1093/eurheartj/ehz405. PMID: 31504429.
- Cossette B., Pelletier M.E., Carrier N., Turgeon M., Leclair C., Charron P., Echenberg D., Fayad T., Farand P. Evaluation of bleeding risk in patients exposed to therapeutic unfractionated or low-molecular-weight heparin: a cohort study in the context of a quality improvement initiative // Ann Pharmacother. – 2010. – 44. – Р. 994‑1002.
- Erkens P.M., Prins M.H. Fixed dose subcutaneous low molecular weight heparins versus adjusted dose unfractionated heparin for venous thromboembolism // Cochrane Database Syst Rev. – 2010. – 9. – CD001100.
- van der Hulle T., Kooiman J., den Exter P.L., Dekkers O.M., Klok F.A., Huisman M.V. Effectiveness and safety of novel oral anticoagulants as compared with vitamin K antagonists in the treatment of acute symptomatic venous thromboembolism: a systematic review and meta-analysis // J Thromb Haemost. – 2014. – 12. – Р. 320‑328.
- Stacy Z.A., Call W.B., Hartmann A.P. et al. Edoxaban: a comprehensive review of the pharmacology and clinical data for the management of atrial fibrillation and venous thromboembolism // Cardiol Ther. – 2016. – 5. – 1‑18.
- Daiichi-Sankyo Ltd. Lixiana summary of product characteristics, 2016; https://www.medicines.org. uk/emc/medicine/30506 (аccessed 22 July 2016).
- Steffel J., Giugliano R.P., Braunwald E. et al. Edoxaban vs. warfarin in patients with atrial fibrillation on amiodarone: a subgroup analysis of the ENGAGE AF-TIMI 48 trial // Eur Heart J. – 2015. – 36. – 2239‑2245.
- Connolly S.J., Milling T.J. Jr, Eikelboom J.W. et al. Andexanet alfa for acute major bleeding associated with factor Xa inhibitors // N Engl J Med. – 2016. – 375. – Р. 1131‑41.
- Zahir H., Brown K.S., Vandell A.G. et al. Edoxaban effects on bleeding following punch biopsy and reversal by a 4-factor prothrombin complex concentrate //Circulation. – 2015. – 131. – Р. 82‑90.
- Hokusai-VTE Investigators, Büller H.R., Décousus H., Grosso M.A., Mercuri M., Middeldorp S., Prins M.H., Raskob G.E., Schellong S.M., Schwocho L., Segers A., Shi M., Verhamme P., Wells P. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism // N Engl J Med. – 2013. – 369 (15). – Р. 1406‑1415; doi: 10.1056/NEJMoa1306638 (Erratum in: N Engl J Med. – 2014. – 370 (4). – 390; PMID: 23991658).
- Verhamme P., Wells P.S., Segers A., Ageno W., Brekelmans M.P., Cohen A.T., Meyer G., Grosso M.A., Raskob G., Weitz JI, Zhang G., Buller H. Dose reduction of edoxaban preserves efficacy and safety for the treatment of venous thromboembolism. An analysis of the randomised, double-blind HOKUSAI VTE trial // Thromb Haemost. – 2016. – 116 (4). – Р. 747‑753; doi: 10.1160/TH16‑03‑0244 (Epub 2016 Jul 21; PMID: 27440518).
- Vanassche T., Verhamme P., Wells P.S., Segers A., Ageno W., Brekelmans M.P.A, Chen C.Z., Cohen A.T., Grosso M.A., Medina A.P., Mercuri M.F., Winters S.M., Zhang G., Weitz J.I.., Raskob G.E., Büller H.R. Impact of age, comorbidity, and polypharmacy on the efficacy and safety of edoxaban for the treatment of venous thromboembolism: An analysis of the randomized, double-blind Hokusai-VTE trial // Thromb Res. – 2018. – 162. – Р. 7‑14; doi: 10.1016/j.thromres.2017.12.005 (Epub 2017 Dec 13; PMID: 29248859).
- Agnelli G., Hoffmann U., Hainaut P., Gaine S., Ay C., Coppens M., Schindewolf M., Jimenez D., Brüggenjürgen B., Levy P., Laeis P., Fronk E.M., Zierhut W., Malzer T., Manu M.C., Reimitz P.E., Bramlage P., Cohen A.T.; ETNA-VTE-Europe investigators. ETNA-VTE Europe: Benefits and risks of venous thromboembolism treatment using edoxaban in the first 3 months // Thromb Res. – 2020. – 196. – Р. 297‑304; doi: 10.1016/j.thromres.2020.09.001 (Epub 2020 Sep 12; PMID: 32950897).
- Beyer-Westendorf J., Marten S., Naue C., Köhler C., Tittl L., Bornhäuser M. Edoxaban dosing patterns in real life practice – Results from the DRESDEN NOAC REGISTRY // Thrombosis Update. – 2021. – 5; https://doi.org/10.1016/j.tru.2021.100070).
- Posch F., Konigsbrugge O., Zielinski C., Pabinger I., Ay C. Treatment of venous thromboembolism in patients with cancer: a network meta-analysis comparing efficacy and safety of anticoagulants // Thromb Res. – 2015. – 136. – Р. 582‑589.
- Raskob G.E., van Es N., Verhamme P., Carrier M., Di Nisio M., Garcia D., Grosso M.A., Kakkar A.K., Kovacs M.J., Mercuri M.F., Meyer G., Segers A., Shi M., Wang T.F., Yeo E., Zhang G., Zwicker J.I., Weitz J.I., Büller H.R. Hokusai VTE Cancer Investigators. Edoxaban for the Treatment of Cancer-Associated Venous Thromboembolism // N Engl J Med. – 2018. – 378 (7). – Р. 615‑624; doi: 10.1056/NEJMoa1711948 (Epub 2017 Dec 12; PMID: 29231094).
- Mulder F.I., van Es N., Kraaijpoel N., Di Nisio M., Carrier M., Duggal A., Gaddh M., Garcia D., Grosso M.A., Kakkar A.K., Mercuri M.F., Middeldorp S., Royle G., Segers A., Shivakumar S., Verhamme P., Wang T., Weitz J.I., Zhang G., Büller H.R., Raskob G. Edoxaban for treatment of venous thromboembolism in patient groups with different types of cancer: Results from the Hokusai VTE Cancer study // Thromb Res. – 2020. – 185. – Р. 13‑19; doi: 10.1016/j.thromres.2019.11.007 (Erratum in: Thromb Res. – 2020. – 191. – Р. 156‑159; PMID: 31733403.
Тематичний номер «Кардіологія, Ревматологія, Кардіохірургія» № 6 (79) 2021 р.