25 липня, 2022
Стандарт медичної допомоги «Раціональне застосування антибактеріальних і антифунгальних препаратів з лікувальною та профілактичною метою»*
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
18 травня 2022 року № 823
Розробники:
Микичак Ірина Володимирівна – заступник Міністра охорони здоров’я України, голова робочої групи
Кузін Ігор Володимирович – заступник Міністра охорони здоров’я, Головний державний санітарний лікар України, заступник голови робочої групи
Бекетова Галина Володимирівна – завідувач кафедри дитячих і підліткових захворювань Національного університету охорони здоров’я України імені П.Л. Шупика
Водяник Аркадій Аркадійович – національний фахівець ВООЗ з профілактики інфекцій та інфекційного контролю (за згодою)
Глушкевич Тетяна Георгіївна – завідувач референс-лабораторії мікробіологічних та паразитологічних досліджень ДУ «Центр громадського здоров’я МОЗ України»
Дубров Сергій Олександрович – завідувач кафедри анестезіології та інтенсивної терапії Національного медичного університету ім. О.О. Богомольця
Зінчук Олександр Миколайович – завідувач кафедри інфекційних хвороб Львівського національного медичного університету ім. Данила Галицького
Колесник Роман Олександрович – завідувач відділу антимікробної резистентності та інфекційного контролю ДУ «Центр громадського здоров’я МОЗ України», секретар консультативної експертної групи
Крамарьов Сергій Олександрович – завідувач кафедри дитячих інфекційних хвороб Національного медичного університету ім. О.О. Богомольця
Медведь Володимир Ісакович – керівник відділу ДУ «Інститут педіатрії, акушерства і гінекології ім. академіка О.М. Лук’янової НАМН України» (за згодою)
Нетяженко Василь Захарович – завідувач кафедри пропедевтики внутрішньої медицини № 1 Національного медичного університету ім. О.О. Богомольця
Олещук Олександра Михайлівна – завідувач кафедри фармакології з клінічною фармакологією Тернопільського національного медичного університету
Петренко Василь Іванович – завідувач кафедри фтизіатрії та пульмонології Національного медичного університету ім. О.О. Богомольця
Романенко Ірина Миколаївна – начальник відділу оцінки клінічної ефективності лікарських засобів Департаменту оцінки медичних технологій ДП «Державний експертний центр МОЗ України»
Хайтович Микола Валентинович – завідувач кафедри клінічної фармакології та клінічної фармації Національного медичного університету ім. О.О. Богомольця
Чабан Тетяна Володимирівна – завідувач кафедри інфекційних хвороб Одеського національного медичного університету
Методологічний супровід та інформаційне забезпечення:
Гуленко Оксана Іванівна – начальник відділу стандартизації медичної допомоги ДП «Державний експертний центр Міністерства охорони здоров’я України», заступник голови робочої групи з методологічного супроводу
Перелік скорочень
ATC – анатомо-терапевтично-хімічна класифікація лікарських засобів
Срl – плазмова концентрація антимікробного препарату
CRE – карбапенем-резистентні Enterobacteriaceae
ESBL – β-лактамази розширеного спектра дії
ESKAPE – група бактерій, до якої входять Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp
IMP – різновид β-лактамаз, стійких до іміпенему
KPC – карбапенемази, які продукуються K. pneumoniae
MIC – мінімальна інгібуюча концентрація антибіотика
MRSA – метицилін-резистентний Staphylococcus aureus
MSSA – метицилін-чутливий Staphylococcus aureus
NDM (New Delhi Metalo-β-lactamase) – назва гена і кодованого ним фермента β-лактамази, яка надає стійкість бактеріям до впливу всіх β-лактамаз, у т.ч. карбапенемаз
VIM (Verona Integron encoded Metalo-β-lactamase) – клас β-лактамаз, які гідролізують усі β-лактами, у т.ч. карбапенеми, але окрім монобактамів
VRE – ванкоміцин-резистентний Enterococcus
АМП – антимікробні препарати
АМР – антимікробна резистентність
ВАІТ – відділення анестезіології та інтенсивної терапії
ВАП – вентилятор-асоційована пневмонія
ВІК – відділ з інфекційного контролю
ЗОЗ – заклад охорони здоров’я
ІПНМД – інфекційна хвороба, пов’язана з наданням медичної допомоги
ІФА – імуноферментний аналіз
КАІК – катетер-асоційована інфекція кровотоку
КАІСШ – катетер-асоційовані інфекції сечових шляхів
КУО/мл – кількість колонієутворюючих одиниць в 1 мл
МАМР – множинна резистентність до антимікробних препаратів
МНН – міжнародна непатентована назва
ПЛР – полімеразна ланцюгова реакція
СОП – стандартна операційна процедура
ТЛМ – терапевтичний лікарський моніторинг
уІСШ – ускладнені інфекції сечових шляхів (наявність структурних або функціональних змін з боку сечостатевого тракту, тяжкої фонової соматичної патології, будь-яка ІСШ у вагітної, пацієнта чоловічої статі)
ШКК – шлунково-кишкова кровотеча
ШКТ – шлунково-кишковий тракт
ШКФ – швидкість клубочкової фільтрації
Загальні положення
1. Цей Стандарт розроблений на виконання наказу Міністерства охорони здоров’я України від 03 серпня 2021 року № 1614 «Про організацію профілактики інфекцій та інфекційного контролю в закладах охорони здоров’я та установах/закладах надання соціальних послуг/соціального захисту населення», зареєстрованого в Міністерстві юстиції України 11 жовтня 2021 року за № 1318/36940, з метою забезпечення надання якісної, ефективної та безпечної медичної допомоги пацієнтам, які потребують лікування антимікробними препаратами. Цей Стандарт встановлює загальні вимоги до призначення, коригування і припинення антибактеріальної/антифунгальної терапії в закладах охорони здоров’я та фізичними особами-підприємцями, які зареєстровані в установленому законом порядку та одержали ліцензію на право провадження господарської діяльності з медичної практики, що забезпечують медичне обслуговування населення відповідної території, з метою попередження і зниження поширеності інфекційних хвороб, викликаних мікроорганізмами з резистентністю.
2. Цей Стандарт не поширюються на вимоги до призначення парентеральної періопераційної антибіотикопрофілактики і антимікобактеріальної терапії.
3. Цей Стандарт призначений для керівників закладів охорони здоров’я, які надають первинну (амбулаторну), вторинну (спеціалізовану) стаціонарну та третинну (високоспеціалізовану) стаціонарну медичну допомогу, їхніх заступників, фармацевтів клінічних, фармацевтів та лікарів різних спеціальностей (у тому числі лікарів загальної практики – сімейних лікарів та лікарів первинної спеціалізованої медичної допомоги, які провадять господарську діяльність з медичної практики як фізичні особи – підприємці), які залучені до призначення антибактеріальних і антифунгальних препаратів.
ІІ. Загальні принципи раціонального призначення антибактеріальних препаратів у ЗОЗ
1. У ЗОЗ відповідальним за призначення обстеження та лікування пацієнта є його лікуючий лікар, відповідно до Основ законодавства України про охорону здоров’я.
2. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, відповідальним за розробку плану дій з адміністрування антимікробних препаратів та СОП з адміністрування призначення антибактеріальних препаратів є фармацевт клінічний ВІК, відповідно до Інструкції з впровадження адміністрування антимікробних препаратів у закладах охорони здоров’я, які надають медичну допомогу в стаціонарних умовах, затвердженого наказом Міністерства охорони здоров’я України від 03 серпня 2021 року № 1614, зареєстрованого в Міністерстві юстиції України 11 жовтня 2021 року за № 1322/36944 (далі – Інструкція).
3. Лікування антибактеріальними (ATC J01) лікарськими засобами для системного застосування (далі – антибіотикотерапія) слід розпочинати лише у випадку наявної у пацієнта лабораторно підтвердженої або з високою ймовірністю підозрюваної бактеріальної інфекції.
4. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, керівнику закладу слід забезпечити цілодобову можливість для збору зразків біологічного матеріалу, тимчасового зберігання до надсилання до мікробіологічної лабораторії (за необхідності) та отримання результатів мікробіологічних досліджень. Для прийняття рішення щодо доцільності початку емпіричної антибіотикотерапії необхідно використовувати методи пришвидшеної ідентифікації збудника інфекційної хвороби і виявлення бактеріальних маркерів запалення (прокальцитонін).
5. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, у всіх випадках призначення емпіричної антибіотикотерапії необхідно отримати зразок біологічного матеріалу для проведення бактеріологічного дослідження з метою ідентифікації збудника інфекційної хвороби до введення антибактеріального препарату пацієнтові. Зразок(ки) біологічного матеріалу необхідно асептично зібрати з усіх передбачуваних/підозрюваних локусів інфекції та надіслати до мікробіологічної лабораторії.
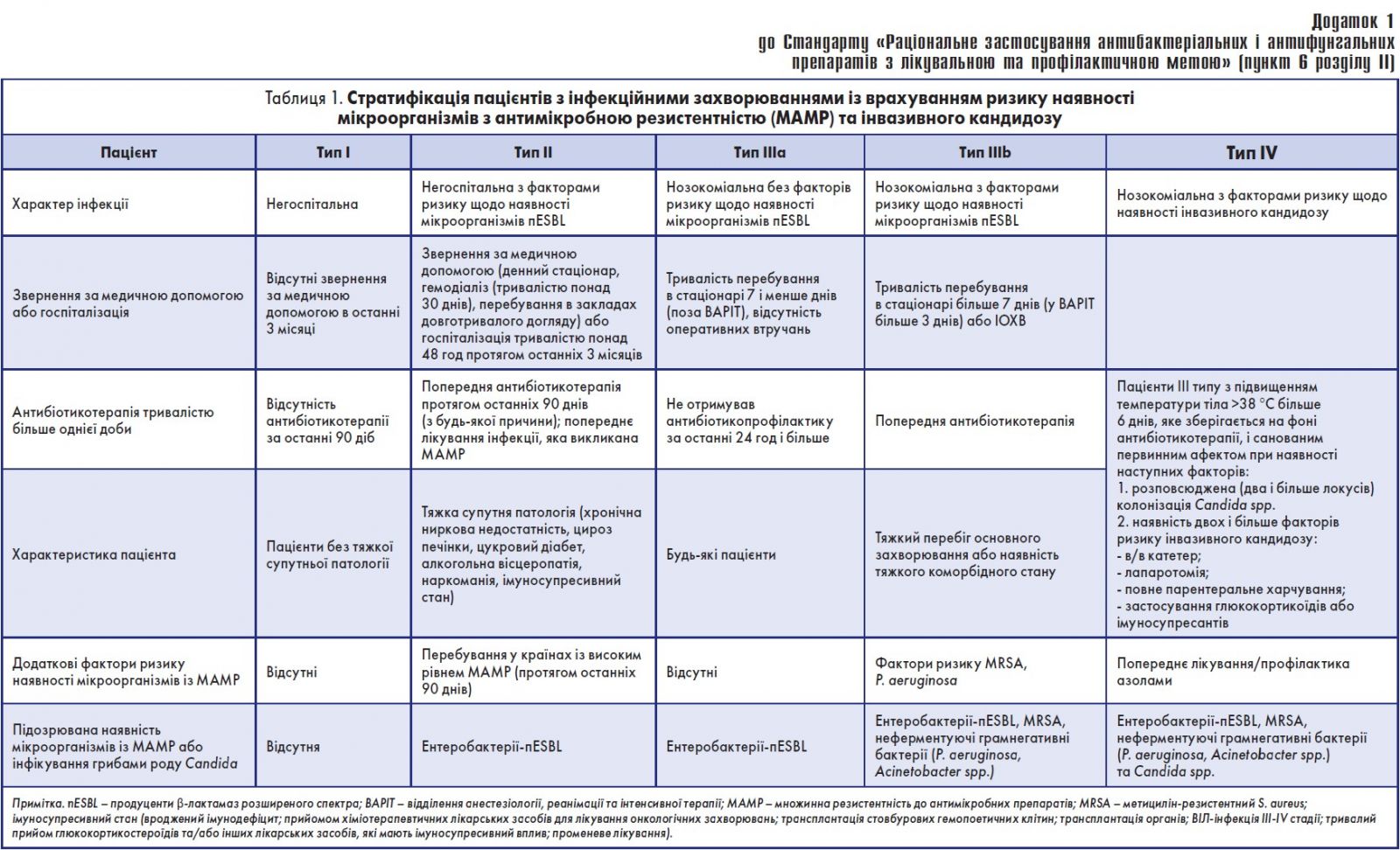
6. У ЗОЗ, що надають первинну медичну допомогу, необхідно отримати зразок біологічного матеріалу для проведення бактеріологічного дослідження з метою ідентифікації збудника інфекційної хвороби перед призначенням антибактеріального препарату за умови, що пацієнт відповідає критеріям типу ІІ та/або має ризик наявності МАМР, відповідно до додатка 1 до цього Стандарту. Для прийняття рішення щодо доцільності початку емпіричної антибіотикотерапії необхідно використовувати методи пришвидшеної ідентифікації збудника інфекційної хвороби.
7. Вибір емпіричного режиму антибіотикотерапії має враховувати типи/групи пацієнтів з інфекційними захворюваннями та ризик наявності МАМР.
8. Призначення антибактеріальних препаратів для системного застосування (ATC J01) з метою лікування інфекційних хвороб, викликаних вірусами, грибами або паразитами, заборонено, якщо такі показання не передбачені інструкцією для медичного застосування лікарського засобу або чинними галузевими стандартами медичної допомоги.
9. Призначення антибактеріальних препаратів для системного застосування (ATC J01) з метою профілактики інфекцій заборонено в таких випадках:
1) відсутність показань до профілактичного використання антибактеріального препарату в інструкції для медичного застосування лікарського засобу;
2) відсутність антибактеріального препарату у додатках 1, 2 до Стандарту «Парентеральна періопераційна антибіотикопрофілактика»;
3) відсутність рекомендації профілактичного використання антибактеріального препарату у чинних галузевих стандартах медичної допомоги.
10. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, кожне призначення антибіотикотерапії має бути письмово обґрунтоване у формі первинної облікової документації № 003/о «Медична карта стаціонарного хворого № ___ », затвердженій наказом Міністерства охорони здоров’я України від 14 лютого 2012 року № 110, зареєстрованим у Міністерстві юстиції України 28 квітня 2012 року за № 661/20974 (у редакції наказу Міністерства охорони здоров’я України від 21 січня 2016 року № 29; формі первинної облікової документації № 097/о «Медична карта новонародженого № _____ », затвердженій наказом Міністерства охорони здоров’я України від 21 січня 2016 року № 29, зареєстрованим у Міністерстві юстиції України 12 лютого 2016 року за № 230/28360; формі первинної облікової документації № 096/о «Історія вагітності та пологів № _____ », затвердженій наказом Міністерства охорони здоров’я України від 21 січня 2016 року № 29, зареєстрованим у Міністерстві юстиції України 12 лютого 2016 року за № 230/28360 або у Реєстрі медичних записів, записів про направлення та рецептів в електронній системі охорони здоров’я (далі – медична карта).
11. У ЗОЗ, що надають первинну медичну допомогу, кожне призначення антибіотикотерапії має бути письмово обґрунтоване у формі первинної облікової документації № 025/о «Медична карта амбулаторного хворого № ____ », затвердженій наказом Міністерства охорони здоров’я України від 14 лютого 2012 року № 110 (у редакції наказу МОЗ України 28 лютого 2020 року № 587), зареєстрованим у Міністерстві юстиції України 28 квітня 2012 року за № 661/20974 або у Реєстрі медичних записів, записів про направлення та рецептів в електронній системі охорони здоров’я (далі – амбулаторна карта).
12. Обґрунтування призначення антибіотикотерапії має містити:
1) встановлене або з високою ймовірністю підозрюване захворювання бактеріальної етіології та критерії, які враховувались для призначення антибіотикотерапії;
2) назва антибактеріального препарату зазначається у формі МНН;
3) доза, лікарська форма, кратність та шлях введення антибактеріального препарату;
4) передбачувана тривалість антибіотикотерапії;
5) дата наступного перегляду та/або припинення призначеної антибіотикотерапії (через 48-72 год).
13. У випадку лабораторного виявлення бактерій, які є коменсалами і вільно колонізують ділянки тіла без ознак інфекційного запалення у пацієнта, призначення антибактеріального препарату з метою лікування заборонено, за виключенням визначених галузевими стандартами медичної допомоги інфекційних агентів, які підлягають обов’язковій ерадикації.
14. Персистенція бактерій у кількості (102-103 КУО/мл) у нестерильному локусі або виділення з нестерильного локусу нового мікроорганізму без клінічних симптомів інфекційного захворювання у пацієнта не може слугувати обґрунтуванням для початку, продовження або корекції антибіотикотерапії. Виділення мікроорганізмів зі стерильного локусу за відсутності клінічних симптомів інфекційного захворювання у пацієнта може свідчити про контамінацію біологічного зразка та потребує додаткового отримання матеріалу для проведення мікробіологічних досліджень.
15. У випадку лабораторного виявлення бактеріальних штамів, які є умовно-патогенними та/або патогенними мікроорганізмами і здатні викликати інфекційне захворювання, попередньо призначену антибіотикотерапію необхідно відкоригувати упродовж перших 12 год, відповідно до встановленої чутливості мікроорганізмів до антибактеріального препарату.
16. Призначення антибіотикотерапії на вимогу/прохання пацієнтів, їхніх родичів або законних опікунів, за умови відсутності ознак захворювання бактеріальної етіології, заборонено. Лікуючий лікар зобов’язаний зрозумілою мовою та у доступний спосіб для пацієнта (його родичів/законних опікунів) надати інформацію про захворювання, необхідність уникнення антибіотикотерапії та клінічні ознаки ускладнень хвороби або симптоми приєднання вторинної бактеріальної ко-інфекції/суперінфекції, які вимагатимуть початку проведення антибіотикотерапії (за наявності).
17. Вибір препарату для проведення емпіричної антибіотикотерапії ґрунтується на передбачуваному отриманні терапевтичного ефекту проти найбільш імовірного інфекційного агента (залежно від анатомічної локалізації вогнища запалення) та його можливої стійкості до обраного антибактеріального препарату (дані локального/регіонального/національного моніторингу АМР). Також необхідно враховувати умови виникнення захворювання бактеріальної етіології (госпітальна/позагоспітальна) та ризик наявності у пацієнта МАМР, відповідно до додатка 1 до цього Стандарту.
18. З метою проведення емпіричної антибіотикотерапії рутинне призначення кількох антибактеріальних препаратів, спектр активності яких включає всіх можливих мікроорганізмів (у тому числі коменсалів і бактерій, що вільно колонізують шкіру та слизові оболонки), заборонено. Лабораторне виявлення мікроорганізмів, які є характерними типовими представниками локального мікробіому анатомічної ділянки, з якої було отримано біологічний зразок для досліджень, не є достатньою підставою для призначення антибіотикотерапії.
19. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, вибір та призначення антибактеріального препарату лікуючим лікарем здійснюється відповідно до СОП з адміністрування призначення антибактеріальних препаратів у ЗОЗ, а також шляхом проведення преавторизації (за необхідності). Розробка відповідного СОП ЗОЗ та процедура преавторизації антибактеріальних препаратів визначена Інструкцією.
20. СОП з адміністрування призначення антибактеріальних препаратів у ЗОЗ, що надають стаціонарну вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, включає такий перелік інфекційних хвороб, але не обмежується ним (за потреби, перелік може бути розширено рішенням керівника ЗОЗ):
1) інфекції сечовидільних шляхів (уретрит, цистит, пієлонефрит, включаючи КАІСШ;
2) інфекції нижніх дихальних шляхів (госпітальна/негоспітальна пневмонія та ВАП);
3) інфекції м’яких тканин (гнійні рани після травм чи укусів; флегмони/некротизуючі фасциїти, абсцеси);
4) інфекції ШКТ (сальмонельоз, шигельоз, холера, інфекції жовчовивідних шляхів, перитоніт);
5) сепсис невідомої етіології, у тому числі КАІК;
6) інфекційні хвороби, спричинені Clostridium difficile.
21. У ЗОЗ, що надають первинну медичну допомогу, вибір та призначення антибактеріальних препаратів лікуючим лікарем здійснюється відповідно до затверджених галузевих стандартів медичної допомоги та Переліку джерел клінічних настанов, затвердженому наказом МОЗ України від 28 вересня 2012 року № 751, зареєстрованому в Міністерстві юстиції України 29 листопада 2012 року за № 2001/22313.
22. Призначення антибіотикотерапії здійснюється індивідуалізовано із врахуванням особливостей фармакокінетики лікарського засобу для кожного пацієнта окремо. Спосіб призначення антибіотикотерапії має сприяти досягненню ефективних концентрацій антибактеріального препарату у тканинах ділянки вогнища інфекції.
23. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, забезпечується проведення ТЛМ для таких категорій пацієнтів та класів антимікробних препаратів (за потреби, перелік може бути розширено рішенням керівника ЗОЗ):
1) антимікробні препарати з вузьким терапевтичним індексом (пряма залежність між плазмовою концентрацією антибактеріального препарату [Cpl] та розвитком побічної реакції) – наприклад, аміноглікозиди (гентаміцин, тобраміцин, амікацин), глікопептиди (ванкоміцин, тейкопланін), антифунгальні засоби (вориконазол, ітраконазол, позаконазол, флуцитозин, каспофунгін, амфотерицин B);
2) антимікробні препарати, для яких встановлено пряму залежність між їхньою плазмовою концентрацією та клінічною ефективністю (необхідність контролю та підтримки встановленого відношення між плазмовою та мінімальною інгібуючою концентрацією (Cpl/MIC);
3) пацієнти, які мають варіабельність фармакокінетичних параметрів (з нирковою/печінковою недостатністю, з гіпопротеїнемією/ожирінням/кахексією, вагітні жінки, новонароджені, пацієнти старші за 65 років);
4) в інструкції для медичного застосування лікарського засобу наведено певну цільову терапевтичну плазмову концентрацію;
5) неможливо здійснювати моніторинг терапевтичного ефекту лікарського засобу;
6) наявність у пацієнта генетично детермінованої варіабельності метаболізму лікарських засобів;
7) пацієнт приймає інші лікарські засоби, які можуть впливати на фармакокінетику призначеного антибактеріального засобу.
24. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, антибіотикотерапію необхідно розпочинати в межах першої години після встановлення діагнозу сепсису/септичного шоку, одразу після забору матеріалу для бактеріологічного дослідження (кров та інший зразок біологічного матеріалу, отриманий із місць, максимально наближених до підозрюваного вогнища інфекції, інвазивним методом); при цьому, рекомендовано отримати зразки біологічного матеріалу для дослідження на аеробні й анаеробні бактерії.
25. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, у випадку сепсису/септичного шоку антибіотикотерапія має включати емпіричне призначення кількох антибактеріальних препаратів, спектр активності яких покриває всіх можливих інфекційних агентів у передбачуваній ділянці інфекційного запалення, а також враховує ризик наявності МАМР до призначених антибактеріальних препаратів та дані локального/регіонального/національного моніторингу поширеності АМР.
26. Комбінована емпірична антибіотикотерапія показана в таких випадках:
1) за умови що один із імовірних бактеріальних інфекційних агентів може бути стійким до одного антибактеріального препарату або такий інфекційний агент невідомий;
2) змішані аеробно-анаеробні інфекційні хвороби (абдомінальні інфекції або інфекції органів малого таза), при яких необхідно додати метронідазол до антибіотиків, які не володіють антибактеріальною активністю до анаеробної флори (аміноглікозиди, цефалоспорини, фторхінолони).
27. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, у всіх клінічних випадках необхідно спрямувати емпіричне лікування до вибору антибактеріальної монотерапії (за можливості). Емпіричне призначення кількох антибактеріальних препаратів із лікувальною метою слід упродовж 72 год замінити одним антибактеріальним препаратом, після отримання даних щодо визначеного етіологічного збудника та, за наявності, чутливості до антибіотиків (провести деескалацію).
28. У ЗОЗ, що надають первинну медичну допомогу, призначення кількох антибактеріальних препаратів для лікування захворювань бактеріальної етіології однієї локалізації заборонено, за виключенням антибактеріальних препаратів, що в одиниці лікарської форми містять фіксовану комбінацію кількох діючих речовин. Диференційоване призначення кількох антибактеріальних препаратів для лікування захворювань бактеріальної етіології у різних локалізаціях можливе, однак перевагу слід надавати лікуванню одним антибактеріальним препаратом (за можливості).
29. У всіх випадках встановлення альтернативного (неінфекційного) діагнозу та/або скасування діагнозу інфекційної хвороби бактеріальної етіології необхідно невідкладно припинити введення антибактеріального препарату.
30. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, під час застосування антибактеріальних препаратів необхідно щоденно контролювати стан пацієнта з метою оцінки клінічної ефективності лікування, реєстрації можливих побічних реакцій і визначення оптимальної тривалості лікування.
31. Не рекомендовано продовжувати антибіотикотерапію, обґрунтовуючи це збереженням окремих симптомів та/або ознак захворювання (наприклад, субфебрильна температура тіла, помірний лейкоцитоз без зсуву формули вліво, невелика кількість трахеального секрету та/або залишкові інфільтративні зміни на рентгенограмі внаслідок ВАП, наявність післяопераційних дренажів у черевній порожнині або сечового катетера (без ознак активної інфекції).
32. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, подовжена антибіотикотерапія проводиться в таких випадках:
1) бактеріємія:
спричинена S. aureus (MSSA/MRSA) – 7-14 днів;
спричинена S. pneumoniae – 7-10 днів;
спричинена Enterobacteriaceae spp. – 7-10 днів;
спричинена P. aeruginosa – 14 днів;
КАІК – залежно від етіологічного збудника;
2) ВАП, спричинена P. aeruginosa або Acinetobacter spp. – 7-10 днів;
3) інфекційні хвороби із «важкодоступною» для антибактеріальних препаратів локалізацією, наприклад:
серцеві клапани (бактеріальний ендокардит) – 4-6 тижнів; центральна нервова система (абсцес мозку/субдуральна емпієма/вентрикуліт) – 2-4 тижні;
бактеріальний менінгіт (залежно від етіологічного збудника) – 7-21 день;
інфекція вентрикуло-перитонеального шунта – 10-21 день;
4) кістки:
остеомієліт – 3-4 тижні;
септичний артрит – 2-3 тижні;
5) стійка афебрильна нейтропенія;
6) захворювання, що спричинені полі- і панрезистентними мікроорганізмами (рекомендовано досягнути повної ерадикації з метою уникнення подальшого розповсюдження).
33. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, антибіотикотерапія здійснюється одночасно із проведенням хірургічного контролю джерела інфекції (за потреби):
1) хірургічне розкриття і дренування вогнища бактеріальної інфекції (абсцесів та флегмон);
2) видалення інфікованого судинного катетера (венозного периферійного/центрального чи артеріального), уретрального катетера, шунта, дренажу, імпланта (ендопротез суглоба, ортопедична конструкція, серцеві клапани, кардіовертер-дефібрилятор, електроди, косметичні імпланти, венозні порти тощо);
3) активна аспірація і санація вогнища захворювання бактеріальної етіології.
Проведення подовженої антибіотикотерапії у якості заміни хірургічного контролю джерела інфекції заборонено.
34. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, антибактеріальні препарати слід вводити відповідно до інструкції для медичного використання. Шляхи введення антибактеріальних препаратів – пероральний, внутрішньовенний, внутрішньокістковий та в деяких випадках – інгаляційний. Такі шляхи введення, як інтраартеріальний, ендолімфатичний, внутрішньочеревний, внутрішньом’язовий та безпосередньо в рану, не мають доведених переваг, тому їхнє застосування заборонено.
35. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, внутрішньом’язовий шлях введення антибактеріальних препаратів може використовуватись лише у таких випадках:
1) технічна неможливість встановлення надійного внутрішньовенного чи внутрішньокісткового доступу за необхідності надання пацієнтові невідкладної медичної допомоги;
2) інструкція для медичного застосування лікарського засобу передбачає виключно внутрішньом’язовий шлях введення антибактеріального препарату (внутрішньовенний шлях введення заборонено).
36. У ЗОЗ, що надають первинну медичну допомогу, призначення ін’єкційних лікарських форм антибактеріальних препаратів, включно із внутрішньом’язовим введенням, заборонено.
Лікарям ЗОЗ, що надають первинну медичну допомогу, призначати внутрішньом’язове введення антибактеріальних препаратів пацієнтами самостійно або їхніми родичами/законними опікунами/іншими особами на дому заборонено.
37. У ЗОЗ внутрішньовенне введення антибактеріальних препаратів пацієнтам має бути призначено у таких випадках:
1) інфекційна хвороба вимагає тривалої антибіотикотерапії (сепсис/септичний шок, бактеріємія, фунгемія, остеомієліт, бактеріальний ендокардит, гнійний артрит, менінгіт, внутрішньочерепний абсцес, тяжкі інфекційні захворювання м’яких тканин та внутрішніх органів, КАІК);
2) тяжкий загальний стан пацієнта, який зумовлений порушенням свідомості, нестабільною гемодинамікою та/або дихальною недостатністю;
3) відсутність альтернативної ентеральної лікарської форми;
4) пацієнт отримує повне парентеральне харчування, не здатен ковтати, або має блювоту, що не піддається медикаментозній корекції, або існує високий ризик аспірації ліків/їжі/води/шлункового вмісту;
5) проведення постійної назогастральної аспірації або двічі отримано аспірат об’ємом >150 мл протягом 24 год;
6) клінічні стани, які пов’язані зі зміною абсорбції діючої речовини лікарського засобу (активна ШКК, синдром мальабсорбції, стан після резекції проксимального відділу ШКТ, синдром короткої кишки, муковісцидоз (кістозний фіброз), некротизуючий ентероколіт у новонароджених, запальні захворювання проксимального відділу тонкої кишки, обструкція ШКТ, гастропарез та ін.);
7) відмова пацієнта приймати лікарські засоби перорально, оформлена документально;
8) потреба лікувати новонароджену дитину в перші 28 днів життя.
38. Пацієнта, який отримує антибактеріальний препарат у ЗОЗ у вигляді парентеральних лікарських форм (внутрішньовенно/внутрішньокістково), слід перевести на ентеральне введення антибактеріального препарату (ступінчаста антибіотикотерапія), щойно це стане можливим клінічно та з урахуванням таких критеріїв:
1) інфекційна хвороба вимагає продовження антибіотикотерапії;
2) наявна доступна лікарська форма антибактеріального препарату для перорального застосування;
3) афебрильна температура тіла пацієнта (36,0 °C < t < 37,1 °C) зберігається протягом 24-48 год без застосування антипіретиків;
4) стабільний загальний клінічний стан пацієнта: у свідомості, гемодинаміка стабільна, дихальна недостатність відсутня;
5) лабораторні маркери запалення повернулися до нормальних значень або зменшилися на >50%;
6) пацієнт здатен ковтати та/або пацієнт отримує повне (100%) або часткове (>50%) ентеральне харчування;
7) новонародженому виповнилося >28 днів (можливий варіабельний ступінь абсорбції у новонароджених віком <28 днів);
8) пацієнт виявляє прихильність до запропонованого підходу до лікування.
39. Пероральне введення антибактеріальних препаратів має такі переваги:
1) зниження ризику розвитку КАІК у пацієнта;
2) зниження ризику розвитку ускладнень, що пов’язані з інфузією у пацієнта (тромбофлебіт та ін.);
3) зниження вартості лікування пацієнта;
4) вищий рівень прихильності пацієнтів до лікування;
5) зниження ризику травмування та/або інфікування медичних працівників, що пов’язано з виконанням ін’єкцій;
6) зменшення тривалості госпіталізації пацієнтів.
40. Для переходу з парентерального на пероральний прийом обраний антибактеріальний препарат має відповідати таким критеріям:
1) МНН (основна діюча речовина) відповідає (ідентична) або належить до того самого класу, що й парентеральний антибактеріальний препарат;
2) спектр антимікробної активності відповідає парентеральному антибактеріальному препарату або мікробіологічне дослідження підтвердило чутливість визначено збудника до МНН (основної діючої речовини) перорального антибактеріального препарату;
3) пероральний антибактеріальний препарат має оптимальний фармакокінетичний профіль (дозволяє досягти бактерицидної тканинної концентрації антибактеріального препарату в місці локалізації інфекційного запального процесу).
Примірна схема переведення пацієнта з парентеральної (внутрішньовенної) на ентеральну лікарську форму антибактеріального препарату наведена у додатку 2 до цього Стандарту.
41. Оцінку ефективності антибіотикотерапії та рішення щодо її припинення приймається лікуючим лікарем на основі комплексу клінічних і лабораторних показників. Припинення антибіотикотерапії необхідно розглянути після досягнення пацієнтом таких критеріїв:
1) нормалізація температури тіла (<37,5 оС) протягом 24-48 год без використання антипіретиків;
2) зникнення та/або значене ослаблення проявів основних клінічних симптомів/синдромів інфекційної хвороби;
3) тенденція до нормалізації або нормалізація основних лабораторних показників (наприклад, зниження лейкоцитозу, нейтрофільозу, зменшення зсуву лейкоцитарної формули вліво, нормалізація або зниження більш ніж на 80% рівня прокальцитоніну);
4) ерадикація бактерій із крові/інших стерильних локусів або зменшення їх кількості в нестерильному локусі (наприклад, аспірат із трахеї, матеріал із рани, сечі);
5) відсутність ознак поліорганної недостатності, яка пов’язана із інфекційною хворобою.
ІІІ. Заходи, спрямовані на зменшення нераціонального використання антибактеріальних препаратів
1. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, адміністративні обмеження відпуску передбачають використання СОП з адміністрування призначення антибактеріальних препаратів, які розробляються фармацевтом клінічним ВІК ЗОЗ та затверджуються керівником ЗОЗ, відповідно до Інструкції (далі – СОП з адміністрування призначення антибактеріальних препаратів).
2. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, запаси антибактеріальних препаратів слід зберігати виключно на території складського приміщення аптеки, що є невід’ємним структурним підрозділом цих ЗОЗ. На території терапевтичних і хірургічних відділень ЗОЗ дозволено зберігати лише таку кількість антибактеріальних препаратів, яка буде використана (введена пацієнтам) протягом 24 год після надходження. На території ВАІТ дозволено зберігати запас антибактеріальних препаратів, об’єм якого дорівнює передбачуваній потребі протягом 48 год з урахуванням наступного:
1) кількості ліжок у ВАІТ (КЛ);
2) переліку антибактеріальних препаратів, що включені до групи доступу (А) та використовуються у ВАІТ, відповідно до прикладу, наведеного у додатку 3 до цього Стандарту;
3) переліку антибактеріальних препаратів, що включені до групи спостереження (B) та використовуються у ВАІТ;
4) окремо для кожної МНН, відповідно до інструкції для медичного застосування лікарського засобу, встановлюється кількість одиниць лікарської форми, яка необхідна для лікування одного пацієнта у ВАІТ протягом 48 год (ОЛФ1);
5) окремо для кожної МНН, розраховується загальна кількість одиниць лікарської форми (ОЛФзаг) за умови, що зайняті всі ліжка у ВАІТ, за формулою:
ОЛФзаг = ОЛФ1 × КЛ.
3. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, для отримання антибактеріальних препаратів, лікуючий лікар заповнює, а старша сестра медична клінічного підрозділу ЗОЗ надсилає до аптеки бланк замовлення довільної форми на отримання антибактеріальних препаратів із зазначенням наступного:
1) номер медичної карти стаціонарного хворого;
2) причина призначення антибактеріальних препаратів (інфекційна хвороба/синдром);
3) діюча речовина антибактеріального препарату (МНН);
4) доза або концентрація в одиниці лікарської форми (г, мг, мг/мл, МО, OД);
5) лікарська форма (таблетки, капсули, флакони, ампули, небули);
6) кількість одиниць лікарської форми;
7) шлях введення;
8) передбачувана тривалість лікування (години/дні);
9) дата наступного перегляду призначення антибактеріального препарату.
Приклад бланку замовлень на отримання АМП та інструкцію до його
заповнення наведено у додатку 4 до цього Стандарту.
4. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, бланк замовлень на отримання антибактеріальних препаратів розглядаються фармацевтом аптечного підрозділу ЗОЗ та, у разі необхідності проведення проспективного фармацевтичного консультування та/або здійснення процедури преавторизації, фармацевтом клінічним ВІК ЗОЗ. Порядок відпуску антибактеріальних препаратів з аптеки ЗОЗ такий:
1) антибактеріальні препарати, що включені до групи доступу (А) відпускаються фармацевтом аптечного підрозділу ЗОЗ відповідно до СОП з адміністрування призначення антибактеріальних препаратів (перелік антибіотиків групи доступу (А) наведений у додатку 3 до цього Стандарту);
2) антибактеріальні препарати, що включені до групи спостереження (B) відпускаються фармацевтом аптечного підрозділу ЗОЗ відповідно до СОП з адміністрування призначення антибактеріальних препаратів і потребують проведення фармацевтом клінічним ВІК ЗОЗ проспективного фармацевтичного консультування (перелік антибіотиків групи спостереження наведений у додатку 3 до цього Стандарту);
3) антибактеріальні препарати, що включені до групи резерву (С) відпускаються фармацевтом аптечного підрозділу ЗОЗ відповідно до СОП з адміністрування призначення антибактеріальних препаратів після проходження процедури преавторизації антибіотиків групи резерву, відповідно до Інструкції. Призначення антибактеріальних препаратів, які включені до групи резерву (С), потребує проведення фармацевтом клінічним ВІК ЗОЗ проспективного фармацевтичного консультування.
5. У ЗОЗ, що надають первинну медичну допомогу, призначення антибактеріальних препаратів пацієнтам здійснюється шляхом заповнення рецептурних бланків № 1 (ф‑1), для виписування лікарських засобів і виробів медичного призначення, що відпускаються за повну вартість, безоплатно або з доплатою, затверджених наказом Міністерства охорони здоров’я від 19 липня 2005 року № 360, зареєстрованих у Міністерстві юстиції України 20 липня 2005 року за № 782/11062 (далі – рецептурний бланк № 1).
6. У ЗОЗ, що надають первинну медичну допомогу, лікуючий лікар може застосувати очікувальну тактику і призначити антибактеріальні препарати відстрочено, шляхом заповнення рецептурного бланку № 1 (ф‑1) «відстрочений рецепт», який буде використано пацієнтом у разі необхідності (появи/виникнення показань/симптомів/клінічних станів), у таких випадках:
1) пацієнт має інфекційну хворобу передбачувано вірусної етіології, яка має самолімітуючий характер і не потребує антибіотикотерапії, але пацієнт має високий ризик розвитку вторинної бактеріальної ко-інфекції/суперінфекції;
2) пацієнт має інфекційну хворобу передбачувано бактеріальної етіології, яка не потребує антибіотикотерапії, але пацієнт має високий ризик розвитку ускладнень;
3) пацієнт має інфекційну хворобу передбачувано бактеріальної етіології, яка потребує етіотропної антибіотикотерапії (відповідно до даних чутливості збудника до антибактеріальних препаратів), але на момент обстеження результати мікробіологічного дослідження відсутні;
4) лікуючий лікар зрозумілою мовою та у доступний для пацієнта спосіб (його родичів/законних опікунів) пояснює суть захворювання, необхідність призначення/уникнення антибіотикотерапії і клінічні ознаки ускладнень хвороби/ приєднання вторинної бактеріальної ко-інфекції/суперінфекції, які потребують початку проведення антибіотикотерапії.
Лише у випадку настання визначених лікуючим лікарем критеріїв (наприклад, погіршення клінічного стану пацієнта, отримано результати мікробіологічних досліджень, якими підтверджено бактеріальну етіологію хвороби), пацієнт звертається до аптечного закладу, отримує призначений антибактеріальний препарат і починає його прийом та повідомляє про це лікуючого лікаря.
7. Перед початком антибіотикотерапії лікуючий лікар надає зрозумілою мовою та у доступний для пацієнта (його родичів/законних опікунів) спосіб наступну інформацію:
1) причина призначення антибактеріального препарату;
2) МНН (основна діюча речовина);
3) лікарська форма антибактеріального препарату, шлях введення та індивідуальні особливості дозування антибактеріального препарату (за наявності);
4) запланована тривалість антибіотикотерапії;
5) особливості взаємодії антибактеріального препарату з їжею чи з іншими лікарськими засобами;
6) ознаки розвитку побічних реакцій внаслідок прийому призначеного антибактеріального препарату та способи їх усунення;
7) план дій на випадок невдачі призначеної антибіотикотерапії та/або погіршення загального клінічного стану пацієнта.
8. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, проспективне фармацевтичне консультування щодо оптимізації призначення антибактеріальних препаратів та інших лікарських засобів здійснюється фармацевтом клінічним ВІК ЗОЗ:
1) за запитом лікуючого лікаря;
2) відповідно до затвердженого керівником ЗОЗ переліку визначених категорій пацієнтів, синдромів/клінічних станів пацієнтів;
3) за групами спостереження (В) і резерву (С) антибактеріальних препаратів.
Рекомендації, що надаються фармацевтом клінічним ВІК в процесі проведення проспективного фармацевтичного консультування, обґрунтовуються і записуються у медичну карту.
Проспективне фармацевтичне консультування проводиться фармацевтом клінічним ВІК протягом усього часу перебування пацієнта в ЗОЗ з метою контролю модифікації антибіотикотерапії (наприклад, комбінування антибактеріальних препаратів, тривалість антибіотикотерапії, запобігання несприятливих лікарських взаємодій, деескалація/ескалація/оптимізація дозування антибактеріальних препаратів, зміна лікарської форми антибактеріального препарату) і навчання лікуючих лікарів раціональному використанню антибактеріальних препаратів.
9. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, до переліку визначених категорій пацієнтів, синдромів/клінічних станів пацієнтів щодо яких здійснюється проспективне фармацевтичне консультування необхідно включити (за потреби, перелік може бути розширено рішенням керівника ЗОЗ):
1) відсутність результатів мікробіологічного дослідження біологічних зразків через 72 год після початку введення антибактеріального препарату із широким спектром дії;
2) неефективність антибіотикотерапії першої лінії (емпіричної або після отримання результатів мікробіологічного дослідження);
3) нераціональне призначення антибактеріального препарату (наприклад, невідповідні доза, лікарська форма, шлях та/або кратність введення, тривалість призначення антибактеріального препарату);
4) призначення антибактеріального препарату здійснюється поза інструкцією для медичного застосування лікарського засобу або призначення не відповідає затвердженому в ЗОЗ СОП з адміністрування призначення антибактеріальних препаратів;
5) проведення антибіотикотерапії понад термін, який встановлено для інфекційної хвороби, відповідно до протоколів /алгоритмів лікування;
6) тривалість парентерального введення антибактеріального препарату перевищує 72 год;
7) однотипні призначення антибактеріальних препаратів для більшості пацієнтів одного з клінічних підрозділів ЗОЗ;
8) призначення антибактеріальних препаратів із групи резерву (С) з або без проведення процедури преавторизації;
9) призначення антибактеріальних препаратів з метою лікування тяжких інфекційних хвороб (наприклад, сепсис/септичний шок, інфекційний ендокардит, остеомієліт, менінгіт, інфекційні хвороби, що призвели до розвитку поліорганної недостатності);
10) виявлення у пацієнта МАМР з групи ESKAPE;
11) призначення антифунгальних препаратів для системного застосування (наприклад, ехінокандини, вориконазол, позаконазол, ліпосомальний амфотерицин B);
12) призначення комбінацій антимікробних препаратів;
13) розвиток тяжких побічних реакцій після введення антибактеріального препарату (наприклад, органна токсичність, алергічні та псевдоалергічні реакції, захворювання, викликані Clostridium difficile);
14) призначення антибіотикотерапії пацієнтам з нирковою/печінковою недостатністю, ожирінням, кахексією, вагітним, пацієнтам дитячого віку;
15) наявність ризику несприятливої взаємодії антибактеріального препарату з іншими призначеними лікарськими засобами;
16) необхідність проведення ТЛМ;
17) необхідність проведення контролю прихильності пацієнта до призначеного лікування;
18) необхідність продовження прийому антибактеріального препарату після закінчення стаціонарного лікування (перед консультуванням пацієнта та/або родичів та/або законних опікунів).
10. У ЗОЗ, що надають первинну медичну допомогу, слід забезпечити можливість проведення телемедичного консультування щодо раціонального застосування антибактеріальних препаратів, відповідно до Порядку організації медичної допомоги на первинному, вторинному (спеціалізованому), третинному (високоспеціалізованому) рівнях із застосуванням телемедицини, затвердженого наказом МОЗ України від 19 жовтня 2015 року № 681, зареєстрованого в Міністерстві юстиції України 09 лютого 2015 року за № 1400/27845.
11. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, ретроспективний аудит призначень антибактеріальних препаратів здійснюється фармацевтом клінічним ВІК, з метою визначення ступеня дотримання рекомендацій щодо раціональної антибіотикотерапії шляхом проведення вибіркової перевірки медичних карт, відповідно до Інструкції.
12. Лікуючому лікарю необхідно проводити первинну оцінку ефективності антибіотикотерапії та доцільність її продовження кожні 48-72 год після початку введення антибактеріального препарату, з урахуванням:
1) динаміки проявів синдрому системної запальної відповіді (включно із лабораторним визначенням рівню прокальцитоніну);
2) загального клінічного стану пацієнта;
3) даних щодо чутливості до антибактеріального препарату.
Одразу після початку прийому антибактеріального(их) препарату(ів) пацієнтом (у межах перших 12-24 год) оцінювати ефективність лікування не рекомендовано, оскільки максимальна бактерицидна дія розвивається, як правило, через 24-48 год. Виключеннями є випадки швидко прогресуючого погіршення клінічного стану пацієнта (наприклад, порушення свідомості, нестабільність гемодинаміки, тяжка дихальна недостатність) або отримання результатів мікробіологічного дослідження, що вказують на потребу ранньої корекції антибіотикотерапії.
У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, лікуючому лікарю слід проводити щоденний моніторинг ефективності лікування та оцінку можливості його припинення із використанням клінічних і/або лабораторних критеріїв припинення антибіотикотерапії.
12. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, лікуючому лікарю при первинному призначенні пацієнтові парентерального введення антибактеріальних препаратів рекомендовано передбачити можливість деескалації антибіотикотерапії (наприклад, обрати антибактеріальний препарат, який має лікарські форми для парентерального і перорального прийому).
ІV. Заходи, спрямовані на обмеження використання окремих класів антибактеріальних препаратів у ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу
1. З метою зниження розповсюдження мікроорганізмів із резистентністю до антибактеріальних препаратів не рекомендовано:
1) використовувати цефалоспорини ІІІ покоління для емпіричної антибіотикотерапії ІПНМД. Першочергове використання піперациліну/тазобактаму або іміпенему/циластатину може сприяти зниженню частоти виділення ESBL;
2) поєднувати два β-лактамні антибактеріальні препарати (цефалоспорини III/IV покоління з карбапенемами або цефалоспорини III/IV покоління з інгібіторзахищеними пеніцилінами, або карбапенеми з інгібіторзахищеними пеніцилінами);
3) призначати комбінацію фторхінолонів та антипсевдомонадних карбапенемів (іміпенем, меропенем, доріпенем);
4) призначати антибактеріальні препарати проти Р. aeruginosa (цефепім, цефтазидим, цефоперазон/сульбактам, піперацилін/тазобактам, іміпенем/циластатин, меропенем) за умови відсутності підтвердження наявності інфекційної хвороби, спричиненої Р. aeruginosa;
5) призначати карбапенеми у ЗОЗ, де розповсюдженість ESBL низька відповідно до даних локального мікробіологічного моніторингу;
6) поєднувати β-лактамні антибактеріальні препарати з аміноглікозидами, або фторхінолонами, або поліміксином для лікування інфекційних хвороб, що спричинені CRE (комбіновану антибіотикотерапію необхідно якомога скоріше замінити монотерапією, спираючись на результати мікробіологічних досліджень);
7) поєднувати антибактеріальні препарати, що впливають на анаеробні мікроорганізми (наприклад, метронідазол з карбапенемами або метронідазол з інгібіторзахищеними пеніцилінами (ампіцилін/сульбактам, амоксицилін/клавуланова кислота або піперацилін/тазобактам) або метронідазол з лінкозамідами);
8) поєднувати декілька антибактеріальних препаратів, що впливають на MRSA (даптоміцин з лінезолідом, або даптоміцин з ванкоміцином, або ванкоміцин з лінезолідом);
9) призначати антибактеріальні препарати проти MRSA за умови відсутності підтвердження наявності MRSA-інфекції у пацієнта;
10) призначати антибактеріальні препарати, що мають специфічну активність щодо грампозитивних мікроорганізмів, у ЗОЗ, де існують низькі рівні виявлення MRSA, відповідно до даних локального мікробіологічного моніторингу;
11) призначати ванкоміцин з метою лікування MSSA-інфекції;
12) рутинно призначати з метою емпіричної антибіотикотерапії комбінацію респіраторних фторхінолонів з макролідами (моксифлоксацину або левофлоксацину з азитроміцином);
13) призначати з метою емпіричної антибіотикотерапії інфекційних хвороб верхніх та нижніх дихальних шляхів макроліди у якості першої лінії терапії;
14) призначати цефтріаксон з метою лікування тяжких інфекційних хвороб, що спричинені MSSA (наприклад, бактеріємія, пневмонія), інфекційних хвороб, що спричинені Enterobacter spp. (оскільки серед Enterobacter spp. відзначається висока поширеність продуцентів β-лактамаз класу Amp-C), нейросифілісу;
15) призначати цефепім із метою лікування інфекційних хвороб, що спричинені E. coli, Proteus, Klebsiella spp. (оскільки серед цих мікроорганізмів відзначається висока поширеність ESBL), за умови що МІК цефтріаксону >1 мг/л;
16) призначати цефепім у комбінації з іншими β-лактамами широкого спектра дії (наприклад, меропенем, піперацилін/тазобактам);
17) призначати комбінацію бактерицидного і бактеріостатичного антибактеріальних препаратів, за виключенням якщо таке поєднання передбачено чинними галузевими стандартами медичної допомоги;
18) призначати цефтріаксон передчасно народженим немовлятам (термін вагітності менше 37 тижнів).
2. Призначення антибактеріального препарату із групи резерву (С) здійснюється виключно шляхом проведення преавторизації, відповідно до Інструкції.
3. Преавторизація може бути відстрочена у випадку відсутності фармацевта клінічного ВІК ЗОЗ (відсутність/неробочий час) і зважаючи на наявність у пацієнта загрозливого для життя клінічного стану (наприклад, сепсис/септичний шок, які супроводжуються порушенням свідомості, нестабільністю гемодинаміки та дихальною недостатністю). У таких виключних випадках дозволено призначення антибактеріального препарату з групи резерву (С) у ВАІТ протягом перших 24 год з наступним обов’язковим проведенням проспективного фармацевтичного консультування.
4. У випадку виявлення у пацієнта інфекційної хвороби, спричиненої MSSA, емпіричне призначення ванкоміцину внутрішньовенно необхідно замінити на β-лактамний антибактеріальний препарат, відповідно до отриманих результатів мікробіологічних досліджень та чутливості до антибактеріального препарату.
5. З метою лікування пацієнта з тяжким ураженням шкіри та/або м’яких тканин, що спричинене MRSA, необхідно призначити глікопептиди (ванкоміцин або тейкопланін) внутрішньовенно. У випадку неможливості призначення пацієнту ванкоміцину/тейкопланіну, слід розглянути призначення оксазолідинонів (лінезолід/тедізолід) або ліпопептидів (даптоміцин) внутрішньовенно. У випадку неефективності вищезазначених антибактеріальних препаратів необхідно розглянути призначення гліцилциклінів (тайгециклін), цефалоспоринів V покоління (цефтаролін), фторхінолонів (делафлоксацин) або гліколіпопептидів (орітаванцин/телаванцин) внутрішньовенно.
6. З метою лікування пацієнта з неускладненою інфекцією нижніх сечових шляхів, спричиненою MRSA, слід призначити доксициклін, сульфаметоксазолу/триметоприм або ципрофлоксацин перорально.
З метою лікування пацієнта з ускладненою інфекцією нижніх сечових шляхів, спричиненою MRSA, необхідно призначити глікопептиди (ванкоміцин або тейкопланін) внутрішньовенно. У випадку неможливості призначення пацієнту ванкоміцину/тейкопланіну, необхідно призначити даптоміцин внутрішньовенно.
Використовувати лінезолід внутрішньовенно з метою лікування інфекції нижніх сечових шляхів не рекомендовано, через недосягнення достатніх концентрацій препарату у сечі.
7. Перед початком лікування пацієнта з КАІСШ, що спричинена MRSA, слід замінити уретральний катетер. З метою лікування КАІСШ необхідно призначити однократне введення аміноглікозидів внутрішньовенно, за виключенням випадків виявлення АМР до аміноглікозидів. У випадку неможливості призначення пацієнту аміноглікозидів (наприклад, резистентність до них MRSA, індивідуальна непереносимість), слід призначити одноразове введення разової дози глікопептиду внутрішньовенно (ванкоміцин або тейкопланін).
8. З метою лікування пацієнта з інфекційними хворобами кісток та/або суглобів (наприклад, остеомієліт, септичний артрит), які викликані MRSA, необхідно призначати глікопептиди (ванкоміцин або тейкопланін) внутрішньовенно. Тривале призначення глікопептидів внутрішньовенно потребує проведення ТЛМ. У випадку неможливості призначення пацієнту ванкоміцину/тейкопланіну слід призначити даптоміцин або лінезолід внутрішньовенно.
Проведення хірургічного контролю джерела інфекції протягом лікування інфекційних хвороб кісток та/або суглобів є обов’язковим.
Деескалаційний підхід до антибіотикотерапії пацієнтів з інфекційними хворобами кісток та/або суглобів передбачає перехід на пероральний прийом кліндаміцину, сульфаметоксазолу/триметоприму, доксицикліну або лінезоліду, відповідно до даних чутливості до антибактеріального препарату збудника хвороби. Пероральне використання рифампіцину, фузидієвої кислоти або фторхінолонів дозволено виключно у комбінації з іншим антибактеріальними препаратами, відповідно до даних чутливості до антибактеріального препарату збудника хвороби.
9. З метою лікування пацієнта з неускладненою бактеріємією, спричиненою MRSA, необхідно призначити ванкоміцин внутрішньовенно. У випадку неможливості призначення пацієнту глікопептидів, слід призначити лінезолід внутрішньовенно. У випадку неефективності вищезазначених антибактеріальних препаратів необхідно призначити даптоміцин або тейкопланін внутрішньовенно. Заборонено використовувати сульфаметоксазол/триметоприм як засіб першої лінії для лікування бактеріємії, спричиненої MRSA, однак слід розглянути можливість його застосування при переході на пероральний прийом з метою деескалації антибіотикотерапії, відповідно до даних чутливості MRSA до антибактеріальних препаратів.
10. З метою лікування пацієнта з некротизуючою пневмонією, спричиненою MRSA, слід призначити ванкоміцин або лінезолід внутрішньовенно. Лікуючому лікарю рекомендовано розглянути доцільність додаткового призначення кліндаміцину або рифампіцину внутрішньовенно, відповідно до даних чутливості MRSA до антибактеріальних препаратів.
11. З метою лікування пацієнта з нозокоміальною пневмонією (включно з ВАП), спричиненою MRSA, необхідно призначити ванкоміцин або лінезолід внутрішньовенно. Введення даптоміцину даній категорії пацієнтів протипоказано внаслідок його інактивації сурфактантом легень.
12. З метою лікування пацієнта з тяжкою інфекцією верхніх дихальних шляхів (в тому числі ЛОР-органів), що спричинена MRSA, слід призначити глікопептиди внутрішньовенно (ванкоміцин або тейкопланін). Якщо захворювання має легкий або середній ступінь тяжкості необхідно призначити доксициклін або сульфаметоксазол/триметоприм перорально, відповідно до даних чутливості MRSA до антибактеріальних препаратів.
13. З метою лікування пацієнта з внутрішньочерепними або спінальними абсцесами, спричиненими MRSA, слід призначити ванкоміцин або лінезолід внутрішньовенно. За відсутності протипоказань, проведення хірургічного контролю джерела інфекції є обов’язковим.
14. З метою лікування пацієнта з менінгітом, що спричинений MRSA, необхідно призначити ванкоміцин внутрішньовенно (монотерапія) або комбінацію ванкоміцину з рифампіцином. Проведення ТЛМ щодо ванкоміцину є обов’язковим. У випадку неефективності внутрішньовенного введення ванкоміцину, лікуючому лікарю рекомендовано розглянути доцільність інтравентрикулярного введення ванкоміцину.
Кліндаміцин, хлорамфенікол (левоміцетин) та лінезолід призначати з метою лікування менінгіту, спричиненого MRSA, заборонено, оскільки вони відносяться до бактеріостатичних антибактеріальних препаратів.
15. З метою лікування пацієнта з неускладненим циститом і наявної обґрунтованої підозри/підтвердження наявності грам негативних продуцентів ESBL, у якості емпіричної/стартової антибіотикотерапії слід призначити пероральні нітрофурани (нітрофурантоїн) або сульфаметоксазол/триметоприм. У випадку неможливості призначення пацієнту нітрофуранів (нітрофурантоїн) або сульфаметоксазолу/триметоприму необхідно призначити перорально амоксицилін/клавулонову кислоту або внутрішньовенно аміноглікозиди (одноразове введення разової дози).
Пероральне призначення фосфоміцину з метою лікування пацієнта з неускладненим циститом показано виключно у випадку мікробіологічного підтвердження E. coli, оскільки інші грамнегативні продуценти ESBL (K. pneumoniae, Klebsiella spp, Enterobacter spp. та Serratia marcescens) часто є носіями гена резистентності fosA.
З метою лікування пацієнта з неускладненим циститом і наявною обґрунтованою підозрою/підтвердженням наявності грамнегативних продуцентів ESBL призначати фторхінолони (ципрофлоксацин, левофлоксацин) або карбапенеми (ертапенем, іміпенем/циластатин, меропенем) слід виключно за умови терапевтичної невдачі попередньо призначеної антибіотикотерапії.
У разі відсутності можливості визначення механізмів резистентності E. coli, K. pneumoniae, K. oxytoca, P. mirabilis ці мікроорганізми необхідно вважати продуцентами ESBL, якщо МІК цефтріаксону >2 мкг/мл.
16. З метою лікування пацієнта з неускладненим циститом та обґрунтованої підозри/підтвердження наявності CRE, у якості емпіричної/стартової антибіотикотерапії слід призначати фторхінолони (ципрофлоксацин, левофлоксацин), сульфаметоксазол/триметоприм, нітрофурани (нітрофурантоїну) або одноразове введення разової дози аміноглікозидів (амікацин чи плазоміцин).
Тривалу інфузію меропенему (до ерадикації збудника) необхідно призначити з метою лікування пацієнта з неускладненим циститом, що спричинений:
1) CRE, стійким до ертапенему, але чутливим до меропенему;
2) за неможливості лабораторного підтвердження продукції карбапенемаз;
3) з лабораторно підтвердженою відсутністю продукції карбапенемаз.
Призначати меропенем із метою лікування пацієнта з неускладненим циститом, що спричинений CRE (з лабораторно підтвердженою продукцією карбапенемаз), заборонено, у тому числі у випадку лабораторно підтвердженої чутливості CRE до меропенему.
У випадку неможливості призначення пацієнту вищезазначених антибактеріальних препаратів слід призначити цефтазидим/авібактам, або меропенем/ваборбактам, або іміпенем/циластатин/релебактам, або цефідерокол.
Призначення колістину необхідно розглядати виключно у випадку невдачі лікування вищезазначеними антибактеріальними препаратами.
17. З метою лікування пацієнта з неускладненим циститом та обґрунтованої підозри/підтвердженої наявності P. aeruginosa у якості емпіричної/стартової антибіотикотерапії слід використати цефтолозан/тазобактам, або цефтазидим/авібактам, або іміпенем/релебактам, або цефідерокол, або одноразове внутрішньовенне введення разової дози аміноглікозидів (амікацин або плазоміцин).
Призначення колістину необхідно розглядати виключно у випадку невдачі лікування вищезазначеними антибактеріальними препаратами.
18. З метою лікування пацієнта з пієлонефритом або уІСШ та обґрунтованої підозри/підтвердженої наявності грамнегативних МАМР-продуцентів ESBL, у якості емпіричної антибіотикотерапії слід призначити карбапенеми (ертапенем або іміпенем/циластатин, або меропенем), фторхінолони (ципрофлоксацин або левофлоксацин) або сульфаметоксазол/триметоприм. У разі відсутності можливості визначення механізмів резистентності E. coli, K. pneumoniae, K. oxytoca або P. mirabilis, ці мікроорганізми необхідно вважати продуцентами ESBL, якщо МІК цефтріаксону >2 мкг/мл.
19. З метою лікування пацієнта з пієлонефритом або уІСШ та обґрунтованої підозри/підтвердженої наявності CRE слід призначити цефтазидим/авібактам, або меропенем/ваборбактам, або іміпенем/циластатин/релебактам, або цефідерокол.
Призначення тривалої інфузії меропенему (до ерадикації збудника) необхідне з метою лікування пацієнта з пієлонефритом або уІСШ, що спричинений:
1) CRE, стійким до ертапенему, але чутливим до меропенему;
2) за неможливості лабораторного підтвердження продукції карбапенемаз;
3) з лабораторно підтвердженою відсутністю продукції карбапенемаз.
Призначати меропенем з метою лікування пацієнта з пієлонефритом або уІСШ, що спричинений CRE (з лабораторно підтвердженою продукцією карбапенемаз), заборонено, у тому числі у випадку лабораторно підтвердженої чутливості CRE до меропенему.
У випадку неможливості призначення пацієнту вищезазначених антибактеріальних препаратів, слід використати одноразове введення разової дози аміноглікозидів (амікацин або плазоміцин).
20. З метою лікування пацієнта з пієлонефритом або уІСШ та обґрунтованої підозри/підтвердженої наявності P. aeruginosa у якості емпіричної антибіотикотерапії необхідно призначити цефтолозан/тазобактам, або цефтазидим/авібактам, або іміпенем/циластатин/релебактам, або цефідерокол.
Призначення колістину необхідно розглядати виключно у випадку невдачі лікування вищезазначеними антибактеріальними препаратами.
У випадку неможливості призначення пацієнту вищезазначених антибактеріальних препаратів слід використати одноразове введення добової дози аміноглікозидів (амікацин або плазоміцин).
21. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри/підтвердженої наявності грамнегативних продуцентів ESBL у якості емпіричної/стартової антибіотикотерапії необхідно призначити карбапенеми (ертапенем, або іміпенем/циластатин, або меропенем). У разі відсутності можливості визначення механізмів резистентності E. coli, K. pneumoniae, K. oxytoca або P. mirabilis їх необхідно вважати продуцентами ESBL, якщо МІК цефтріаксону >2 мкг/мл.
22. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри/підтвердженої наявності CRE слід призначити тривалу інфузію (до ерадикації збудника) меропенему, якщо:
1) CRE, стійкий до ертапенему та чутливий до меропенему;
2) за неможливості лабораторного підтвердження продукції карбапенемаз;
3) з лабораторно підтвердженою відсутністю продукції карбапенемаз.
Призначати меропенем з метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри/підтвердженої наявності CRE з лабораторно підтвердженою продукцією карбапенемаз, заборонено, в тому числі у випадку лабораторно підтвердженої чутливості CRE до меропенему.
У випадку неможливості призначення пацієнту тривалої інфузії меропенему у якості альтернативи необхідно призначити цефтазидим/авібактам.
23. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри або підтвердженої наявності грамнегативних МАМР – CRE (у тому числі карбапенемази, що продукуються K. pneumoniae – KPC), необхідно призначити цефтазидим/авібактам, або меропенем/ваборбактам, або іміпенем/циластатин/релебактам, якщо:
1) CRE (у тому числі продуцент KPC) стійкий до ертапенему та стійкий до меропенему;
2) за неможливості лабораторного підтвердження продукції карбапенемаз;
3) з лабораторно підтвердженою відсутністю продукції карбапенемаз.
У випадку неможливості призначення пацієнту вищезазначених антибактеріальних препаратів слід призначити цефідерокол.
Пацієнтам з інтраабдомінальними інфекційними хворобами, які викликані CRE (у тому числі продуцентами KPC), рекомендовано призначити тайгециклін або еравациклін.
24. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри/підтвердженої наявності грамнегативних МАМР-продуцентів метало-β-лактамаз (включно з NDM, VIM та IMP) необхідно призначити цефтазидим/авібактам у комбінації з азтреонамом або цефідерокол (монотерапія).
25. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами й обґрунтованої підозри/підтвердженої наявності грамнегативних МАМР-продуцентів карбапенемази OXA‑48 слід призначити цефтазидим/авібактам. У випадку неможливості призначення пацієнту цефтазидиму/авібактаму слід призначити цефідерокол.
26. З метою лікування пацієнта з інфекційною хворобою (інфекційним запаленням) поза сечовими шляхами та обґрунтованої підозри/підтвердженої наявності P. aeruginosa у якості емпіричної/стартової антибіотикотерапії необхідно призначити цефтолозан/тазобактам, або цефтазидим/авібактам, або іміпенем/циластатин/релебактам. У випадку неможливості призначення пацієнту вищезазначених антибактеріальних препаратів слід призначити цефідерокол або одноразове введення разової дози аміноглікозидів (амікацин або плазоміцин).
27. Призначення антибактеріальних препаратів у дітей має враховувати вікові обмеження й/або обмеження за масою тіла відповідно до інструкції для медичного застосування лікарського засобу.
Коментар робочої групи: Призначення антибактеріальних препаратів у новонароджених з профілактичною і лікувальною метою проводиться відповідно до діючих галузевих стандартів медичної допомоги.
Станом на 01.04.2022 лікарські засоби за міжнародними непатентованими назвами: тедізолід, цефтаролін, делафлоксацин, орітаванцин, телаванцин, плазоміцин, меропенем/ваборбактам, іміпенем/циластатин/релебактам, цефідерокол, еравациклін в Україні не зареєстровані.
V. Обґрунтування призначення антифунгальної терапії
1. Терапію антифунгальними (протигрибковими – ATC J02) лікарськими засобами для системного застосування слід призначати виключно за наявності у пацієнта лабораторно підтвердженої/обґрунтовано підозрюваної грибкової інфекції (мікозу).
2. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, лікуючий лікар повинен мати цілодобову можливість для збору зразків біологічного матеріалу, надсилання до мікробіологічної лабораторії та отримання результатів мікробіологічних досліджень. Для прийняття рішення щодо доцільності початку емпіричної антифунгальної терапії необхідно використовувати методи пришвидшеної ідентифікації збудника інфекційної хвороби.
3. Виявлення у пацієнта без ознак інфекційного запалення, штамів грибів-коменсалів (за результатами мікробіологічного дослідження) не є причиною (показанням) для призначення антифунгальних засобів (використання антифунгальних лікарських засобів із метою лікування пацієнта заборонено), за виключенням визначених галузевими стандартами медичної допомоги грибів, які підлягають обов’язковій ерадикації.
Персистенція грибів у кількості (102-103 КУО/мл) у нестерильному локусі або виділення із нестерильного локусу нового штаму грибів без клінічних симптомів інфекційного захворювання у пацієнта не може слугувати обґрунтуванням для початку, продовження або корекції антифунгальної терапії. Виділення мікроорганізмів зі стерильного локусу за відсутності клінічних симптомів інфекційного захворювання у пацієнта може свідчити про контамінацію біологічного зразка та потребує додаткового отримання матеріалу для проведення мікробіологічних досліджень.
Виділення Candida spp. та/або інших збудників інвазивних мікозів із стерильних локусів (наприклад, кров, ліквор, біоптат) є показанням для обов’язкового призначення системних антифунгальних препаратів (антифунгальна терапія ехінокандинами або азолами). Азоли слід призначати виключно при стабільному стані пацієнта та наявності мікробіологічно підтвердженого інфікування Candida albicans.
4. Мікробіологічне виділення із зразків біологічних матеріалів штамів грибів, які відносяться до умовно-патогенних та/або патогенних, і здатні викликати інвазивний мікоз, необхідно призначити або відкоригувати попередньо призначену антифунгальну терапію упродовж перших 12 год після отримання результатів дослідження, відповідно до встановленої чутливості до антифунгальних лікарських засобів.
5. Призначення антифунгальної терапії проводиться індивідуалізовано з урахуванням особливостей фармакокінетики лікарського засобу для кожного пацієнта окремо. Шлях введення антифунгальних лікарських засобів слід обирати таким чином, аби досягти фунгіцидних концентрацій антифунгального засобу у тканинах ділянки вогнища грибкової інфекції.
6. Обґрунтування призначення антифунгальної терапії має містити:
1) встановлений або з високою ймовірністю підозрюваний діагноз інфекційного (грибкового) захворювання та критерії, які враховувались для призначення антифунгальної терапії;
2) назва антифунгального лікарського засобу зазначається у формі МНН;
3) доза, лікарська форма, кратність та шлях введення антифунгального лікарського засобу;
4) тривалість антифунгальної терапії;
5) дата наступного перегляду та/або припинення призначеної антифунгальної терапії (через 48-72 год).
7. Призначення антифунгальних лікарських засобів здійснюється лікуючим лікарем із врахуванням епідеміологічних даних, чинників ризику, даних мікробіологічних досліджень.
8. До чинників ризику розвитку інвазивного кандидозу у пацієнта (не є причиною (показанням) до призначення антифунгальної, у тому числі профілактичної, терапії відносяться:
1) попереднє виявлення грибкової колонізації;
2) призначення антибактеріального препарату широкого спектра дії;
3) наявність внутрішньосудинних девайсів/пристроїв (наприклад, катетери, датчики, порти);
4) парентеральне харчування;
5) проведення гемодіалізу;
6) хронічна ниркова недостатність (ШКФ <30 мл/хв);
7) цукровий діабет у стадії декомпенсації;
8) панкреонекроз;
9) проведення абдомінальних хірургічних втручань;
10) нейтропенія;
11) трансплантація органів;
12) проведення імуносупресивної терапії;
13) онкологічні хвороби, клінічний перебіг яких супроводжується імуносупресією;
14) проведення променевої терапії;
15) опікова хвороба;
16) трансплантація гемопоетичних стовбурових клітин.
9. Профілактичне призначення антифунгальних лікарських засобів пацієнтам, які отримують антибіотикотерапію, за відсутності чинників ризику розвитку інвазивного кандидозу заборонено.
10. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, протягом застосування антифунгальних засобів необхідно щоденно контролювати стан пацієнта з метою оцінки клінічної ефективності лікування, реєстрації можливих побічних реакцій і визначення оптимальної тривалості лікування.
11. При встановленні альтернативного або скасування діагнозу мікозу необхідно припинити призначення антифунгального лікарського засобу.
12. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, антифунгальну терапію слід проводити одночасно із проведенням хірургічного контролю джерела грибкової інфекції (за необхідності):
1) хірургічне розкриття і дренування вогнища грибкової інфекції;
2) видалення інфікованого судинного катетера (венозного периферійного/центрального, артеріального), уретрального катетера, шунта, дренажу, імпланта (наприклад, ендопротез суглоба, ортопедична конструкція, серцеві клапани, кардіовертер-дефібрилятор, електрод, косметичні імпланти, венозний порт);
3) аспірація та санація вогнища грибкової інфекції.
13. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, лікуючому лікарю при первинному призначенні антифунгального лікарського засобу пацієнту парентерально рекомендовано передбачити можливість деескалації антифунгальної терапії (наприклад, обрати антифунгальний лікарський засіб, який має лікарські форми для парентерального й перорального прийому).
14. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, з метою профілактики інвазивного мікозу використання полієнових антифунгальних засобів, які не адсорбуються в ШКТ (наприклад, ністатин і натаміцин), флуконазолу в добовій дозі <400 мг та перорального кетоконазолу не рекомендовано.
15. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, емпіричне призначення азолів або ехінокандинів рекомендовано за наявності у пацієнта з нейтропенією рефрактерної до антимікробної терапії лихоманки.
16. У ЗОЗ, що надають вторинну (спеціалізовану) та третинну (високоспеціалізовану) медичну допомогу, у пацієнтів без нейтропенії, показаннями для емпіричної антифунгальної терапії (ехінокандини, флуконазол (у випадках коли він не використовувався із профілактичною метою), позаконазол) є такі клінічні стани/симптоми:
1) підвищення температури тіла невідомої етіології більше 4 діб та відсутність ефекту від емпіричної антимікробної терапії;
2) розповсюджена колонізація Candida spp. (три і більше локусів);
3) наявність двох і більше факторів ризику розвитку інвазивного кандидозу.
Коментар робочої групи: Призначення антифунгальних препаратів у новонароджених з профілактичною і лікувальною метою проводиться відповідно до діючих галузевих стандартів медичної допомоги.
VI. Контроль за побічними реакціями
1. Побічні реакції, що характерні для АМП (профіль безпеки), клінічна ефективність, а також активність по відношенню до мікроорганізмів складають перелік ключових чинників, що впливають на вибір раціональної антимікробної терапії. Примірна оцінка профілю безпеки АМП наведена в додатку 5 до цього Стандарту.
2. Побічні реакції на введення АМП за поширеністю шкоди поділяються:
1) загально-екологічні – індукція АМР (наприклад, селекція бактерій ESBL на фоні поширеного використання цефалоспоринів ІІІ покоління, поява MRSA на фоні використання фторхінолонів, селекція штамів P. aeruginosa з АМР у випадку використання антипсевдомонадних карбапенемів, виникнення інфекції C. difficile), що, у свою чергу, в майбутньому може зашкодити іншим особам;
2) індивідуальні – побічні реакції, які були виявлені або існує ризик їх появи у певного пацієнта.
3. Побічні реакції на введення АМП за часом та умовами виникнення поділяються:
1) тип A – передбачувані та залежні від дози побічні реакції, що зникають після припинення введення лікарського засобу або зменшення його дози. Такі побічні реакції можуть виникати у пацієнтів з варіабельними параметрами фармакокінетики (новонароджені, пацієнти з ожирінням/кахексією/гіпопротеїнемією або з печінковою/нирковою недостатністю) та за умови призначення АМП з вузьким терапевтичним індексом. Такі АМП часто викликають прояви органотоксичності (наприклад, нейро-, гепато-, нефротоксичність) та потребують проведення ТЛМ;
2) тип B – непередбачувані рідкісні та не залежні від дози побічні реакції (наприклад, реакції гіперчутливості на введення β-лактамів, розвиток тендинітів внаслідок прийому фторхінолонів). Прояви побічних реакцій типу В можуть зберігатись після припинення введення лікарського засобу або зменшення його дози. Пацієнтам, які мали в анамнезі прояви таких побічних реакцій, необхідно уникати вводити відповідні лікарські засоби в майбутньому;
3) тип C – довготривалі побічні реакції, клінічні прояви яких зберігаються тривалий час після припинення введення лікарського засобу (наприклад, лейкопенія після прийому хлорамфеніколу);
4) тип D – побічні реакції, що виникають через деякий час після прийому лікарського засобу (наприклад, канцерогенні чи тератогенні), що ускладнює встановлення причинно-наслідкового зв’язку;
5) тип E – побічні реакції, що виникають у зв’язку з припиненням введення лікарського засобу;
6) тип F:
невдача лікування, що пов’язана зі зміною чутливості мікроорганізму до призначеного АМП (розвиток АМР);
сумісний прийом АМП з іншими лікарськими засобами, що впливають на фармакокінетичний профіль призначеного АМП;
дозування АМП, що призводить до досягнення субтерапевтичних плазмових/тканинних концентрацій;
7) тип G – побічні реакції, що пов’язані з розвитком незворотних генетичних мутацій у осіб, які приймали лікарський засіб.
4. Лікуючий лікар проводить активне виявлення ознак побічної реакції на введення АМП, відповідно до інструкції для медичного застосування лікарського засобу.
5. Реєстрація та звітування щодо побічних реакцій при використанні АМП проводяться відповідно до Порядку здійснення фармаконагляду, затвердженого наказом Міністерства охорони здоров’я України від 27 грудня 2006 року № 898, зареєстрованого в Міністерстві юстиції України 29 січня 2007 року за № 73/13340. (Автоматизована інформаційна система з фармаконагляду доступна за посиланням: https://aisf.dec.gov.ua).
6. За наявності в анамнезі пацієнта підтвердженої тяжкої реакції гіперчутливості на введення АМП (або підозри на наявність причинно-наслідкового зв’язку між розвитком тяжкої реакції гіперчутливості та введенням АМП), лікуючий лікар:
1) вносить відомості про минулу (підозрювану) тяжку реакцію гіперчутливості до медичної або амбулаторної карти. Відомості повинні містити вичерпну інформацію про минулу (підозрювану) тяжку реакцію гіперчутливості, а саме: МНН та торгова назва АМП, дозування та шлях введення, опис минулої (підозрюваної) тяжкої реакції гіперчутливості, мета призначення АМП; дата, час та тривалість минулої (підозрюваної) тяжкої реакції гіперчутливості, кількість введених доз перед початком минулої (підозрюваної) тяжкої реакції гіперчутливості, дані щодо потреби у госпіталізації, джерело інформації про минулу (підозрювану) тяжку реакцію гіперчутливості;
2) попереджає про минулу (підозрювану) тяжку реакцію гіперчутливості у пацієнта медичних працівників, які залучені до призначення/введення АМП пацієнтові;
3) надає рекомендації пацієнтові, його родичам/законним опікунам щодо доцільності проведення подальшого обстеження та консультації з лікарем-імунологом/алергологом та/або специфічної десенситизації та/або уникнення введення підозрюваного АМП (у першу чергу β-лактамних антибактеріальних препаратів) у майбутньому;
4) розглядає доцільність призначення альтернативного АМП з іншого класу.
7. До тяжких реакцій гіперчутливості на введення β-лактамного антибактеріального препарату відносяться:
1) синдром Стівенса – Джонсона;
2) синдром Лаєлла (токсичний епідермальний синдром);
3) сироваткова хвороба;
4) гострий інтерстиційний нефрит;
5) гемолітична анемія;
6) DRESS-синдром (шкірний висип, еозинофілія та системні прояви, що пов’язані з прийомом лікарського засобу).
8. За наявності в анамнезі пацієнта тяжкої реакції гіперчутливості негайного типу (IgE-опосередкованої: поширеної кропив’янки, ангіоневротичного набряку, ларингоспазму, бронхоспазму, гіпотензії, колапсу або анафілаксії) на введення пеніциліну необхідно уникати призначення пеніцилінів/цефалоспоринів і розглянути доцільність призначення не β-лактамних антибактеріальних препаратів, або азтреонаму, або карбапенемів.
9. За наявності в анамнезі пацієнта реакції гіперчутливості негайного типу середньої тяжкості (IgE-опосередкованої: непоширеної кропив’янки або іншого висипу без системних проявів) на введення пеніциліну необхідно уникати призначення пеніцилінів та розглянути доцільність призначення цефалоспоринів, або карбапенемів, або азтреонаму. Необхідно уникати призначення цефалексину та цефаклору пацієнтам з відомою алергією на амоксицилін або ампіцилін.
10. За наявності в анамнезі пацієнта тяжкої реакції гіперчутливості сповільненого типу (T-лімфоцит-опосередкованої: тяжкі шкірні прояви або прояви інтерстиційного нефриту) на введення пеніциліну, необхідно уникати призначення пеніцилінів/цефалоспоринів і розглянути доцільність призначення не β-лактамних антибактеріальних препаратів, або азтреонаму, або карбапенемів. Необхідно уникати призначення проведення специфічної десенситизації та внутрішньошкірних проб (прик-тест).
11. За наявності в анамнезі пацієнта реакції гіперчутливості сповільненого типу середньої тяжкості (T-лімфоцит-опосередкованої: макуло-папулярний висип без системних проявів та залучення внутрішніх органів) на введення пеніциліну, необхідно уникати призначення пеніцилінів та розглянути доцільність призначення цефалоспоринів, або азтреонаму, або карбапенемів.
12. За наявності в анамнезі пацієнта імуноопосередкованої реакції гіперчутливості на введення пеніциліну/цефалоспоринів, слід уникати призначення всіх β-лактамних антибактеріальних препаратів та розглянути доцільність призначення азтреонаму.
13. За наявності в анамнезі пацієнта даних щодо реакції гіперчутливості на азтреонам або цефтазидим вводити цефтазидим або азтреонам (відповідно) пацієнту не рекомендовано через ризик розвитку перехресної реакції гіперчутливості.
14. За наявності в анамнезі пацієнта неімуноопосередкованої реакції гіперчутливості на введення пеніциліну введення пеніциліну та інших β-лактамних антибактеріальних препаратів є безпечним, зважаючи на низьку (<2%) перехресну реактивність.
15. Пацієнти, які в минулому не мали жодних проявів гіперчутливості на введення β-лактамних антибактеріальних препаратів або мали легкі прояви гіперчутливості, а саме шкірний висип без системних проявів, не потребують проведення діагностичного внутрішньошкірного введення антибактеріальних препаратів (шкірний прик-тест).
16. Пацієнтам, які в минулому на введення β-лактамних антибактеріальних препаратів мали тяжкі прояви гіперчутливості, а саме DRESS-синдром, синдром Стівенса – Джонсона, синдром Лаєлла (токсичний епідермальний синдром), проведення діагностичного внутрішньошкірного введення антибактеріальних препаратів (шкірний прик-тест) заборонено.
В.о. Генерального директора
Директорату громадського здоров’я та профілактики захворюваності О. Даниленко
* Друкується зі скороченнями. Повний текст – https://moz.gov.ua/uploads/7/37016-dn_822_17_05_2022_dod.pdf.