18 грудня, 2022
Практичні аспекти ведення пацієнтів із когнітивними розладами
Скажи мені – і я забуду, покажи мені – і я запам’ятаю, дай мені зробити – і я зрозумію
Конфуцій
 Найпоширенішим видом неврологічних розладів, який зустрічається у практиці лікарів різних спеціальностей, є порушення когнітивних функцій (КФ). Дуже важко уявити захворювання головного мозку або церебральне ускладнення соматичного захворювання, яке не мало б негативного впливу на КФ.
Найпоширенішим видом неврологічних розладів, який зустрічається у практиці лікарів різних спеціальностей, є порушення когнітивних функцій (КФ). Дуже важко уявити захворювання головного мозку або церебральне ускладнення соматичного захворювання, яке не мало б негативного впливу на КФ.
Ризик когнітивних розладів (КР) значно зростає за наявності таких захворювань, як артеріальна гіпертензія, цукровий діабет, ожиріння, гіперліпідемія тощо. Тому необхідна лікарська настороженість щодо КР під час роботи з пацієнтами похилого віку та/або за наявності в анамнезі серцево-судинних захворювань та інших чинників ризику КР.
Підставою для клінічного дослідження КФ є скарги пацієнта на забудькуватість, труднощі концентрації, зниження розумової працездатності або підвищену втомлюваність при інтелектуальній роботі. Іноді когнітивні скарги мають завуальований характер.
Зокрема, пацієнти з КР нерідко повідомляють про різні неприємні відчуття в голові («голова як чавунна», «як мішком вдарили», «важка голова», «несвіжа голова», «не моя, чужа»), які заважають зосередитися, працювати та виконувати звичні справи.
На наш погляд, подібні скарги також слід розцінювати як суб’єктивні еквіваленти КР. Пацієнт із виразними КР може зовсім не заявляти жодних скарг через зниження критики або анозогнозії. Джерелом інформації про когнітивне зниження в таких випадках є родичі пацієнта або інші близькі люди.
Для об’єктивізації стану КФ пацієнта застосовують нейропсихологічні методи дослідження. Найчастіше у клінічній практиці використовують Міні-дослідження розумового стану: Mini-Mental State Examination (MMSE) та Монреальський когнітивний тест (MoCa-тест) [9, 14].
Останній ефективніший, оскільки має більшу чутливість: МоСа-тест виявляє КР на більш ранніх стадіях. Наприклад, за даними авторів тесту, його чутливість (за критерієм діагнозу – 26 балів) при легких і помірних КР становить 90%, тоді як чутливість MMSE – лише 18% [14].
Про наявність об’єктивних КР у пацієнта можна говорити за двох умов:
1) за результатами тестів нижчеприйнятих нормативів (26 балів для МоСа-тесту та 25 балів для MMSE);
2) при анамнестичних даних щодо зниження КФ порівняно з преморбідним рівнем (індивідуальною нормою).
За наявності анамнестичних відомостей про когнітивне зниження важливим завданням лікаря є визначити стадію зниження, оскільки від цього залежить терапевтична тактика. Виокремлюють три стадії розвитку когнітивного дефіциту:
- Суб’єктивні КР – скарги на стійке зниження КФ порівняно з недавнім минулим, проте результати нейропсихологічних тестів (MMSE, MoCa, інші методики) залишаються в межах прийнятого для відповідного віку та рівня освіти нормативу.
- Легкі (помірні) КР – результати нейропсихологічних тестів (MMSE, MoCa, інші методики) виходять за межі прийнятого для віку та рівня життя нормативу; однак пацієнти залишаються повністю самостійними у повсякденному житті.
- Тяжкі КР (деменція) – КР виражені настільки, що пацієнт потребує сторонньої допомоги, щонайменше у деяких звичайних життєвих ситуаціях (наприклад, під час подорожі, здійсненні фінансових операцій, професійної діяльності тощо) (рис. 1)
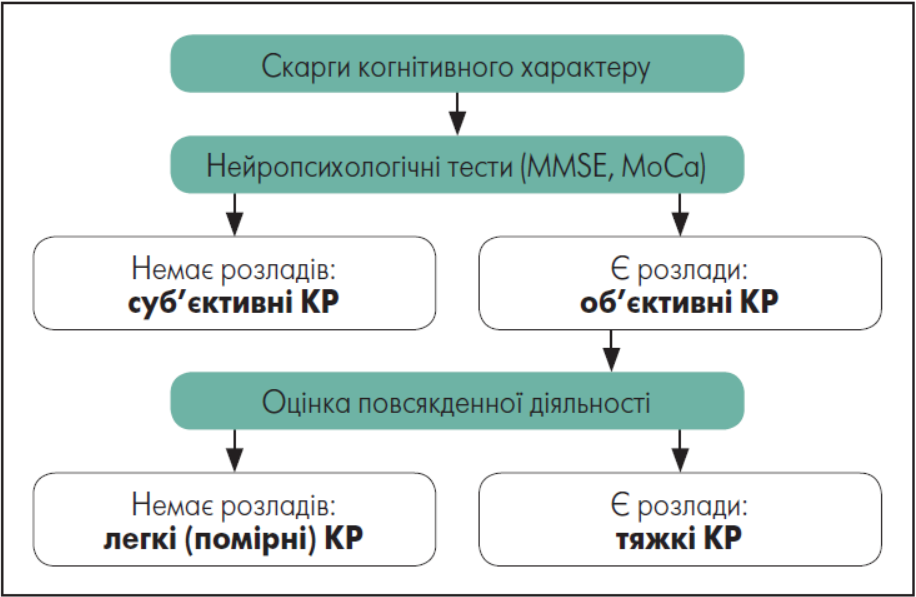 Рисунок 1. Алгоритм синдромальної діагностики КР
Рисунок 1. Алгоритм синдромальної діагностики КР
Зниження КФ не завжди розвивається внаслідок первинного церебрального захворювання. У деяких випадках причиною КР може бути церебральна дисфункція через системні дисметаболічні розлади при соматичних, ендокринних захворюваннях або екзогенних інтоксикаціях:
- електролітні порушення (гіпо- або гіпернатріємія, гіпо- або гіперкаліємія, гіпо- або гіперкальціємія);
- серцева, печінкова, ниркова або дихальна недостатність;
- алкоголізм, вживання психоактивних речовин, інші інтоксикації;
- дефіцит вітамінів групи В, фолієвої кислоти;
- гіпотиреоз, гіперкортицизм, інші ендокринопатії.
У цих випадках своєчасна діагностика та корекція метаболічних показників спричиняє повний регрес або значне зменшення виразності наявних розладів.
Тому всім пацієнтам із КР, незалежно від їхньої тяжкості, рекомендований лабораторний скринінг дисметаболічної енцефалопатії, який охоплює: загальний аналіз крові; дослідження рівня глюкози, біохімічний скринінг захворювань печінки та нирок (АСТ, АЛТ, креатинін, азот сечовини); дослідження ТТГ, вітаміну В12, фолієвої кислоти.
Втім, у пацієнтів із швидкопрогресуючими КР необхідно виключати електролітні розлади, для чого доцільно дослідити показники натрію, калію та кальцію. Рідкісною причиною швидкопрогресуючих КР є енцефалопатія Хашимото, для якої характерне значне (у десятки разів) підвищення рівня антитіл до тиреопероксидази.
Бажано, щоб кожному пацієнтові з КР будь-якого ступеня виразності хоча б одного разу було виконано нейровізуалізацію – КТ або МРТ головного мозку. За наявності виразних або прогресуючих КР, на наш погляд, нейровізуалізація є обов’язковою. Якщо у пацієнта в процесі динамічного спостереження суттєво змінюються клінічні характеристики КР або прискорюється темп їх прогресування, нейровізуалізацію слід виконати повторно.
Головним завданням нейровізуалізації при КР є виключення загрозливих для життя захворювань: пухлина головного мозку, хронічна субдуральна гематома, абсцес мозку тощо. КТ або МРТ голови допомагають також підтвердити або виключити наявність внутрішньої гідроцефалії (розширення шлуночків головного мозку), що характерно для однієї з форм зворотних КР – нормотензивної гідроцефалії. Важливим завданням нейровізуалізації є диференційний діагноз між первинними церебральними захворюваннями з КР у клінічній картині.
Після виключення «вторинних КР» (дисметаболічні порушення, пухлини мозку, нейроінфекція) слід уточнити: яке первинне церебральне захворювання є основою КР. За статистикою, найчастішими причинами КР є: хвороба Альцгеймера, судинні захворювання головного мозку, лобно-скронева дегенерація та дифузна хвороба з тільцями Леві (таблиця).
Тривога і депресія є найпоширенішими у популяції психічними розладами. Вони можуть зумовлювати когнітивне зниження або бути коморбідним станом, що посилює когнітивний дефіцит. За епідеміологічними даними, ризик розвитку депресії протягом життя досягає 10% у чоловіків та до 20% у жінок [1]. Частота розладів тривожного спектра, за даними популяційних досліджень, становить 6‑14% серед дорослих осіб [21].
Депресія і тривога негативно позначаються на КФ. Трирічне спостереження за пацієнтами з депресією продемонструвало, що під час загострення пацієнти мають КР у середньому 94% часу неспання. Цікавим є те, що під час ремісії цей показник знижується, але залишається досить високим (44%) [7]. Отже, у частини пацієнтів КР зберігаються попри регрес емоційних розладів. Можливо, це пов’язано з тим, що депресія через активацію гіпоталамо-гіпофізарно-наднирникової системи може сприяти атрофічним змінам у таких важливих для пізнавальної діяльності церебральних структурах, як медіальна скронева кора та гіпокамп [17]. Підвищена тривога також асоціюється з нижчими результатами нейропсихологічних тестів [2].
Зважаючи на можливий негативний вплив тривоги та депресії на КФ та високу коморбідність тривожно-депресивних і когнітивних розладів, у всіх пацієнтів із КР необхідно досліджувати емоційно-поведінкову сферу. Для цього доцільно використовувати формалізовані опитувальники (наприклад, госпітальну шкалу тривоги та депресії), які дають змогу провести скринінг із мінімальними витратами часу лікаря.
У разі виявлення тривожно-депресивних розладів потрібна їхня медикаментозна корекція. При цьому слід уникати препаратів із холінолітичним ефектом, оскільки вони можуть посилювати когнітивний дефект. Завдяки безпеці та переносимості перевагу мають антидепресанти з груп селективних інгібіторів зворотного захоплення серотоніну (есциталопрам, сертралін, пароксетин, флюоксетин, флювоксамін), інгібіторів зворотного захоплення серотоніну та норадреналіну (венлафаксин, дулоксетин, милнаципрам) та інші препарати, які не мають впливу на ацетилхолінергічну систему (агомелатин, вортіоксетин, тразадон).
Артеріальна гіпертензія (АГ) є одним з основних чинників ризику КР, що підтверджується численними епідеміологічними дослідженнями. Метааналіз, що об’єднав шість великих міжнародних рандомізованих клінічних досліджень (Syst-Eur, PROGRESS, SCOPE, SHEP, PRoFESS HYVET, загалом понад 19 тис. пацієнтів), засвідчив, що на тлі антигіпертензивної терапії достовірно знижується ризик когнітивного дефекту. Він визначався як зниженням результату MMSE на 3‑4 бали і більше. Цей ефект не залежав від класу гіпотензивних лікарських засобів. Водночас зниження ризику деменції було статистично недостовірним [3].
За ретроспективними спостереженнями простежується статистичний зв’язок із віком початку терапії та її тривалістю: чим молодші були пацієнти на початку і чим довше було спостереження, тим достовірніше знижувався ризик деменції [8, 10, 11, 16, 20].
Лікування статинами, ймовірно, не значно впливає на ризики виникнення, темпи прогресування та виразність КР. У дослідженнях Heart Protection Study та PROSPER не отримано достовірного впливу статинів на КФ пацієнтів із судинними чинниками ризику [12, 19]. В інших роботах аналізували вплив статинів на КФ пацієнтів із початковими стадіями хвороби Альцгеймера. Проте статистично достовірних відмінностей із плацебо також не отримано [13].
У двох великих рандомізованих дослідженнях вивчали зв’язок терапії дезагрегантами та КР. Так, у роботі «Аспірин у лікуванні безсимптомного атеросклерозу» (3350 пацієнтів віком від 50 до 75 років) через 5 років спостереження не виявлено достовірних відмінностей за когнітивними показниками між групою ацетилсаліцилової кислоти (100 мг на добу) та плацебо [16].
Інші антитромбоцитарні препарати (комбінація ацетилсаліцилової кислоти з дипіридамолом повільного вивільнення, клопідогрелем) також не підтвердили жодних переваг перед плацебо (дослідження PRoFESS) [8].
В арсеналі практикуючого лікаря є достатня кількість лікарських засобів, які можуть мати позитивний вплив на когнітивну сферу [4, 15]. Проте можливості більшості лікарських засобів, зокрема препаратів із вазоактивною дією, у лікуванні КР остаточно не визначено, оскільки не доведено їхньої здатності покращувати перфузію головного мозку за тривалого застосування.
У лікуванні КР використовують кілька груп препаратів: інгібітори ацетилхолінестерази, прекурсори ацетилхоліну, антиглутаматергічні засоби, метаболічні та судинні препарати. Загалом усі ці препарати з різним механізмом дії можна поєднати в групу ноотропних лікарських засобів.
Ноотропні препарати умовно можна поділити на чотири основні групи:
- що чинять вплив на певні нейротрансмітерні системи;
- із нейротрофічною дією;
- із нейрометаболічним ефектом;
- із вазоактивною дією.
До засобів нейрометаболічної дії належать пірацетам та гінкго білоба. Попри те, що пірацетам покращує показники когнітивного стану хворого та приводить до виразнішого поліпшення показників тесту відтворення годинника, у пацієнтів із віковим зниженням пам’яті у тривалому однорічному дослідженні, у пацієнтів із помірними КР позитивний ефект препарату продемонструвати не вдалося.
Тривале застосування препаратів гінкго білоба, за даними багатоцентрового контрольованого плацебо дослідження, не призводить до зниження ризику деменції, хоча і зумовлює помірне поліпшення КФ у пацієнтів із судинною деменцією та на переддементній стадії КР.
До засобів нейротрофічної дії належать такі відомі препарати, як церебролізин та кортексин. Зокрема, на тлі приймання церебролізину в пацієнтів із судинною деменцією помірний позитивний ефект препарату на КФ зберігався всього протягом 3‑4 місяців. На тлі застосування кортексину пацієнти із хронічною ішемією мозку, помірними КР та легкою деменцією також мали короткочасний ефект. Застосування засобів із вазоактивною дією (наприклад, німодипін, дигідроергокриптин, ніцерголін, вінпоцетин) у хворих на КР до кінця не визначено, оскільки не доведено здатність препаратів цієї групи покращувати перфузію головного мозку за тривалого використання.
Найефективнішими препаратами для лікування КР, за даними контрольованих досліджень, є засоби, що чинять вплив на специфічні нейромедіаторні системи.
Препарати, що посилюють активність холінергічних, норадренергічних, дофамінергічних, серотонінергічних рецепторів, а також блокуючі глутаматні рецептори, зумовлюють поліпшення КФ. Проте і серед препаратів цієї групи не все так просто і зрозуміло. Наприклад, представники холіноміметичних засобів, інгібітори холінестерази, як-от галантамін, ривастигмін і донепезил, не дають змоги досягти суттєвого поліпшення повсякденної активності пацієнтів при судинній деменції, оскільки основною точкою застосування цих препаратів є деменція при хворобі Альцгеймера.
Крім того, продемонстровано позитивний ефект неконкурентного антагоніста глутаматних рецепторів мемантину при лікуванні пацієнтів із судинною деменцією. Хоча і в цьому випадку основною точкою застосування цього препарату є рухові розлади, і ефект можна отримати лише в разі поєднання рухових та когнітивних розладів.
З іншого боку, розглянуті препарати цієї групи використовують насамперед при лікуванні деменції, уже сформованого тяжкого КР. Для лікарів терапевтів і лікарів загальної практики актуальнішим є застосування ефективних препаратів на стадії легких та помірних КР, коли є резерв і час для проведення профілактики прогресування цього інвалідизуючого розладу в пацієнтів із захворюваннями серцево-судинної системи.
У клінічній практиці накопичено значний досвід застосування дофамінергічних і норадренергічних препаратів при недементних КР. Ефективність пірибедилу, який поєднує дофамінергічні та норадренергічні властивості, вивчали більш ніж у 15 клінічних дослідженнях, у яких брали участь загалом понад 7 тис. пацієнтів із різних країн світу. Зокрема, ефективність цього препарату було доведено у пацієнтів із віковими порушеннями пам’яті та уваги, помірними КР та КР у рамках хронічної ішемії мозку [5, 6].
Так, за даними W. E. Scholing, ефективність пірибедилу перевищувала дію монотерапії судинними препаратами [18].
Отже, натепер накопичено достатній досвід із діагностики та корекції КР. Не менш важливим також є активне виявлення таких хворих в амбулаторно-поліклінічній практиці лікаря-терапевта. Проте роботи, присвячені ранній діагностиці КР і подальшому їх лікуванню в умовах роботи лікаря первинної ланки охорони здоров’я, недостатньо розкривають цю проблему.
Клінічний випадок
Пацієнт, 58 років, зріст 173 см, вага 82 кг. Освіта середня. Скарги: підвищення АТ, зниження пам’яті впродовж останніх 4‑5 років, зниження концентрації уваги, швидку втомлюваність.
З анамнезу: страждає близько 13 років на АГ із максимальними значеннями АТ до 180/110 мм рт. ст.
Перебував на диспансерному обліку з 2012 року, періодично проходив лікування у кардіологічній клініці Військово-медичного клінічного центру Західного регіону (ВМКЦ ЗР).
Під час огляду: стан задовільний. Шкірні покриви та видимі слизові оболонки чисті, вологі. Периферичні лімфовузли не збільшені. У легенях аускультативно – везикулярне дихання, хрипів немає. Тони серця приглушені, ритм правильний. ЧСС – 68 ударів за хвилину. АТ на правій руці – 180/100 мм рт. ст., на лівій – 170/90 мм рт. ст. Живіт м’який, безболісний при пальпації. Печінка по краю реберної дуги. Фізіологічні відправлення в нормі.
Неврологічний статус: свідомість ясна, правильно орієнтований у місці, часі та просторі, емоційно стійкий. Черепно-мозкові нерви без особливостей. М’язова сила у кінцівках збережена. Сухожилкові та періостальні рефлекси живі, симетричні з верхніх та нижніх кінцівок. Патологічних рефлексів немає. Чітких порушень чутливості не виявлено. Координаторні проби виконує задовільно, легка дискоординація в пальце-носовій пробі з обох боків. У позі Ромберга простежується легка нестійкість.
Результати нейропсихологічного дослідження: MMSE – 24 бали (помилки у наступних пунктах: повторення речення, запам’ятовування – із трьох слів відтворив лише одне, конструктивний праксис); MoCA – 24 бали (помилки у таких пунктах: абстрактне мислення, відстрочене відтворення, увага); за шкалою HADS – 5 балів (немає достовірно виразних симптомів тривоги та депресії).
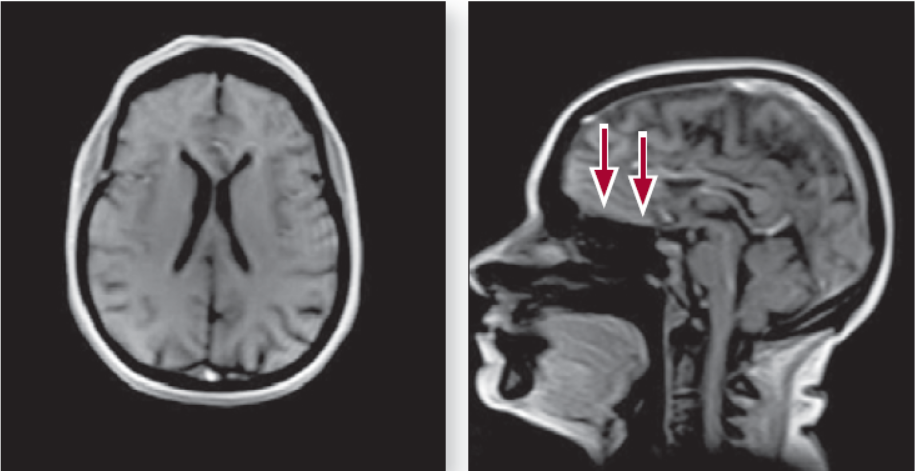
МРТ головного мозку: у конвекситальних відділах лобних, тім’яних часток, у білій речовині скроневих часток візуалізуються дрібні (до 3 мм) вогнища з підвищеною інтенсивністю сигналу на Т2-зважених зображеннях і в режимі FLAIR, ймовірно, судинного генезу. Субарахноїдальні простори розширені переважно у конвекситальних відділах. В інших відділах головного мозку вогнищевих змін не виявлено (рис. 2).
Рисунок 2. МРТ головного мозку пацієнта в сагітальній та аксіальній проекціях (стрілками вказано розширені субарахноїдальні простори)
Добове моніторування АТ: артеріальна гіпертензія за рахунок середньодобових, середньоденних і середньонічних показників САТ та ДАТ, із максимальним підвищенням САТ до 185 мм рт.ст. у денний час та ДАТ до 115 мм рт. ст.; із максимальним зниженням САТ до 130 мм рт. ст., ДАТ – до 65 мм рт. ст. Недостатнє нічне зниження САТ (ШНЗ – 7,5%) та недостатнє нічне зниження ДАТ (ШНЗ – 8%) (тип добової кривої «non-dipper»). Підвищені індекси часу САТ і ДАТ.
Дуплексне сканування брахіоцефальних гілок дуги аорти: брахіоцефальний стовбур звичайного ходу, прохідний; загальна сонна артерія справа: Vs – 72 см/с; Vd – 17 см/с, звичайного ходу; загальна сонна артерія зліва: Vs – 65 см/с; Vd – 13 см/с, звичайного ходу; ВСА справа: Vs – 47 см/с; Vd – 16 см/с; деформація ходу: S-вигин у дистальному відділі, із перегином; прискорення лінійної швидкості кровотоку до 1,2 м/с; є турбулентність; ВСА зліва: Vs – 80 см/с; Vd – 18 см/с, непрямолінійність ходу.
Раніше пацієнту було призначено лікування: вальсакор-Н 80/12,5 мг 1 табл. per os; амлодипін 5 мг 1 таблетка раз на день per os; лоспірин 75 мг 1 таблетка ввечері per os; аторвастатин 20 мг 1 таблетка ввечері per os. Регулярно препарати не приймав.
Пацієнту призначено пірибедил 50 мг по 1 таблетці 1 раз на день per os, не розжовуючи після їди, запиваючи ½ склянки води, протягом 6 місяців. Надано рекомендації щодо регулярного приймання антигіпертензивних препаратів.
Візит 2-й (12-й тиждень)
Пацієнт відзначає покращення пам’яті, уваги.
Під час огляду: стан задовільний. Шкірні покриви та видимі слизові оболонки чисті, вологі. Периферичні лімфовузли не збільшені. У легенях аускультативно – везикулярне дихання, хрипів немає. Тони серця приглушені, ритм правильний, ЧСС – 70 ударів за хвилину. АТ на правій руці – 140/90 мм рт. ст., на лівій– 135/90 мм рт. ст. Живіт м’який, безболісний при пальпації. Печінка по краю реберної дуги. Фізіологічні відправлення в нормі.
Неврологічний статус: свідомість ясна, правильно орієнтований у місці, часі та просторі, емоційно стійкий. Черепно-мозкові нерви без особливостей. М’язова сила у кінцівках збережена. Сухожилкові та періостальні рефлекси живі, симетричні з верхніх та нижніх кінцівок. Патологічних рефлексів немає. Чітких порушень чутливості не виявлено. Координаторні проби виконує задовільно, легка дискоординація в пальце-носовій пробі з обох боків. У позі Ромберга спостерігається легка нестійкість.
Результати нейропсихологічного дослідження: MMSE – 27 балів (помилки у таких пунктах: рахунок, запам’ятовування: із трьох слів не відтворив одного); за шкалою MoCA – 26 балів (помилки у пунктах: серійний рахунок, відстрочене відтворення).
Результати СМАТ: достовірно знизилися середньоденні, середньонічні та середньодобові значення САТ та ДАТ. Виявлено достовірне зменшення часу гіпертонічного навантаження підвищеним САТ упродовж доби та зменшення часу навантаження підвищеним ДАТ у денні та нічні години. Виявлено достовірне зниження варіабельності САТ вдень. Також встановлено адекватне зниження САТ та ДАТ у нічний час (тип добової кривої «dipper»). Показники дуплексного сканування брахіоцефальних гілок дуги аорти не змінилися через 12 тижнів лікування.
Візит 3-й (24-й тиждень)
Пацієнт відзначає значне покращення пам’яті, уваги та розумової працездатності.
Під час огляду: стан задовільний. Шкірні покриви та видимі слизові оболонки чисті, вологі. Периферичні лімфовузли не збільшені. У легенях аускультативно – везикулярне дихання, хрипів немає. Тони серця приглушені, ритм правильний, ЧСС – 67 ударів за хвилину. АТ на правій руці – 135/90 мм рт. ст., на лівій – 135/85 мм рт. ст. Живіт м’який, безболісний при пальпації. Печінка по краю реберної дуги. Фізіологічні відправлення у нормі.
Неврологічний статус: свідомість ясна, правильно орієнтований у місці, часі та просторі, емоційно стійкий. Черепно-мозкові нерви без особливостей. М’язова сила у кінцівках збережена. Сухожильні та періостальні рефлекси живі, симетричні з верхніх та нижніх кінцівок. Патологічних рефлексів немає. Чітких порушень чутливості не виявлено. Координаторні проби виконує задовільно. У позі Ромберга спостерігається легка нестійкість.
Результати нейропсихологічного дослідження: за шкалою MMSE – 29 балів (помилки у пунктах запам’ятовування — із трьох слів не відтворив одного); за шкалою MoCA – 28 балів (помилки у пунктах повторення речення, відстрочене відтворення – із п’яти слів відтворено чотири).
Візит 4-й (48-й тиждень)
Скарг на погіршення пам’яті пацієнт не має.
Під час огляду: стан задовільний. Шкірні покриви та видимі слизові оболонки чисті, вологі. Периферичні лімфовузли не збільшені. У легенях аускультативно – везикулярне дихання, хрипів немає. Тони серця приглушені, ритм правильний, ЧСС – 69 ударів за хвилину. АТ на правій руці – 130/90 мм рт. ст., на лівій – 130/85 мм рт. ст. Живіт м’який, безболісний при пальпації. Печінка по краю реберної дуги. Фізіологічні відправлення у нормі.
Неврологічний статус: свідомість ясна, правильно орієнтований у місці, часі та просторі, емоційно стійкий. Черепно-мозкові нерви без особливостей. М’язова сила у кінцівках збережена. Сухожильні та періостальні рефлекси: живі, симетричні з верхніх та нижніх кінцівок. Патологічних рефлексів немає. Чітких порушень чутливості не виявлено. Координаторні проби виконує задовільно. У позі Ромберга спостерігається легка нестійкість.
Результати нейропсихологічного дослідження: MMSE – 28 балів (помилки у пунктах: запам’ятовування: із трьох слів не відтворив одне); MoCA – 28 балів (помилки у пунктах: повторення речення, відстрочене відтворення – із п’яти слів відтворив чотири).
Результати та обговорення
У наведеному клінічному спостереженні представлено пацієнта середнього віку, який тривалий час (близько 13 років) страждає на АГ. За його словами, антигіпертензивну терапію приймав нерегулярно. Мав скарги на підвищення АТ, головний біль, зниження пам’яті, зниження концентрації уваги, швидку втомлюваність. Під час нейропсихологічного обстеження виявлено помірні КР. Зокрема, при проведенні СМАТ виявлено підвищені середньодобові, середньоденні та середньонічні показники САТ і ДАТ, недостатнє нічне зниження САТ та недостатнє нічне зниження ДАТ, підвищені індекси часу САТ та ДАТ.
За даними дуплексного сканування брахіоцефальних гілок дуги аорти виявлено ознаки атеросклеротичного ураження артерій; деформація ходу ВСА справа (S-вигин) та нерівність ходу ВСА зліва. На МРТ головного мозку є зміни, характерні для тривалої артеріальної гіпертензії, помірний лейкоареоз, розширені субарахноїдальні простори в ділянці основи головного мозку.
Пацієнту було надано рекомендації щодо приймання антигіпертензивних препаратів і надано пірибедил на 6 місяців. Через 12 тижнів лікування у пацієнта нормалізувалися показники СМАТ; бали за шкалами MMSE та MoCA, отримані при нейропсихологічному обстеженні, відповідали нормальним.
На 24-му тижні лікування зберігалася позитивна динаміка, оцінена нейропсихологічними тестами. На 48-му тижні у пацієнта зберігалися нормальні результати нейропсихологічних показників когнітивних функцій: MMSE – 28 балів; MoCA – 28 балів.
Отже, курсове (24 тижні) застосування агоністу дофамінергічних рецепторів пірибедилу в поєднанні з антигіпертензивною терапією у пацієнта з АГ та супутніми КР призвело до значної редукції КР через 3 місяці лікування та стабілізації когнітивного статусу.
Висновки
Проблема КР поки що далека від свого розв’язання. Нині необхідні подальші дослідження для розроблення ефективної терапії хвороби Альцгеймера та інших нейродегенеративних захворювань, які є найпоширенішими причинами КР у популяції.
Хоча вже сьогодні використання індивідуально підібраної терапії, що охоплює нейропротективні та симптоматичні лікарські засоби, допомагає досягти покращення інтелектуального стану в більшості випадків КР як нейродегенеративної, так і судинної природи.
Під час спостереження пацієнтів із соматичною патологією в амбулаторно-поліклінічній практиці особливу увагу слід приділяти ранньому виявленню КР. Для своєчасного виявлення осіб із додементними КР доцільним є застосування MMSE та MoCa-тесту.
Пацієнти із соматичною патологією, у яких виявлено когнітивну дисфункцію, мають проходити нейропсихологічне тестування не рідше одного разу на рік. Для корекції КР додатково до антигіпертензивної терапії є доцільним призначення агоністу дофамінергічних рецепторів пірибедилу.
Література
- Вейн А. М., Вознесенская Т. Г., Голубев В. Л., Дюкова Г. М. Депрессия в неврологической практике, 3-е изд. М.: МИА, 2007. 208 с.
- Вознесенская Т. Г. Акатинол в лечении некогнитивных нервно-психических расстройств при нейрогериатрических заболеваниях. Nevrologiya, Neyropsikhiatriya, Psikhosomatika. 2012. Vol. 4. С. 11‑17.
- Ankolekar S. Geeganage C. Clinical trials for prevention post stroke cognitive impairment. J. of Neurological Sciences. 2010. Vol. 299. Р. 168‑174.
- Bagoly E., Feher G., Szapary L. The role of vinpocetine in the treatment of cerebrovascular diseases based in human studies. Orv. Hetil. 2007. Vol. 148, № 29. Р. 1353‑1358.
- Bartoli G., Wichrowska E. Controlled clinical trial of piribedil in the treatment of cerebrovascular insufficiency. La. Clin. Ter. 1976. Vol. 78, № 2. P. 141‑151.
- Bille J., Bukiwsky J. V., De Ferron A. Decline cerebral et therapeutique: une etude clinique multicenrique de Trivastal 50 retard en Neuro-Geriatrie. Psych. Med. 1986. Vol. 18. P. 609‑626.
- Conradi H. J., Ormel J. Presence of individual (residual) symptoms during depressive episodes and periods of remission: a 3-year prospective study. Psychol. Med. 2011. Vol. 41, № 6. Р. 1165‑1174.
- Diener H. C., Sacco R. L., Yusuf S. Prevention Regimen for Effectively Avoiding Second Strokes (PRoFESS) Study Group. Effects of aspirin plus extended-release dipyridamole versus clopidogrel and telmisartan on disability and cognitive function after recurrent stroke in patients with ischaemic stroke in the Prevention Regimen for Effectively Avoiding Second Strokes (PRoFESS) trial: a double-blind, active and placebo controlled study. Lancet Neurol. 2008. Vol. 7. Р. 875‑884.
- Folstein M. F., Folstein S. E., McHugh P. R. Mini-Mental State: a practical guide for grading the mental state of patients for the clinician. J. Psych. Res. 1975. Vol. 12. P. 189‑198.
- Guire C. B., Ibrahim N. A., Adam M. B., Said S. M. Impact of physical activity on cognitive decline, dementia and its subtypes: meta-analysis of prospective studies. Biomed Res Int. 2017. Vol. 90. Р. 16‑24.
- Hamer M., Chida Y. Physical activity and risk of neurodegenerative disease: a systematic review of prospective evidence. Psychological Medicine. 2009. Vol. 39, № 1. Р. 3‑11.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomized placebo-controlled trial. Lancet. 2002. Vol. 360. Р. 7‑22.
- McGuinness B., CraigD., Bullock R., Passmore P. Statins for the treatment of dementia. Cohrane Database Syst Rev. 2014. Vol. 8, № 7.Р. 75‑84. DOI: 10.1002/14651858.CD007514.pub2.
- Nasreddine Z. S., Philips N. A., Bedirian V. J. The Montreal cognitive assessment, MoCa: a brief screening tool for mild cognitive impairment. Am. Ger. Soc. 2005. Vol. 53, № 4. Р. 695‑699.
- Patyar S. A., Prakash M., Modi B. Medhi Role of vinpocetine in cerebrovascular diseases. Pharmacol. Rep. 2011. Vol. 63, № 3. Р. 618‑628.
- Price J. F., Stewart M. C., Deary I. J. Low dose aspirin and cognitive function in middle aged to elderly adults: randomized controlled trial. BMJ. 2008. Vol. 437. 1198 р.
- Sapolsky R. N. Depression, antidepressants and the shrinking of the hippocampus. Natl Acad Sci. 2001. Vol. 98, № 22. Р. 12320‑12322.
- Scholing W. E. Controlled trial of trivasal retard 50 and comparision with trivasal 20 in the treatment of clinical and mental signs of neurovascular disease. Scienc. Med. 1977. Vol. 4. P. 4‑8.
- Shepherd J., Blauw G. J., Murphy M. B., Bollen E.L.E.M., Buckley B. M., Cobbe S. M. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomised controlled trial. Lancet. 2002. Vol. 360. Р. 623‑30.
- Sofi F.,Valecchi D., Bacci D. Physical activity and risk of cognitive decline: a meta-analysis of prospective studies. Journal of Internal Medicine. 2011. Vol. 269, № 1. Р. 107‑117.
- The ESEMed/MHEDEA 2000 Investigators. Prevalence of mental disorders in Europe: results from the European study of the epidemiology of mental disorders (ESEMeD) projectю. Acta Psychiatr Scand. 2004. Vol. 109, № 420. Р. 21‑27.