1 березня, 2023
Гіпотиреоз: сучасний алгоритм скринінгу, діагностики й лікування
Гормони щитоподібної залози (ЩЗ) необхідні для нормального розвитку більшості тканин людського організму і відіграють ключову роль у регуляції метаболізму практично всіх клітин і органів людини протягом життя. Гіпотиреоз, клінічний стан дефіциту гормонів ЩЗ, достатньо поширений у світовій популяції.
Явний (маніфестний) гіпотиреоз визначають, якщо рівень тиреотропного гормону (ТТГ) перевищує верхню межу референтного діапазону, при цьому рівень вільного тироксину (вT4) нижче нижньої межі референтного діапазону. Референтний діапазон зазвичай статистично встановлюють 2,5-м і 97,5-м процентилями рівнів циркулюючого тиреоїдного гормону в здорових популяціях. При субклінічному гіпотиреозі рівень ТТГ підвищений, але рівень вT4 все ще перебуває в межах референтного діапазону.
Нелікований гіпотиреоз, особливо явний, може призвести до серйозних негативних наслідків для більшості систем органів як у короткостроковій, так і в довгостроковій перспективі. У більшості дорослих пацієнтів гіпотиреоз є набутим, зумовленим патологією або ЩЗ (первинний гіпотиреоз), або гіпофіза чи гіпоталамуса (центральний гіпотиреоз). Гіпотиреоз також може бути наслідком серйозного дефіциту йоду, оскільки для синтезу гормонів ЩЗ цей мікроелемент життєво необхідний. Тиреоїдит Хашимото – найпоширеніша причина первинного гіпотиреозу в регіонах із високим умістом йоду в ґрунті. Оскільки гормони ЩЗ також необхідні для багатьох аспектів нормального розвитку в дитинстві, більшість економічно розвинених країн запровадили програми неонатального скринінгу для виявлення вродженого гіпотиреозу (поширеність 1 на 500-3000 новонароджених, залежно від етнічної приналежності), а також програми профілактики тяжкого дефіциту йоду (наприклад, обов’язкове йодування солі) [1, 2].
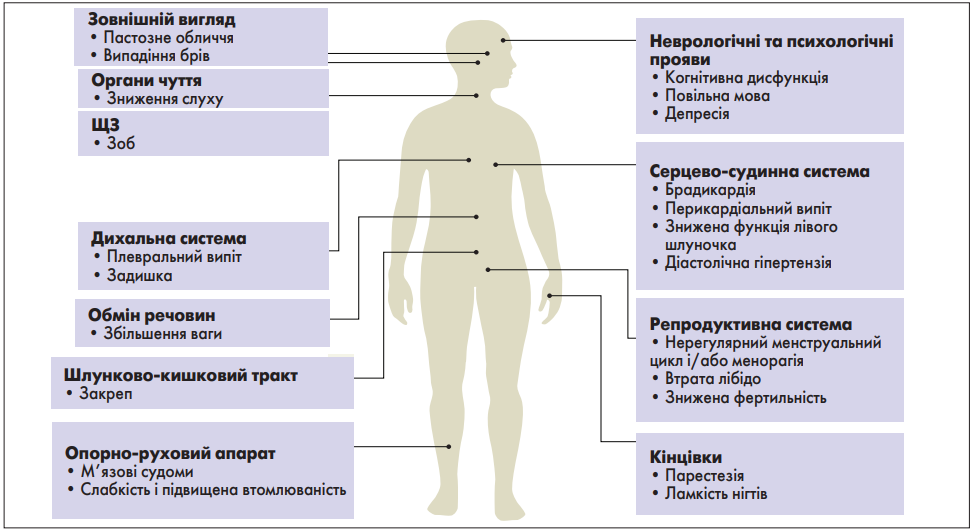
Початок гіпотиреозу в більшості випадків не виражений, симптоми можуть проявлятися на пізній стадії захворювання. Прояви захворювання, як правило, неспецифічні. Найпоширенішими є втома, непереносимість холоду і закрепи. У результаті спостерігається значна варіативність клінічних проявів, що відображено на рисунку 1, а наявність симптомів має низьку чутливість і малу позитивну прогностичну цінність (тобто симптоми не є специфічними) для діагностики.
Таким чином, визначальним для діагностики гіпотиреозу є виявлення високого рівня ТТГ і низького рівня вT4 [3].
Більшість симптомів, пов’язаних із гіпотиреозом, поширені в загальній популяції і не є специфічними. Менш поширеними симптомами гіпотиреозу є сухість шкіри (у тяжких випадках – щільний набряк, при натисканні на який не утворюються ямки, відомий як мікседема), охриплість голосу, анемія (зазвичай нормохромна нормоцитарна, іноді макроцитарна), підвищений ризик тромбозу (через порушення коагуляції та фібринолізу), а також різні неврологічні (синдром зап’ястного каналу й енцефалопатія), кістково-м’язові (міалгія і підвищення рівня креатинкінази в сироватці крові) і метаболічні (гіпонатріємія та підвищення рівня креатинкінази в сироватці крові) симптоми
Епідеміологія
Первинний гіпотиреоз
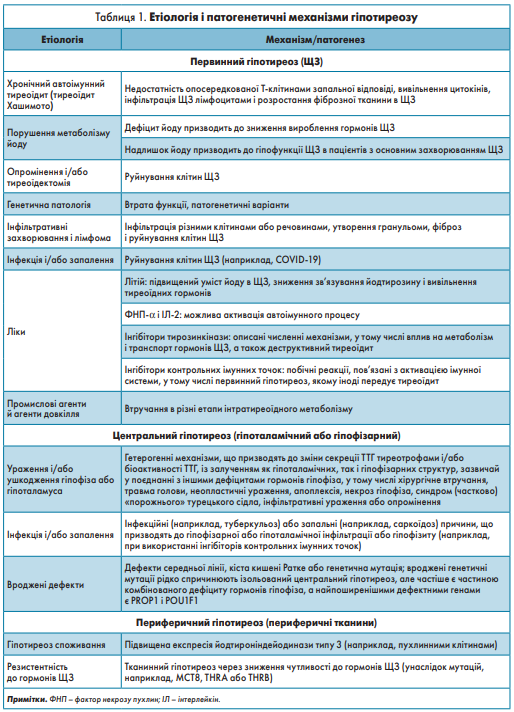
Первинний гіпотиреоз – поширена патологія ЩЗ, головними причинами якої є дефіцит йоду і тиреоїдит Хашимото. Іншими, менш поширеними, причинами первинного гіпотиреозу є вроджені, індуковані ліками, ятрогенні й інфільтративні захворювання, що відображено в таблиці 1.
Оцінки поширеності первинного гіпотиреозу в загальній популяції зазвичай не враховують етіологію і залежать від кількох факторів, зокрема типу досліджуваної популяції та власне визначення захворювання (наприклад, чи враховується субклінічний гіпотиреоз). Дані Національного дослідження здоров’я та харчування США (National Health and Nutrition Examination Survey) оцінили поширеність гіпотиреозу (як явного, так і субклінічного) у 4,6% [8]. Скринінгове дослідження в США встановило, що поширеність явного і субклінічного гіпотиреозу становить 0,4% і 9% відповідно, причому поширеність останнього зросла до більш як 20% серед жінок віком ≥75 років [9].
За даними метааналізу, проведеного в Європі, поширеність явного і субклінічного гіпотиреозу дорівнювала 0,37% і 3,8% відповідно, з урахуванням як діагностованих, так і недіагностованих випадків, а захворюваність, за оцінками, становила 226 випадків на 100 тис осіб на рік [10].
Поширеність первинного гіпотиреозу найвища в популяціях із надмірним споживанням йоду або тяжким йододефіцитом порівняно з популяціями з нормальним йодним статусом [11]. Поширеність знижується зі зменшенням тяжкості йодного дефіциту і зростає, коли споживання йоду змінюється від легкого дефіциту до оптимального або надмірного споживання. Крім того, покращення йодного статусу також супроводжується частішим виявленням антитіл до ЩЗ і, відповідно, збільшенням ризику розвитку тиреоїдиту Хашимото [12].
Виникнення гіпотиреозу залежить від генетичних, вроджених (наприклад, статі) і зовнішніх факторів. Метааналіз загальногеномних асоціаційних досліджень (GWAS), в який були включені дані понад 70 тис учасників із 22 когорт, виявив 42 локуси, пов’язані з рівнями циркулюючого ТТГ у межах референтного діапазону [13]. Лише 7 із цих 42 локусів були пов’язані з гіпотиреозом, у тому числі тиреопероксидаза (ТПО), яка кодує фермент, незамінний для синтезу тиреоїдного гормону [13]. Особи з оцінкою генетичного ризику на основі ТТГ у найвищому квартилі мали в 2,5 раза більші шанси розвитку гіпотиреозу порівняно з особами з оцінкою генетичного ризику в найнижчому квартилі [13]. Результати метааналізу GWAS не виявили жодних відмінностей між чоловіками й жінками щодо генетичних варіантів ТТГ і вT4 [13]. Незважаючи на це, ризик розвитку первинного гіпотиреозу в жінок удесятеро вищий, ніж у чоловіків, що свідчить про важливість негенетичних факторів ризику [14].
Концентрації антитіл до ТПО нижчі в курців проти некурців [15, 16]. Крім того, рівень ТТГ нижчий в активних курців порівняно з колишніми курцями і нижчий у колишніх курців, якщо порівняти з тими, хто ніколи не курив [15, 16]. Через рік після початку куріння в чоловіків значно знижуються рівні сироваткового ТТГ. Ожиріння пов’язане з вищим рівнем ТТГ у сироватці крові в дорослих і дітей, хоча спрямованість зв’язку обговорюється і навіть може бути двонаправленою [17, 18]. Діти, народжені малими для гестаційного віку, мають вищі рівні ТТГ у сироватці крові, ніж діти, народжені відповідно до гестаційного віку, отже, у них частіше діагностують субклінічний гіпотиреоз [19]. Зовнішніми факторами, пов’язаними з розвитком гіпотиреозу і тиреоїдиту Хашимото, є дефіцит вітаміну D і селену, а також помірне споживання алкоголю [16].
Центральний і периферичний гіпотиреоз
Центральний гіпотиреоз – рідкісна патологія, яка може розвиватися внаслідок вторинного (патологія гіпофіза) або третинного (патологія гіпоталамуса) гіпотиреозу і може бути вродженою або набутою. За різними оцінками, захворюваність на вроджений центральний гіпотиреоз коливається від 1:21 000 до 1:160 000, причому варіабельність принаймні частково пояснюється відмінностями в стратегіях неонатальної діагностики [20, 21]. Найпоширенішими причинами центрального гіпотиреозу в дорослих є аденома гіпофіза, інфільтративне захворювання гіпофіза та променева терапія. Активне використання інгібіторів імунних контрольних точок для лікування раку протягом останнього десятиліття призвело до різкого зростання частоти центрального гіпотиреозу, пов’язаного з гіпофізитом, хоча точні патогенетичні механізми все ще вивчені недостатньо [22]. Периферичний (екстратиреоїдний) гіпотиреоз охоплює різноманітну групу розладів, що супроводжуються дефектами, які знижують ефективність гормонів ЩЗ шляхом порушення їх транспорту крізь клітинну мембрану та метаболізму. Ці розлади можуть бути зумовлені генетичними (вродженими) змінами, що супроводжуються зниженням чутливості до біологічної активності хімічно інтактних гормонів і, як правило, тканиноспецифічним гіпотиреозом. Іншим прикладом периферичного гіпотиреозу є гіпотиреоз споживання, зумовлений підвищеною експресією йодтироніндейодинази 3 типу (DIO3, ферменту, який інактивує тиреоїдні гормони) у пухлинах (наприклад, стромальних пухлинах шлунково-кишкового тракту) [23].
Механізми/патофізіологія
Первинний гіпотиреоз
Первинний гіпотиреоз може бути зумовлений різними причинами, які переважно впливають на функцію тироцитів, і характеризується широким спектром основних патофізіологічних механізмів, відображених у таблиці 1. Хронічний автоімунний тиреоїдит є найпоширенішою причиною первинного гіпотиреозу і найчастіше проявляється у вигляді тиреоїдиту Хашимото. Розвитку хронічного автоімунного тиреоїдиту може сприяти безліч причин, зокрема генетичні і зовнішні фактори, мікронутрієнти (переважно йод і селен), ліки, інфільтрація і/або інфекція, дефекти імунної системи (наприклад, полігландулярні синдроми) та молекулярна мімікрія між антигенами мікроорганізмів і хазяїна [32]. Високі концентрації антитиреоїдних антитіл (переважно антитіла до ТПО (АТ-ТПО) і антитиреоглобулінові антитіла) виявляють у більшості пацієнтів з автоімунним тиреоїдитом, але також спостерігають у приблизно 10% загальної популяції з еутиреозом [8]. АТ-ТПО виявляють у 2-17% жінок під час вагітності, що може супроводжуватися підвищенням рівня ТТГ у сироватці крові протягом першого триместру [14]. У більш ніж 40% вагітних жінок з автоімунною патологією ЩЗ на пізніх термінах вагітності концентрація вT4 у сироватці крові падає до рівня гіпотиреоїзу, що може ускладнити діагностику явного гіпотиреозу протягом третього триместру вагітності [33].
Це пов’язано з недостатньою активністю ЩЗ матері у відповідь на підвищені потреби у виробленні тиреоїдних гормонів, зумовлені стимуляцією ЩЗ хоріонічним гонадотропіном людини, збільшенням рівня тироксин-зв’язувального глобуліну, а також змінами плацентарного дейодування і ниркового кліренсу йоду під час вагітності [34]. У вагітних з автоімунною патологією ЩЗ зростає частота викиднів і передчасних пологів [35]. Було висунуто припущення щодо негативного зв’язку між АТ-ТПО під час вагітності з нервовим розвитком нащадків, але це потребує подальшого дослідження [36].
Хронічний автоімунний тиреоїдит зумовлений порушенням запальних реакцій, опосередкованих Т-клітинами, через складні механізми, за участю, зокрема, антигенпрезентувальних Т- і В-клітин, що відображено на рисунку 2. Інфільтрація тканини ЩЗ лімфоцитами, переважно Т-хелперами 1 типу (Th1), може безпосередньо змінювати функцію фолікулярних клітин ЩЗ через ІЛ‑1, ФНП та інтерферон (ІФН)-γ [37, 38]. Хемокіни (малі хемоатрактантні молекули, структурно схожі на цитокіни) також беруть участь в інфільтрації ЩЗ, яка може бути індукована ІФН-γ [39].
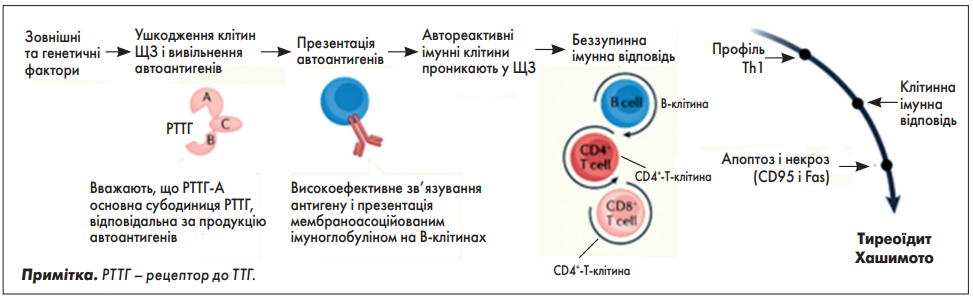 Рис. 2. Патогенетичні механізми тиреоїдиту Хашимото
Рис. 2. Патогенетичні механізми тиреоїдиту Хашимото
Автоімунна патологія ЩЗ розвивається в результаті взаємодії генетичних і зовнішніх факторів, які призводять до ушкодження тиреоїдних клітин із наступним вивільненням та презентацією автоантигену. Надходження автореактивних імунних клітин у ЩЗ призводить до активації клітинної і гуморальної імунної відповіді, продукції цитокінів, цитотоксичності й апоптозу.
Йод – незамінний мікроелемент, який відіграє вирішальну роль у біосинтезі гормонів ЩЗ. Як дефіцит, так і надлишок йоду можуть спричинювати гіпотиреоз, але явний гіпотиреоз здебільшого виникає в контексті тяжкого йододефіциту і зазвичай супроводжується зобом [40]. Споживання великої кількості йоду з їжею більшість людей переносять добре, але, у разі впливу високих концентрацій йоду на осіб із високим ризиком (наприклад, на схильних до тиреоїдиту Хашимото), синтез тиреоїдного гормону може бути пригнічений так званим ефектом Вольфа–Чайкова без відновлення органіфікації йоду через кілька днів [41]. Отже, гіпотиреоз із зобом або без нього може розвиватися в разі постійного надходження великих доз йоду з йодовмісних контрастних матеріалів, аміодарону, повідон-йоду або безрецептурних йодовмісних дієтичних добавок [42].
Оптимальне функціонування ЩЗ також залежить від споживання незамінного мікроелемента селену, який безпосередньо впливає на метаболізм тиреоїдних гормонів і окисно-відновні процеси [43]. Недостатнє споживання селену пов’язане з підвищеним ризиком захворювань ЩЗ [44].
Як внутрішнє, так і зовнішнє опромінення ЩЗ може призводити до гіпотиреозу. Терапію радіоактивним йодом (131I) можна застосовувати для лікування гіпертиреозу або раку ЩЗ. Руйнівні дози 131I, рекомендовані для лікування хвороби Грейвса (автоімунного гіпертиреозу), призводять до стійкого гіпотиреозу в більшості пацієнтів [45]. Лікування токсичного або нетоксичного вузлового зоба (збільшення ЩЗ з або без гіпертиреозу відповідно) 131I призводить до гіпотиреозу приблизно у 25% пацієнтів [46, 47]. Зовнішнє опромінення при злоякісних пухлинах голови та шиї дозами ≥25 Гр (2500 рад) може спричинити стійкий гіпотиреоз у більш як 50% пацієнтів [48]. Тотальна або майже повна тиреоїдектомія в контексті лікування раку ЩЗ, хвороби Грейвса або багатовузлового зобу є важливими причинами явного ятрогенного гіпотиреозу. Субтотальна тиреоїдектомія призводить до гіпотиреозу в майже 50% пацієнтів [49].
Іншими причинами гіпотиреозу є транзиторний тиреоїдит або різноманітні форми деструктивного тиреоїдиту. Післяпологовий тиреоїдит із наступним гіпотиреозом – поширене явище, через що поширеність післяпологової дисфункції ЩЗ становить 2-10% [50]. Явний і субклінічний гіпотиреоз спостерігають у 14-27% пацієнтів із первинною лімфомою ЩЗ і в 30-40% пацієнтів із тиреоїдитом Рейделя [51-53]. Повідомлялося про гіпотиреоз, зумовлений ураженням ЩЗ Pneumocystis jirovecii, туберкульозом і бруцельозом [54, 55]. Також описана дисфункція ЩЗ, пов’язана з COVID‑19, при цьому гіпотиреоз, імовірно, виникає внаслідок підгострого тиреоїдиту, хоча точний механізм ще не з’ясований [56]. Гіпотиреоз також частіше спостерігають у пацієнтів з іншими автоімунними захворюваннями, зокрема цукровим діабетом 1 типу, автоімунною атрофією шлунка і целіакією.
Гіпотиреоз може розвинутися внаслідок прийому ліків, які порушують ендогенну функцію ЩЗ [57]. Наприклад, гіпотиреоз розвивається у 20% пацієнтів, які використовують літій. Останній підвищує вміст йоду в ЩЗ, зменшує зв’язування залишків йодтирозину з Т4 і Т3 та пригнічує вивільнення тиреоїдних гормонів [58]. Гіпотиреоз також виникає в 5-15% осіб, які приймають аміодарон [59]. Клінічно значуща дисфункція ЩЗ розвивається у 58% і 32% пацієнтів, які отримували ФНП-α і ІЛ‑2 відповідно. Частково це зумовлено активацією автоімунних процесів [60]. Гіпотиреоз виникає у 18-52% пацієнтів, які отримують інгібітори тирозинкінази [61]. Інгібітори імунних контрольних точок пов’язані з побічними ефектами з боку імунної системи, у тому числі дисфункцією ЩЗ і гіпофізитом, що може призвести до центрального гіпотиреозу. Більш як у 20% пацієнтів, які отримували моноклональні антитіла проти цитотоксичного T-лімфоцит-асоційованого антигену 4 (CTLA4) або антигену запрограмованої клітинної смерті‑1 (PD‑1) – переважно комбінацію цих препаратів, – розвивається або тиреоїдит із подальшим гіпотиреозом, або первинний гіпотиреоз [62], а в майже 15% пацієнтів – гіпофізит [63, 64].
Куріння сигарет супроводжується зниженням сироваткових рівнів ТТГ і АТ-ТПО й ризику гіпотиреозу в пацієнтів із хронічним автоімунним тиреоїдитом [15]. Повідомлялося, що численні хімічні сполуки, що забруднюють навколишнє середовище, гербіциди, пестициди і промислові хімікати спричинюють гіпофункцію ЩЗ [65].
Причинами вродженого первинного гіпотиреозу можуть бути відсутність, недорозвиненість або ектопія ЩЗ (дисгенезія) або порушення біосинтезу тиреоїдних гормонів (дисгормоногенез). Мутації в генах TSHR, FOXE1, NKX2-1, PAX8 і NKX2-5 пов’язані з дисгенезом ЩЗ, тоді як мутації в генах SLC5A5, TPO, DUOX2, DUOXA2, SLC6A4 і DHEAL1 – з дисгормоногенезом. Більшість випадків вродженого гіпотиреозу є наслідком ектопії ЩЗ, причому менше 5% випадків пов’язані з мутацією в гені, який бере участь у диференціації, міграції або рості ЩЗ [66, 67].
Центральний і периферичний гіпотиреоз
Центральний гіпотиреоз характеризується недостатньою стимуляцією нормальної ЩЗ ТТГ, що призводить до порушення вироблення тиреоїдних гормонів. Вроджений центральний гіпотиреоз спостерігається вкрай рідко, на відміну від поширенішого набутого центрального гіпотиреозу, що переважно розвивається в дорослих, має варіабельний патогенез і найчастіше зумовлений аденомою гіпофіза. У більшості випадків недостатність ТТГ поєднується з дефіцитом багатьох інших гормонів [68]. Концентрація сироваткового ТТГ у пацієнтів із центральним гіпотиреозом часто перебуває в межах референтного діапазону, але секретована ізоформа ТТГ хоча і є імунореактивною, характеризується серйозним порушенням біологічної активності. Отже у пацієнтів із центральним гіпотиреозом поширене поєднання недоречно нормального сироваткового ТТГ і низького рівня циркулюючого вT4 [69]. Крім того, у пацієнтів із тривалим тиреотоксикозом, новонароджених від матерів із гіпертиреозом, а також в осіб, які отримували соматостатин, глюкокортикоїди, протипухлинні засоби або дофамінергічні сполуки, можуть виникати транзиторні або оборотні форми захворювання [68-70].
Периферичний гіпотиреоз охоплює різноманітну групу розладів, які знижують ефективність гормонів ЩЗ внаслідок порушення їх транспорту крізь клітинну мембрану та метаболізму і є рідкісними причинами гіпотиреозу [71]. До таких розладів належать гіпотиреоз споживання (наприклад, підвищення рівня DIO3 у пухлинних клітинах), а також тканинно-специфічний гіпотиреоз унаслідок зниження чутливості до гормонів ЩЗ в пацієнтів із мутаціями, наприклад, генів MCT8, THRA або THRB.
Діагностика, скринінг і профілактика
Загальні симптоми і клінічна картина
Гіпотиреоз клінічно впливає практично на всі органи людського організму і, відповідно, може супроводжуватися безліччю симптомів різного ступеня тяжкості залежно від ступеня дефіциту тиреоїдних гормонів і незалежно від причини [72].
Майже всі прояви гіпотиреозу зумовлені загальним зниженням метаболічних процесів (наприклад, такими симптомами, як втома, непереносимість холоду, брадикардія, збільшення ваги) або накопиченням матричних глікозаміногліканів в інтерстиціумі тканин (унаслідок чого волосся стає жорстким, а голос – осиплим). Прояви гіпотиреозу можуть варіюватися від легких, з невеликою кількістю або майже повною відсутністю симптомів (особливо в разі субклінічного гіпотиреозу) до дуже тяжких (у тому числі з небезпечною для життя мікседемною комою).
У більшості випадків гіпотиреоз розвивається непомітно, його симптоми й ознаки можуть бути нечіткими, широко варіювати і з’являтися на пізніх стадіях захворювання, що ускладнює диференційну діагностику. Одним із найпоширеніших симптомів є втома або слабкість. Іншими поширеними симптомами є сухість шкіри, збільшення ваги й закрепи.
Вважають, що основними механізмами розвитку закрепу, гіпотонії жовчного міхура й утворення каменів у жовчних протоках при гіпотиреозі є зниження моторики шлунково-кишкового тракту і жовчного міхура [73]. При гіпотиреозі може розвинутися легка гепатоцелюлярна дисфункція, тому він вважається фактором ризику неалкогольної жирової хвороби печінки та, інколи, стеатогепатиту [74].
Зміни з боку нирок полягають у порушенні функції клубочків, зміні функції ниркових канальців, порушенні виведення вільної води й розвитку гіпонатріємії [75].
Явний гіпотиреоз у дорослих може сприяти розвитку компресійних нейропатій (таких як синдром зап’ястного каналу) і метаболічних полінейропатій, погіршенню пам’яті, поганій концентрації, м’язово-скелетним симптомам, апное уві сні, депресії та іншим психіатричним розладам [76].
Тяжкий і тривалий гіпотиреоз призводить до збільшення опору судин, зниження серцевого викиду та зниження функції лівого шлуночка [77]. Іншими серцево-судинними ефектами є ушкодження міокарда, перикардіальний випіт і елементи метаболічного синдрому, зокрема гіпертензія, збільшення окружності талії та дисліпідемія [78, 79].
Однак більшість симптомів і ознак, пов’язаних із гіпотиреозом, є неспецифічними та діагностично незначущими. Крім того, низка загальних симптомів, пов’язаних із гіпотиреозом, часто спостерігається в дорослих [80]. Так, у дослідженні осіб, які відвідували ярмарку здоров’я, 12% осіб із явним гіпотиреозом, 7,4% – з легким (або субклінічним) гіпотиреозом і 7,7% – з еутиреозом скаржилися на симптоми гіпотиреозу [9]. Таким чином, наявність симптомів гіпотиреозу сама по собі має низьку чутливість і мале позитивне прогностичне значення. Крім того, невідомо, скільки симптомів, пов’язаних із гіпотиреозом (таких як втома або збільшення ваги), можуть бути зумовлені старінням, особливо тому, що рівень ТТГ у сироватці крові з віком підвищується [81]. Насправді зростання тяжкості симптомів може бути предиктором гіпотиреозу, оскільки в дослідженні було встановлено, що в разі зміни ≥7 симптомів за попередній рік коефіцієнт вірогідності розвитку гіпотиреозу становить 8,7 [3]. Але використання лише симптомів для діагностики гіпотиреозу призведе до помилкового встановлення діагнозу в осіб з еутиреозом [82, 83]. Пацієнти з гіпотиреозом можуть мати ≥1 симптом гіпотиреозу або відхилення від норми в результатах аналізів функції ЩЗ, які зазначають у рамках рутинних скринінгових тестів на тлі інших захворювань, таких як дисліпідемія, фібриляція передсердь, зниження когнітивних функцій, незрозуміле збільшення ваги або знижена фертильність. Оскільки функцію ЩЗ оцінюють доволі часто, не дивно, що багатьом людям випадково діагностують гіпотиреоз, зазвичай субклінічний [84].
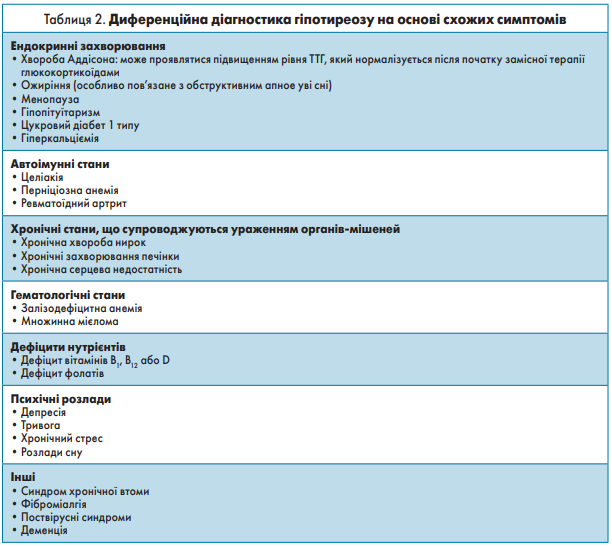
Діагностувати гіпотиреоз особливо складно у вагітних жінок і дітей. Під час вагітності пацієнтки з гіпотиреозом можуть мати один або кілька симптомів, які зазвичай пов’язані з гіпотиреозом (наприклад, втома або збільшення ваги), але їх можна неправильно пов’язати з власне вагітністю. На практиці, особливо в регіонах, де не застосовують скринінгові стратегії, у більшості жінок діагноз встановлюють на пізніх термінах вагітності або випадково, або за допомогою скринінгу на дисфункцію ЩЗ у тих, хто має супутні ускладнення, такі як гестаційна гіпертензія або прееклампсія [85, 86]. Через важливу роль тиреоїдних гормонів у нормальному розвитку мозку в ранньому віці гестаційний гіпотиреоз, спричинений дефіцитом йоду, нелікований або недіагностований явний гіпотиреоз під час вагітності і нелікований вроджений гіпотиреоз можуть призвести до серйозної нейрокогнітивної і психомоторної дисфункції в нащадків. Кретинізм, стан, спричинений тяжким гестаційним дефіцитом йоду, характеризується серйозною затримкою фізичного і розумового розвитку в ранньому дитинстві [87]. У дітей тривалий і тяжкий явний гіпотиреоз може проявлятися не лише типовими симптомами, що спостерігають у дорослих (такими як втома, незрозуміле збільшення ваги або непереносимість холоду), але також зобом, затримкою росту або статевого дозрівання [88]. Оскільки симптоми гіпотиреозу є неспецифічними і варіабельними, під час диференційної діагностики треба пам’ятати про низку інших захворювань із подібними проявами, які відображені в таблиці 2.
Мікседематозна кома
Мікседематозна кома (МК) є найтяжчою формою гіпотиреозу, яка, за відсутності вчасної діагностики і лікування, може прогресувати до смерті. У разі МК летальність становить 50-60%; таким чином, раннє розпізнавання є життєво необхідним [89].
МК може розвинутися de novo або, що вірогідніше, виникнути на тлі гіпотиреозу внаслідок прийому низки ліків, системних захворювань (таких як пневмонія) або інших причин [89]. МК частіше спостерігається взимку в літніх жінок і може проявлятися типовими ознаками тяжкого гіпотиреозу, а також гіпотермією, гіпонатріємією, гіперкапнією та гіпоксемією. Дуже важливо, щоб лікування гормонами ЩЗ було розпочато негайно, в ідеалі – в умовах відділення інтенсивної терапії [89]. Утім досі до кінця не ясно, який тип тиреоїдних гормонів (тироксин, трийодтиронін або обидва) потрібно при цьому використовувати. Окрім замісної терапії гормонами ЩЗ використовують додаткові заходи, зокрема вентиляцію легень, зігрівання, інфузійну терапію, антибіотики, вазопресорні засоби і кортикостероїди.
Діагностичний алгоритм
До появи біохімічних досліджень для оцінки функції ЩЗ основою діагностики гіпотиреозу були симптоми. Наявність таких ознак, як уповільнені гомілковостопні рефлекси, низький рівень базального метаболізму і брадикардія, допомагали підтверджувати діагноз, але при цьому, імовірно, як легкі, так і тяжкі форми гіпотиреозу часто залишалися нерозпізнаними.
Поява аналізів для оцінки функції ЩЗ (спочатку рівні циркулюючих тиреоїдних гормонів у 1950-х роках, а потім ТТГ у 1960-х) змінила правила гри. Можливість вимірювати сироватковий рівень ТТГ і рівні гормонів ЩЗ (спочатку за допомогою радіоімунологічного аналізу, а пізніше за допомогою імунологічного аналізу) означала можливість виявлення легших форм, а також те, що пацієнтів можна було лікувати значно меншими дозами тиреоїдних гормонів [90].
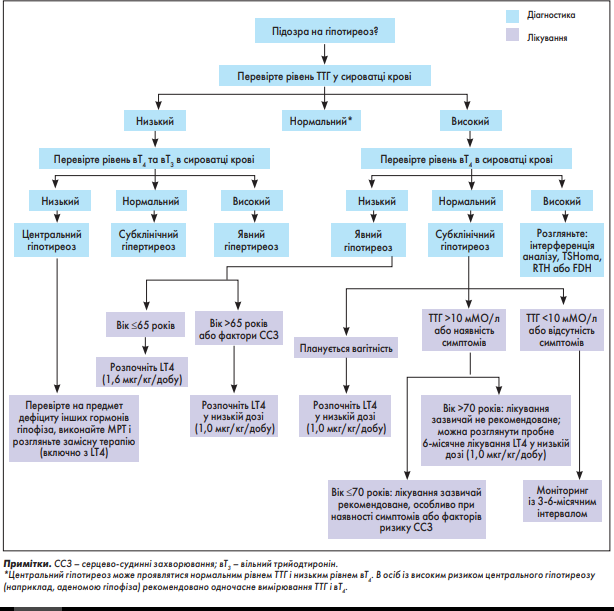
Біохімічне дослідження функції ЩЗ, як правило, за допомогою імунологічних аналізів ІІІ покоління, сьогодні залишається наріжним каменем точності діагностики дисфункції ЩЗ. Визначення сироваткового рівня ТТГ – найнадійніший маркер оцінки стану ЩЗ в більшості пацієнтів за умови виключення патології гіпофіза і прийому ліків, що змінюють секрецію ТТГ. Між ТТГ і тироксином існує логарифмічно-лінійний зв’язок: зниження рівня вT4 удвічі асоціюється з підвищенням рівня циркулюючого ТТГ у 100 разів [91]. Проте зв’язок ТТГ–вT4 у деяких осіб може бути нелінійним і залежати від віку, статі, куріння та наявності АТ-ТПО [16]. Аномальний рівень циркулюючого ТТГ є найбільш раннім показником дисфункції ЩЗ, оскільки гіпоталамус і гіпофіз реєструють, що рівень вT4 змінився від генетично визначеного значення для конкретної людини [92]. Є різні моделі тестів, які допомагають діагностувати дисфункцію ЩЗ (рис. 3).
Рис. 3. Алгоритм діагностики і лікування гіпотиреозу
Першим кроком в обстеженні пацієнта з підозрою на первинний гіпотиреоз є визначення рівня ТТГ у сироватці крові. Якщо рівень ТТГ у сироватці крові постійно підвищений, потрібно визначити периферичні рівні гормонів ЩЗ, щоб відрізнити субклінічний гіпотиреоз від явного. Терапія левотироксином (LT4) має бути розпочата в усіх пацієнтів з явним гіпотиреозом. Лікування LT4 може бути розпочато за наявності стійкого субклінічного гіпотиреозу в пацієнтів віком ≤70 років, які мають симптоми, потенційно спричинені гіпотиреозом, в осіб із серцево-судинним ризиком, зобом, АТ-ТПО, у тих, хто планує вагітність і/або чий рівень ТТГ у сироватці крові >10 мМО/л. Більшість пацієнтів із субклінічним гіпотиреозом і старше 70 років можна вести без лікування. У пацієнтів із субклінічним гіпотиреозом, які не розпочали терапію тироксином, слід періодично контролювати функцію ЩЗ. Низький рівень ТТГ у сироватці разом із низьким периферичним рівнем тиреоїдних гормонів має викликати підозру на центральний гіпотиреоз, тому необхідно оцінити функцію гіпофіза. Підвищення сироваткового рівня ТТГ з підвищеним периферичним рівнем гормонів ЩЗ може бути наслідком викривлення результатів аналізів, ТТГ-секретуючої аденоми гіпофіза, резистентності до тиреоїдних гормонів (РТГ) або сімейної дизальбумінемічної гіпертироксинемії (СДГ).
Скринінг на гіпотиреоз
Скринінг на гіпотиреоз передбачає оцінку функції ЩЗ в безсимптомних осіб без дисфункції ЩЗ, але з підвищеним ризиком розвитку тиреоїдної патології. Незважаючи на високу поширеність гіпотиреозу в загальній популяції, легкість діагностики (визначення рівня ТТГ у сироватці крові) і доступність дешевого лікування, немає доказів того, що раннє виявлення й лікування гіпотиреозу супроводжується кращими клінічними наслідками для пацієнта. Деякі організації, такі як Американська тиреоїдна асоціація (American Thyroid Association), Американська асоціація клінічних ендокринологів (American Association of Clinical Endocrinologists) і Латиноамериканське тиреоїдне товариство (Latin American Thyroid Society), рекомендують проходити скринінг через різні проміжки часу для осіб старше певного віку, наприклад кожні 5 років починаючи з 35-річного віку [96, 97]. Однак у 1996 році Королівський коледж лікарів Великої Британії (Royal College of Physicians in the UK) дійшов висновку, що скринінг загальної популяції невиправданий, ураховуючи низьку кількість випадків явного гіпотиреозу, виявлених під час скринінгу [98]. Подібним чином у 2015 р. Робоча група з профілактичних послуг США дійшла висновку, що наявних доказів для визначення співвідношення користь-ризик для скринінгу гіпотиреозу недостатньо [99]. Потенційним поясненням відмінностей у стратегіях перевірки між різними організаціями можуть бути відмінності в акцентах.
Скринінг може виявити багатьох осіб із незначним підвищенням рівня ТТГ у сироватці крові, особливо серед людей похилого віку або тих, хто страждає на ожиріння, але надійних доказів того, що лікування подібних порушень приносить користь пацієнтам, бракує. Проте в осіб із високим ризиком дисфункції ЩЗ, у тому числі з факторами ризику гіпотиреозу (наприклад, зоб, попереднє лікування гіпертиреозу, таке як терапія радіоактивним йодом або часткова тиреоїдектомія, опромінення шиї в анамнезі, прийом ліків, що впливають на функцію ЩЗ, або наявність інших автоімунних захворювань) скринінг може бути корисним.
Скринінг на гіпотиреоз треба розглядати в пацієнтів із дисліпідемією, гіпонатріємією, незрозумілим високим рівнем м’язових ферментів, макроцитарною анемією або перикардіальним чи плевральним випотом незрозумілої етіології [97]. Крім того, особи з високим ризиком розвитку захворювань ЩЗ, наприклад із синдромом Дауна, синдромом Тернера або захворюванням гіпофіза, також мають регулярно проходити обстеження на предмет розвитку гіпотиреозу.
Необхідно розглянути цілеспрямоване виявлення випадків дисфункції ЩЗ у вагітних жінок із регіонів із помірним і тяжким дефіцитом йоду, жінок із симптомами, які можуть свідчити про дисфункцію ЩЗ, в осіб з особистою і/або сімейною історією захворювань ЩЗ або в жінок із повторним викиднем чи безпліддям нез’ясованої етіології [97]. Під час вагітності скринінг легких форм гіпотиреозу є суперечливим і залишається предметом дискусій через можливість надмірного лікування і відсутність доказів того, що лікування легкої дисфункції ЩЗ тиреоїдними гормонами покращує нейрокогнітивні наслідки в нащадків [100, 101].
Користь скринінгу вродженого гіпотиреозу в новонароджених за допомогою оцінки тиреоїдної функції методом сухої краплі крові є беззаперечною. Це одна з найуспішніших програм неонатального скринінгу. Вроджений гіпотиреоз є однією з найпоширеніших причин інтелектуальних порушень, яким можна запобігти. Оскільки більшість немовлят із цим захворюванням не мають явних клінічних проявів і сімейного анамнезу, неможливо визначити групу високого ризику.
Універсальні програми скринінгу новонароджених доступні в багатьох країнах, і саме вони стали запорукою нормального або майже нормального нейрокогнітивного розвитку більшості немовлят із вродженим гіпотиреозом [102].
Модифікація харчування для запобігання гіпотиреозу в осіб із групи ризику
Йодування солі – успішний захід для зменшення частоти розвитку гіпотиреозу в регіонах, де раніше спостерігався тяжкий дефіцит йоду [11]. Однак дефіцит йоду залишається важливою проблемою громадського здоров’я, незважаючи на глобальні зусилля подолання цього дефіциту за допомогою програм йодування. Адекватне споживання йоду є важливим для всіх людей, але може мати особливе значення для осіб з автоімунною патологією ЩЗ, оскільки дефіцит йоду може спровокувати або погіршити гіпотиреоз [11].
Рекомендована добова доза йоду становить 90 мкг для дітей дошкільного віку, 120 мкг для дітей шкільного віку, 150 мкг для дорослих і 250 мкг для вагітних жінок [103].
Хронічне надмірне споживання йоду також може спричинити зміни функції ЩЗ – як правило, підвищення рівня ТТГ у сироватці крові – у чутливих осіб. Підтримання оптимального споживання йоду має вирішальне значення, особливо під час вагітності [104].
Добавки із селеном можуть знижувати рівні АТ-ТПО у пацієнтів з автоімунним захворюванням ЩЗ в короткостроковій або середньостроковій перспективі [105]. Треба зазначити, що клінічна користь зниження рівня АТ-ТПО неясна, і довгострокова безпека добавок селену досі не встановлена. Немає достатніх доказів того, що така терапія нормалізує підвищений рівень ТТГ у сироватці крові в осіб із хронічним автоімунним захворюванням ЩЗ [106].
Ведення пацієнтів із гіпотиреозом
Замісна терапія дефіциту тиреоїдних гормонів тироксином
Терапія тироксином є основою лікування гіпотиреозу. Лікування може зменшувати тканинні прояви і поліпшувати якість життя пацієнтів, а також сприяти розвитку нервової системи в немовлят і маленьких дітей. Типові повні замісні дози для дорослих становлять 1,6 мкг/кг/добу [7]. Нижчі початкові дози можна використовувати для людей похилого віку, тих, хто страждає легким гіпотиреозом або пацієнтів із нелікованими ССЗ. Оскільки дозування на основі маси тіла може переоцінювати потреби в осіб з ожирінням, були розроблені алгоритми дозування з поправкою на індекс маси тіла (ІМТ) [107].
У пацієнтів із первинним гіпотиреозом лікування спрямоване на нормалізацію рівня ТТГ у сироватці крові. У пацієнтів із центральним гіпотиреозом рівень ТТГ у сироватці крові є значною мірою неінформативним, і натомість лікування має бути спрямоване на те, щоб рівень вT4 у сироватці крові перебував у верхній половині референтного діапазону [108]. Лікування сприяє зникненню симптомів гіпотиреозу в більшості пацієнтів, хоча неспецифічний характер симптомів означає, що вони можуть бути зумовлені іншими причинами. Рівень ТТГ у сироватці крові слід контролювати через 6 тиж після початку лікування або будь-якої зміни дози, а потім кожні 6-12 місяців.
Потрібно уникати недостатнього і надмірного заміщення гормонів ЩЗ (окрім раку ЩЗ, коли для зниження ризику рецидиву пухлини може знадобитися дозування, що пригнічує виділення ТТГ) через потенційний токсичний вплив на серце і кістки та підвищений ризик смерті [108-110]. Тироксин треба приймати постійно, в ідеалі за 60 хв до сніданку, але також прийнятний прийом тироксину за 30 хв до сніданку або перед сном натщесерце [111]. Рівень ТТГ необхідно контролювати після початку або припинення прийому ліків, які можуть перешкоджати всмоктуванню, зв’язуванню або метаболізму тироксину [57]. Порушення всмоктування тироксину також може спостерігатися після баріатричних операцій або внаслідок шлунково-кишкових розладів. У пацієнтів із мальабсорбцією допомогти стабілізувати рівень ТТГ можуть допомогти рідкі, а не таблетовані форми тироксину [112].
Лікування субклінічного гіпотиреозу в дорослих
Ризик прогресування від субклінічного до явного гіпотиреозу становить приблизно 2-4% на рік і є ймовірнішим у пацієнтів з АТ-ТПО [113]. Підвищені рівні ТТГ у сироватці крові, особливо >10 мМО/л, пов’язані з підвищеними серцево-судинним ризиком і смертністю [114, 115]. Однак наразі немає єдиної думки щодо того, чи потрібно лікувати субклінічний гіпотиреоз. Дослідження, які оцінювали ефективність тироксину в осіб віком ≥65 років, не виявили чіткої симптоматичної користі [116, 117]. Подібним чином дослідження з використання тироксину в пацієнтів із гострим інфарктом міокарда і субклінічним гіпотиреозом не виявило покращення функції лівого шлуночка [118].
Метааналіз показав, що тироксин може знижувати смертність у пацієнтів із субклінічним гіпотиреозом віком <65-70 років, але не в літніх осіб [119]. Хоча одна настанова рекомендує не проводити лікування, коли рівень ТТГ <20 мМО/л [120], більшість авторів пропонують індивідуальний розгляд доцільності призначення низьких доз тироксину в пацієнтів, особливо ≤70 років, які мають симптоми, потенційно пов’язані з гіпотиреозом, серцево-судинні фактори ризику, зоб, АТ-ТПО, планують вагітність і/або рівень ТТГ у сироватці крові яких становить >10 мМО/л [97, 121-123].
Лікування вагітних
Плід, що розвивається, під час критичних фаз раннього розвитку мозку повністю залежить від гормонів ЩЗ матері (зазвичай до 16-20 тиж вагітності). Нелікований явний гіпотиреоз під час вагітності асоціюється з підвищеним ризиком викидня, передчасних пологів, гестаційної гіпертензії, прееклампсії, низької ваги при народженні, внутрішньоутробної смерті і порушення інтелектуального розвитку дитини [97, 124]. Явний гіпотиреоз під час вагітності потребує негайної ініціації замісного лікування тироксином [34, 125]. Рекомендації щодо потреби в лікуванні при легших формах гіпофункції ЩЗ в матері під час вагітності залишаються суперечливими. Субклінічний гіпотиреоз у матері асоціюється з підвищеним ризиком переривання вагітності, відшарування плаценти, передчасного розриву плодових оболонок, передчасних пологів і неонатальної смерті [126, 127]. Гіпотироксинемія у матері (низький рівень вT4 за умов нормального рівня ТТГ у сироватці крові) також пов’язана з несприятливими акушерськими наслідками і порушенням розвитку нервової системи дитини [126, 128]. Проте проведені на сьогодні клінічні випробування не продемонстрували чіткої переваги лікування LT4 у разі субклінічного гіпотиреозу або гіпотироксинемії під час вагітності [129-131].
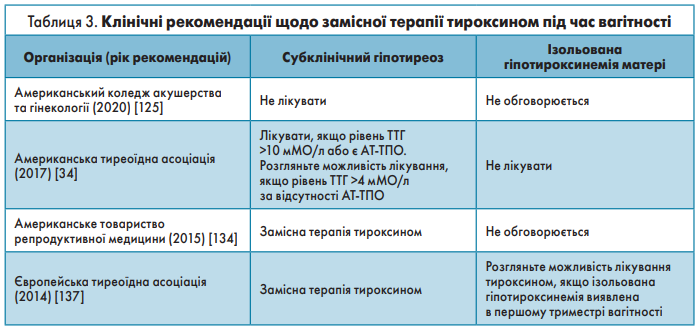
Сучасні рекомендації в клінічних практичних настановах широко варіюють і представлені в таблиці 3.
Більшість вагітних жінок, які отримують терапію LT4, для забезпечення еутиреозу під час вагітності потребуватимуть збільшення дози LT4 (на 25-30%, щойно діагностовано вагітність). Протягом першої половини вагітності необхідно ретельно контролювати рівень ТТГ у сироватці крові, приблизно кожні 4 тиж [34]. Під час вагітності і в період до зачаття дозу тироксину потрібно підбирати для досягнення цільового рівня ТТГ у сироватці <2,5 мМО/л [34, 125].
Лікування жінок із недостатністю репродуктивної функції
Невеликі рандомізовані дослідження продемонстрували, що терапія тироксином, розпочата до зачаття, покращує результати допоміжних репродуктивних технологій, коли вихідний рівень ТТГ становить >4,0 мМО/л, особливо в жінок з АТ-ТПО [132]. Рекомендований цільовий рівень ТТГ у жінок, які отримували лікування, становить <2,5 мМО/л [133]. Хоча явний гіпотиреоз завжди треба лікувати, невідомо, чи покращує лікування субклінічного гіпотиреозу перед зачаттям фертильність або наслідки вагітності в жінок, які завагітніли без використання допоміжних репродуктивних технологій [134].
Лікування немовлят і дітей
Оскільки гормони ЩЗ необхідні для нормального росту і нейророзвитку в ранньому віці, немовлята зі вродженим гіпотиреозом не здатні виробляти достатню кількість гормонів ЩЗ для підтримання їх фізіологічного рівня в тканинах після народження і потребують швидкого початку терапії тироксином протягом перших 2 тиж після пологів. Початкові дози тироксину для немовлят мають становити 10-15 мкг/кг на добу [7]. Контрольну лабораторну і клінічну оцінку необхідно проводити кожні 1-2 тиж, доки рівень ТТГ у сироватці крові не нормалізується, кожні 1-3 міс до 12-місячного віку, а потім кожні кілька місяців, доки не завершиться ріст. Терапія має бути спрямована на те, щоб у дітей із первинним гіпотиреозом рівень ТТГ у сироватці крові був у межах вікового референтного діапазону, а в дітей із центральним гіпотиреозом – у верхній половині референтного діапазону вT4. У дітей без чіткої першопричини стійкого вродженого гіпотиреозу потрібно провести повторну оцінку гіпофізарно-щитоподібної системи приблизно у віці 3 роки, щоб визначити потребу в постійному прийомі тироксину.
Дітям молодшого віку потрібні вищі дози тироксину на кілограм маси тіла проти дітей старшого віку: рекомендовано 4-6 мкг/кг для дітей віком 1-3 роки, 3-5 мкг/кг віком 3-10 років і 2-4 мкг/кг віком 10-16 років [7]. У більшості дітей субклінічний гіпотиреоз не прогресує до явного і має безсимптомний перебіг. Лікування субклінічного гіпотиреозу в дітей старше 3 років зазвичай розглядають лише тоді, коли рівень ТТГ у сироватці крові >10 мМО/л, особливо за наявності АТ-ТПО, гіперліпідемії [135] або побоювань щодо швидкості росту [136]. За дітьми з менш вираженим підвищенням рівня ТТГ можна спостерігати без терапії [137].
Лікування пацієнтів похилого віку
Особи старше 65-70 років мають підвищений ризик несприятливих ефектів від прийому надмірних доз тироксину, у тому числі серцевої аритмії, прогресуючої серцевої недостатності, посиленого метаболізму кісткової тканини, що призводить до остеопорозу, катаболічної атрофії м’язової тканини, погіршення якості життя і підвищення смертності [138]. Саме тому часто рекомендують починати лікування з низьких доз тироксину (25-50 мкг/добу) і поступово титрувати дози в осіб старше 65 років, особливо в тих, хто має ССЗ. При нормальному старінні може спостерігатися фізіологічне підвищення рівня ТТГ у сироватці крові [139], що є аргументом проти лікування помірного підвищення ТТГ у літніх пацієнтів. Якщо вирішено лікувати субклінічний гіпотиреоз, особливо важливо до початку лікування підтвердити протягом певного часу стійкість підвищення ТТГ вище відповідного віку рівня, оскільки функція ЩЗ може спонтанно нормалізуватися майже в 50% осіб віком ≥65 років [140]. Також важливо уникати надмірного лікування, а в пацієнтів старше 70 років рекомендовано досягти рівня ТТГ у сироватці крові 4-6 мМО/л [7].
Резюме
Хоча причини та наслідки гіпотиреозу були вперше описані більш як століття тому [90], важлива інформація щодо поширеності, генетичних причин, зовнішніх факторів і діагностичних порогів, лікування та оптимізації лікування гіпотиреозу все ще обмежена.
У багатьох регіонах світу відсутні дані щодо поширеності первинного гіпотиреозу і захворюваності на нього. Крім того, незважаючи на важливість програм неонатального скринінгу для раннього виявлення й лікування вродженого гіпотиреозу, понад 70% населення світу не проходять скринінг під час народження, що ускладнює оцінку частоти виникнення вродженого гіпотиреозу [176] і, що важливіше, перешкоджає своєчасному лікуванню.
За оцінками, генотипова зумовленість мінливості рівня ТТГ становить 65%, тоді як у найбільшому на сьогодні загальногеномному асоціаційному дослідженні (GWAS) усі 42 значущі асоціації разом становлять 33% генетичної варіації рівнів ТТГ, демонструючи чітку полігенність [13]. Хоча збільшення розміру вибірки в майбутньому GWAS сприятиме виявленню відсутньої генотипової зумовленості мінливості рівня ТТГ, очікується, що вдосконалені методи (такі як секвенування всього геному) також матимуть значний вплив. На додаток до генетичних і вроджених факторів (наприклад, статі) відомо, що фактори ризику довкілля, у тому числі куріння та надмірна вага, впливають на функцію ЩЗ. Однак варіабельність, що пояснюється віком, статтю, курінням, ІМТ, рівнями АТ-ТПО і вживанням алкоголю, разом становить лише ~7% варіації ТТГ і 5% вT4 [16]. Тому дослідження інших факторів ризику, у тому числі впливу хімічних речовин, що порушують роботу ендокринної системи, необхідне для визначення їхнього впливу на ризик розвитку дисфункції ЩЗ, можливо, починаючи з періоду до або самого зачаття.
Для уникнення гіпотиреозу необхідно споживати оптимальну кількість йоду. Незважаючи на те що йодування солі було впроваджено в більш як 120 країнах світу, дефіцит йоду легкого і помірного ступеня все ще залишається проблемою громадського здоров’я в багатьох регіонах. Крім того, сіль усе частіше споживається з комерційно оброблених харчових продуктів, які зазвичай не використовують йодовану сіль, що призводить до змін у йодному статусі на національному і регіональному рівнях. Програми йодування солі потребують ретельного моніторингу з метою уникнення дефіциту або надлишку йоду в населення [177]. Групи, найвразливіші до дефіциту йоду, – це маленькі діти, особливо віком до 6 міс, а також вагітні й жінки, які годують груддю, оскільки дефіцит йоду в плода і в дитини раннього віку може призвести до когнітивних розладів. Низьке споживання йоду під час лактації призводить до зниження його вмісту в грудному молоці, що особливо важливо, оскільки останнє може бути єдиним джерелом йоду для
овонароджених до 6 міс [178]. Кілька національних опитувань показують, що багато вагітних жінок наразі споживають недостатньо йоду [179]. В одному з досліджень, проведених у Великій Британії, середня концентрація йоду в сечі вагітних жінок становила 85,3 мкг/л, що відповідає дефіциту йоду [179]. За рекомендаціями ВООЗ вагітні досягають оптимального йодного статусу, коли медіана концентрації йоду в сечі становить 150-249 мкг/л (у невагітних це значення становить 100-199 мкг/л). Гіпотиреоз під час вагітності особливо важко діагностується і лікується.
На сьогодні не встановлено консенсусу щодо порогових значень сироваткового рівня ТТГ для початку лікування, і дискусія щодо визначення дисфункції ЩЗ під час вагітності триває.
Діагностика гіпотиреозу базується на лабораторних вимірюваннях сироваткових рівнів ТТГ і вT4. Референтні діапазони ТТГ і вT4, визначені 2,5-м і 97,5-м перцентилями, зазнали критики через їх довільний характер і те, що вони не враховують потенційний довгостроковий ризик серйозних захворювань [99]. Як субклінічний, так і явний гіпотиреоз пов’язані з підвищеним ризиком ішемічної хвороби серця і факторів ризику ССЗ, таких як неалкогольна жирова хвороба печінки. Крім того, були запропоновані вікові референтні діапазони сироваткового рівня ТТГ для того, щоб уникнути необґрунтованого лікування людей похилого віку, особливо в контексті субклінічного гіпотиреозу [140].
Це уявлення ґрунтується на припущенні, що рівень ТТГ з віком зростає. Два дослідження, одне в Австралії (n=1100) [184], а інше в США (n=834), виявили, що рівень ТТГ у сироватці крові підвищується з віком, тоді як дослідження в Нідерландах (n=1225) повідомило про відсутність змін рівня ТТГ з віком [16]. Крім того, в одному з досліджень, проведених в Австралії, було встановлено, що в осіб із найвищим рівнем ТТГ на початку дослідження з часом спостерігали найменше його підвищення [184]. Ці суперечливі результати потребують подальших досліджень у більших популяціях дорослих для визначення відповідних вікових референтних меж.
Гормони ЩЗ зазнають тканиноспецифічного метаболізму, у тому числі дейодування, сульфатування, глюкуронідації, дезамінування і декарбоксилювання. Відповідно, є широкий спектр метаболітів тиреоїдних гормонів [184]. У дослідженнях на тваринах і кількох дослідженнях на людях із невеликим розміром вибірки різні метаболіти гормонів ЩЗ продемонстрували чіткий вплив на серцево-судинну систему та серцево-судинні фактори ризику [185]. Проте на сьогодні бракує інформації про важливість метаболітів тиреоїдних гормонів для прогнозування результатів лікування пацієнтів із ССЗ та їх потенційну корисність як детермінанти ССЗ у загальній популяції, у тому числі осіб із гіпотиреозом.
Залишкові симптоми та інші прояви гіпотиреозу в пацієнтів, які отримували замісну терапію, пояснюють нездатністю монотерапії тироксином відновити нормальну фізіологію ЩЗ, особливо нормальне співвідношення Т4 і Т3 у сироватці крові. У кількох дослідженнях вивчали ефективність комбінованої терапії тироксином і трийодтироніном; результати виявилися неоднозначними. Ця невідповідність пояснюється невеликими розмірами вибірки і потенційною мінливістю частки учасників з однонуклеотидним поліморфізмом (ОНП) DIO2T92A. Вважають, що відсутність відповіді на монотерапію в підгрупи пацієнтів із гіпотиреозом пов’язана з наявністю ОНП, який знижує активність DIO2 і, отже, зменшує перетворення Т4 на Т3. Однак у жодному з включених у метааналіз досліджень, в якому оцінювали вплив комбінованої терапії, не повідомляли частку пацієнтів із ОНП [159]. Таким чином, необхідні подальші дослідження з більшою вибіркою пацієнтів для оцінки ефективності й безпечності комбінованої терапії.
Список літератури – у редакції.
Реферативний огляд статті Layal Chaker et al. Hypothyroidism. Nature Reviews Disease Primers. Volume 8, 30 (2022)/
Підготувала Ганна Кирпач
Повну версію статті дивіться: https://www.nature.com/articles/s41572-022-00357-7
Збірник клінічних рекомендацій: ендокринологія. Додаток № 1 до Медичної газети «Здоров’я України», Тематичного номера «Діабетологія. Тиреоїдологія. Метаболічні розлади»