21 березня, 2023
Антитромбоцитарна терапія у пацієнтів із гострим ішемічним інсультом або транзиторною ішемічною атакою
Антитромбоцитарна терапія – наріжний камінь у веденні пацієнтів із гострим ішемічним інсультом (ГІІ) та у вторинній профілактиці інсульту. Пропонуємо до вашої уваги огляд оновлених клінічних настанов з антитромбоцитарної та антикоагулянтної терапії у пацієнтів, які перенесли ГІІ або транзиторну ішемічну атаку (ТІА), які були створені експертами Корейського товариства боротьби з інсультом (KSS, 2022) (P. Hong-Kyun et al. Clinical practice guidelines for stroke: antithrombotic therapy for patients with acute ischemic stroke or transient ischemic attack. Journal of Stroke. 2022; 24 (1): 166‑175).
Тривалий час ацетилсаліцилова кислота (АСК) була єдиним антитромбоцитарним засобом із доведеною у масштабних клінічних дослідженнях ефективністю щодо запобігання ранньому рецидиву інсульту та смерті або інвалідизації у пацієнтів із ГІІ (CAST Collaborative Group, 1997; International Stroke Trial Collaborative Group, 1997; Chen et al., 2000). Оскільки ефект АСК у пацієнтів із ГІІ є помірним, тривали пошуки дієвіших схем антитромбоцитарної терапії.
Зокрема, у дослідженні CHANCE (2013) вперше продемонстровано переваги подвійної антитромбоцитарної терапії (ПАТТ) клопідогрелем і АСК порівняно з монотерапією АСК у китайських пацієнтів із так званим малим ГІІ або ТІА, асоційованою з високим ризиком інсульту (ТІА високого ризику) (Wang et al., 2013). Пізніше результати дослідження CHANCE були відтворені та додатково підтверджені для різних етнічних груп у випробуванні POINT (Johnston et al., 2018). Наразі ПАТТ клопідогрелем і АСК визнана і рекомендована як стандарт ведення пацієнтів із малим ГІІ або ТІА високого ризику (Powers et al., 2019; Boulanger et al., 2018; Australian clinical guidelines for stroke management, 2022).
Тривала терапія пероральними антикоагулянтами, що не є антагоністами вітаміну К, (НОАК) або варфарином рекомендована для вторинної профілактики інсульту пацієнтам із фібриляцією передсердь (ФП), які перенесли ішемічний інсульт або ТІА (Powers et al., 2018).
Проте бракує даних клінічних досліджень щодо оптимального часу старту пероральної антикоагулянтної терапії впродовж гострої фази, коли одночасно є високий ризик повторного інсульту та геморагічної трансформації. Хоча пероральну антикоагулянтну терапію у пацієнтів із ГІІ і ФП широко застосовують у реальній клінічній практиці. За результатами спостережних досліджень і експертного консенсусу в деяких настановах оновлено рекомендації щодо застосування пероральної антикоагулянтної терапії у пацієнтів із ГІІ і ФП (Powers et al., 2019; Klijn et al., 2019; Steffel et al., 2018).
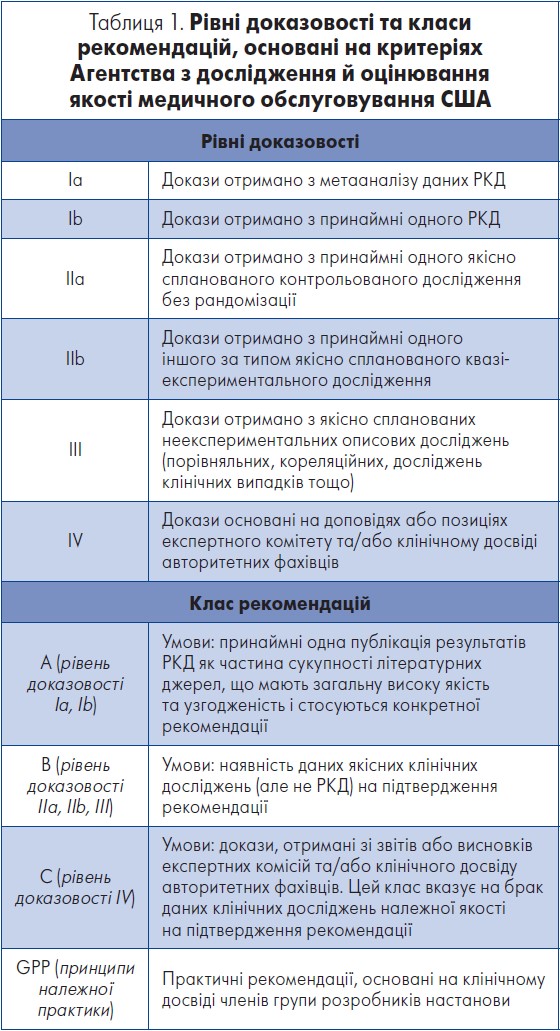
У настановах Корейського товариства боротьби з інсультом застосовано позначення рівнів доказовості та класів рекомендацій, основаних на критеріях Агентства з дослідження й оцінювання якості медичного обслуговування США (AHRQ) (табл. 1). Нижче викладено доказову базу, на підставі якої створено настанови, тобто дані досліджень і метааналізів.
Адаптовано за Agency for Health Care Policy and Research, 1993.
Подвійна антитромбоцитарна терапія клопідогрелем і АСК
Випробування CHANCE
У випробуванні CHANCE взяли участь 5170 пацієнтів із Китаю з малим ішемічним інсультом (показник за шкалою тяжкості інсульту Національного інституту здоров’я США [NIHSS] ≤3 балів) або ТІА високого ризику (показник за шкалою оцінювання ризику інсульту після ТІА ABCD2 [Age, Blood pressure, Clinical features, Duration of symptoms, Diabetes mellitus] ≥4 балів). Упродовж 24 год із виникнення симптомів вони почали отримувати комбінацію клопідогрелю (навантажувальна доза 300 мг за 1-й день, по 75 мг раз на добу впродовж 90 днів) і АСК (75‑300 мг за 1-й день, по 75 мг раз на добу впродовж 21 дня) або монотерапію АСК (75‑300 мг за 1-й день, по 75 мг раз на добу впродовж 90 днів) (Wang et al., 2013).
Зокрема, у групі, яка отримувала клопідогрель і АСК, фіксували нижчий, ніж у групі монотрепії АСК, ризик настання первинної кінцевої точки ефективності (повторного інсульту – ішемічного або геморагічного) протягом 90 днів (8,2 проти 11,7%; відношення ризиків [ВР] 0,68; 95% довірчий інтервал [ДІ] 0,57‑0,81; p<0,001; абсолютне зниження ризику [АЗР] 3,5%). Користь була суттєвою для всіх визначених заздалегідь підгруп. Щодо вторинних кінцевих точок ефективності, то застосування комбінації клопідогрелю з АСК порівняно з монотерапією АСК знижувало ризик виникнення будь-якого інсульту, інфаркту міокарда (ІМ) або судинної смерті (8,4 проти 11,9%; ВР 0,69; 95% ДІ 0,58‑0,82; p<0,001; АЗР 3,5%) та ішемічного інсульту (7,9 проти 11,4%; ВР 0,67; 95% ДІ 0,56‑0,82; p<0,001; АЗР 3,5%). У групах не виявлено відмінностей щодо ризику виникнення від помірних до тяжких кровотеч (0,3 проти 0,3%, p=0,73) або геморагічного інсульту (0,3 проти 0,3%, p=0,98).
Випробування POINT
До дослідження POINT залучили 4881 пацієнта різних етносів із Північної Америки, Європи, Австралії та Нової Зеландії (загалом із 10 країн), із малим ГІІ (показник за шкалою NIHSS ≤3 балів) або ТІА високого ризику (показник за шкалою ABCD2 ≥4 балів). На відміну від дослідження CHANCE, пацієнти були рандомізовані впродовж 12 год після маніфестації інсульту або ТІА. Одна група учасників отримувала навантажувальну дозу клопідогрелю (600 мг), а надалі ПАТТ – комбінацію клопідогрелю з АСК – упродовж 90 днів, тоді як друга – монотерапію АСК (Johnston et al., 2018). Первинна кінцева точка ефективності була комбінованою і охоплювала ішемічний інсульт, ІМ або смерть через ішемію, спричинену аномалією судин. Дослідження POINT припинили раніше запланованого терміну через підвищення ризику великих кровотеч у групі ПАТТ. Медіана часу між виникненням симптомів і рандомізацією становила 7,4 год. Зокрема, 57% залучених до випробування пацієнтів мали ГІІ. Група учасників, які отримували ПАТТ, порівняно з тими, хто приймав тільки АСК, мала суттєво нижчий ризик настання первинної кінцевої точки впродовж 90 діб (5,0 проти 6,5%; ВР 0,75; 95% ДІ 0,59‑0,95; p=0,020; АЗР 1,5%). Цей ефект був стійким у всіх попередньо визначених підгрупах. Щодо вторинних кінцевих точок, то ПАТТ, порівняно з монотерапією АСК, ефективніше знижувала ризик ішемічного інсульту (4,6 проти 6,3%; ВР 0,72; 95% ДІ 0,56‑0,92; p=0,01; АЗР 1,7%) та будь-якого інсульту (4,8 проти 6,4%; ВР 0,74; 95% ДІ 0,58‑0,94; p=0,01; АЗР 1,6%). Проте в групі ПАТТ частота великих кровотеч була значно вищою, ніж у групі монотерапії АСК (0,9 проти 0,4%; ВР 2,32; 95% ДІ 1,10‑4,87; p=0,02; АЗР 0,5%). Ретроспективний аналіз результатів дослідження POINT засвідчив, що переваги ПАТТ над монотерапією АСК є значущими протягом перших 7 і 30 днів, але зникають із 31-го по 90-й день, тоді як ризик великих кровотеч у групі ПАТТ значно зростає з 8-го по 90-й день. Так, на 1 тис. пацієнтів, що отримали лікування, ПАТТ упродовж 90 днів порівняно з монотерапією АСК може запобігти 15 великим ішемічним подіям і спричинити п’ять додаткових великих кровотеч, а протягом 30 днів – запобігти 19 великим ішемічним подіям та спричинити дві додаткові великі кровотечі.
Об’єднаний аналіз і метааналіз
За результатами об’єднаного аналізу даних окремих пацієнтів, які брали участь у дослідженнях CHANCE та POINT (n=10 051), порівняно з монотерапією АСК комбінація клопідогрелю і АСК значуще знижувала ризик великих ішемічних подій, а саме ішемічного інсульту, ІМ, смерті через ішемію, спричинену аномалією судин (6,5 проти 9,1%; ВР 0,70; 95% ДІ 0,61‑0,81; p<0,001). ПАТТ також знижувала ризик ішемічного інсульту (6,3 проти 8,9%; ВР 0,69; 95% ДІ 0,60‑0,80; p<0,001) і будь-якого інсульту (6,5 проти 9,1%; ВР 0,71; 95% ДІ 0,61‑0,81; p<0,001) порівняно з монотерапією АСК. Великі кровотечі (0,6 проти 0,4%; ВР 1,67; 95% ДІ 0,93‑2,99; p=0,09) і геморагічний інсульт (0,3 проти 0,2%; ВР 1,16; 95% ДІ 0,52‑2,60; p=0,71) частіше траплялися у пацієнтів, які отримували ПАТТ, ніж у групі монотерапії АСК, проте, ця різниця незначна. Часовий аналіз продемонстрував, що переваг ПАТТ щодо великих ішемічних подій переважно досягали впродовж періоду 1‑21-й день (5,2 проти 7,8%; ВР 0,66; 95% ВР 0,56‑0,77; p<0,001) та не є значущими між 22 і 90-м днем (1,4 проти 1,5%; ВР 0,94; 95% ДІ 0,67‑1,32; p=0,72). Щодо суто клінічної користі (запобігання великим ішемічним подіям – зменшення великих кровотеч) ПАТТ мала чітку перевагу в період 1‑21-й день, але з 22-го до 90-го дня така перевага була незначною (Pan et al., 2019).
Потрійна антитромбоцитарна терапія
У дослідженні TARDIS порівнювали ефективність і безпеку потрійної антитромбоцитарної терапії (АСК, дипіридамол і клопідогрель) і стандартної терапії (монотерапія клопідогрелем або комбінація АСК і дипіридамолу), розпочатих впродовж 48 год після виникнення симптомів у пацієнтів із гострим некардіоемболічним ішемічним інсультом або ТІА (Bath et al., 2018). Пацієнтів із Великої Британії (95%), Грузії, Данії та Нової Зеландії рандомізували в групи потрійної (n=1556) або стандартної терапії (n=1540). Пацієнти отримували призначену терапію впродовж 30 днів, після чого з 31-го до 90-го дня отримували лікування згідно з локальними настановами.
Дослідження TARDIS було припинено невдовзі після залучення 76% запланованої кількості учасників через суттєве зростання частоти великих кровотеч та брак ефективності потрійної терапії.
Не виявлено відмінностей щодо настання первинної кінцевої точки (частота і тяжкість повторного інсульту або ТІА) впродовж 90 днів між групами потрійної й стандартної терапії (6 проти 7%; скориговане загальне відношення шансів [ВШ] 0,90; 95% ДІ 0,67‑1,20; p=0,47). Проте потрійна терапія порівняно зі стандартною супроводжувалася вищим ризиком великих кровотеч (20 проти 9%), зокрема внутрішньочерепних крововиливів (ВК).
Тикагрелор
У дослідженні SOCRATES порівнювали застосування тикагрелору та АСК у пацієнтів із малим ГІІ (показник за шкалою NIHSS ≤5 балів) або ТІА високого ризику (показник за шкалою ABCD2 ≥4 балів) упродовж перших 24 год після появи симптомів (Johnston et al., 2016). Група тикагрелору отримувала навантажувальну дозу 180 мг, після чого – по 90 мг двічі на добу впродовж 90 днів; група АСК –300 мг, після чого – по 100 мг раз на добу впродовж 90 днів. До дослідження залучили 13 199 пацієнтів різних рас із 33 країн; 36,5% осіб рандомізували протягом 12 год з появи симптомів; 73,2% учасників перенесли малий ГІІ.
Порівняно з АСК тикагрелор суттєво не знижував частоту настання первинної кінцевої точки, що охоплювала повторний інсульт, ІМ або смерть упродовж 90 днів (6,7 проти 7,5%; ВР 0,89; 95% ДІ 0,78‑1,01; p=0,07). Щодо вторинних кінцевих точок, то група тикагрелору порівняно з групою АСК мала нижчий ризик ішемічного інсульту (5,8 проти 6,7%; ВР 0,87; 95% ДІ 0,76‑1,00; p=0,046) і будь-якого інсульту (5,9 проти 6,8%; ВР 0,86; 95% ДІ 0,75‑0,99; p=0,03).
Однак заздалегідь визначений статистичний план мав певну ієрархію, за якою статистична значущість для кожної вторинної кінцевої точки могла бути прийнята лише в разі досягнення статистичної значущості первинної кінцевої точки. У групах тикагрелору і АСК фіксували подібний ризик виникнення великих кровотеч (0,5 проти 0,6%; ВР 0,83; 95% ДІ 0,52‑1,34; p=0,45), але пацієнти, які отримували тикагрелор, мали більший ризик появи задишки АСК (6,2 проти 1,4% відповідно).
Результати дослідження THALES були опубліковані вже після завершення розроблення консенсусу для цієї настанови, тож в оновлених рекомендаціях їх не відображено. Загалом у дослідженні THALES порівнювали ефективність і безпеку застосування комбінації тикагрелору (навантажувальна доза 180 мг із подальшим прийманням по 90 мг двічі на добу) і АСК (300‑325 мг за 1-й день із подальшим прийманням 75‑100 мг/добу) із монотерапією АСК у 11 016 пацієнтів із малим ГІІ (показник за шкалою NIHSS ≤5 балів) або ТІА високого ризику (показник за шкалою ABCD2 ≥6 балів або інтра- / екстракраніальний стеноз ≥50%). Застосування цих препаратів розпочинали протягом 24 год після виникнення симптомів (Johnston et al., 2020). Через 30 днів група, яка отримувала комбінацію тикагрелору й АСК, порівняно з тими, хто приймав монотерапію АСК, мала нижчий ризик настання первинної кінцевої точки, а саме інсульту або смерті (5,4 проти 6,5%; ВР 0,83; 95% ДІ 0,71‑0,96; p=0,020) та ішемічного інсульту (5,0 проти 6,3%; ВР 0,79; 95% ДІ 0,68‑0,93; p=0,004). Проте у групі комбінованої терапії порівняно з групою монотерапії АСК виявлено значно більше випадків тяжких кровотеч (0,5 проти 0,1%; ВР 3,99; 95% ДІ 1,74‑9,14; p=0,001) і ВК або фатальних кровотеч (0,4 проти 0,1%; ВР 3,66; 95% ДІ 1,48‑9,02; p=0,005).
Початок антитромбоцитарної терапії у пацієнтів після внутрішньовенного тромболізису
У попередніх настановах KSS (2009) рекомендовано уникати антитромбоцитарної терапії впродовж 24 год після проведення внутрішньовенного (в/в) тромболізису (ВВТ), ці рекомендації основані на консенсусі експертів.
За даними одноцентрового спостережного дослідження, проведеного в Південній Кореї, ранній (упродовж 24 год після реперфузійної терапії) початок приймання антитромбоцитарних засобів є безпечним. Із 712 пацієнтів, що отримали реперфузійну терапію (із яких тільки ВВТ – 34%, ВВТ і механічну тромбоектомію (МТ) – 34%, тільки МТ – 32%), 456 (64%) осіб застосовували антитромбоцитарну терапію впродовж перших 24 год після реперфузії. Порівняння раннього (<24 год) і пізнього (>24 год) початку антитромбоцитарної терапії не виявило збільшення ризику симптоматичної геморагічної трансформації у першому випадку (3,3 проти 3,1%; скориговане ВШ 0,85; 95% ДІ 0,35‑2,10). Зокрема, показники 3-місячних сприятливих результатів (0‑1 бал за модифікованою шкалою Ренкіна [mRS]) були порівнянними у групах раннього і пізнього початку антитромбоцитарної терапії (39,3 проти 34,8%; ВШ 1,09; 95% ДІ 0,75‑1,59). Модальність реперфузійної терапії (ВВТ, ВВТ+МТ або МТ) не змінювала зв’язку між часом початку і геморагічною трансформацією або показниками за шкалою mRS (Jeong et al., 2016).
У Настанові з ведення пацієнтів з інсультом Американської асоціації серця / Американської асоціації з вивчення інсульту (AHA/ASA, 2019) цей момент викладено так: Розділ 3.9. Антитромбоцитарна терапія – призначення АСК – рекомендована пацієнтам із ГІІ упродовж 24‑48 год після виникнення симптомів. Як правило, у пацієнтів, які отримують альтеплазу в/в, приймання АСК відкладають на 24 год. Проте воно може бути розглянуто за наявності супутніх захворювань, щодо яких відомо, що таке лікування за відсутності введення альтеплази в/в має суттєву користь або ж відмова від нього може спричинити значний ризик (клас рекомендації I, рівень доказовості A).
Цилостазол
У Південній Кореї було проведено рандомізоване подвійне сліпе дослідження CAIST за участю 458 пацієнтів із ГІІ (показник за шкалою NIHSS ≤15 балів), у якому порівнювали терапію цилостазолом (200 мг/добу) з АСК (300 мг/добу); лікування розпочинали протягом 48 год від появи симптомів, воно тривало 90 днів (Lee et al., 2011). Первинної кінцевоїточки – 0‑2 бали за шкалою mRS через 90 днів –досягли 76% пацієнтів із групи цилостазолу і 75% із групи АСК. За ефективністю цилостазол не поступався АСК. Частота серцево-судинних подій (3 проти 4%, p=0,41) і геморагічних ускладнень (11 проти 13%, p=0,43) були порівнянними в обох групах. Однак дослідження мало обмеження, передусім – це малий обсяг вибірки.
Антагоністи рецепторів глікопротеїну IIb/IIIa
Ранні РКД не продемонстрували безпеки та ефективності в/в введення абциксимабу в пацієнтів із ГІІ (Adams et al., 2008). Власне, за попередньою настановою не рекомендовано в/в застосування антагоністів рецепторів глікопротеїну IIb/IIIa для екстреної антитромбоцитарної терапії. Пацієнти, яким виконували МТ, часто потребували резервну терапію через неповну реканалізацію або реоклюзію внаслідок тромбозу in situ. За результатами нещодавнього спостережного дослідження можна припустити, що застосування тирофібану як резервної терапії є безпечним у пацієнтів із невдалою реканалізацією після МТ (Zhang et al., 2019).
У двох спостережних дослідженнях, проведених у Південній Кореї, підтверджено безпеку та доцільність застосування тирофібану в/в або внутрішньоартеріально у пацієнтів із гострою атеросклеротичною оклюзією великих артерій, яким виконували МТ. В одному дослідженні за участю 118 пацієнтів із залишковим стенозом після МТ у групі тирофібану (n=59) фіксували більшу кількість успішних реканалізацій (81,4 проти 42,4%, p=0,016) і значно нижчу частоту великих внутрішньомозкових і/або субарахноїдальних крововиливів (15,3 проти 5,1%, p=0,068), ніж у групі, яка не отримувала тирофібану (n=59). Крім того, пацієнти, які отримували тирофібан, через 3 міс. досягали ліпших функціональних результатів – показників за шкалою mRS0‑2 бали (52,5 проти 32,2%, p=0,025) (Kim et al., 2020).
В іншому дослідженні 98 пацієнтів, яким виконували тромбектомію з подальшою ангіопластикою, зі стентуванням залишкового внутрішньочерепного атеросклеротичного стенозу або без нього, розподілили в групи, одна з яких отримувала тирофібан в/в (n=30), а друга була контрольною (n=68). Частота внутрішньомозкових крововиливів, смертність упродовж 90 днів і кількість пацієнтів, які досягли через 90 днів показників за шкалою mRS0‑2 бали суттєво не різнилися у групах тирофібану та контрольній. Рання реоклюзія в групі тирофібану траплялася рідше, ніж у контрольній групі (3,3 проти 25,0%, p=0,01) (Baek et al., 2021).
Антикоагулянтна терапія у пацієнтів із ФП, які перенесли інсульт
Довготривала пероральна антикоагулянтна терапія із застосуванням НОАК або варфарину рекомендована для вторинної профілактики інсульту в пацієнтів із ФП, які перенесли ішемічний інсульт або ТІА (Powers et al., 2019; Steffel et al., 2018). У гострому періоді після ішемічного інсульту, асоційованого з ФП, антикоагулянтна терапія має знижувати ризик повторного ішемічного інсульту, але потенційно збільшує ризик ВК. Через підвищений ризик ВК парентеральне введення антикоагулянтних засобів не рекомендоване (International Stroke Trial Collaborative Group, 1997; Saxena et al., 2001; Berge et al., 2000; Paciaroni et al., 2007; Whiteley et al., 2013). Щодо пероральної антикоагулянтної терапії, то у клінічних дослідженнях застосування варфарину в пацієнтів із ГІІ не вивчали, а з масштабних досліджень ефективності НОАК пацієнти, які перенесли інсульт 7‑30 днів тому, виключали (Giugliano et al., 2013; Patel et al., 2011; Granger et al., 2011; Connolly et al., 2009). Отже, попри явну користь тривалої антикоагулянтної терапії в пацієнтів із ФП, які перенесли ішемічний інсульт або ТІА, оптимальний час старту пероральної антикоагулянтної терапії досі не визначено.
Нещодавно у декількох спостережних дослідженнях та невеликому РКД підтверджено безпеку та ефективність ранньої пероральної антикоагулянтної терапії у пацієнтів із ФП, які перенесли ГІІ або ТІА (Paciaroni et al., 2015; Arihiro et al., 2016; Seiffge et al., 2016; Hong et al., 2017).
Проте рівень доказовості цих досліджень не є достатнім, тож Європейські, Канадські та Австралійські настанови з ведення пацієнтів з інсультом не надають спеціальних рекомендацій щодо часу початку застосування пероральних антикоагулянтів після ГІІ (Boulanger et al., 2018; Australian clinical guidelines for stroke management, 2022; Klijn et al., 2019).
Європейська асоціація серцевого ритму (EHRA, 2018) надала специфічні рекомендації щодо початку приймання НОАК залежно від тяжкості інсульту на підставі консенсусу експертів (Steffel et al., 2018). У настанові ASA (2019) зазначено, що доцільно розпочинати пероральну антикоагулянтну терапію між 4 і 14-м днями після виникнення неврологічних симптомів (середня сила рекомендації) (Powers et al., 2019).
Спостережні дослідження
У дослідженні RAF вивчали ризик розвитку повторних ішемічних подій і тяжких кровотеч під час антикоагулянотної терапії та оптимальний час старту такого лікування. Загалом 1029 пацієнтів із ФП, які перенесли ГІІ, були залучені в 29 медичних центрах Європи та Азії (Paciaroni et al., 2015). На початку дослідження в учасників середній показник за шкалою NIHSS становив 9,2±7,3 бала і був нижчим у 766 пацієнтів, які отримували антикоагулянтну терапію (тільки пероральні антикоагулянти, тільки низькомолекулярний гепарин або так звану «міст-терапію» [спочатку низькомолекулярний гепарин, а потім – пероральні антикоагулянти]), ніж у 263 пацієнтів, які не приймали антикоагулянтної терапії. Частота настання події комбінованої первинної кінцевої точки (інсульт, ТІА, симптоматична системна емболія, симптоматична мозкова кровотеча або велика позачерепна кровотеча) впродовж 90 днів була найнижчою у пацієнтів, які отримували тільки пероральні антикоагулянти (~7%), потім ішли «міст-терапія» (12,3%), відсутність антикоагулянтної терапії (14,4%), тільки низькомолекулярні гепарини (16,8%).
Антикоагулянтна терапія, розпочата між 4 і 14-м днями після виникнення симптомів інсульту, порівняно з іншими режимами була пов’язана зі значущим зниженням частоти настання комбінованої первинної кінцевої точки (скориговане ВШ 0,53; 95% ДІ 0,30‑0,93) та ішемічних подій (0,43; 95% ДІ 0,19‑0,97), а також із незначним зниженням частоти симптоматичних ВК (0,39; 95% ДІ 0,12‑1,19). Аналіз, обмежений пацієнтами, які отримували лише пероральні антикоагулянти, засвідчив, що найліпшим часом старту їх застосування є період із 4-го до 14-го дня після появи симптомів інсульту.
У мультицентровому дослідженні CROMIS‑2 (Велика Британія та Нідерланди) порівнювали клінічні результати 358 пацієнтів із ФП із раннім (≤4 днів після ГІІ або ТІА) і 997 – із пізнім (≥5 днів після ГІІ / ТІА або ж терапію не розпочинали) стартом пероральної антикоагулянтної терапії (Wilson et al., 2019). Частота настання композитної кінцевої точки (ішемічний інсульт, ВК, ТІА або смерть) упродовж 90 днів не була значно нижчою в групі раннього старту порівняно з групою пізнього старту (2 проти 5%; скориговане ВШ 0,85; 95% ДІ 0,35‑2,08).
Зокрема, у японському мультицентровому спостережному дослідженні SAMURAI-NVAF порівнювали ризик виникнення інсульту або системної емболії (СЕ) та великої кровотечі у 475 пацієнтів із ФП, які отримували НОАК, і 662 осіб, які отримували варфарин, під час перебування в стаціонарі з приводу ГІІ. Медіана інтервалу між інсультом і стартом приймання пероральних антикоагулянтів становила 3 дні в групі варфарину та 4 дні в групі НОАК. Упродовж 90 днів пацієнти із групи НОАК та варфарину мали порівнянний ризик інсульту або СЕ (2,84 проти 3,09%; скориговане ВШ 0,96; 95% ДІ 0,44‑2,04) і в групі НОАК виявили незначне зменшення частоти великих кровотеч (1,11 проти 2,61%; скориговане ВШ 0,63; 95% ДІ 0,19‑1,78) (Arihiro et al., 2016).
У межах дослідження порівнювали також клінічні результати 223 пацієнтів із раннім (0‑3 дні після ГІІ або ТІА) і 276 осіб із пізнім стартом терапії НОАК (≥4 днів, медіана 6 днів) (Mizoguchi et al., 2020).
Показники частоти інсульту / СЕ, великої кровотечі і смерті впродовж 2 років були порівнянними у двох групах. За даними аналізу результатів впродовж 90 днів, частота інсульту / СЕ становила 4,2% у групі раннього старту і 2,6% у групі пізнього старту (скориговане ВШ 1,49; 95% ДІ 0,48‑4,64).
Спостережні дослідження свідчать про потенційну користь раннього старту терапії НОАК у пацієнтів із ФП, які перенесли ГІІ або ТІА. Проте ці дослідження мають обмеження, пов’язані передусім із залученням до випробувань переважно пацієнтів із нетяжким інсультом.
Клінічні дослідження
У рандомізованому багатоцентровому відкритому дослідженні 2-ї фази Triple AXEL, (Південна Корея, 2014‑2015 рр.) 195 пацієнтів із ГІІ легкого ступеня тяжкості, асоційованими з ФП, упродовж 5 днів після виникнення симптомів розподілили на групи, що отримували ривароксабан (10 мг/добу впродовж 5 днів, потім – 15 або 20 мг/добу) або варфарин (цільове міжнародне нормалізоване відношення від 2,0 до 3,0) (Hong et al., 2017).
Медіана інтервалу від маніфестації інсульту до рандомізації становила 2 дні, медіана показника за шкалою NIHSS – 2 бали. У групах ривароксабану і варфарину спостерігали порівнянну частоту ішемічних ушкоджень (29,5 проти 34,5%; ВР 0,83; 95% ДІ 0,54‑1,26; p=0,38) і нових ВК (31,6 проти 28,7%; ВР 1,10; 95% ДІ 0,70‑1,71; p=0,68), які фіксували через 4 тижні за допомогою МРТ.
У кожній групі стався один випадок ішемічного інсульту, пов’язаного з ФП, і не було жодного випадку симптоматичного ВК. Дослідження підтвердило, що ранній (≤5 днів після появи симптомів) старт антикоагулянтної терапії є безпечним і може бути ефективним щодо запобігання ранньому повторному інсульту в пацієнтів із нетяжким інсультом, асоційованим із ФП.
Нині тривають чотири РКД (ELAN, OPTIMAS, TIMING, START), до яких залучено загалом 9974 пацієнтів і які мають на меті порівняти ранній і пізній старти застосування НОАК у пацієнтів із ГІІ, пов’язаним із ФП.
У таблиці 2 наведено короткий зміст рекомендацій KSS (2022) і зміни, що сталися порівняно з попередньою їх редакцією.
Адаптовано за P. Hong-Kyun et al., 2022.
Висновки
Як зазначають укладачі, поточне оновлення настанови було зосереджене на рекомендаціях щодо антитромбоцитарної терапії за малого ГІІ або ТІА високого ризику, яку застосовують упродовж 24 год від появи симптомів, а також щодо ранньої пероральної антикоагулянтної терапії у пацієнтів із ФП, які перенесли ГІІ. За статистичними даними щодо клінічних досліджень у Південній Кореї за 2020 рік, 29,7% усіх пацієнтів з ішемічним інсультом були госпіталізовані протягом 24 год після появи симптомів і мали показник за шкалою NIHSS ≤3 балів (легкий ступінь тяжкості), а 7,4% страждали на ФП і перенесли інсульт відносно легкого ступеня тяжкості (Clinical research collaboration for stroke in Korea: CRCS-K statistics 2020 report). На думку авторів, переглянуті рекомендації суттєво вплинуть на лікування принаймні третини пацієнтів із ГІІ або ТІА, які мають високий ризик раннього прогресування або рецидиву інсульту.
Підготувала Тетяна Ткаченко
Оригінальний текст документа читайте на сайті
www.stroke.or.kr