27 березня, 2015
Функция ненасыщенных жирных кислот в организме
Ненасыщенные жирные кислоты (НЖК) по числу двойных связей разделяются на моно-, ди-, три-, тетра-, пента-, гексаеновые. НЖК с одной или несколькими двойными связями являются структурными элементами фосфолипидов мембран и имеются в организме человека в значительных количествах (незаменимые жирные кислоты — линолевая, линоленовая, арахидоновая — поступают в организм с пищей). Самой распространенной из ненасыщенных жирных кислот является олеиновая (Е. А. Строев, 1986).
В фосфолипидах животных тканей очень мало содержится линолевой кислоты (0,05-0,4%), так как она превращается в линоленовую и арахидоновую. Линоленовая НЖК содержится в значительных количествах — 4-24%, содержание арахидоновой кислоты в фосфолипидах тканей составляет 0,2-22% (табл. 1). Биологическое значение ненасыщенных жирных кислот в метаболизме окончательно не выяснено, механизмы катаболизма НЖК в клетках животных также досконально не изучены. В молекулах НЖК две двойные связи, расположенные следующим образом: -СН=СН-СН=СН–, называются сопряженными (конъюгированными) (Л. Уайт и соавт., 1981).
Двойные связи определяют существование двух разных жирных кислот с 18-20 углеродными атомами, имеющими различное положение в пространстве: трансизомер имеет прямую форму, а углеродная цепь цисизомера всегда изогнута в месте двойной связи. Ненасыщенные жирные кислоты являются только цисизомерами, т.е. они все изогнуты. Жирные кислоты в свободном состоянии редко встречаются в составе мембран. Они являются важным фактором регулирования проницаемости мембран (влияют на поверхностные свойства фосфолипидов, белок-липидные и липид-липидные взаимодействия), функционирования мембранно-связанных ферментов (П. Г. Богач и соавт., 1981). В мембранах располагаются ферменты, активность которых зависит от липидного окружения. В этом окружении ферменты имеют определенную конформацию. Изменение липидного окружения (делипидирование, использование липолитических ферментов, липидообменивающих белков) ведет к изменению конформации белков (ферментов), изменению их каталитической активности (Н. Е. Кучеренко, А. Н. Васильев, 1985). Активность ферментов в мембранах связана с вязкостью липидной фазы мембран, составом липидов (П. Г. Богач и соавт., 1981; Н. Е. Кучеренко, А. Н. Васильев, 1985). Метаболическая активность липидзависимых ферментов определяется изменениями в липидном микроокружении и в первую очередь это касается фосфолипидов: от их состава и метаболизма зависят ферментативные процессы. Это подтверждено для микросомальной монооксигеназной системы. Липидные молекулы являются матриксом, оптимальным для функционирования мембранно-связанных ферментов. НЖК в мембранах придают им такое качество, как жидкостность (текучесть). Увеличение в мембранах содержания холестерина, насыщенность жирнокислотных радикалов в фосфолипидах снижают жидкостность мембран. Подвижность липидов изменяет конформацию полярных головок. Регулирующее влияние на мембранно-связанные ферменты оказывают гликофосфолипиды (стабилизируя мембраны). При модификации липидного состава теряется чувствительность к гормонам, фосфолипиды влияют на функционирование рецепторов, могут регулировать их число (Н. Е. Кучеренко, А. В. Васильев, 1985), взаимодействовать с токсинами. Интенсивность обновления фосфолипидов зависит от скорости синтеза ДНК в клетке. Имеется связь синтеза ДНК с составом липидов, перераспределением фракций фосфолипидов, степенью ненасыщенности жирнокислотных радикалов (насыщенные жирные кислоты тормозят синтез ДНК). Такие фракции фосфолипидов, как фосфатидилэтаноламины, кардиолипины дестабилизируют молекулы ДНК путем усиления активности ДНК-полимеразы. Фосфолипиды влияют на прочность ДНК (стабилизацию структуры). Все эти данные (Н. Е. Кучеренко, А. Н. Васильев, 1985) свидетельствуют о важной регуляторной роли фосфолипидов мембран, составной частью которых являются ненасыщенные жирные кислоты.
Окисление ненасыщенных жирных кислот
Мембраны клетки являются неполярной средой, в которой кислород растворяется в 7-8 раз лучше, чем в полярной (А. Хорст, 1982). Поэтому, по мнению автора, именно в мембранах чаще наблюдается окислительное превращение полиненасыщенных жирных кислот. Реакции окисления протекают в тех местах, где имеются ненасыщенные липиды (фосфолипиды): в мембранах митохондрий, эндоплазматического ретикулума, лизосом, плазматических мембранах. Окисление ненасыщенных жирных кислот протекает по схеме: RH + O2 –> ROOH.
К продуктам перекисного окисления ненасыщенных жирных кислот относят гидроперекиси липидов, альдегиды, малоновый диальдегид, другие диальдегиды, кетоны, спирты, эпоксиды. Физиологической функцией перекисного окисления является регуляция обновления, распада ненасыщенных структурных липидов, проницаемости липидов биологических мембран (Е. А. Строев, 1985). По мнению автора, активатором перекисного окисления липидов служат свободнорадикальные формы кислорода, образующиеся при одноэлектронном восстановлении его по схеме:
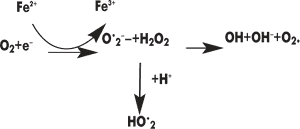
Кислородные радикалы (супероксидный, гидроксильный, пероксидный), обладая высокой реакционной способностью, ускоряют процесс перекисного окисления ненасыщенных жирных кислот. Активные атомы водорода ненасыщенных жирных кислот для вступления в реакцию, по мнению А. Хорста, нуждаются лишь в минимальных количествах энергии. Это окисление активирует радикальные формы кислорода, ионы металлов и, наоборот, тормозит витамин Е (токоферол), связывая пероксид и ОН-радикал. В присутствии оксидантов (даже небольшого количества) водород переходит к окислителю, что вызывает цепочку реакций, изменяющих структуру и функцию мембран. У насыщенных жирных кислот энергия разрыва С-Н-связи составляет около 381,3 кДж/моль, у ненасыщенных жирных кислот по месту двойной связи она равна 364,9 кДж/моль, т.е. значительно меньше (П. Г. Богач и соавт., 1981). Наименьшую энергию связи имеет водород, который находится в a-положении по отношению к двойной связи, — 315,7 кДж/моль. Активные формы кислорода способны отнимать водород из групп — СН2 — ненасыщенной жирной кислоты, превращая их в свободнорадикальные группы НС– (А. Я. Николаев, 1989). Радикал жирной кислоты легко присоединяет молекулу кислорода и превращается в перекисный радикал жирной кислоты: HC•+O2 –> HC–O–O–. Перекисный радикал может отнимать водород от другой молекулы жирной кислоты и восстанавливаться в гидроперекись (за счет окисления этой другой молекулы жирной кислоты в свободный радикал): HC–O-O•+CH2 –> HC–O–OH+HC•.
Образовавшийся второй радикал аналогично вступает в реакцию и возникает цепная химическая реакция, которая продолжается уже без инициирующих веществ. Катализировать окислительный процесс может двухвалентное железо: Fe2+ + O2 + H+ –> Fe3+ + HO2–. Затем радикал НО2– вступает в реакцию с жирной кислотой: RH + НО2– Н2О2 + R–, в дальнейшем образовавшийся радикал соединяется с молекулой кислорода О2 и образуется перекисный радикал RO2–. Он также может взаимодействовать с нейтральными молекулами жирных кислот и т.д. Перекиси (пероксиды) нестабильны и распадаются с образованием альдегидов в результате разрывов в жирной кислоте углерод-углеродной связи, которая соседствует с перекисной группой. Подобным образом могут окисляться не только ненасыщенные жирные кислоты в фосфолипидах мембран, но и свободные ненасыщенные жирные кислоты, остатки ненасыщенных жирных кислот. В тканях животных основное количество перекисей липидов составляют продукты, полученные из полиненасыщенных β-ацильных остатков эндогенных мембранных фосфатидилэтаноламинов и фосфатидилхолинов.
Однако имеются и иные взгляды на проблему окисления ненасыщенных жирных кислот. Л. С. Страйер (1984) считает, что образованный ковалентными связями скелет биомолекул стабилен в отсутствие ферментов или притока энергии. Для диссоциации углерод-углеродной связи (С-С) необходимо 83 ккал/моль, в то время как содержание энергии, запасенной в молекулах АТФ, составляет лишь 12 ккал/моль. Разрыв С-С связей под действием радикалов кислорода in vivo представляется маловероятным. А. Ленинджер считает, что самоокисление липидов в организме полностью заторможено благодаря наличию витамина Е, различных ферментов и аскорбиновой кислоты.
Ненасыщенные жирные кислоты, как и насыщенные, подвергаются β-окислению (А. Ленинджер,1985). Положение и число двойных связей в молекулах ненасыщенных жирных кислот определяют особенности их окисления. НЖК окисляются как насыщенные до места двойной связи. Если двойная связь имеет трансконфигурацию и расположение, как в еноил-КоА, образующемся при окислении насыщенных жирных кислот, то дальше окисление идет обычным путем (Е. А. Строев, 1986). При отсутствии этого условия вступает в действие дополнительный фермент, перемещающий двойную связь и меняющий цис- в трансконфигурацию. Двойная связь может восстанавливаться НАДФ•Н2 (Я. Кольман, К. Г. Рем, 2000). Е. А. Строев (1986) отмечает, что скорость окисления ненасыщенных жирных кислот очень высока: олеиновой кислоты в 11 раз, линолевой — в 114, линоленовой — в 170, арахидоновой — в 200 раз выше, чем стеариновой. В исследованиях с олеиновой кислотой, меченной дейтерием, было установлено, что она может редуцироваться, превращаясь в стеариновую, а последняя подвергается β-окислению (И. В. Савицкий, 1973,1982). Такой путь допускали и для других ненасыщенных жирных кислот. Однако, по мнению И. В. Савицкого (1973, 1982), их окисление происходит иначе. На первом этапе под действием липоксигеназы происходит дегидрирование (отщепление) одного атома водорода и жирная кислота превращается на свободный радикал. Липоксигеназы широко представлены в тканях животных и обнаружены в микросомальной фракции гомогенатов клеток. Они катализируют реакции переокисления жирных кислот, которые различаются расположением окисляемого кислородом атома углерода. (В микросомальных мембранах образование перекисей катализирует диоксигеназа фосфолипидов, зависящая от НАДФ-Н2. Для образования перекисей липидов необходимо участие негеминового железа, которое в дальнейшем восстанавливается в микросомальной электронно-транспортной цепи). Образование под влиянием липоксигеназы свободного радикала обусловливает перестройку всей молекулы жирной кислоты. В результате этого превращения двойные связи из изолированных становятся сопряженными (приближаются одна к одной), а кислота с сопряженными двойными связями при наличии кислорода, по мнению автора, окисляется с образованием гидроперекиси и цикличной перекиси. Перекиси и гидроперекиси разлагаются до отдельных фрагментов — жирного альдегида (к примеру, капронового), малонового диальдегида, полуальдегида дикарбоновой кислоты (И. В. Савицкий ). При этом имеется прямая зависимость количества образовавшегося малонового диальдегида от количества двойных связей в молекуле ненасыщенной жирной кислоты: линолевая образует одну молекулу малонового диальдегида, линоленовая — две, арахидоновая — три, клупанодоновая — четыре. В качестве примера можно привести окисление линолевой кислоты: она последовательно превращается в свободный радикал линолевой кислоты, затем в ненасыщенную кислоту с двойными сопряженными связями, дальше в гидроперекись и циклическую перекись линолевой кислоты, которые разлагаются на капроновый альдегид, малоновый диальдегид и полуальдегид азелаиновой кислоты. Последние три продукта расщепления претерпевают дальнейшее окисление: образуются капроновая, азелаиновая и малоновая кислоты. Капроновая кислота после превращения в капронилкоэнзим А подвергается β-окислению. Азелаиновая кислота также включается в β-окисление, а малоновая после декарбоксилирования превращается в уксусную кислоту. Таким образом, линолевая кислота превращается в остатки уксусной кислоты, которые затем в цикле Кребса окисляются до СО2 и Н2О. Аналогичным образом (но с другими промежуточными продуктами) окисляются и другие ненасыщенные жирные кислоты: при окислении линоленовой кислоты образуется пропионовая, азелаиновая и две молекулы малоновой кислоты, при окислении арахидоновой — капроновая, глютаровая и три молекулы малоновой кислоты. Путем многостадийного процесса линолевая кислота может сначала превратиться в арахидоновую, которая затем подвергается окислению. Таким образом, в данном случае ненасыщенные жирные кислоты подвергаются β-окислению, но это наступает на более поздних этапах после их предварительной фрагментации и образования альдегидов с короткой углеродной цепью. Однако следует напомнить, что приведенная выше в качестве примера окисления линолевая кислота используется для синтеза арахидоновой кислоты и в фосфолипидах тканей содержится лишь в следовых количествах. Продукты превращения линолевой и линоленовой кислот представлены в таблице 2.
Омега-3 жирные кислоты эйкозапентаеновая и докозагексаеновая оказывают выраженное антиатеросклеротическое, вазодилататорное, антитромботическое действие, улучшают реологию крови. Арахидоновая кислота (эйкозатетраеновая), входящая в состав фосфолипидов плазматических мембран, является предшественником эйкозаноидов — медиаторов (локальных гормонов), сигнальных веществ, которые образуются почти во всех клетках организма и имеют небольшую дальность действия (Я. Кольман, К. Г. Рем, 2000). К эйкозаноидам относят первичные (классические) простагландины, простациклины, тромбоксаны, лейкотриены, метаболиты простагландинов, гидроперекиси (рис.). Наиболее изучены производные арахидоновой кислоты. В результате ее превращения образуются простагландины Е2, F22, простациклин I2, тромбоксан А2. Эйкозаноиды образуются и из других ненасыщенных жирных кислот — эйкозатриеновой, эйкозапентаеновой (т.е. из С20 — полиеновых жирных кислот). Продукты превращения различных жирных кислот отличаются своими свойствами. Биосинтез эйкозаноидов начинается с гидролиза фосфолипидов плазматической мембраны под действием фосфолипазы А2, активность которой контролируется гормонами, другими биорегуляторами, сопряженными с G-белками (активность фосфолипазы А2 повышается и под воздействием липоперекисей). Авторы отмечают два главных пути биосинтеза эйкозаноидов. Инициатором первого пути является простагландин-синтаза (имеет свойства циклооксигеназы и пероксидазы), катализирующая превращение арахидоновой кислоты в циклические эндоперекиси. В результате последующих реакций, катализируемых другими ферментами, образуются простагландины, простациклины и тромбоксаны. Этот путь (циклооксигеназный) блокируют ацетилсалициловая кислота и нестероидные противовоспалительные препараты (в настоящее время различают циклооксигеназы-1 и 2). Их антитромбогенный эффект обусловлен торможением образования тромбоксана и агрегации тромбоцитов. Инициатором второго пути биосинтеза эйкозаноидов является упоминавшаяся выше липоксигеназа (блокирующее действие оказывают витамин Е, рутин). При участии липоксигеназы все полиеновые (полиненасыщенные) жирные кислоты окисляются с образованием гидроперокси- и гидроксипроизводных жирных кислот. В дальнейшем за счет дегидратации, различных реакций переноса из них образуются лейкотриены. Детальные механизмы биосинтеза эйкозаноидов и пути их окисления до конечных продуктов не выяснены. Как отмечают Я. Кольман и К. Г. Рем (2000), эйкозаноиды служат вторичными мессенджерами гидрофильных гормонов, контролируют сокращение гладкомышечных тканей сосудов, бронхов, матки, принимают участие в высвобождении продуктов внутриклеточного синтеза (гормонов, соляной кислоты, мукоидов), влияют на метаболизм костной ткани, периферическую нервную систему, иммунную систему, передвижение и агрегацию лейкоцитов и тромбоцитов (свертывание крови), являются эффективными лигандами болевых рецепторов. Эйкозаноиды быстро разрушаются (инактивируются в течение нескольких секунд в результате восстановления двойных связей и окисления гидроксигрупп), поэтому действуют как локальные биорегуляторы путем связывания с близко расположенными мембранными рецепторами своей клетки (аутокринное действие) или соседних клеток (паракринное действие). Их действие может быть опосредовано через цАМФ и цГМФ. Особое внимание исследователи уделяют в настоящее время метаболизму арахидоновой кислоты в тромбоцитах и эндотелии. Под действием циклооксигеназы в тромбоцитах образуются циклические эндоперекиси, простагландины, которые под действием тромбоксансинтетазы (содержится в микросомальной фракции тромбоцитов) превращаются в тромбоксан А2 (ТхА2) с периодом полураспада 30 секунд (А. Хорст, 1982). Тромбоксан А2 вызывает агрегацию тромбоцитов, тромбообразование, сужение сосудов, боль, отек. Находящаяся в эндотелии сосудов простациклинсинтетаза превращает эндоперекиси в простациклин ПГI2, который обладает противоположными по отношению к тромбоксану А2 свойствами: подавляет агрегацию тромбоцитов, расширяет сосуды. При повреждении эндотелия выработка в нем простациклинсинтетазы нарушается и преимущественно образуется тромбоксан А2, вызывающий изменения, необходимые для восстановления эндотелия: агрегацию тромбоцитов, тромбоз, спазм сосудов. В данном случае выбор пути метаболизма, очевидно, связан с состоянием эндотелия сосудов. Как отмечает А. Хорст (1982), при метаболизме эндоперекисей образуются свободные радикалы. Освобождаемые при ферментном окислении арахидоновой кислоты свободные радикалы гидрокси-типа, по его мнению, могут быть дополнительными факторами воспаления. В частности, гидроперокси — PGE2 — образуют свободные радикалы с центральным атомом кислорода.
Имеется функциональная связь между обменом незаменимых полиненасыщенных жирных кислот (линолевой, линоленовой и арахидоновой) и функционированием костной ткани. При отсутствии незаменимых жирных кислот в пищевом рационе экспериментальных животных замедляется их рост, нарушается работа почек. Образующиеся из НЖК простагландины оказывают влияние на метаболизм костной ткани, воспаление, кровообращение, транспорт ионов через мембраны. Простагландины принимают участие в ремоделировании костной ткани. Так ПГЕ2 влияет на формирование и активность остеокластов, процессы резорбции костной ткани. В частности усиление костной резорбции при иммобилизации, воспалении, злокачественных процессах объясняют действием простагландинов. Влияние ПГЕ2 на костное формирование зависит от концентрации: в концентрации 10–9-10–7 ммоль/л он увеличивает синтез коллагена остеобластами, при концентрации 10–6 ммоль/л — замедляет. ПГЕ1 ускоряет выход кальция из кости (А. Уайт и соавт., 1981). Как и паратгормон, ПГЕ1 стимулирует высвобождение из клеток костной ткани лизосомальных ферментов. Ацетилсалициловая кислота, ингибируя биосинтез простагландинов, снимает эти эффекты. Усилению костной резорбции способствуют, образующиеся в процессе окисления липидов, свободные радикалы: они участвуют в активации остеокластов.
Выделяют и третий путь метаболизма арахидоновой кислоты (В. Г. Денисюк и соавт., 1992). Под действием фосфолипазы А2 от молекулы арахидоновой кислоты отщепляется плазменилхолин и образуется предшественник фактора агрегации тромбоцитов (ФАТ) лизоплазменилхолин (лизо-ФАТ, лизофосфатидилхолин). Лизоплазменилхолин подвергается ацетилированию под влиянием ацетилтрансферазы и образуется ФАТ, вызывающий вазоконстрикцию, индуцирующий агрегацию тромбоцитов. Одновременно с увеличением содержания в крови ФАТ активизируется липоксигеназный путь метаболизма арахидоновой кислоты (увеличивается концентрация 5-НЕТЕ–5-гидроокись эйкозапентаеновой кислоты) и синтез лейкотриенов.
Продукты переокисления ненасыщенных жирных кислот легко обнаруживаются in vitro (Н. Е. Кучеренко, А. Н. Васильев, 1985). По мнению авторов in vivo их обнаружить сложно из-за незначительной концентрации, а также нейтрализации антиоксидантами. Кроме того, они включаются в β-окисление, цикл Кребса, а также из них образуются чрезвычайно не стабильные эйкозаноиды. Промежуточные гидроперекиси очень не стабильны и in vitro (Н. А. Тюкавкина, Ю. И. Бауков, 1991) и уже при комнатной температуре распадаются с образованием альдегидов, которые окисляются в конечные продукты реакции — кислоты (образуется четыре моно- и дикарбоновые кислоты с короткими углеродными цепями).
Как отмечает А. Лабори (1970), на липидные молекулы окисление действует своеобразно: размещение в пространстве длинных молекул жирных кислот тесно связано с восстановленным или окисленным состоянием связей между различными атомами углерода, с изгибами по месту двойных связей. И окисление молекулы жирной кислоты не ограничивается потерей молекулы водорода, а сопровождается пространственной перестройкой молекулы. Так как молекула находится в мембране, изменяется ее проницаемость.
Резюмируя изложенную информацию, следует отметить, что имеется несколько путей окисления ненасыщенных жирных кислот. К ним относятся следующие.
- β-Окисление, при этом вклад ненасыщенных жирных кислот в энергетические процессы незначителен.
- Перекисное окисление, инициированное активными формами кислорода, (АФК) металлами с переменной валентностью, т.е. неферментативное. Параметры этого процесса не установлены. А. Ленинджер указывает на возможность повреждения молекул ненасыщенных жирных кислот активными формами кислорода, однако в его работах, как и монографиях других всемирно известных биохимиков, отсутствуют данные о перекисном окислении липидов, инициированном АФК, как системном биологическом явлении, о механизмах перекисного окисления липидов. С другой стороны, наличие нормального (фонового) уровня в организме продуктов окисления ненасыщенных жирных кислот (гидроперекисей, диеновых конъюгатов, малонового диальдегида) показывает, что перекисное окисление липидов не может быть случайным, цепным, хаотичным патологическим процессом (тогда он не может и не должен характеризоваться нормой). Если процесс представлен нормой, то возникает вопрос о его физиологической роли в организме. Следует отметить также, что показатель малонового диальдегида не может характеризовать выраженность перекисного окисления липидов, инициированного АФК, ионами металлов с переменной валентностью, так как он образуется и в результате ферментативного перекисного окисления липидов инициированного липоксигеназами (И. В. Савицкий, 1973, 1982).
Метаболический путь продуктов переокисления липидов не прослежен. Накопление продуктов переокисления липидов обнаруживается in vitro. In vivo продукты расщепления ненасыщенных жирных кислот включаются в конечном итоге в энергетические процессы, как это было показано И.В. Савицким, из них образуются «короткоживущие» эйкозаноиды.
- Ферментативное перекисное окисление липидов, осуществляемое с участием липооксигеназ (диоксигеназ — в микросомальной сети) при наличии кислорода. Оно описано И.В Савицким (1973, 1982) и достаточно детально представлено выше.
- Окисление арахидоной (эйкозатетраеновой), дигомо-гамма-линолевой (эйкозатриеновой), эйкозапентаеновой кислот (т.е. С20-полиеновых жирных кислот) под влиянием циклооксигеназ, липооксигеназ с образованием эйкозаноидов. Линолевая, линоленовая, арахидоновые кислоты при участии липооксигеназ окисляются до гидроперекисей и гидроксипроизводных жирных кислот, из которых образуются лейкотриены.
Физиологическая роль перекисного окисления НЖК
Представленная выше информация позволяет сделать ряд важных выводов. Прежде всего, необходимо подчеркнуть, что переокисление ненасыщеных жирных кислот в мембранах, благодаря включению продуктов их распада в процесс β-окисления, сопряжено с окислительным фосфорилированием, энергетическими клеточными процессами: продукты распада НЖК в конечном итоге окисляются в цикле Кребса до СО2 и воды. Хотя в целом, как мы отметили выше, вклад ненасыщенных жирных кислот в энергетические процессы незначительный. Окисление ненасыщеных жирных кислот контролируется ферментами. Тот факт, что в организме имеется нормальный физиологический уровень (фоновый) малонового диальдегида (МДА), диеновых конъюгатов (ДК), других продуктов перекисного окисления липидов, свидетельствует о существовании строгого контроля за окислением липидов со стороны всей иерархической системы регуляции и в первую очередь ДНК. Последняя осуществляет контроль за метаболизмом посредством синтеза ферментов и клеточных белков, поэтому утверждение о существовании в клетках неконтролируемых свободнорадикальных реакций в больших масштабах не обосновано. Повреждение активными формами кислорода молекул ненасыщенных жирных кислот фосфолипидов мембран, по мнению А. Ленинджера и других исследователей, возможно, но имеет ограниченное место, т.к. АФК нейтрализуются ферментами, биоантиоксидантами (прежде всего витамином Е и С). Следует отметить, что лишь незначительная часть кислорода (1-3%) используется в свободнорадикальных реакциях, т.е. параметры этого процесса весьма ограничены. Образование перекисей липидов в различных тканях животных является нормальным процессом и осуществляется под контролем ферментов. Специфическое окисление ненасыщенных жирных кислот происходит в липоксигеназной реакции, в эндоплазматической сети его катализирует НАДФ•Н2-зависимая диоксигеназа. Образованные перекиси также подвергаются ферментативной деградации. При участии липоксигеназы все полиеновые кислоты (линолевая, линоленовая, арахидоновая) окисляются до гидроперекисей, гидроксипроизводных жирных кислот, из которых в результате последовательных реакций образуются лейкотриены. Арахидоновая кислота при участии простагландинсинтазы (циклооксигеназа + пероксидаза) превращается в ее метаболиты — простагландины, простациклины, тромбоксаны, лейкотриены, т.е. локальные гормоны, обладающие чрезвычайно важной разносторонней физиологической активностью.
Ткани интактных животных имеют определенный, разный для каждого органа, физиологический уровень содержания перекисей липидов (Ю. П. Козлов, 1985; Н. Е. Кучеренко, А. Н. Васильев, 1985). При этом уровень содержания перекисей липидов выше в тканях с высокой метаболической активностью. При различных физиологических состояниях содержание перекисных продуктов в фосфолипидах изменяется. Приведенные П. Г. Богач и соавт. (1981) данные свидетельствуют об увеличении интенсивности переокисления липидов в различных органах животных при дыхании кислородом, физической нагрузке (плавании), раздражении нервов, сокращении мышц. Таким образом, процессы окисления липидов (с образованием перекисей) являются важными для нормального функционирования биологических мембран и организма в целом. Физиологическая роль этих реакций состоит в регуляции обновления и проницаемости липидов биологических мембран, образовании эйкозаноидов — медиаторов (локальных гормонов) или сигнальных веществ, играющих важную биологическую роль в организме. Такие важнейшие мембранные процессы, как перенос электронов в дыхательной цепи, окислительное фосфорилирование, метилирование и гидроксилирование ряда субстратов эндогенного и экзогенного происхождения ферментными системами эндоплазматической сети и даже деление клеток, сопровождаются изменениями интенсивности течения процессов переокисления липидов (П. Г. Богач и соавт., 1981). Липоперекиси являются нормальными и необходимыми продуктами не только при биосинтезе простагландинов, простациклинов, тромбоксанов, но и прогестерона, они участвуют в гидроксилировании стирольного кольца холестерина. Свободные радикалы участвуют во многих биохимических процессах, без их образования в нейтрофилах и макрофагах организм погибает в результате нарушения обезвреживания микробов.
Регуляция процессов перекисного окисления НЖК
Выделяют (Н. Е. Кучеренко, А. Н. Васильев, 1985) целый ряд механизмов регуляции перекисного окисления липидов:
- Строгую структурную организацию липидных компонентов мембран: она влияет на количество промежуточных продуктов, скорость перекисного окисления липидов («разрыхление» мембран ведет к его усилению). Состав фосфолипидов мембран определяет количество, качество образующихся перекисей, перекисных радикалов.
- Нормальное функционирование ферментов, обеспечивающих инактивацию активных форм кислорода, свободных радикалов, и ферментов обмена фосфолипидов мембран. Процесс переокисления липидов зависит от степени ненасыщенности ацильных остатков жирных кислот: она оказывает определяющее влияние на количество гидроперекисей, их устойчивость к действию ферментов метаболизирующих гидроперекиси — глутатионлипопероксидазы, пероксидазы, каталазы.
- Достаточное содержание биоантиоксидантов в клетке, организме.
Для уровня течения перекисного окисления НЖК большое значение имеют концентрация кислорода в тканях (при его низком уровне интенсивность переокисления снижается, как и других окислительных процессов, высоком — усиливается), ферментные и неферментные системы, восстанавливающие перекиси (глутатионпероксидаза, глутатионредуктаза, супероксиддисмутаза, каталаза, пероксидаза, др.). Несколько механизмов регуляции действуют одновременно. С продуктами переокисления в клетке реагируют биоантиоксиданты: токоферолы, убихиноны, витамин К, аскорбиновая кислота. Они снижают активность перекисного окисления липидов. Антиоксидантными свойствами обладают восстановленные фенольные формы этих соединений: их свободные гидроксильные группы взаимодействуют с перекисными радикалами.
На наш взгляд, при анализе механизмов регуляции перекисного окисления ненасыщенных жирных кислот следует учитывать его взаимосвязь с энергетическими внутриклеточными процессами, а также функционированием пентозного цикла. Как это показал И.В. Савицкий, остатки (фрагменты) ненасыщенных жирных кислот, образующихся в процессе переокисления, включаются в конечном итоге в цикл Кребса и «сгорают» до СО2 и воды. Таким образом, их количество в клетке напрямую зависит от функционирования гликолиза, цикла Кребса, окислительно-восстановительной цепи. Имеется сопряженность между энергетическими процессами (окислительным фосфорилированием) в клетке и окислением ненасыщеных жирных кислот. Например, изменение концентрации свободных радикалов при злокачественном перерождении фибробластов в условиях воздействия аденовирусов коррелирует с активностью гликолитической цепи (Н. И. Кучеренко, А. Н. Васильев, 1985). В случае снижения интенсивности процессов окислительного фосфорилирования следует ожидать некоторое уменьшение активности процессов перекисного окисления липидов: уменьшение движения потока электронов по окислительно-восстановительной цепи митохондрий приведет к уменьшению образования активных форм кислорода, а затем к снижению интенсивности процесса переокисления. С другой стороны чрезвычайно важное регулирующее значение для уровня перекисного окисления липидов имеет функционирование пентозного цикла, в котором происходит восстановление НАДФ и окисленного глутатиона. Эти две молекулы, по мнению А. Лабори (1970), являются клеточным запасом водорода, необходимым для восстановления перекисей липидов, ликвидации свободных радикалов. Сульфгидрильные соединения (глутатион, цистеин, метионин, белки, содержащие сульфгидрильные группы), связывая радикалы и разлагая перекиси, снижают количество радикалов в организме. Защитное действие метиленового синего, цистамина, окисленного глутатиона при повышенном давлении О2, ионизирующем влиянии, по мнению А. Лабори, не связано с восстанавливающим действием. Наоборот, метиленовый синий, витамины Е, К могут окислять НАД•Н2, принимая электрон. Окисление, лимитированное НАДФ•Н2, направляет Г-6-Ф в сторону пентозного пути, а последний ведет к восстановлению НАДФ и вторично окисленного глутатиона. Физиологическим восстановителем НАДФ и окисленного глутатиона также является аскорбиновая кислота. Таким образом, в защите против агентов, образующих свободные радикалы и перекиси липидов, важнейшее значение имеет активность пентозного цикла. Ткани, в которых имеется активный пентозный цикл (слизистая оболочка, мышцы тонкого кишечника, яички), высокое содержание НАДФ, окисленного глутатиона, содержат очень мало перекисей.
И, наконец, перекисное окисление НЖК контролируется ДНК путем синтеза ферментов (липоксигеназы, диоксигеназы, глутатионпероксидазы, глутатионредуктазы, пероксидазы, каталазы, супероксиддисмутазы), клеточных белков (глутатиона). Таким образом, процесс перекисного окисления липидов (ненасыщенных жирных кислот) в организме не хаотичный, а контролируемый, имеющий исходный фоновый уровень.
Биологические эффекты продуктов переокисления НЖК
Переокисление ненасыщеных жирных кислот фосфолипидов мембран, значительное увеличение содержания продуктов этого окисления, по мнению П. Г. Богача и соавт. (1981), Н. Е. Кучеренко, А. Н. Васильева (1985), А. Лабори (1970), могут привести к целому ряду отрицательных эффектов, большинство из которых наблюдались in vitro. К этим эффектам относят конформацию липидов и белков, изменение структуры и функции мембран, повышение их проницаемости, нарушение активности мембранно-связанных ферментов. Сведения о свободнорадикальных процессах, полученные в эксперименте (in vitro), нельзя полностью экстраполировать на организм человека, хотя такие исследования помогают прояснить их сущность. Очевидно, что in vivo наиболее серьезные изменения в мембранах наступают в следующих случаях: при влиянии ионизирующей радиации, интенсивном ультрафиолетовом облучении, воздействии токсических веществ, обезвреживание которых совершается в эндоплазматической сети с участием специализированной ферментной системы переноса электронов — цитохрома Р-450, НАДФ•Н2; гипербарической оксигенации (гипероксии), интоксикации озоном. При перечисленных воздействиях подтвержден подобный характер изменений и показана эффективность антиоксидантной терапии. Как показывают результаты наших исследований (В.К. Казимирко и соавт., 2004) и анализ литературы, абсолютное большинство заболеваний (прежде всего в острый период и в период обострения) сопровождается интенсификацией окисления НЖК и развитием выраженной в различной степени антиоксидантной недостаточности. Возникающий дефицит биоантиоксидантов требует проведения соответствующей коррекции.
Таким образом, важная роль НЖК в организме определяется, прежде всего, биологическими эффектами специфического для них перекисного окисления и высокой физиологической активностью образующихся эйкозаноидов.
Литература
- Богач П.Г., Курский МД., Кучеренко Н.Е., Рыбальченко В.К. Структура и функция биологических мембран. Вища шк., Киев, 1981, 336 с.
- Казимирко В.К., Мальцев В.И., Бутылин В.Ю., Горобец Н.И. Свободнорадикальное окисление и антиоксидантная терапия. Морион, Киев, 2004, 160 с.
- Козлов Ю.П. Свободнорадикальное окисление липидов в биомембранах в норме и патологии. Биоантиокислители. Наука, Москва, 1985, С.4-5.
- Кольман Я., Рем К.Г. Наглядная биохимия: Пер. с нем. Мир, Москва, 2000, 469 с.
- Кучеренко Н.Е., Васильев А.Н. Липиды. Вища шк., 1985, 247 с.
- Лабори А. Регуляция обменных процессов: Пер. с франц. Медицина, Москва, 1970, 384 с.
- Ленинджер А. Основы биохимии: В 3-х томах. Т.2. Мир, Москва, 1985, 368 с.
- Николаев А.Я. Биологическая химия. Высш.шк., Москва, 1989, 495 с.
- Савицкий И.В. Биологическая химия. Вища шк., Киев, 1982, 472 с.
- Страер Л.С. Биохимия: Пер. с англ. В 3-х томах. Т.1. Мир, Москва,1984, 1232 с.
- Строев Е.А. Биологическая химия. Высш.шк., Москва, 1986, 479 с.
- Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. 2-е изд. Медицина, Москва, 1991, 528 с.
- Уайт Л., Хендлер Ф., Смит Э., Хилл Р., Леман И. Основы биохимии: в 3-х томах. Т.2. Мир, Москва, 1981, 617 с.
- Хорст А. Молекулярные основы патогенеза болезней: Пер. с польск. Медицина, Москва, 1982, 456 с.


