2 квітня, 2017
Современные подходы к ведению больных с диабетическим гастропарезом
Гастропарез – синдром, характеризующийся замедлением скорости опорожнения желудка (от твердой и/или жидкой пищи) при отсутствии признаков его механической обструкции. Ключевыми симптомами гастропареза являются постпрандиальное чувство переполнения в эпигастрии (чувство раннего насыщения), тошнота, рвота, вздутие живота и эпигастральная боль/дискомфорт, наблюдающиеся в течение 3 мес и более [11, 12, 41].
Большую часть пациентов с гастропарезом составляют женщины, которые в одном большом исследовании составили 87% всех больных. Установлено, что скорость опорожнения желудка у женщин меньше, чем у мужчин, особенно в позднюю фазу менструального цикла, что обусловлено ингибирующим действием прогестерона на сократимость желудка [31].
Этиология и классификация гастропареза
Подавляющее большинство всех случаев гастропареза приходится на 3 основных этиологических типа – идиопатический (~36%), диабетический (~29%) и постхирургический (~13%) [11, 12]. Причина идиопатического гастропареза до конца неясна, хотя в большинстве случаев предполагается вирусный генез (вирусы Эпштейна – Барр, цитомегаловирус, вирусы герпеса). При сахарном диабете (СД) гастропарез возникает вследствие плохо контролируемой гликемии, развития автономной и энтерической нейропатии, уменьшения числа интерстициальных клеток Cajal (ICС) [14, 19, 20, 42]. Постхирургический гастропарез чаще всего развивается после проведения ваготомий, фундопликации по Ниссену и бариатрических операций на желудке. Более редкие причины гастропареза включают другие эндокринные (гипотиреоз, гипо- и гиперпаратиреоз) и неврологические (паркинсонизм) расстройства, заболевания соединительной ткани (склеродермия), хроническую почечную недостаточность, паранеопластические заболевания. Нередко причиной преходящего ятрогенного гастропареза могут быть лекарственные средства, такие как опиоиды, трициклические антидепрессанты, блокаторы кальциевых каналов, холинолитики, некоторые противодиабетические средства (аналоги GLP-1), допаминовые агонисты, прогестерон содержащие средства, циклоспорин, клонидин, препараты лития, никотин и др. [41]. Все установленные этиологические факторы гастропареза приведены в таблице 1.
В зависимости от выраженности симптоматики гастропарез делят на 3 степени тяжести [12,47]. При легком гастропарезе (1 степень) симптомы относительно легко контролируются, потери веса при обычной или слегка модифицированной диете нет. Гастропарез средней степени тяжести является компенсированным, характеризуется умеренно выраженными симптомами, частично контролируемыми при помощи фармакотерапии, модификации питания и стиля жизни. Наконец, тяжелый гастропарез характеризуется рефрактерностью симптомов и декомпенсацией функции желудка, несмотря на фармакотерапию, частыми обращениями к врачу и госпитализациями, невозможностью поддерживать достаточный уровень питания при пероральном приеме пищи. Такие пациенты, кроме медикаментозной комбинированной терапии, нередко требуют проведения энтерального или парентерального питания, эндоскопического или хирургического лечения.
Эпидемиология гастропареза
Точную распространенность и социально-экономическое значение гастропареза оценить довольно тяжело ввиду неполной корреляции симптоматики гастропареза со скоростью опорожнения желудка и значительно более высоким уровнем диагностики гастропареза в академических медицинских центрах, чем на этапе первичной медицинской помощи. Тем не менее, считается, что гастропарезом, выраженным в той или иной степени, может страдать до 4% всей взрослой популяции [11]. По данным эпидемиологических исследований, проведенных в США, распространенность гастропареза составила 24,2 на 100 тыс. населения, причем для мужчин – 9,6, для женщин – 37,8 на 100 тыс. населения. Уровень заболеваемости гастропарезом в США в 1996-2006 гг. составил 2,4 для мужчин и 9,8 для женщин [12, 50]. По данным эпидемиологического исследования в Olmsted County (Миннесота, США), кумулятивный уровень заболеваемости гастропарезом соcтавил 4,8% для пациентов с СД 1 типа, 1% для больных СД 2 типа и 0,1% для пациентов без диабета [16, 31]. C возрастом уровень заболеваемости возрастает.
Установлено, что диабетический гастропарез в типичных случаях развивается при существовании СД более 10 лет, чаще – у пациентов с СД 1 типа, имеющих триопатию: нейропатию, нефропатию и ретинопатию. Хотя гастропарез чаще встречается при СД 1 типа, число больных с гастропарезом, ассоциирующимся с СД 2 типа, значительно больше, поскольку распространенность этого типа СД существенно выше.. Дополнительным фактором риска развития гастропареза у больных СД 2 типа является терапия инкретинами (аналоги GLP-1) [10, 23]. По данным некоторых исследований, проведенных в специализированных медицинских центрах, гастропарез, задокументированный при сцинтиграфии как снижение скорости опорожнения желудка, имел место в среднем у 40% (25-55%) больных СД 1 типа и у 30% больных СД 2 типа [5].
Симптоматика и естественное течение гастропареза
При детальном обследовании 146 больных с гастропарезом тошнота имела место у 92%, рвота – у 84%, вздутие живота – у 75% и чувство раннего насыщения – у 60% больных [12, 13, 24]. Абдоминальная боль или дискомфорт отмечаются у 49-89% больных с гастропарезом, хотя обычно и не являются доминирующими симптомами. Симптомы гастропареза неспецифичны и могут имитировать структурную патологию ЖКТ, такую как пептическая язвенная болезнь, частичная желудочная или тонкокишечная непроходимость, рак желудка или панкреатобилиарные расстройства. Кроме того, нередко имеется перекрест (оверлэп) симптомов гастропареза и функциональной диспепсии, при которой у большей части больных (при постпрандиальном дистресс-синдроме) также имеется замедление скорости опорожнения желудка. Среди осложнений гастропареза рассматриваются развитие рефлюкс-эзофагитов, синдрома Мэллори-Вейса и формирование безоаров желудка [11,41].
Как правило, диабетический гастропарез склонен к персистенции симптоматики, даже несмотря на адекватный гликемический контроль. Он существенно снижает качество жизни практически во всех сферах (физической, психоэмоциональной, ментальной, социальной и др.) независимо от наличия других коморбидных факторов, таких как возраст, курение, алкоголь или тип СД [33,48].
По данным одного из исследований, из 86 пациентов с СД, наблюдавшихся не менее 9 лет, гастропарез после учета других осложнений не ассоциировался с повышенной смертностью. Главными причинами смерти (в среднем через 6 лет) были кардиоваскулярные и почечные осложнения. Из 62 оставшихся в живых пациентов снижение скорости опорожнения желудка от твердой пищи было зафиксировано у 32 (52%) пациентов, от жидкой пищи – у 18 (29%), а эзофагеальный транзит был нарушен у 17 больных (27%). Из числа умерших длительность СД (р=0,048) и степень тяжести нейропатии (р=0,046), ретинопатии (р=0,017) и нарушение эзофагеального транзита (р=0,017) были достоверно выше, чем у оставшихся в живых пациентов [8, 33]. В то же время другие исследователи (Jung et al.) предоставили убедительные доказательства того, что наличие гастропареза ассоциируется с повышенной заболеваемостью и смертностью, повышением числа госпитализаций, в том числе скоропомощных, и увеличением объема медицинской помощи [31]. У пациентов с СД 1 и 2 типа и задокументированным гастропарезом достоверно чаще отмечали гипертензию и другие кардиоваскулярные осложнения, а также ретинопатию, связанную с развитием микро- и макроангиопатий и неадекватным гликемическим контролем [49].
Механизмы развития диабетического гастропареза (ДГ)
Опорожнение желудка зависит от тонуса фундального отдела желудка и фазовых сокращений его антрального отдела параллельно с торможением пилорической и дуоденальной сократимости. Оно требует четкого взаимодействия между гладкомышечной мускулатурой, энтерической и автономной нервной системой, специализированными клетками – водителями желудочного ритма ICС. При СД имеется целый ряд отклонений, потенциально способствующих развитию моторной дисфункции желудка, таких как автономная нейропатия, энтерическая нейропатия, вовлекающая как стимулирующие, так и ингибирующие нервы, аномалии со стороны ICС, острые колебания гликемического профиля, применение препаратов-инкретинов для лечения СД, психосоматические факторы и др. [10, 25, 39].
Гипергликемия сама по себе способна обратимо ухудшать моторику желудка и снижать эффективность прокинетиков. Также она снижает сократимость антрального отдела желудка и угнетает 3-ю антральную фазу мигрирующего моторного комплекса, способствует релаксации фундального отдела желудка, повышает сократимость его пилорического отдела, вызывает желудочную дисритмию (преимущественно, тахигастрию), вследствие чего скорость опорожнения желудка существенно замедляется [5, 7, 27, 30]. Нормализация уровня сывороточной глюкозы у пациентов с СД стабилизирует миоэлектрическую активность желудка и ускоряет опорожнение желудка.
Автономная нейропатия при диабетическом гастропарезе наблюдается очень часто. Исследование эффектов, опосредованных блуждающим нервом, продемонстрировало угнетение при ДГ панкреатической и желудочной секреции. Считается, что дисфункция блуждающего нерва обусловливает некоторые острые эффекты гипергликемии, поскольку схожие эффекты получаются при проведении поддиафрагмальной ваготомии. В некоторых морфологических исследованиях обнаруживали демиелинизацию блуждающего нерва. Схожие изменения описаны также в аксонах и дендритах превертебральных симпатических ганглиев, что подтверждает повреждение при ДГ как парасимпатического, так и симпатического компонента автономной нервной системы. При восстановлении нормального гликемического контроля после трансплантации клеток поджелудочной железы диабетическая автономная нейропатия, по крайней мере, частично обратима, что сопровождается улучшением функции желудка [25, 39, 42, 44].
Экспериментальный ДГ развивается в результате повышения уровня оксидативного стресса, вызванного снижением уровня гемоксигеназы-1 – важной цитопротективной молекулы, препятствующей оксидативному повреждению. Усиление экспрессии гемоксигеназы-1 предохраняет от развития ДГ и восстанавливает опорожнение желудка у экспериментальных мышей и крыс. Исследование на лабораторных животных и добровольцах также показали, что наиболее характерным желудочным клеточным дефектом при ДГ является потеря экспрессии нейронального оксида азота (nNOS), не связанная со снижением числа самих нейронов. Это предполагает, что восстановление экспрессии nNOS может быть привлекательной терапевтической целью при ДГ [4, 15, 22, 32].
Важным механизмом развития ДГ также является потеря числа ICС. Этот феномен является наиболее характерной нейропатологической аномалией как при диабетическом, так и при идиопатическом гастропарезе. В ЖКТ ICС выполняют множественные функции, в том числе генерируют медленные волны, контролирующие сократимость гладких мышц, участвуют в нейротрансмиссии и нейротрансдукции, а также в формировании мембранного градиента гладкомышечных клеток. При ДГ возникает дисбаланс между процессами повреждения и восстановления ICС, чему способствует инсулинопения, недостаток инсулиноподобного фактора роста-1 (IGF-1) и оксидативный стресс. Поскольку инсулин и IGF-1 способствуют выработке фактора стволовых клеток, приводящего к росту гладкомышечных клеток, они рассматриваются как важные факторы выживания ICС, а их недостаток для ICС крайне опасен [20, 26, 28, 34]. Воздействие на резидуальные стволовые клетки или их трансплантация в настоящее время рассматривается как новая перспективная терапевтическая стратегия при ДГ.
Диагностика гастропареза
Гастропарез диагностируется в случае замедления опорожнения желудка у пациентов, имеющих характерные симптомы, после исключения других потенциальных причин симптомов и обструкции при проведении верхней эндоскопии или рентгенологического обследования желудка. Косвенным методом диагностики неэффективного опорожнения желудка и гастропареза является наличие в желудке остатков съеденной накануне пищи при проведении утренней эндоскопии при отсутствии структурных изменений. В тех случаях, когда симптоматика отсутствует, вместо термина «гастропарез» следует использовать термин «замедление опорожнения желудка».
Документация замедленного желудочного опорожнения включает в себя сцинтиграфическую оценку скорости опорожнения желудка от твердой пищи. Американское Общество Нейрогастроэнтерологии и Моторики (ANMS) вместе с Обществом Ядерной Медицины утвердили сцинтиграфию с тестовым завтраком (меченным низкомолекулярным жиром яичного белка с тостом и джемом) и сканированием через 1, 2 и 4 ч после приема пищи как стандартизированный протокол диагностики гастропареза [2]. Легкая задержка опорожнения желудка составляет 11-15%, умеренная – 16-35% и тяжелая – >35% за 4 ч.
В качестве альтернативных методов оценки скорости опорожнения желудка разработаны так называемые офисные тесты, такие как электрогастрография, 13С-октаноевый дыхательный тест и капсула SmartPill [12, 40].
При дыхательном тесте 13С-октаноевая кислота, растворенная в яичнице-болтунье, эвакуируясь из желудка, попадает в тонкую кишку, где абсорбируется и метаболизируется с выделением 13СО2, уровень которого в дальнейшем регистрируется инфракрасным анализатором стабильных изотопов. Данный тест дает возможность количественного определения скорости опорожнения желудка (в норме время полувыведения <75 мин, коэффициент опорожнения >3,1), при этом отсутствует лучевая нагрузка, его можно проводить детям, беременным, послеоперационным больным, данные легко воспроизводимы, тест может проводиться многократно [11, 12].
Другой тест – это сравнительно недавно разработанная инновационная методика с помощью одноразовой капсулы SmartPill (SmartPill Corp., Buffalo, Нью-Йорк), позволяющей одновременно измерять рН, давление и температуру на протяжении всего ЖКТ. Полученные данные передаются по беспроводной технологии и регистрируются принимающим устройством, которое пациент носит с собой на поясе. Эти физиологические измерения по изменению рН и других показателей позволяют точно определить время опорожнения желудка, а также общее и тонко-толстокишечное время транзита.
Современные подходы к ведению больных с гастропарезом
В основе лечения тошноты и рвоты при гастропарезе лежит выявление главного заболевания и устранение возможных причин. В соответствии с принципом доказательности, основные принципы лечения больных с гастропарезом включают: 1) коррекцию водного баланса, электролитов и недостаточности питания; 2) выявление и лечение основных причин данной патологии; 3) уменьшение или устранение симптомов, в первую очередь – тошноты и рвоты [1, 12, 23, 41].
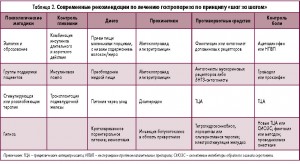
В таблице 2 представлены различные варианты лечения, которые в настоящее время применяются в клинике. Лечение рекомендуется выполнять в соответствии с тяжестью симптомов по принципу «шаг за шагом» [12].
Диета и контроль гликемии. Модификация диеты является основой лечения гастропареза. Желательно обеспечить прием пищи часто и небольшими порциями. Бывает очень полезной замена твердой пищи на жидкую или полужидкую. Выбор жидкой пищи обусловлен тем, что жидкости движутся в кишечнике под действием силы тяжести и градиента гастродуоденального давления и не зависят от работы пилорического сфинктера, функция которого у пациентов с тяжелой задержкой опорожнения желудка может быть нарушена. Белки и жиры замедляют опорожнение желудка, поэтому продукты с этими пищевыми компонентами также должны быть исключены. Другие питательные вещества, способствующие замедлению скорости опорожнения желудка, такие как высшие жирные кислоты, могут применяться только в жидком виде. Незаменимые жирные кислоты, аминокислоты и витамины в жидкой форме также обычно хорошо переносятся. Пациентам с тяжелым гастропарезом, которые не в состоянии переносить модифицированное пероральное питание, может потребоваться зондовое питание или даже выполнение еюностомии. Переход на парентеральное питание проводят только на короткий срок, поскольку это может привести к таким осложнениям как тромбозы и/или инфекция [23].
Гипергликемия также провоцирует задержку опорожнения желудка. Исследования показали, что у пациентов с диабетом контроль уровня сахара в крови может улучшить опорожнение желудка и уменьшить симптомы, характерные для гастропареза, но эта гипотеза требует детального изучения [5]. Во всех случаях у больных СД с гастропарезом необходимо измерение 2-часового постпрандиального уровня глюкозы в крови. Неконтролируемое опорожнение желудка в сочетании с экзогенным введением инсулина может привести к гипогликемии, поэтому частый контроль сахара в крови является обязательным. Показатели уровня глюкозы в крови можно скорректировать с помощью диеты и употребления медикаментов. В дополнение к принятому утром инсулину длительного действия для предотвращения глубокой постпрандиальной гипергликемии сразу после приема пищи должны применяться короткодействующие препараты инсулина [11].
Лечение. Медикаментозную терапию гастропареза можно разделить на прокинетическую и противорвотную терапию. Пациентам с постоянным наличием симптомов рекомендована комбинация из этих препаратов.
Противорвотные средства. Использование препаратов типа прохлорперазина, прометазина и триметобензамида обычно останавливает тошноту в типичных случаях. Исследования по сравнению эффективности этих препаратов пока отсутствуют. Ондансетрон является более дорогим препаратом и, как правило, применяется в последнюю очередь [23]. Он доступен в форме таблеток внутрь, а также в виде растворимых таблеток, принимаемых сублингвально, и в жидкой форме для внутривенного введения. У пациентов с рвотой употребление 8 мг препарата сублингвальным путем имеет преимущества над пероральным, при необходимости используется до 3 р/день. Чаще применяется у госпитализированных пациентов с непрерывной рвотой или невосприимчивых к пероральной форме препарата. Лучшим является использование максимальных доз во время обострения симптомов и соответствующее постепенное уменьшение доз при ремиссии. Новые противорвотные средства, такие как антагонисты рецепторов нейрокинина (например, апрепитант), которые предназначены для вызванной химиотерапией тошноты, для использования в лечении гастропареза пока не изучались [17].
Прокинетические средства, такие как метоклопрамид, могут быть использованы в виде монотерапии или в комбинации с противорвотными препаратами. К сожалению, метоклопрамид в связи с наличием большой частоты побочных эффектов, применяется все реже и реже. Если метоклопрамид все-таки применяется, с пациентом должны обсуждаться его центральные кратко- и долгосрочные побочные эффекты, связанные с так называемой тардивной дискинезией [45]. Также могут быть использованы низкие дозы эритромицина (125 мг внутрь 2-3 р/день), поскольку он активизирует мотилиновые рецепторы, стимулирует сокращения антрального отдела и улучшает моторику желудка. Лечение эритромицином также может быть ограничено в связи с развитием побочных эффектов при использовании его в высоких дозах, таких как тошнота, рвота и развитие тахифилаксии (как правило, после месяца ежедневного использования). Лучшие результаты можно получить при применении другого макролида – азитромицина [37].
В последнее время из прокинетиков наиболее часто применяется домперидон, хотя его использование в США полностью не одобрено FDA. Лечение этим препаратом не покрывается страховкой, поэтому за рубежом пациентам приходится дополнительно платить за него 50-100 долларов США в месяц. Домперидон, как и метоклопрамид, блокирует дофаминовые рецепторы 2-го типа в хеморецепторной триггерной зоне и в дополнение к периферическому прокинетическому действию имеет противорвотный эффект [43, 46]. В последнее время все чаще применяются более современные и безопасные прокинетики, такие как итоприд и прукалоприд [6, 9]. Среди новых изучаемых в настоящее время препаратов следует отметить агонисты рецепторов грелина, которые показали способность ускорять опорожнение желудка у больных с диабетическим гастропарезом, а также лечение стволовыми клетками [18].
Пока нет препаратов, которые были бы в равной степени эффективны для лечения абдоминальной боли, ассоциированной с замедленным опорожнением желудка. Механизм абдоминальной боли в таких случаях неизвестен, однако предполагается, что она может быть следствием перерастяжения желудка и/или висцеральной гиперчувствительности. Для ее коррекции всегда пробуют применять комбинацию ингибиторов протонной помпы и прокинетиков, однако результаты лечения не всегда бывают удовлетворительными. Во всех случаях необходимо избегать применения наркотических веществ, поскольку они усугубляют замедленное опорожнение желудка и вызывают сильную зависимость, следует отдавать предпочтение НПВП [12].
Психотропные вещества, такие как ТЦА, могут способствовать уменьшению выраженности таких симптомов как тошнота, рвота и/или абдоминальная боль, вызванная парезом желудка. Вероятным механизмом такого влияния могло бы быть угнетение передачи импульсов в ЦНС, способствующих развитию упомянутых симптомов, однако пока отсутствуют подтверждающие это данные. Используемые дозы ТЦА всегда меньше, чем для лечения классических депрессий. Рекомендуемая доза амитриптилина – 10-25 мг перед сном. Если через 4 недели улучшения не наступает, доза может быть постепенно увеличена до 50-75 мг перед сном. Побочные эффекты типичны и приводят к отмене и замене препарата у 25% пациентов. К сожалению, амитриптилин обладает антихолинергическим действием и сам по себе может замедлять эвакуацию из желудка [1, 23]. Вторичные амины, такие как нортриптилин и дезипрамин, имеют меньше побочных эффектов и менее выраженные антихолинергические свойства. Кроме ТЦА могут применяться и селективные ингибиторы обратного захвата серотонина (СИОЗС), однако достоверных данных в отношении их эффективности при гастропарезе пока недостаточно [35].
Среди альтернативных методов лечения поначалу с энтузиазмом был встречен метод лечения пареза желудка инъекцией ботулинового токсина А в область пилорического отдела желудка. Поскольку ботулотоксин уменьшает холинергическую передачу, его инъекция в область пилорического отдела желудка предположительно уменьшает тонус пилорического сфинктера, что может способствовать ускорению замедленной эвакуации пищи из желудка. Опубликованные результаты небольших открытых клинических исследований свидетельствовали об улучшении опорожнения желудка и уменьшении симптомов, хотя и на относительно короткий период (около 3 мес). Однако результаты больших контролируемых исследований оказались разочаровывающими – улучшение, вызванное инъекцией ботулотоксина, через 1 мес после инъекции не отличалось от плацебо. Поэтому этот метод терапии не может широко применяться в связи с высокой стоимостью и неустановленной до конца эффективностью действия, по крайней мере, до тех пор, пока контролируемые исследования не дадут более удовлетворительных результатов [3, 21]. Продолжаются исследования для определения эффективности этого метода у пациентов с СД и после ваготомии, у которых с высокой степенью вероятности имеется пилороспазм.
Для коррекции замедленного опорожнения желудка применяется его электростимуляция, хотя полной уверенности в эффективности этой методики также нет. Рекомендованный в последнее время гастростимулятор (Enterra; Medtronics, Inc., Minneapolis, MN) использует для стимуляции желудка электрические импульсы высокой частоты и низкой интенсивности. Такая высокочастотная и низкоамплитудная стимуляция приводит к улучшению только у части пациентов. Также считается, что гастростимуляция может улучшать усвоение пищи в верхних отделах желудочно-кишечного тракта и изменять афферентную ноцицептивную стимуляцию из желудка [38]. Пациенты с диабетическим парезом желудка, испытывающие тошноту и рвоту, лучше отвечают на этот метод лечения, чем пациенты с идиопатическим парезом желудка и болью в эпигастрии, особенно регулярно получающие медикаментозную терапию [36]. Необходимы дополнительные контролируемые исследования до того, как эта терапия сможет быть включена в рекомендации. По мере того, как развивается метод электростимуляции желудка, необходимы дальнейшие уточнения по ее общей эффективности, установлению групп пациентов, для которых этот метод наиболее адекватен, наиболее оптимальному размещению электродов и параметрам электростимуляции.
В наиболее тяжелых случаях прибегают к хирургическим вмешательствам, начиная от наложения питающей гастро- или еюностомы и вплоть до гастрэктомии.
Литература
- Abell T.L., Bernstein R.K., Cutts T. et al. Treatment of gastroparesis: a multidisciplinary clinical review. Neurogastroenterol Motil 2006; 18: 263-283.
- Abell T.L., Camilleri M., Donohoe K., Hasler W.L., Lin H.C., McCallum R.W., Nowak T., Nusynowitz M.L., Parkman H.P., Shreve P., Szarka L.A., Snape W.J. Jr., Ziessman H.A. Consensus recommendations for gastric emptying scintigraphy. A Joint Report of the Society of Nuclear Medicine and the American Neurogastroenterology and Motility Society. Am J Gastroenterol 2008; 103: 753-763.
- Arts J., Holvoet L., Caenepeel P., Bisschops R., Sifrim D., Verbeke K., Janssens J., Tack J. Clinical trial: a randomized-controlled crossover study of intrapyloric injection of botulinum toxin in gastroparesis. Aliment Pharmacol Ther 2007; 26: 1251-1258.
- Bharucha A.E., Kulkarni A., Choi K.M., Camilleri M., Lempke M., Brunn G.J., Gibbons S.J., Zinsmeister A.R., Farrugia G. First-in-human study demonstrating pharmacological activation of heme oxygenase-1 in humans. Clin Pharmacol Ther 2010; 87: 187-190.
- Bharucha A.E., Camilleri M., Forstrom L., Zinsmeister A.R. Relationship between clinical features and gastric emptying disturbances in diabetes mellitus. Clin Endocrinol 2008; 70: 415-420.
- Bouras E.P., Camilleri M., Burton D.D. et al. Prucalopride accelerates gastrointestinal and colonic transit in patients with constipation without a rectal evacuation disorder. Gastroenterology 2001; 120: 354-360.
- Bredenoord A.J., Chial H.J., Camilleri M., Mullan B.P., Murray J.A. Gastric accommodation and emptying in evaluation of patients with upper gastrointestinal symptoms. Clin Gastroenterol Hepatol 2003; 1: 264-272.
- Bytzer P., Talley N.J., Leemon M., Young L.J., Jones M.P., Horowitz M. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15,000 adults. Arch Intern Med 2001; 161: 1989-1996.
- Camilleri M., Vazquez-Roque M.I., Burton D., Ford T., McKinzie S., Zinsmeister A.R., Druzgala P. Pharmacodynamic effects of a novel prokinetic 5-HT receptor agonist, ATI-7505, in humans. Neurogastroenterol Motil 2007; 19: 30-38.
- Camilleri M. The stomach in diabetes: from villain to ally. Clin Gastroenterol Hepatol 2009; 7: 285-287.
- Camilleri M., Bharucha A.E., Farrugia G. Epidemiology, Mechanisms, and Management of Diabetic Gastroparesis. Clin Gastroenterol Hepatol 2011; 9: 5-12.
- Camilleri M., Parkman H.P., Shafi M.A., Abell T.L., Gerson L. Clinical Guideline: Management of Gastroparesis. Am J Gastroenterol 2013; 108: 18-37.
- Cherian D., Sachdeva P., Fisher R.S., Parkman H.P. Abdominal pain is a frequent symptom of gastroparesis. Clin Gastroenterol Hepatol 2010; 8: 676-681.
- Choi K.M., Gibbons S.J., Nguyen T.V., Stoltz G.J., Lurken M.S., Ordog T., Szurszewski J.H., Farrugia G. Heme oxygenase-1 protects interstitial cells of Cajal from oxidative stress and reverses diabetic gastroparesis. Gastroenterology 2008; 135: 2055-2064.
- Choi K.M., Kashyap P.C., Dutta N., Stoltz G.J., Ordog T., Shea Donohue T., Bauer A.J., Linden D.R., Szurszewski J.H., Gibbons S.J., Farrugia G. CD206-positive M2 macrophages that express heme oxygenase-1 protect against diabetic gastroparesis in mice. Gastroenterology 2010; 138: 2399-2409.
- Choung R.S., Locke G.R., Schleck C., Zinsmeister A., Talley N.J. Cumulative incidence of gastroparesis in people with type 1 and 2 diabetes in the general population. Am J Gastroenterol 2008; 103 (Suppl): S309.
- Curran M.P., Robinson D.M. Aprepitant: a review of its use in the prevention of nausea and vomiting. Drugs 2009; 69: 1853-1878.
- Ejskjaer N., Vestergaard E.T., Hellstro..m P.M., Gormsen L.C., Madsbad S., Madsen J.L., Jensen T.A., Pezzullo J.C., Christiansen J.S., Shaughnessy L., Kosutic G. Ghrelin receptor agonist (TZP-101) accelerates gastric emptying in adults with diabetes and symptomatic gastroparesis. Aliment Pharmacol Ther 2009; 29: 1179-1187.
- Farrugia G. Interstitial cells of Cajal in health and disease. Neurogastroenterol Motil 2008; 20: 54-63.
- Forster J., Damjanov I., Lin Z., Sarosiek I., Wetzel P., McCallum R.W. Absence of the interstitial cells of Cajal in patients with gastroparesis and correlation with clinical findings. J Gastrointest Surg 2005; 9: 102-108.
- Friedenberg F.K., Palit A., Parkman H.P., Hanlon A., Nelson D.B. Botulinum toxin A for the treatment of delayed gastric emptying. Am J Gastroenterol 2008; 103: 416-423.
- Gangula P.R., Mukhopadhyay S., Ravella K., Cai S., Channon K.M., Garfield R.E., Pasricha P.J. Tetrahydrobiopterin (BH4), a cofactor for nNOS, restores gastric emptying and nNOS expression in female diabetic rats. Am J Physiol 2010; 298: G692-G699.
- Gumaste V., Baum J. Treatment of Gastroparesis: An Update. Digestion 2008; 78: 173-179.
- Hasler W.L., Wilson L., Parkman H.P., Koch K.L., Abell T.L., Pasricha P.J., Nguyen L., Snape W.J., Farrugia G., Tonascia J., Unalp-Arida A., Lee L.A., Hamilton F.A. Importance of abdominal pain as a symptom in gastroparesis: relation to clinical factors, disease severity, quality of life, gastric retention, and medication use. Gastroenterology 2010; 138 (Supplement 1): S461.
- Harberson J., Thomas R.M., Harbison S.P., Parkman H.P. Gastric neuromuscular pathology in gastroparesis: analysis of full-thickness antral biopsies. Dig Dis Sci 2010; 55: 359-370.
- He C.L., Soffer E.E., Ferris C.D., Walsh R.M., Szurszewski J.H., Farrugia G. Loss of interstitial cells of Cajal and inhibitory innervation in insulin-dependent diabetes. Gastroenterology 2001; 121: 427-434.
- Hyett B., Martinez F.J., Gill B.M., Mehra S., Lembo A., Kelly C.P., Leffler D.A. Delayed radionucleotide gastric emptying studies predict morbidity in diabetics with symptoms of gastroparesis. Gastroenterology 2009; 137: 445-452.
- Horvath V.J., Vittal H., Lo..rincz A., Chen H., Almeida-Porada G., Redelman D., Ordo..g T. Reduced stem cell factor links smooth myopathy and loss of interstitial cells of cajal in murine diabetic gastroparesis. Gastroenterology 2006; 130: 759-770.
- Iltz J.L., Baker D.E., Setter S.M., Keith Campbell R. Exenatide: an incretin mimetic for the treatment of type 2 diabetes mellitus. Clin Ther 2006; 28: 652-665.
- Jones K.L., Russo A., Berry M.K., Stevens J.E., Wishart J.M., Horowitz M. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med 2002; 113: 449-455.
- Jung H.K., Choung R.S., Locke G.R. 3rd, Schleck C.D., Zinsmeister A.R., Szarka L.A., Mullan B., Talley N.J. The incidence, prevalence, and outcomes of patients with gastroparesis in Olmsted County, Minnesota, from 1996 to 2006. Gastroenterology 2009; 136: 1225-1233.
- Kashyap P.C., Choi K.M., Dutta N., Linden D.R., Szurszewski J.H., Gibbons SJ, Farrugia G. Carbon monoxide reverses diabetic gastroparesis in NOD mice. Am J Physiol 2010; 298: G1013-G1019.
- Kong M.F., Horowitz M., Jones K.L., Wishart J.M., Harding P.E. Natural history of diabetic gastroparesis. Diabetes Care 1999; 22: 503-507.
- Lurken M.S., Parkman H.P., Abell T.L., Snape W.J., Nyugen L.A., Hasler W.L., Koch K., Pasricha P.J., Tonascia J., James S.P., Hamilton F.A., Lee L.A., Farrugia G. Histological changes in idiopathic and diabetic gastroparesis. Neurogastroenterol Motil 2009; 21: 74.
- Manini M.L., Camilleri M., Goldberg M., Sweetser S., McKinzie S., Burton D., Wong S., Kitt M.M., Li Y-P., Zinsmeister A.R. Effects of velusetrag (TD-5108) on gastrointestinal transit and bowel function in health and pharmacokinetics in health and constipation. Neurogastroenterol Motil 2010; 22: 42-49, e7-8.
- McCallum R.W., Dusing R.W., Sarosiek I., Cocjin J., Forster J., Lin Z. Mechanisms of symptomatic improvement after gastric electrical stimulation in gastroparetic patients. Neurogastroenterol Motil 2010; 22: 161-167.
- Moshiree B., McDonald R., Hou W., Toskes P.P. Comparison of the effect of azithromycin versus erythromycin on antroduodenal pressure profiles of patients with chronic functional gastrointestinal pain and gastroparesis. Dig Dis Sci 2010; 55: 675-683.
- O’Grady G., Egbuji J.U., Du P., Cheng L.K., Pullan A.J., Windsor.JA. High-frequency gastric electrical stimulation for the treatment of gastroparesis: a meta-analysis. World J Surg 2009; 33: 1693-1701.
- Ordo..g T., Hayashi Y., Gibbons S.J. Cellular pathogenesis of diabetic gastroenteropathy. Minerva Gastroenterol Dietol 2009; 55: 315-343.
- Parkman H.P., Hasler W.L., Barnett J.L., Eaker E.Y., American Motility Society Clinical GI Motility Testing Task Force. Electrogastrography: a document prepared by the gastric section of the American Motility Society Clinical GI Motility Testing Task Force. Neurogastroenterol Motil 2003; 15: 89-102.
- Parkman H.P., Hasler W.L., Fisher R.S. American Gastroenterological Association technical review on the diagnosis and treatment of gastroparesis. Gastroenterology 2004; 127: 1592-1622.
- Pasricha P.J., Pehlivanov N.D., Gomez G., Vittal H., Lurken M.S., Farrugia G. Changes in the gastric enteric nervous system and muscle: a case report on two patients with diabetic gastroparesis. BMC Gastroenterol 2008; 30: 8-21.
- Patterson D., Abell T., Rothstein R., Koch K., Barnett J. A double-blind multicenter comparison of domperidone and metoclopramide in the treatment of diabetic patients with symptoms of gastroparesis. Am J Gastroenterol 1999; 94: 1230-1234.
- Punkkinen J., Fa..rkkila.. M., Ma..tzke S., Korppi-Tommola T., Sane T., Piirila.. P., Koskenpato J. Upper abdominal symptoms in patients with Type 1 diabetes: unrelated to impairment in gastric emptying caused by autonomic neuropathy. Diabet Med 2008; 25: 570-577.
- Rao A.S., Camilleri M. Review article: Metoclopramide and tardive dyskinesia. Aliment Pharmacol Ther 2010; 31: 11-19.
- Reddymasu S.C., Soykan I., McCallum R.W. Domperidone: review of pharmacology and clinical applications in gastroenterology. Am J Gastroenterol 2007; 102: 2036-2045.
- Reddymasu S.C., Sarosiek I., McCallum R.W. Severe gastroparesis: medical therapy or gastric electrical stimulation. Clin Gastroenterol Hepatol 2010; 8: 117-124.
- Talley N.J., Young L., Bytzer P., Hammer J., Leemon M., Jones M., Horowitz M. Impact of chronic gastrointestinal symptoms in diabetes mellitus on health-related quality of life. Am J Gastroenterol 2001; 96: 71-76.
- Uppalapati S.S., Ramzan Z., Fisher R.S., Parkman H.P. Factors contributing to hospitalization for gastroparesis exacerbations. Dig Dis Sci. 2009; 54: 2404-9.
- Wang Y.R., Fisher R.S., Parkman H.P. Gastroparesis-related hospitalizations in the United States: trends, characteristics, and outcomes, 1995-2004. Am J Gastroenterol 2008; 103: 313-322.