8 червня, 2017
Антитромбоцитарная терапия после острого коронарного синдрома: как сохранить баланс эффективности и безопасности?
Заболевания, обусловленные артериальным тромбозом, – ишемическая болезнь сердца (ИБС), инфаркт миокарда (ИМ), атеротромботический инсульт – лидируют в структуре причин смертности и инвалидности. Лечение и профилактика этих осложнений напоминает восхождение по узкой горной дороге, по обе стороны от которой – пропасть. Чтобы преодолеть этот путь, не подвергая жизнь пациента опасности, и сохранить баланс между риском и пользой, иногда необходимо проявлять настоящее врачебное искусство. В связи с этим в рамках образовательного проекта «Лечение и профилактика тромбозов» мы начинаем рассмотрение актуальных практических аспектов управления рисками артериальных тромбозов и эмболий в свете рекомендаций ведущих экспертных групп и новых данных доказательной медицины.
 Модератором рубрики, как обычно, выступает член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины» (г. Киев), доктор медицинских наук, профессор Александр Николаевич Пархоменко.
Модератором рубрики, как обычно, выступает член-корреспондент НАМН Украины, руководитель отдела реанимации и интенсивной терапии ГУ «ННЦ «Институт кардиологии им. Н.Д. Стражеско» НАМН Украины» (г. Киев), доктор медицинских наук, профессор Александр Николаевич Пархоменко.
Узкие специалисты привыкли диагностировать и лечить артериальные тромбозы в рамках локальных патологий, занимаясь каждый своим участком сосудистого русла. Все мы знаем, что дестабилизация коронарной атеросклеротической бляшки является основным пусковым фактором острого коронарного синдрома (ОКС), каждый пятый ишемический инсульт происходит в результате стенозирующего атеросклероза и эмболии сонных артерий, а острый артериальный тромбоз нижних конечностей – частая причина нетравматических ампутаций. Однако, углубляясь в специфику нозологических форм, не стоит забывать, что артериальный тромбоз и его катастрофические последствия – это следствие системных процессов, происходящих в организме в целом.
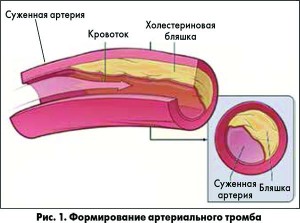
Принципиальное патофизиологическое отличие артериального тромбоза от венозного заключается в том, что инициирующими факторами образования тромба являются сосудисто-тромбоцитарные механизмы. Тромб формируется на участке поврежденного эндотелия или разорвавшейся атеросклеротической бляшки (рис. 1), в то время как при венозных тромбозах решающую роль играет коагуляционный фактор: тромбы образуются в просвете кровеносного сосуда, как правило, на участке замедленного кровотока, вблизи несостоятельного клапана вены. Таким образом, артериальный тромбоз неразрывно связан с состоянием эндотелия и течением атеросклероза, а это системный процесс, поэтому катастрофу можно ожидать в любом артериальном бассейне. Существует корреляция между атеросклерозом в одном отделе сосудистого русла и поражением других. Так, у пациента, который обратился на прием с жалобами, типичными для ИБС, высока вероятность обнаружить бляшки в сонных артериях, и наоборот.
Без преувеличения можно сказать, что на первичной и вторичной профилактике артериального тромбоза и его разрушительных последствиях основывается популяционная медицина, которая призвана изменить статистику сердечно-сосудистой заболеваемости и смертности в мире. В соответствии с ключевыми патофизиологическими явлениями основой профилактики и лечения артериальных тромбозов является гиполипидемическая и антитромбоцитарная терапия, направленная, с одной стороны, на сдерживание атеросклероза, прогрессирующего в течение всей жизни человека, а с другой – на подавление клеточного звена тромбообразования, которое может активизироваться в определенных условиях и в любой момент привести к сосудистой катастрофе.
С чем сталкивается современный врач на этом пути? Достижения в области фундаментальных исследований и фармакологии привели к разнообразию антитромбоцитарных средств с альтернативными механизмами действия. Ацетилсалициловая кислота (АСК) продолжает играть важнейшую роль, но группа антиагрегантов существенно расширилась за последние годы.
С учетом результатов все новых исследований и проспективных регистров клинической практики меняются и обновляются рекомендации профильных обществ, и сферу антитромбоцитарной терапии за последние годы эти изменения затронули весьма значительно. Формируется тенденция к интенсификации, а также продлению сроков двойной и даже тройной антитромботической терапии после интервенционных вмешательств при ОКС. Образовалась категория пациентов, которым показана одновременно антитромбоцитарная и антикоагулянтная терапия. Параллельно растет обеспокоенность по поводу риска кровотечений, обсуждается несовершенство существующих оценочных шкал. Не все вопросы решены в отношении роли антиагрегантов в первичной профилактике, то есть у пациентов без явных сердечно-сосудистых заболеваний и с промежуточными оценками 10-летнего риска неблагоприятных событий.
Для того чтобы поддерживать баланс между пользой и риском, кардиолог должен обладать знаниями, которые выходят за рамки антитромботической терапии. В настоящей публикации рассмотрим возможности снижения риска кровотечений у пациентов, получающих длительную антитромбоцитарную терапию.
Стратификация риска тромбозов и кровотечений при назначении антитромботической терапии после ОКС
 Доктор медицинских наук, профессор кафедры внутренней медицины № 3 ГУ «Днепропетровская медицинская академия МЗ Украины» (г. Днепр) Елена Акиндиновна Коваль:
Доктор медицинских наук, профессор кафедры внутренней медицины № 3 ГУ «Днепропетровская медицинская академия МЗ Украины» (г. Днепр) Елена Акиндиновна Коваль:
– Клопидогрель в сочетании с АСК стал стандартом профилактики повторных сердечно-сосудистых событий у пациентов с ОКС. Двойная антитромбоцитарная терапия (ДАТ) показана независимо от того, получают пациенты только медикаментозное лечение или подвергаются чрескожному коронарному вмешательству (ЧКВ) с постановкой как непокрытых, так и особенно стентов с лекарственным покрытием. А в последние годы получили распространение более мощные, но в связи с этим и требующие тщательного изучения геморрагических рисков иные ингибиторы P2Y12-рецепторов тромбоцитов – прасугрел и тикагрелор. При этом применение любой схемы связано с риском развития основного побочного эффекта всех антиагрегантов – кровоточивости вследствие постоянного угнетения тромбоцитарного звена гемостаза.
Основные факторы, влияющие на риск кровотечений, следующие:
• исходный геморрагический риск больного;
• выбор стента, доступа и техники проведения ЧКВ;
• состав, дозовый режим и сроки двойной или тройной (вместе с антикоагулянтом) антитромботической терапии;
• дополнительная медикаментозная протекция.
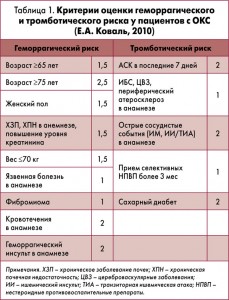
Основой предупреждения кровотечений является определение величины исходного геморрагического риска у пациента, для чего были разработаны и валидированы специальные шкалы. Каждая из них имеет свою нишу применения и сроки оценки риска.
При ОКС без элевации сегмента ST в остром периоде применяется шкала оценки риска развития кровотечения CRUSADE. Для подсчета баллов по этой шкале учитывают такие показатели, как исходный уровень гематокрита <36%, клиренс креатинина, частота сердечных сокращений, женский пол, наличие признаков застойной сердечной недостаточности при поступлении, систолическое артериальное давление <110 или >180 мм рт. ст., заболевания сосудов и сахарный диабет. Риск кровотечений, выражаемый в процентах, возрастает в зависимости от набираемых баллов: от 3,1% – очень низкий риск (20 баллов), до 19,5% – очень высокий риск (50 баллов). Валидность модели проверена на 17 857 больных, включенных в регистр CRUSADE, и имеет равнозначную прогностическую ценность вне зависимости от выбранной стратегии ведения (консервативной или инвазивной) и объема получаемой антитромбоцитарной терапии.
Инвазивные кардиологи чаще пользуются шкалой BARС для оценки тяжести геморрагических осложнений у пациентов, у которых проводятся элективные или экстренные ЧКВ при всех типах ОКС.
Опыт и данные литературы показывают, что клинически значимые кровотечения нечасто возникают при ОКС в сравнении с любым другим неблагоприятным сердечно-сосудистым событием, поскольку основой развития ОКС является именно тромбоз. Однако стратегия ведения больных зачастую заострена только на максимальное подавление тромботических механизмов и рисков, и значительно реже учитываются индивидуальные геморрагические риски больного. При ЧКВ клинически значимые кровотечения (требующие немедленной терапии или фатальные) наблюдаются в 1-7% случаев, чаще при бедренном доступе.
Кроме того, бедренный доступ ограничивает применение современного антиагреганта тикагрелора. Поэтому рекомендованным сегодня всеми зарубежными и национальными украинскими руководствами является выполнение ЧКВ с радиальным доступом.
Если на выбор стента и технику ЧКВ лечащий врач повлиять не может – это предопределено наличием расходных материалов в клинике и решением инвазивного кардиолога, то дальнейшая тактика ведения пациента во многом находится в нашей компетенции.
В европейских рекомендациях 2015 г. по ведению пациентов с ОКС без элевации сегмента ST впервые была высказана мысль, что длительность и режим антитромбоцитарной терапии необходимо индивидуализировать в рамках стандарта. Стандарт на сегодняшний день – это АСК + клопидогрель в течение как минимум 1 года после ЧКВ. Продление двойной терапии АСК и ингибитором P2Y12 более 1 года можно рассматривать после тщательного оценивания ишемических и геморрагических рисков пациента (класс рекомендации IIb, уровень доказательств А).
Относятся ли эти рекомендации только к стентированным больным? Ведущие европейские эксперты (L. Mauri, G. Montalescot, S. James, N. Danchin, 2015) считают, что обе ситуации – и ЧКВ, и перенесенный ИМ – являются факторами высокого риска и ДАТ длительностью более года предупреждает повторные ИМ. Геморрагический риск при этом возрастает, однако без фатальных кровотечений. Дальнейшая индивидуализация терапии увеличивает пользу и снижает геморрагические риски. Рекомендуется рассматривать продолжение терапии, когда ишемические риски перевешивают геморрагические. Это более 90% наших больных, но у 10% риск кровотечений преобладает над риском тромбозов.
Так как же рассчитать соотношение рисков для конкретного больного в рутинной клинической практике?
Очевидно, назрела необходимость в оценочных шкалах, которые позволяли бы одновременно провести оценку и тромботического, и геморрагического риска и сопоставить их для принятия решений у конкретного пациента.
Для пациентов с фибрилляцией предсердий существуют шкалы оценки риска тромбоэмболических событий (CHADVASC) и риска кровотечений (HAS-BLED), однако в исследованиях по ОКС они не проверялись.
Мы предприняли практически ориентированную попытку разработать очень краткую, доступную при первом контакте в стационаре шкалу одновременной индивидуальной оценки тромботических и геморрагических рисков у больных ОКC.
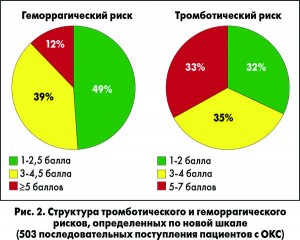
На материале 503 последовательно поступавших с ОКС пациентов мы разработали систему стратификации геморрагического и тромботического риска для пациентов со всеми формами ОКС, которую можно быстро использовать даже в острых ситуациях, без потребности в дополнительных лабораторных анализах (табл. 1).
На рисунке 2 представлена структура тромботического и геморрагического рисков у обследованных пациентов, на рисунке 3 – их распределение по совокупности рисков.
В настоящее время наша шкала модернизирована и проходит дальнейшую клиническую апробацию, но пока не входит в официальные клинические протоколы.
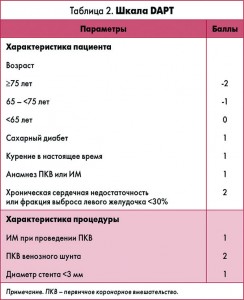
Еще один новый инструмент стратификации рисков после ЧКВ – шкала DAPT, разработанная на материале одноименного исследования. В 2014 г. было завершено международное исследование DAPT, которое было спланировано для ответа на вопрос: дает ли дополнительные преимущества продление ДАТ до 30 мес? В него были включены пациенты с ИБС, перенесшие стентирование, которые получали ДАТ (клопидогрель или прасугрел в комбинации с АСК) без осложнений в течение первого года, из них 26% – с ОКС. При продлении ДАТ до 30 мес отмечалось достоверное снижение частоты тромбозов стентов и связанных с ними инфарктов, однако появилась тенденция на грани достоверности к увеличению риска смерти. Ценой положительных эффектов стало также увеличение частоты кровотечений. В связи с этим была разработана математическая модель для оценки риска ишемических и геморрагических событий, результатом которой стала шкала DAPT.
Эта шкала достаточно проста в использовании, учитывает клинические и анамнестические данные, а также характеристики процедуры ЧКВ, в настоящее время стала абсолютно доступна через интернет-калькулятор каждому врачу (табл. 2).
Среди пациентов, не имевших большого ишемического или геморрагического события в течение первого года после ЧКВ, выявлены по шкале DAPT больные, для которых преимущество снижения ишемических рисков превалируют над геморрагическими осложнениями, и больные, для которых риск кровотечений превалирует над снижением ишемического риска (рис. 4).
Таким образом, комплексная оценка рисков, индивидуальное определение показаний к антитромбоцитарной терапии с помощью новых оценочных инструментов, а также сотрудничество с инвазивными кардиологами при возможности выполнения ЧКВ (выбор стента, доступа) позволяют проводить профилактику тромботических событий после ОКС достаточной длительности и безопасно для пациента.
Комментарий профессора А.Н. Пархоменко:
– Помимо комплексной оценки геморрагического риска в арсенале наших возможностей имеется и гастропротекторная терапия, которая назначается на фоне приема антиагрегантов. Кровотечения из органов желудочно-кишечного тракта (ЖКТ) в результате повреждающего действия антитромбоцитарных препаратов на слизистые оболочки представляют реальную угрозу для пациентов. Любой режим антитромбоцитарной терапии – клопидогрель, альтернативный ингибитор P2Y12, АСК или их комбинация – ассоциируется с повышенным риском кровотечений. Одновременный прием антикоагулянтов увеличивает риск в еще большей степени, например, когда тройная антитромботическая терапия показана после стентирования пациенту с фибрилляцией предсердий. Как правило, кровотечения данной локализации происходят с постепенной кровопотерей и без явных симптомов, которые мы помним со студенческой скамьи (свежая кровь в кале, мелена, рвота «кофейной гущей»). Поэтому их легче предупредить, чем диагностировать и лечить.
Согласно консенсусу американских кардиологических ассоциаций и коллегии гастроэнтерологов (ACCF/ACG/AHA, 2010) к наиболее значимым факторам риска желудочно-кишечных кровотечений (ЖКК) на фоне антитромбоцитарной терапии относятся:
– перенесенный в прошлом эпизод ЖКК;
– возраст >65 лет;
– одновременный прием кортикостероидов, антикоагулянтов, НПВП;
– инфекция Helicobacter pylori.
Чем больше перечисленных факторов у пациента, тем выше риск возникновения ЖКК на фоне антитромбоцитарной терапии.
По опыту работы нашего отделения, около 20% пациентов, которые перенесли ИМ, имеют сопутствующую патологию ЖКТ, и это только клинически или анамнестически подтвержденные случаи. А сколько на самом деле необследованных пациентов с жалобами на изжогу, недиагностированных гастритов и язв – можно только догадываться.
Взгляды кардиологов и гастроэнтерологов на профилактику ЖКК при приеме НПВП и антитромботических средств сходятся и основываются на одной доказательной базе, согласно которой наиболее эффективную гастропротекцию обеспечивают ингибиторы протонной помпы (ИПП). Высокая кислотность признана основным эндогенным фактором агрессии, вызывающим повреждение слизистой оболочки в присутствии других неблагоприятных воздействий, таких как инфекция H. рylori и прием антиагрегантов. ИПП по сравнению с другими кислотоснижающими препаратами и гастропротекторами, например все еще популярными у нас блокаторами Н2-гистаминовых рецепторов, обеспечивают наиболее стабильное подавление продукции соляной кислоты париетальными клетками желудочного эпителия. Поэтому ИПП были включены в кардиологические рекомендации как препараты выбора для предупреждения ЖКК у пациентов группы риска на фоне двойной и тройной антитромботической терапии после ИМ и интервенционных вмешательств.
Все было бы просто, если бы не обнаружение того факта, что ИПП могут вступать в фармакокинетические взаимодействия с антиагрегантами, в частности с клопидогрелем. Указанные препараты проходят первую фазу метаболизма в печени под действием одного изофермента, поэтому из-за конкуренции за метаболический путь на фоне приема ИПП может снижаться концентрация клопидогреля и его эффект подавления агрегации тромбоцитов уже не будет достаточным для предотвращения тромбообразования. В результате теоретически может повышаться риск тромбоза, в частности тромбоза стентов, и смертности среди пациентов, которые принимают ИПП для защиты желудка от воздействия компонентов антитромбоцитарной терапии после ЧКВ, хотя клиническое значение этого взаимодействия убедительно не доказано (M. Lettino, 2010; T.J. Liu, C.A. Jackevicius, 2010). До сих пор остается открытым вопрос, является ли этот эффект классовым. Для ИПП, как и для сердечно-сосудистых препаратов, характерна внутриклассовая разнородность молекул. Наибольшее количество доказательств нежелательных взаимодействий с клопидогрелем получено для омепразола, что соотносится с его преимущественно печеночным метаболизмом.
Пантопразол отличается наличием альтернативных неферментативных путей метаболизма, поэтому вероятность его перекрестных взаимодействий с антиагрегантами сводится к минимуму. Рабепразол также имеет альтернативный путь выведения, но этот препарат обладает меньшей доказательной базой.
Шесть лет назад мы опубликовали результаты исследования безопасности и эффективности ДАТ клопидогрелем и АСК с гастропротекцией ИПП (рабепразолом) у пациентов после ОКС, которое проводилось на базе 30 клиник во всех регионах Украины (А.Н. Пархоменко, Я.М. Лутай, О.И. Иркин, 2011). Все пациенты получали нагрузочную дозу клопидогреля и АСК, после чего назначалась поддерживающая доза клопидогреля 75 мг и АСК 75 мг/сут. Каждый второй пациент рандомизировался в группу приема ИПП.
Проведенное исследование показало возможность безопасного длительного применения ДАТ у большинства пациентов, перенесших ОКС. Риск кровотечений, которого так опасаются практические врачи, на протяжении 180 дней наблюдения был достаточно низким. По-видимому, играет роль и особенность условий исследования – низкая частота первичных коронароангиографий и стентирования, хотя около 80% пациентов имели острый ИМ (ОИМ). Это отражает реалии медицинской помощи в Украине. Представляют интерес выявленные различия по частоте внутригоспитальных осложнений в зависимости от наличия или отсутствия в анамнезе гастропатии и/или язвы желудка / двенадцатиперстной кишки. У больных с указанной патологией назначение ИПП уменьшало число осложнений (включая рецидив ОИМ), а у больных без такого анамнеза ИПП достоверно увеличивал число рецидивов ОИМ и комбинированной конечной точки (смерть, рецидив ОИМ, инсульт, кровотечение).
Мы рекомендуем постинфарктным больным с язвами или кровотечениями в анамнезе принимать ИПП как минимум в течение 6 мес дополнительно к ДАТ. Подобную точку зрения разделяют и американские эксперты, которые в 2010 г. рекомендовали индивидуально взвешивать соотношение польза/риск и назначать ИПП только пациентам с преобладающим риском кровотечений по отношению к риску тромбозов.
В 2014 г. Управление по контролю качества продуктов питания и лекарственных средств США (FDA), вернувшись к вопросу лекарственных взаимодействий ИПП, обязало производителей внести изменения в инструкции к препаратам и указать, что применение ИПП у пациентов, которые принимают клопидогрель, следует ограничить пантопразолом, рабепразолом, лансопразолом и декслансопразолом. Поскольку в сравнительных исследованиях омепразол и эзомепразол в наибольшей степени препятствовали образованию активного метаболита клопидогреля через ферментативный путь CYP2C19, снижая таким образом его антиагрегантные свойства, FDA рекомендует избегать назначения этих ИПП пациентам, принимающим клопидогрель. Даже 12-часовой интервал между приемом омепразола и клопидогреля не предотвращает это взаимодействие. Таким образом, омепразол и эзомепразол не рекомендуется использовать с целью профилактики ЖКК на фоне антитромботической терапии (D.A. Johnson, R. Chilton, H.R. Liker, 2014).
На сегодняшний день самую убедительную доказательную базу в профилактике НПВП-гастропатий, стрессовых язв ЖКТ и кровотечений у пациентов с тяжелыми соматическими заболеваниями имеет пантопразол. Показано, что стандартная пероральная доза пантопразола 20 мг/сут эффективно предотвращает ЖКК без существенного влияния на эффекты ДАТ (АСК + клопидогрель) как у пациентов с ОКС (D.K. Yao et al., 2015), так и у больных стабильной стенокардией, которым ДАТ была показана после планового коронарного стентирования (K. Mizia-Stec et al., 2015).
Что касается сроков гастропротекции с применением ИПП у пациентов, принимающих антиагреганты, то единой точки зрения на этот счет нет. Если это пациент старше 65 лет с заболеваниями гастродуоденальной зоны в анамнезе, который перенес ОКС, стентирование и нуждается в ДАТ, то гастропротекция может потребоваться и пожизненно. В каждом случае решение о длительности терапии следует принимать на основании оценки соотношения потенциальной пользы и рисков.
Подготовил Дмитрий Молчанов