9 травня, 2017
Использование новой шкалы риска, основанной на измерении уровня циркулирующих биомаркеров, в прогнозировании наступления неблагоприятного исхода у пациентов с хронической сердечной недостаточностью

Резюме
Целью настоящего исследования явилось создание шкалы оценки кардиоваскулярного риска, основанного на анализе уровня циркулирующих биологических маркеров хронической сердечной недостаточности (ХСН).
Методы. В исследовании проспективным методом была изучена частота встречаемости фатальных и нефатальных кардиоваскулярных событий, а также частота наступления летального исхода от любых причин в когорте 388 пациентов с ХСН в течение 3 лет наблюдения. Измерены циркулирующие уровни N-терминального предшественника мозгового натрийуретического пептида (NT-pro-МНУП), галектина‑3, высокочувствительного С-реактивного протеина (hs-CРП), остеопротегерина и его растворимого рецептора sRANKL, остеопонтина, остеонектина, адипонектина, а также изучены эндотелиальные апоптические микрочастицы (ЭАМ) и эндотелиальные прогениторные клетки (ЭПК).
Результаты. Медиана периода наблюдения за пациентами, включенными в исследование, составила 2,76 года (размах – 1,8-3,4 года). В течение данного периода было зарегистрировано 285 кардиоваскулярных событий, в том числе 43 смертельных случая и 242 повторных госпитализации. Независимыми предикторами неблагоприятных клинических исходов у больных ХСН являются NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, соотношение sRANKL/остеопротегерин, уровень циркулирующих ЭПК CD14+CD309+Tie2+, ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК. Индекс величины кардиоваскулярного риска рассчитывался путем математического суммирования рангов всех независимых предикторов, которые встречались у пациентов, включенных в исследование. Полученные данные показали, что средняя величина индекса кардиоваскулярного риска у пациентов с ХСН составляет 3,17 ед. (95% ДИ от 1,65 до 5,10 ед.).
Результаты анализа Каплана-Мейера показали, что пациенты с ХСН и величиной риска менее 4 ед. имеют преимущества в выживании по сравнению с больными, для которых получены более высокие значения рангов шкалы кардиоваскулярного риска. Новая оригинальная шкала оценки риска неблагоприятных клинических исходов у пациентов с ХСН превосходит по своей прогностической ценности Seattle Heart Failure Model, Heart Failure Risk Calculator, National Heart Care Project независимо от продолжительности наблюдения, а также Barcelona Bio-HF при двух- и трехлетних наблюдениях.
Вывод. Шкала оценки риска возникновения фатальных и нефатальных кардиоваскулярных событий, построенная на основе измерения циркулирующих биомаркеров (NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК), дает возможность достаточно достоверно прогнозировать вероятность выживания пациентов с ХСН независимо от их возраста, гендерной принадлежности, состояния контрактильной функции миокарда левого желудочка (ЛЖ) и количества коморбидных состояний.
Введение
ХСН является основной кардиоваскулярной причиной смертельного исхода в общей популяции [1, 2]. Несмотря на широкое внедрение современных клинических рекомендаций по диагностике, профилактике и лечению ХСН, стратификация пациентов в группу риска возникновения неблагоприятных клинических исходов рассматривается в качестве главного компонента для выбора стратегии терапии, во многом определяющего прогноз [3, 4]. Биологические маркеры, отражающие этапы эволюции и различные стороны патогенеза ХСН, выглядят наиболее привлекательно не только для индивидуализации лечения [5, 6], но и как объективный инструмент в моделировании прогноза [7, 8]. К настоящему времени созданы и используются различные варианты мультимаркерных планшетных систем, основной целью которых является повышение чувствительности суммарного результата теста без потери его специфичности [9-11].
В то же время поиск оптимальной комбинации биомаркеров, способной отвечать задачам индивидуализированного лечения и сохранять свое значения в структуре диагностического алгоритма ХСН, остается чрезвычайно актуальным [12, 13].
Целью настоящего исследования явилось создание шкалы оценки кардиоваскулярного риска, основанного на анализе уровня циркулирующих биологических маркеров ХСН.
Материал и методы исследования
В ходе исследования проспективным методом была изучена частота встречаемости фатальных и нефатальных кардиоваскулярных событий, включая повторные госпитализации, а также частота наступления летального исхода от любых причин в когорте 388 пациентов с ХСН на протяжении 3 лет наблюдения.
Размер выборки был рассчитан с помощью on-line калькулятора http://www.nss.gov.au/nss/home.nsf/pages/Sample+size+calculator (Национальный сервис статистики Австралийского бюро статистики, Мельбурн, Австралия) с учетом величины альфа-ошибки равной 0,05, 5% маргинальной ошибки при допущении, что не менее 50% пациентов получат то или иное событие в течение периода наблюдения.
Диагноз ХСН верифицировался на основании критериев, предложенных действующим клиническим соглашением [14]. Все пациенты дали письменное информированное согласие на свое участие в исследовании.
В качестве критериев исключения использовались Q-инфаркт миокарда или нестабильная стенокардия на протяжении 30 суток до включения в исследование, стенокардия напряжения IV функционального класса (ФК), неконтролируемая артериальная гипертензия (АГ), тяжелое течение сахарного диабета (СД) или необходимость в проведении инсулинотерапии, тяжелые заболевания печени и почек, онкологические заболевания, симптоматическая АГ, инфекционные заболевание в течение 3 нед до скринирования, перенесенный мозговой инсульт, черепно-мозговая травма в течение 3 мес; критические стенозы/окклюзии уязвимых участков коронарных артерий (КА), включая ствол левой и правой КА, требующие немедленного проведения аортокоронарного шунтирования (АКШ) или чрескожного вмешательства (ЧКВ); уровень креатинина плазмы крови >440 мкмоль/л, скорость клубочковой фильтрации (СКФ) <35 мл/мин/м2, а также любые другие нарушения, которые, по мнению исследователей, могли препятствовать участию пациентов в исследовании.
Ишемическая природа ХСН устанавливалась в случае ее непосредственной связи с ранее документированным инфарктом миокарда, а также при наличии позитивного результата мультиспиральной компьютерной томографии-ангиографии с контрастированием (n=63) и/или ангиографического исследования КА (n=84).
Оценка показателей систолической и диастолической функции осуществлялась с помощью трансторакальной эхокардиографии по общепринятому методу на аппарате ACUSON (SIEMENS, Германия) в В-режиме эхолокации [15] и режиме тканевой допплерографии (TDI — Tissue Doppler Imaging) [16]. Конечно-диастолический и конечно-систолический объемы ЛЖ измерялись посредством метода Симпсона.
Вычисление СКФ проводилось с использованием формулы CKD-EPI [17].
Оценка риска неблагоприятных клинических исходов, включая летальный исход, проводилась с помощью стандартных моделей Seattle Heart Failure Model и Heart Failure Risk Calculator, основанных на демографических, клинических, лабораторных данных, а также величине фракции выброса (ФВ) ЛЖ и комбинации лекарственных средств, использованных для лечения пациентов с ХСН. Расчет величины риска по Seattle Heart Failure Model и Heart Failure Risk Calculator проводился с помощью on-line калькуляторов http://depts.washington.edu/shfm/windows.php и http://www.heartfailurerisk.org/ соответственно. Дополнительно величина риска смерти от всех причин измерялась с помощью модели Barcelona Bio-HF http://www.bcnbiohfcalculator.org/web/calculations [18].
Ожидаемая частота повторных госпитализаций рассчитывалась с помощью on-line калькулятора, основанного на данных National Heart Care Project http://www.readmissionscore.org/heart_failure.php [19].
Образцы крови в количестве 10 мл отбирались в ранние утренние часы (7:00-8:00) в начале исследования и подвергались обработке в соответствии с рекомендациями к аналитическим исследованиям, которые предоставляют производители лабораторных наборов.
Для последующей оценки прогностической ценности были измерены уровни глюкозы, гликозилированного гемоглобина, креатинина, мочевой кислоты, компонентов липидного профиля плазмы крови, а также биологические маркеры биомеханического стресса (NT-pro-МНУП), фенотипический индикатор кардиоваскулярного риска галектин‑3, маркеры провоспалительной активации (hs-CРП, остеопротегерин и его растворимый рецептор sRANKL), маркеры эндотелиальной дисфункции и васкулярного ремоделирования (остеопонтин, остеонектин), представитель семейства адипоцитокинов адипонектин, а также индикаторы интенсивности апоптоза (CD31+/annexin V+ ЭАМ) и эндогенной эндотелиальной репарации (ЭПК с фенотипами CD14+CD309+ и CD14+CD309+Tie2+).
Концентрация галектина‑3 и адипонектина измерялась с помощью сэндвич-метода ELISA (Bender Med Systems GmbH, Вена, Австрия). Содержание NT-pro-МНУП было измерено иммуноэлектрохемилюминисцентным методом с использованием наборов фирмы R&D Systems (США) на анализаторе Elecsys 1010 (Roche, Мангейм, Германия). Содержание остеопротегерина, остеонектина и остеопонтина измерялось с помощью техники ELISA с использованием наборов фирмы IBL (Immunochemie und Immunobiologie Gmb, Германия). Концентрация высокочувствительного C-реактивного протеина (hs-CРП) в образцах крови измерялась нефелометрическим методом на аппарате AU640 Analyzer (Olympus Diagnostic Systems Group, Япония). Содержание мочевой кислоты в крови определялось энзиматическим методом с помощью биохимического анализатора Beckman Synchron LX20. Концентрация общего холестерина (ХС) и ХС липопротеинов высокой плотности (ХС ЛПВП) измерялась ферментативным методом. Содержание липопротеинов низкой плотности (ЛПНП) рассчитывали по формуле W.T. Friedewald (1972) [20].
Фенотипирование популяций проангиогенных CD14+CD309+ и CD14+CD309+Tie2+ ЭПК и ЭАМ осуществлялось методом проточной цитофлуориметрии с помощью моноклональных антител, меченных флуорохромами FITC (флуоресцеин изотиоцианат) или двойной меткой FITC/PE (фикоэритрин) (BD Biosciences, США), к антигенам CD45, CD34, CD14, Tie‑2 и СD309(VEGFR2) — по методологии HD-FACS (High-Definition Fluorescence Activated Cell Sorter) с удалением эритроцитов лизирующим буфером в соответствии с протоколом гейтирования ISHAGE (International Society of Hematotherapy and Graft Engineering sequential) [21]. Для каждой из проб анализировалось 500 тысяч событий. ЭАМ фенотипировались как CD31+/annexin V+ микрочастицы [22]. Проангиогенный фенотип циркулирующих ЭПК идентифицировался как экспрессия CD14+СD309(VEGFR2)+Tie‑2+ антигенов. Результаты скатерограмм, полученные при продольном и поперечном рассеивании лазерного луча в проточном цитофлуометре, подвергались анализу с использованием принципа Булина (Boolean principles) для двойных или тройных позитивных событий.
Статистическую обработку результатов проводили в системе SPSS для Windows (версия 22) и GraphPad Prism (версия 5). Все номинальные данные представлены как среднее (М) и стандартное отклонение (±SD), медиана (Ме) и 95% доверительный интервал (ДИ) или межквартильный интервал (МКИ). Данные о категориальных переменных представлены как n (%). Гипотезу о нормальности распределения исследуемых показателей проверяли с использованием критерия Шапиро-Уилка и Колмогорова-Смирнова. При проведении парных сравнений уровней показателей внутри групп применяли парный критерий Вилкоксона. Сравнение категориальных переменных между группами проводили с использованием χ2-теста и точного F-критерия Фишера. Потенциальные факторы, которые могли бы быть связаны с изменением ЭПК, первоначально были определены с помощью однофакторного дисперсионного анализа (ANOVA), а затем все идентифицированные факторы с уровнем р<0,1 были дополнительно изучены в многофакторном дисперсионном анализе. При сравнении вероятности выживаемости когорт больных ХСН с различными величинами индекса кардиоваскулярного риска, рассчитанного с помощью измерения уровня циркулирующих биомаркеров, использовали парный t-критерий Стьюдента или U-критерий Манна-Уитни.
Величина отношения шансов (ОШ) и 95% ДИ были рассчитаны для всех независимых предикторов возникновения суммарных кардиоваскулярных событий. Процедура реклассификации с назначением ранга проводилась в произвольном режиме для отобранных независимых предикторов отдаленного прогноза. Построение кривых Каплана-Мейера выполнялось для пациентов с ХСН стратифицированных в зависимости от ранга высокого или низкого риска наступления неблагоприятных клинических событий. Сопоставление предикторной ценности различных прогностических моделей со стандартной АВС-моделью проводилось с помощью AUC (area under curve — площадь под кривой) ROC (Receive Operation Characteristic curve) и С-статистики. Для каждой из моделей, исключая стандартную, применяли процедуры реклассификации с расчетом индексов IDI (Integrated Discrimination Improvement) и NRI (Net Reclassification Improvement). Результаты считались достоверными при уровне р<0,05.
Результаты
В таблице 1 приведены основные сведения о больных, принявших участие в исследовании. Как видим, популяция пациентов с ХСН представлена преимущественно мужчинами (53,3%) среднего возраста с II ФК (37,9%) и III ФК (21,4%) ХСН. Среди зарегистрированных факторов кардиоваскулярного риска наибольшее значение имеют дислипидемия (66,0%), АГ (55,5%), ожирение (44,3%) и СД 2 типа (37,6%).
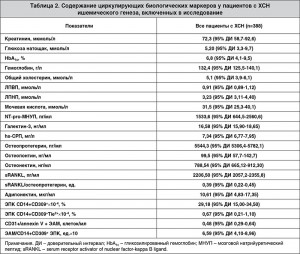
Содержание циркулирующих маркеров, измеренное в начале исследования, представлено в таблице 2.
Все пациенты получали современную терапию ХСН, основанную на использовании ингибитора ангиотензинпревращающего фермента (ИАПФ) (преимущественно рамиприл 10 мг/сут) или антагониста рецепторов ангиотензина ІІ (АРА) (преимущественно валсартан 180-360 мг/сут) в рекомендованных дозах в сочетании с бета-адреноблокаторами (83,5% пациентов) и/или ивабрадином (35,3% пациентов), петлевыми диуретиками (80,1%), антагонистами минералокортикоидных рецепторов (спиронолактон 25-100 мг/сут
или эплеренон 25-50 мг/сут) (39,2% пациентов) (табл. 3). Пациенты с АГ дополнительно получали дигидропиридиновые блокаторы медленных кальциевых каналов (преимущественно амлодипин в суточной дозе 2,5-10 мг). Больные ХСН с сопутствующим СД 2 типа наряду с диетическими ограничениями получали метформин (37,6% больных) и/или ситаглиптин (12,4% пациентов). В большинстве случаев к проводимой терапии была добавлена ацетилсалициловая кислота (АСК) в дозе 75-150 мг/сут в форме кишечного высвобождения или при непереносимости последней (21,4% пациентов) иной антиагрегант (преимущественно клопидогрель в суточной дозе 75 мг).
Медиана периода наблюдения за пациентами, включенными в исследование, составила 2,76 года (размах – 1,8-3,4 года). В течение данного периода было зарегистрировано 43 смертельных случая (11,1%). Среди всех смертельных случаев 35 событий (81,4%) были непосредственно связаны с прогрессированием ХСН, а 8 эпизодов (16,6%) рассмотрены как внезапная сердечная смерть, случаи фатального инфаркта миокарда или системной тромбоэмболии. Кроме того, 206 больных были госпитализированы повторно в связи с прогрессированием ХСН и 36 госпитализаций были связаны с иными кардиоваскулярными причинами.
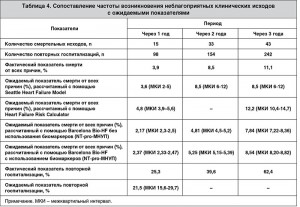
Общее количество кардиоваскулярных событий, которое удалось идентифицировать, составило 285 случаев (73,5% от общего количества включенных пациентов). Данные о частоте неблагоприятных фатальных и нефатальных клинических исходов в сопоставлении с показателями смертности, рассчитанными с помощью Seattle Heart Failure Model, Heart Failure Risk Calculator, Barcelona Bio-HF, представлены в таблице 4. Необходимо отметить, что в таблице не указаны ожидаемые величины ежегодной смертности через 3 года наблюдения, поскольку Seattle Heart Failure Model способна представлять данные только для одно-, двух- и пятигодичного периода наблюдения. Для последующих расчетов ожидаемые величины ежегодной смертности через 3 года наблюдения были условно приняты эквивалентными таковым через 2 года. Соответственно, Heart Failure Risk Calculator не позволяет рассчитывать риск общей смерти через 2 года наблюдения, в связи с чем ожидаемые данные не были получены. Модель Barcelona Bio-HF использовалась как с дополнительным измерением уровня циркулирующих биомаркеров (NT-pro-МНУП), так и без него. Аппроксимация данных National Heart Care Project позволила получить только величину одногодичного риска повторных госпитализаций.
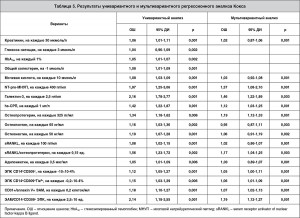
Используя уни- и мультивариантный регрессионный анализ Кокса было установлено, что независимой предсказующей ценностью в отношении возникновения неблагоприятных клинических исходов обладали NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, соотношение sRANKL/остеопротегерин, уровень циркулирующих ЭПК CD14+CD309+Tie2+, CD31+/annexin V+ ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК (табл. 5). Используя С-статистику было установлено, что восемь отобранных независимых предикторов существенно не различались от АВС-модели, которая включала эти факторы как непрерывные переменные (С-статистика = 0,81; 95% ДИ от 0,79 до 0,95; р=0,001). Вместе с тем в бинарной модели были получены данные о том, что такие предикторы, как соотношение sRANKL/остеопротегерин и уровень циркулирующих ЭПК CD14+CD309+Tie2+ достоверно отличаются от АВС-модели (С-статистика = 1,04; 95% ДИ от 1,01 до 1,06; р=0,001). В этой связи для выполнения процедуры реклассификации и построения шкалы оценки кардиоваскулярного риска были отобраны только 6 биологических маркеров, а именно: уровень NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, CD31+/annexin V+ ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК. Для выполнения процедуры реклассификации каждому из независимых предикторов было присвоено значение 1 ед., при отсутствии любого из указанных предикторов назначалось значение 0 ед. Индекс величины кардиоваскулярного риска рассчитывался путем математического суммирования рангов всех независимых предикторов, которые встречались у пациентов, включенных в исследование (от 0 ед. до 6 ед).
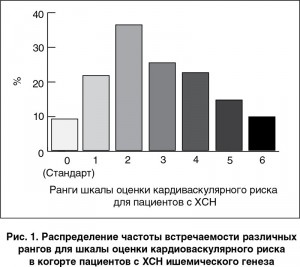
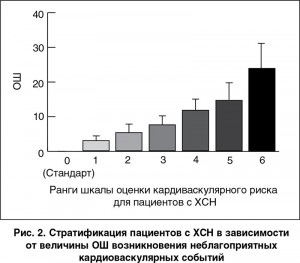
Полученные данные показали, что средняя величина индекса кардиоваскулярного риска у пациентов с ХСН составляет 3,17 ед. (95% ДИ = 1,65 ед. - 5,10 ед.). Распределение частоты встречаемости каждого из независимых предикторов в отобранной популяции пациентов с ХСН представлено на рис. 1.
Анализ количества кардиоваскулярных событий в зависимости от величины ранга шкалы риска для пациентов с ХСН показал, что имеет место тесная ассоциация между величиной ранга, полученного после процедуры реклассификации, и суммарной частотой возникновения фатальных и нефатальных кардиоваскулярных исходов в изучаемой когорте больных (r=0,72; Wald χ2=11,9; р=0,001). При этом величина ОШ возникновения кардиоваскулярных клинических исходов прогрессивно возрастает пропорционально повышению ранга на 1 ед. (рис. 2). Можно предположить, что ранги шкалы оценки риска с суммарной величиной менее 4 ед. отражают относительно низкий риск возникновения неблагоприятных клинических событий, а более высокие значения рангов — высокий кардиоваскулярный риск соответственно.
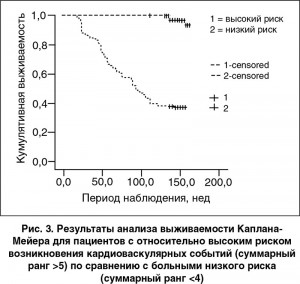
Построение кривых Каплана-Мейера выполнялось для пациентов с ХСН стратифицированных в две группы в зависимости от ранга высокого или низкого риска наступления неблагоприятных клинических событий (рис. 3). Обращает на себя внимание тот факт, что накопление клинических конечных точек для двух когорт пациентов с различной величиной кардиоваскулярного риска, оцененного с помощью биологических маркеров, приводило к раннему (приблизительно через 40 нед после начала исследования) расхождению кривых выживаемости, которое к концу периода наблюдения достигало уровня р<0,001.
Таким образом, использование шкалы оценки риска вероятности возникновения фатальных и нефатальных кардиоваскулярных событий, построенной на основе измерения циркулирующих биомаркеров (NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, CD31+/annexin V+ ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК), позволяет достаточно достоверно прогнозировать вероятность выживания пациентов с ХСН независимо от их возраста, гендерной принадлежности, состояния контрактильной функции миокарда ЛЖ и количества коморбидных состояний.
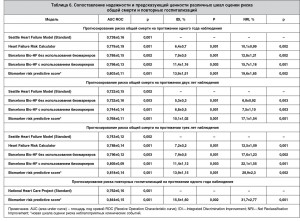
При сопоставлении надежности и предсказующей ценности различных моделей в качестве стандартных моделей были выбраны Seattle Heart Failure Model для показателя общей смерти и National Heart Care Project для показателя повторной госпитализации. Результаты проведенного анализа представлены в таблице 6.
Анализ полученных данных показал, что для всех направлений прогнозирования (общая смертность и повторная госпитализация) предлагаемая новая оригинальная система оценки риска смерти и повторной госпитализации больных с ХСН позволяет существенно повысить специфичность одно-, двух- и трехгодичного прогноза при достаточно высоком дискриминационном потенциале, достоверно превышающем стандартные значения Seattle Heart Failure Model, Heart Failure Risk Calculator, а также National Heart Care Project для одногодичного периода наблюдения и Barcelona Bio-HF для двух- и трехгодичного наблюдения.
Таким образом, новая модель, построенная на основе измерения уровня циркулирующих биомаркеров, демонстрирует более высокий дискриминационный потенциал для пациентов с ХСН при наличии коморбидных состояний, включая СД, чем ранее созданные прогностические модели. Исключением является Barcelona Bio-HF (с использованием биомаркеров), позволяющая рассчитывать величину одногодичной общей смерти для пациентов с ХСН с близкой предикторной ценностью к новой биомаркерной модели. Вместе с тем для показателя общей смерти в условиях двух- и трехгодичного наблюдения новая модель оказывается более точной.
Обсуждение
Результаты настоящего исследования свидетельствуют о том, что шкала оценки риска возникновения неблагоприятных клинических исходов у пациентов с ХСН, основанная только на измерении уровня циркулирующих биомаркеров, способна достаточно точно идентифицировать больных высокого риска [23]. Полученные данные позволяют надеяться на то, что комбинация мультифункциональных биомаркеров будет сохранять свою высокую предикторную ценность независимо от наличия коморбидных состояний, которые достаточно часто идентифицируются у пациентов с ХСН [24]. Ранее предпринимались попытки создания новых шкал риска ХСН, основанные на изолированных критериях, таких как клинические или эхокардиографические параметры, а также уровнях тех или иных биомаркеров, преимущественно натрийуретических пептидов и галектина‑3 [25, 26]. Однако подобный подход оказался более успешным в популяции пациентов с острой декомпенсированной ХСН, чем у лиц со стабильным течением ХСН [27, 28].
Кроме того, для большинства уже созданных шкал критическим моментом явился возраст и гендерная принадлежность пациентов, состояние почечного клиренса, а также сопутствующие метаболические коморбидные состояния (ожирение, СД 2 типа) и анемия [29, 30]. Кроме того, не создано достаточно надежной модели, позволяющей прогнозировать риск повторной госпитализации стабильного пациента с ХСН после выписки из стационара на протяжении более одного года наблюдения [31]. В настоящем исследовании были учтены эти данные с целью минимизировать влияние дополнительных факторов на надежность прогностической модели, включив в состав идентифицируемых биомаркеров те из них, которые не зависят от почечного клиренса (ЭПК, ЭАМ), не связаны с тяжестью миокардиальной дисфункции (отношение sRANKL/остеопротегерин), а также отражают тяжесть дисфункции эндотелия (остеопонтин, остеонектин). При этом NT-pro-МНУП и галектин‑3 сохранялись в качестве основных биологических маркеров, отражающих напряженность биомеханического стресса и фенотипический риск ХСН соответственно. В целом предлагаемая нами шкала оценки риска негативной эволюции ХСН выглядит оптимистично с точки зрения точности и прогностической ценности при сопоставлении с ранее созданными системами.
Выводы
1. Независимыми предикторами неблагоприятных клинических исходов у больных ХСН являются NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, соотношение sRANKL/остеопротегерин, уровень циркулирующих ЭПК CD14+CD309+Tie2+, CD31+/annexin V+ ЭАМ и соотношение ЭАМ/ CD14+CD309+ ЭПК.
2. Шкала оценки риска возникновения фатальных и нефатальных кардиоваскулярных событий, построенная на основе измерения циркулирующих биомаркеров (NT-pro-МНУП, галектин‑3, hs-CРП, остеопротегерин, ЭАМ и соотношение ЭАМ/CD14+CD309+ ЭПК), позволяет с высокой точностью прогнозировать вероятность выживания пациентов с ХСН независимо от их возраста, гендерной принадлежности, состояния контрактильной функции миокарда ЛЖ и количества коморбидных состояний в анамнезе.
3. Анализ Каплана-Мейера показал, что пациенты с ХСН и величиной риска менее 4 ед. имеют преимущества в выживании по сравнению с больными, для которых получены более высокие значения рангов шкалы кардиоваскулярного риска.
4. Новая оригинальная шкала оценки риска неблагоприятных клинических исходов у пациентов с ХСН превосходит по своей прогностической ценности Seattle Heart Failure Model, Heart Failure Risk Calculator, National Heart Care Project независимо от продолжительности наблюдения, а также Barcelona Bio-HF при двух- и трехлетних наблюдениях.
Литература
1. Lloyd-Jones D. Adams R.J., Brown T.M., Carnethon M., et al. Heart disease and stroke statistics — 2010 update: a report from the American Heart Association. Circulation. 2010; 121(7): e46-e215.
2. Roger V.L. The heart failure epidemic. Int. J. Environ. Res. Public Health. 2010; 7(4): 1807-1830.
3. Luttik M.L., Jaarsma T., van Geel P.P., Brons M., Hillege H.L., Hoes A.W., de Jong R., Linssen G., Lok D.J., Berge M., van Veldhuisen D.J. Long-term follow-up in optimally treated and stable heart failure patients: primary care vs. heart failure clinic. Results of the COACH‑2 study. Eur J Heart Fail. 2014; 16(11): 1241-8.
4. Schou M., Gislason G., Videbaek L., Kober L., Tuxen C., Torp-Pedersen C., Hildebrandt P.R., Gustafsson F.; NorthStar Investigators. Effect of extended follow-up in a specialized heart failure clinic on adherence to guideline recommended therapy: NorthStar Adherence Study. Eur J Heart Fail. 2014; 16(11): 1249-55.
5. Berezin A. Biomarker-guided therapy of chronic heart failure. In: Biomarkers in Disease: Methods, Discoveries and Applications. Biomarkers in Cardiovascular Disease. Victor R. Preedy and Vinood B. Patel, editors. Switzerland: Springer; 2016. 368 p.
6. Wu A. H. Biological and analytical variation of clinical biomarker testing: implications for biomarker-guided therapy. Curr. Heart Fail. Rep. 2013; 10(4): 434-440.
7. Buonocore D., Wallace E. Comprehensive guideline for care of patients with heart failure. AACN Adv Crit Care. 2014; 25(2): 151–62.
8. Ho T.H., Caughey G.E., Shakib S. Guideline compliance in chronic heart failure patients with multiple comorbid diseases: evaluation of an individualized multidisciplinary model of care. PLoS One. 2014; 9(4): e93129.
9. DeBeradinis B., Januzzi J.L. Jr. Use of biomarkers to guide outpatient therapy of
heart failure. Curr. Opin. Cardiol. 2012; 27(6): 661-668.
10. Fiuzat M., O’Connor C.M., Gueyffier F., et al. Biomarker-guided therapies in heart failure: a forum for unified strategies. J. Card Fail. 2013; 19(8): 592-599.
11. Vavuranakis M., Kariori M.G., Kalogeras K.I. et al. Biomarkers as a guide of medical treatment in cardiovascular diseases. Curr. Med. Chem. 2012; 19(16): 2485-2496.
12. Ahmad T., Fiuzat M., Pencina M. J. et al. Charting a Roadmap for Heart Failure Biomarker Studies. JACC Heart Fail. 2014. pii: S2213-1779(14)00111-5.
13. Ahmad T., O’Connor C.M. Therapeutic implications of biomarkers in chronic heart failure. Clin Pharmacol Ther. 2013; 94(4): 468-479.
14. McMurray J.J.V., Adamopoulos S., Anker S. D. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012. Eur Heart J. 2012; 33: 1787-1847.
15. Schiller N.B., Shah P.M., Crawford M., et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. American Society of Echocardiography Committee on Standards, Subcommittee on Quantitation of Two-Dimensional Echocardiograms. J. Am. Soc. Echocardiogr. 1989; 2: 358-367.
16. Mor-Avi V., Lang R.M., Badano L.P. et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur J Echocardiogr. 2011; 12(3): 167-205.
17. Levey A.S., Stevens L.A., Schmid C.H. et al. for the CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A New Equation to Estimate Glomerular Filtration Rate. Ann. Intern. Med. 2009; 150(9): 604-612.
18. Lupоn J., de Antonio M., Vila J, Penafiel J., Galan A., et al. Development of a Novel Heart Failure Risk Tool: The Barcelona Bio-Heart Failure Risk Calculator (BCN Bio-HF Calculator). PLoS ONE. 2014; 9(1): e85466.
19. Keenan P.S., Normand S.L., Lin Z. et al. An administrative claims measure suitable for profiling hospital performance on the basis of 30-day all-cause readmission rates among patients with heart failure. Circ. Cardiovasc. Qual. Outcomes. 2008; 1(1): 29-37.
20. Friedewald W.T., Levy R.I., Fredrickson D.S. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin. Chem. 1972; 18(6): 499-502.
21. Lacroix R., Judicone C., Mooberry M. et al. The ISTH SSC Workshop. Standardization of pre-analytical variables in plasma microparticle determination: results of the International Society on Thrombosis and Haemostasis SSC Collaborative workshop. J. Thromb. Haemost. 2013; 11 (6): 1190-1193.
22. Tung J.W., Parks D.R., Moore W.A., HerzenbergL. A., HerzenbergL. A. New approaches to fluorescence compensation and visualization of FACS data. Clin. Immunol. 2004; 110(3): 277-283.
23. Chyu J., Fonarow G.C., Tseng C.H., Horwich T.B. Four-variable risk model in men and women with heart failure. Circ. Heart Fail. 2014; 7(1): 88-95.
24. Giallauria F., Fattirolli F., Tramarin R. et al; ISYDE‑2008 Investigators of the Italian Association for Cardiovascular Prevention and Rehabilitation (GICR-IACPR). Cardiac rehabilitation in chronic heart failure: data from the Italian SurveY on carDiac rEhabilitation (ISYDE‑2008). J. Cardiovasc. Med. (Hagerstown). 2014; 15(2): 155-163.
25. Carluccio E., Dini F.L., Biagioli P. et al. The ’Echo Heart Failure Score’: an echocardiographic risk prediction score of mortality in systolic heart failure. Eur J Heart Fail. 2013; 15(8): 868-876.
26. Li Y., Neilson M.P., Whellan D.J. et al. Associations between Seattle Heart Failure Model scores and health utilities: findings from HF-ACTION // J. Card. Fail. 2013; 19(5): 311-316.
27. Scrutinio D., Ammirati E., Guida P. et al. The ADHF/NT-proBNP risk score to predict 1-year mortality in hospitalized patients with advanced decompensated heart failure. J. Heart Lung Transplant. 2014; 33(4): 404-411.
28. Vakil K.P., Dardas T., Dhar S., et al. Impact of renal dysfunction on the Seattle Heart Failure Model. J. Heart Lung Transplant. 2014; 33(2): 163-169.
29. Alba A.C., Agoritsas T., Jankowski M., et al. Risk prediction models for mortality in ambulatory patients with heart failure: a systematic review. Circ. Heart Fail. 2013; 6(5): 881-889.
30. Cabassi A., de Champlain J., Maggiore U., et al. Prealbumin improves death risk prediction of BNP-added Seattle Heart Failure Model: results from a pilot study in elderly chronic heart failure patients. Int J Cardiol. 2013; 168(4): 3334-3339.
31. ElMaghawry M., ElGuindy A. STOP-HF: Expanding the role of HF programs into the community. Glob Cardiol Sci Pract. 2014; 2014(2): 40-3.
32. Srinivas P., Manjunath C.N., Banu S., Ravindranath K. S. Prognostic significance of a multimarker strategy of biomarkers in acute heart failure. J Clin Diagn Res. 2014; 8(9): MC01-6.