17 квітня, 2017
Деменція після інсульту: клінічні кореляції та можливості профілактики
За матеріалами науково-практичної конференції з міжнародною участю «Сучасні аспекти клінічної неврології» (10-12 березня 2016 року, м. Яремче, Буковель)
Мозковий інсульт і його наслідки домінують у структурі смертності населення та причин інвалідності. Когнітивні порушення, які розвиваються у різні терміни після перенесеної судинної катастрофи, істотно обмежують активність пацієнтів, перешкоджають залученню їх до програм реабілітації, зумовлюють низьку прихильність до лікування та спустошливі соціально-економічні наслідки.
 Завідувач кафедри неврології, психіатрії, наркології та медичної психології Тернопільського державного медичного університету ім. І.Я. Горбачевського, доктор медичних наук, професор Світлана Іванівна Шкробот у своїй доповіді узагальнила сучасний стан проблеми постінсультної деменції й окреслила перспективні профілактичні напрями.
Завідувач кафедри неврології, психіатрії, наркології та медичної психології Тернопільського державного медичного університету ім. І.Я. Горбачевського, доктор медичних наук, професор Світлана Іванівна Шкробот у своїй доповіді узагальнила сучасний стан проблеми постінсультної деменції й окреслила перспективні профілактичні напрями.
Епідеміологічні дані щодо поширеності постінсультної деменції різняться залежно від місця проведення досліджень і діагностичних критеріїв, які в них застосовували. Поширеність деменції через рік після інсульту оцінюють від 7% у популяційних дослідженнях серед пацієнтів із першим у житті інсультом до 41% у групах госпіталізованих пацієнтів із повторними мозковими подіями (M. Brainin et al., 2015). Найвищий ризик розвитку деменції спостерігається протягом перших місяців після інсульту, що, імовірно, зумовлено внеском раніше нерозпізнаних та недіагностованих когнітивних порушень. Після першого року частота нових випадків деменції лінійно зростає щороку на 3%, за даними госпітальних досліджень, і на 1,7%, за даними популяційних досліджень. Дослідження з найдовшим терміном спостереження показало, що протягом 25 років після перенесеного інсульту деменція розвивалася майже в половини пацієнтів (E. Kokmen et al., 1996).
Щодо помірних когнітивних розладів, виразність яких не досягає ступеня деменції, то згідно з даними різних авторів залежно від застосовуваних методик нейропсихологічного тестування та підтипу інсульту їх частота становить від 17 до 92% у перші 3 міс після гострого порушення мозкового кровообігу (M. Brainin et al., 2015).
Загалом вивчені кореляції інсульту та деменції можна представити трьома співвідношеннями (S.T. Pendlebury, P.M. Rothwell, 2009):
– в 1 пацієнта з 10 деменція була до інсульту;
– в 1 пацієнта з 10 деменція розвиваєтьcя після першого інсульту;
– в 1 пацієнта з 3 деменція розвиваєтьcя після повторного інсульту.
Наразі тривають дискусії про походження постінсультного когнітивного дефіциту та взаємозв’язок судинної деменції з первинними нейродегенеративними її формами. Інсульт не лише спричиняє клінічно значущий неврологічнийдефіцит, а й впливає на функціонування мозку в цілому, включно з когнітивною та поведінковою сферами. При цьому когнітивні розлади, які виникають у пацієнтів, є сукупним наслідком і гострого судинного ураження, і супутніх вікових, первинно дегенеративних та соматичних порушень.
Доведено зв’язок частоти розвитку когнітивних порушень з артеріальною гіпертензією та гіпотензією, серцевою недостатністю, особливо тією, що супроводжується гіпотензією (систолічний артеріальний тиск <110 мм рт. ст.) і гіпоперфузією мозку, а також із цукровим діабетом, фібриляцією передсердь, курінням, надлишком або дефіцитом маси тіла. Важливу роль відіграють психічний та фізичний стан хворого до розвитку інсульту, лікування, яке проводили за різними показаннями, а також соціально-економічний статус пацієнта, його інтелектуальний рівень, сімейний анамнез.
З другого боку, когнітивні порушення часто діагностують ще до розвитку інсульту. Досі нез’ясованим залишається питання, чи інсульт безпосередньо впливає на розвиток когнітивних порушень, чи виступає тригером процесів, які вже певний час тривають (M. Brainin et al., 2015).
Поєднання нейродегенеративних змін і судинних патологічних процесів спостерігають у 20% пацієнтів із деменцією («змішана деменція»), що особливо актуально після перенесеного інсульту (M. Koistinaho et al., 2005). Цереброваскулярні захворювання та первинні нейродегенеративні процеси мають спільні передумови: носіння гена апо-Е4, гіпертонічна хвороба, атеросклероз судин головного мозку, аритмії, високий рівень холестерину, нераціональне харчування, куріння, гіподинамія. Наразі найпоширенішою є гіпотеза про те, що судинні та нейродегенеративні процеси взаємно потенціюють один одного. Судинні фактори ризику спричиняють змінифункціонального стану церебральних судин, знижують кровоток, зокрема в білій речовині, створюючи передумови для порушення нейротрофічних процесів. В умовах цереброваскулярних процесів порушується гематоенцефалічний бар’єр. Є дані про те, що патологічний бета-амілоїд (субстрат хвороби Альцгеймера) може безпосередньо пошкоджувати кровоносні судини та погіршувати мозковий кровоток. Судинні процеси, у свою чергу, можуть сприяти ущільненню бета-амілоїду та прогресуванню нейродегенерації (D.A. Bennett et al., 2005; T. Del Ser et al., 2005; M.J. Lee et al., 2014).
Встановлено, що субклінічні цереброваскулярні захворювання у вигляді «німих» інфарктів, ураження білої речовини чи мікрокрововиливів, які супроводжуються когнітивними порушеннями, можуть бути предикторами інсульту. За даними метааналізу, кожне стандартне відхилення у результатах нейропсихологічного тестування супроводжується підвищенням ризику розвитку інсульту на 15% (S. Rostamian et al., 2014). Більше того, особи з вираженими когнітивними порушеннями мають значно вищий ризик розвитку інсульту.
Зниження когнітивних функцій після інсульту не є неминучим. Імовірно, вік пацієнта на момент судинної катастрофи є визначальним фактором. Так, за даними госпітальних досліджень, порушені когнітивні функції певною мірою відновлюються протягом 12-18 міс у 30% хворих старше 60 років і лише у 10% хворих старше 70 років (C. Ballard et al., 2003).
Наразі не запропоновано надійних критеріїв, які давали б можливість передбачати еволюцію помірних когнітивних розладів у деменцію чи ймовірність успішного відновлення. Проте сучасні стратегії вторинної профілактики судинних подій та нейропротекції вже сьогодні дають змогу підвищити шанси пацієнтів на відновлення порушених функцій і не допустити поглиблення когнітивного дефіциту до рівня деменції.
Згідно з керівництвом Європейської агенції лікарських засобів (EMA) з розробки фармакологічних препаратів для лікування хвороби Альцгеймера та інших видів деменції (2008) визначено три основні напрями у лікуванні й профілактиці когнітивних порушень: симптоматичне покращення, модифікація перебігу захворювання (сповільнення чи запобігання прогресуванню деменції), а також первинна профілактика шляхом впливу на патогенетичні механізми на стадії до появи симптомів.
Обов’язковим компонентом має бути адекватна корекція судинних факторів ризику – артеріальної гіпертензії (гіпотензивні препарати), дисліпідемії (дієта, статини, нікотинова кислота), гіпергомоцистеїнемії (вітаміни В6, В12, фолієва кислота).
Корекція артеріального тиску в постінсультний період є важливою складовою стратегії вторинної профілактики судинних катастроф і запобігання прогресуванню когнітивного дефіциту. Так, у дослідженні PROGRESS антигіпертензивна терапія інгібітором ангіотензин-перетворювального ферменту (периндоприлом) та діуретиком (індапамідом) зменшувала частоту повторних інсультів на 43%, що супроводжувалося меншою частотою розвитку когнітивних порушень.
Терапія статинами також має доведені властивості запобігання первинним і повторним інсультам.
Окрім зниження вмісту атерогенних фракцій холестерину, статини справляють додаткові ефекти – антиагрегантний, протизапальний, покращують функціонування ендотелію, що може знаходити точки прикладання в багатофакторному патогенезі деменції.
Для покращення когнітивних функцій застосовують широкий спектр фармакологічних засобів, які можна поділити на чотири основні групи:
1) препарати, які впливають на певні нейротрансмітерні системи;
2) препарати з нейротрофічною дією;
3) препарати з нейрометаболічною дією;
4) препарати з вазоактивною дією.
Особливе місце посідають препарати біологічного походження з мультимодальною дією. Серед них найвідомішим в Україні є Актовегін, який являє собою депротеїнізований гемодериват із численними нейрометаболічними, трофічними та нейропротективними властивостями. У низці досліджень було показано, що терапія Актовегіном зменшує неврологічний дефіцит і покращує функціональне відновлення у терміни 10-30 днів після ішемічного інсульту за індексом Бартел (Н.А. Шамалов і співавт., 2010), а також істотно покращує когнітивні функції та загальний стан пацієнтів зі змішаною деменцією у короткострокові терміни (S. Kanowski et al., 1995).
Позитивний досвід застосування Актовегіну при когнітивних порушеннях став передумовою для проведення міжнародного багатоцентрового дослідження АRTEMIDA.
Рандомізоване плацебо-контрольоване дослідження у паралельних групах із подвійним засліпленням проводили з метою оцінювання ефективності лікування пацієнтів із постінсультними когнітивними порушеннями препаратом Актовегін, спершу внутрішньовенно (2000 мг на добу, до 20 інфузій), а потім перорально (1200 мг на добу) тривалістю 6 міс із подальшим спостереженням іще 6 міс. У дослідження включали чоловіків та жінок віком 60 років і старше, які перенесли ішемічний інсульт, підтверджений даними комп’ютерної та магнітно-резонансної томографії головного мозку (з оцінкою тяжкості за шкалою NIHSS від 3 до 18 балів), і мали когнітивні порушення (≤25 балів за результатами скринінгового Монреальського тесту – MoCA). Виключали пацієнтів, які мали деменцію, депресію чи психотичні епізоди в анамнезі.
Загалом було рандомізовано 503 пацієнти: 255 – у групу плацебо та 248 – у групу Актовегіну. В результаті цього дослідження, дизайн якого відповідає всім сучасним вимогам доказової медицини, було доведено ефективність препарату Актовегін при постінсультних когнітивних порушеннях, ґрунтуючись на досягненні статистично достовірної відмінності за первинною кінцевою точкою: Актовегін через 6 міс терапії ефективно покращував когнітивні функції за шкалою ADAS-Cog+. Достовірні відмінності між групами плацебо та Актовегіну не тільки збереглися, а й посилилися до кінця періода спостереження (рис.).
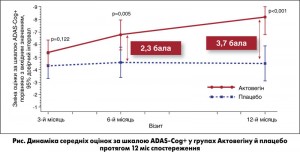
Отже, результати дослідження АRTEMIDA доводять, що Актовегін не просто забезпечує покращення порушених когнітивних функцій, а й модифікує перебіг постінсультних процесів у головному мозку, запобігаючи прогресуванню порушень когнітивних функцій у довгостроковій перспективі.
Підготував Дмитро Молчанов
UA/AVG/0217/0007


