22 березня, 2017
Псевдопрогрессия в онкологии: критерии оценки
Иммунотерапевтические препараты являются инновационными противоопухолевыми агентами с принципиально новым механизмом действия. Арсенал современной онкологии за последние годы пополнился целым рядом новых лекарственных средств, дающих значительные преимущества в выживаемости пациентов с разными локализациями злокачественных опухолей. Наиболее изученными из этой группы препаратов к настоящему времени являются ипилимумаб*, ниволумаб*, пембролизумаб, атезолизумаб*, тремелимумаб*. Продолжаются многочисленные клинические исследования, детализирующие возможности использования этих и некоторых других иммунотерапевтических агентов при различных злокачественных новообразованиях, линиях терапии и в отдельных клинических ситуациях. Однако клиническим онкологам приходится сталкиваться с целым рядом необычных реакций на иммунотерапевтические агенты. Прежде всего, препараты противоопухолевой иммунотерапии имеют весьма специфический спектр побочных иммунозависимых эффектов, не свойственных традиционной цитотоксической терапии. Важнейшим фактором, определяющим необходимый режим назначения иммунотерапевтических агентов, является корректная оценка ответа на лечение, которая также отличается от общепринятой для классического подхода системы RECIST (Response Evaluation Criteria in Solid Tumors) или системы критериев Всемирной организации здравоохранения (ВОЗ). В последние годы общепринятой для клинической практики является оценка ответа на лечение в соответствии с модифицированной системой RECIST 1.1. Для оценки ответа на лечение препаратами иммунотерапии разработана система irRC (immune-related Response Criteria), имеющая целый ряд особенностей, обусловленных механизмом действия иммунотерапевтических препаратов.
Эффект иммунотерапии реализуется посредством опухолевого микроокружения, которое представляет собой комплекс взаимодействий различных клеток. На рост опухоли могут оказывать влияние эффекторные лимфоциты, макрофаги, супрессорные клетки, фибробласты стромы, различные субпопуляции иммунокомпетентных клеток. В регуляции противоопухолевого иммунного ответа участвует также огромное количество иммуногенных и иммуносупрессивных цитокинов.
Активно пополняющийся арсенал знаний в области молекулярной биологии опухолевого роста позволил выделить наиболее перспективные сигнальные пути, воздействие на которые в конечном итоге приводит к индукции апоптоза.
В фокусе современных исследований находятся молекулы CTLA-4 и PD-1, которые функционируют на разных этапах противоопухолевого иммунного ответа. Так, CTLA-4 (СD152) ослабляет активацию наивных Т-лимфоцитов и Т-клеток памяти в лимфоидных органах, в то время как молекула PD-1 (CD279) вовлечена в модуляцию Т-клеточной активности в завершающую фазу иммунного ответа в периферических тканях, в том числе в опухоли, путем взаимодействия со специфическими лигандами PD-L1 (В7-Н1, или СD274) и PD-L2 (В7-DC, или CD273) (D.M. Pardoll, 2012).
Блокада рецептора CTLA-4 позволяет увеличивать противоопухолевую активность Т-лимфоцитов. Однако на Т-лимфоците существует рецептор программированной смерти PD, и опухоль экспрессирует лиганд для этого рецептора. На сегодняшний день известны лиганды двух типов – PD-L1 и PD-L2. Если рецептор на Т-лимфоците встречается с лигандом, лимфоцит утрачивает эффекторную функцию и способность разрушать опухоль. Можно заблокировать либо рецептор на Т-лимфоците с помощью моноклонального антитела к CTLA-4 (в настоящее время с этой целью используются препараты ипилимумаб и тремелимумаб), либо лиганд на опухоли с помощью моноклональных антител к PD-1 – препаратов ниволумаб, пембролизумаб, атезолизумаб, которые блокируют рецептор PD-1. Данное направление является самым многообещающим в лечении злокачественных новообразований.
Реализация этого механизма зависит от экспрессии PD-L1 опухолевыми клетками. Экспрессия PD-L1 служит предиктором ответа на анти-PD-1-, анти-PD-L1-терапию и коррелирует с типом опухоли. Лидеры по экспрессии PD-L1 на опухоли – меланома, множественная миелома, рак легкого, рак почки и ряд других опухолей. Лиганд PD-L1 широко экспрессирован не только на опухолевых, но и на иммунокомпетентных клетках, в частности на клетках опухолевого микроокружения.
Уровень экспрессии PD-L1 коррелирует с прогнозом при указанных опухолях, что подтверждает представление о выработке PD-L1 как ключевом механизме уклонения опухоли от иммунного надзора.
Блокирование взаимодействия в системе PD-1/PD-L1 и PD-1/PD-L2 может быть многообещающим объектом иммунотерапии, направленной на устранение избирательной супрессии специфического клеточного иммунного ответа в опухолевом микроокружении. Таким образом, злокачественные опухоли, использующие экспрессию молекул PD-L1 и PD-L2 для выживания путем уклонения от иммунного ответа, являются потенциальными мишенями для моноклональных антител к PD-1, обеспечивающих нечувствительность периферических цитотоксических Т-лимфоцитов, инфильтрирующих опухоль, к иммуносупрессивному влиянию опухоли через молекулы PD-L1 и PD-L2. При этом стоит отметить, что блокирование взаимодействия PD-1/PD-L1 путем связывания молекулы PD-L1 позволяет не только восстановить активность Т-лимфоцитов, но и сохранить периферический иммунный гомеостаз, поддерживая PD-1/PD-L2 взаимосвязь.
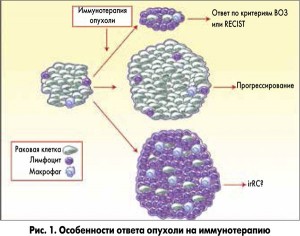
Метастатические опухолевые очаги состоят в основном из злокачественных и стромальных клеток с очень ограниченной иммунной и воспалительной инфильтрацией лимфоцитами и макрофагами. После введения иммунотерапевтических агентов размер метастатических очагов у некоторых пациентов может уменьшиться вследствие инфильтрации опухоли лимфоцитами и макрофагами и быстрого лизиса злокачественных клеток, что соответствует объективному ответу по критериям ВОЗ и RECIST. Метастатические опухолевые поражения могут увеличиваться в размерах в случаях истинного роста опухоли, что свидетельствует о прогрессировании заболевания. Однако иногда при особенно активном иммунном ответе опухолевые очаги могут значительно инфильтрироваться иммунными и воспалительными клетками, вследствие чего заметно увеличиваются в размере метастазы, а также визуально проявляются новые очаги, до начала лечения находившиеся вне разрешающей способности диагностического оборудования. Следует подчеркнуть, что, в отличие от истинного прогрессирования, связанного с неконтролируемым опухолевым ростом, такое явление обусловлено активной инфильтрацией опухоли рекрутированными иммунокомпетентными клетками. В этом случае поражение будет квалифицировано согласно критериям ВОЗ или RECIST как прогрессирующее заболевание, однако обращает на себя внимание несоответствие клинического события формальным критериям (рис. 1, по Ribas et al., Clin Cancer Res 2009). Это явление получило название псевдопрогрессирования. Выявление такой особенности реагирования опухолевой ткани на иммунотерапевтические агенты потребовало внесения изменений в существующую систему оценки ответа на лечение. Ранее с понятием псевдопрогрессирования сталкивались нейроонкологи при оценке течения опухолей центральной нервной системы после хирургического и комбинированного лечения.
Так, в клинических исследованиях было отмечено и описано четыре основных типа ответа на иммунотерапию:
- уменьшение размеров исходных очагов без появления новых;
- стабилизация болезни: медленное постепенное уменьшение объема опухоли;
- наступление ответа через некоторое время после увеличения общего объема опухоли;
- ответ со стороны исходных очагов на фоне появления новых, которые впоследствии исчезают.
Согласно стандартным рекомендациям, первой конечной точкой ответа на противоопухолевое лечение считается время окончания четырехкратного введения препарата (12 недель). Как показывает реальная клиническая практика, этого времени для объективной оценки эффективности иммунотерапии недостаточно. При пересмотре критериев оценки ответа опухоли в связи с появлением иммунотерапевтических агентов вторичной конечной точкой признано окончание 20-й недели – время, когда реализуются эффекты, обусловленные введением первых доз иммуноонкологических препаратов, и появляется возможность оценить их подлинную активность.
В процессе оценки эффективности иммунотерапии критерии первого полного ответа совпадают с критериями оценки ВОЗ и критериями оценки ответа солидных опухолей RECIST (исчезновение всех очагов). Однако критерии оценки частичного ответа и стабилизации процесса несколько различаются и предусматривают не только уменьшение старых очагов, но и возможность появления новых, которые впоследствии могут исчезнуть, что подтверждается клинической практикой.
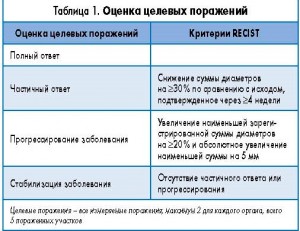
Напомним критерии оценки ответа RECIST 1.1. (по данным Einsenhauser EJC2009) (табл. 1 и 2).
Ответ на цитотоксические агенты можно легко оценить с самого начала лечения, поскольку они непосредственно убивают раковые клетки.
В критериях оценки ответной реакции для солидных опухолей (критерии RECIST) предусмотрен фиксированный период оценки реакции, который нельзя увеличить (нельзя оценивать реакцию после прогрессирования заболевания).
Раннее увеличение опухолевой нагрузки или размера опухоли означает истинное прогрессирование заболевания и резистентность к лечению.
Система оценки ответа на лечение irRC (immune-related Response Criteria), разработанная с учетом особенностей ответа опухоли на принципиально новый иммуноонкологический подход к противоопухолевому воздействию, имеет ряд отличий, которые следует учитывать при лечении иммунотерапевтическими агентами.
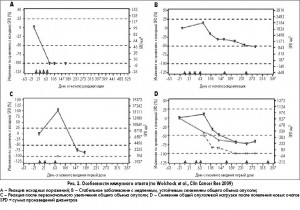
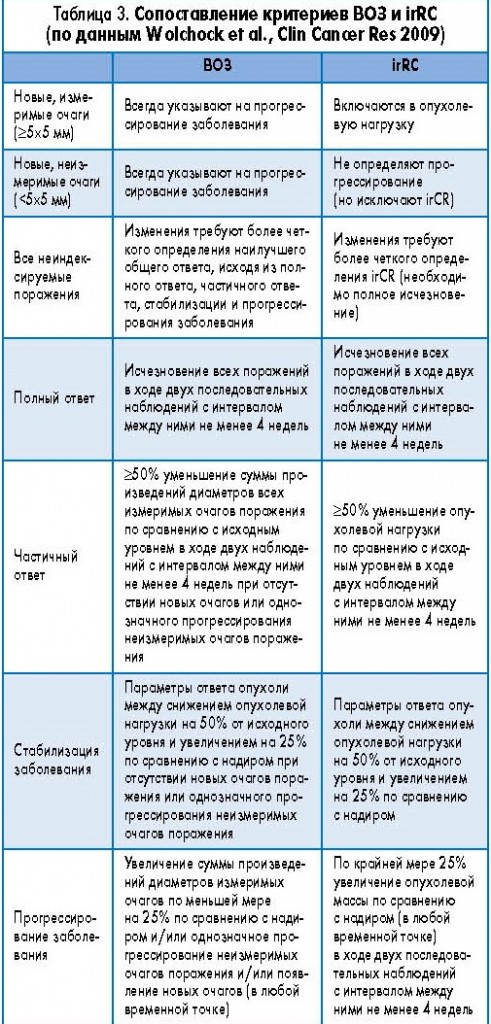
С внедрением в клиническую практику различных цитокинов, противоопухолевых вакцин, таргетных агентов были отмечены некоторые несоответствия ответа опухоли на такие терапевтические подходы в сравнении с традиционными цитотоксическими препаратами. Однако первые систематические наблюдения, проведенные в процессе регулярного обследования пациентов с меланомой, получавших в рамках клинических исследований (CA184-008, CA184-022 и CA184-007) лечение иммунотерапевтическим препаратом ипилимумабом – блокатором рецептора CTLA-4, – представлены в публикации Wolchock et al., Clin Cancer Res 2009. Именно они легли в основу работы над системой irRC и впоследствии были подтверждены многочисленными исследованиями пациентов, получавших иммуноонкологические препараты следующего поколения (рис. 2).
Таким образом, на основании наблюдений за реакцией опухолевых очагов на иммунотерапевтическое воздействие в процессе клинических исследований был сделан ряд выводов.
- Противоопухолевый ответ на иммунотерапию может потребовать больше времени по сравнению с ответом на цитотоксический препарат (время для развития иммунного ответа).
- Перед регрессом заболевания (лимфоцитарной инфильтрацией и некрозом опухоли) может произойти транзиторное ухудшение (условное прогрессирование) – «псевдопрогрессирование».
- Может произойти «клинически незначимое» прогрессирование (например, появление небольших новых очагов на фоне других пораженных участков, в которых наблюдается ответ на терапию).
- Продолжительная стабилизация заболевания может указывать на противоопухолевую активность, тогда как при химиотерапии стабилизация часто транзиторная и не считается показателем истинной противоопухолевой активности.
Такой уникальный механизм действия иммуноонкологических препаратов требует изменения критериев ответа опухоли.
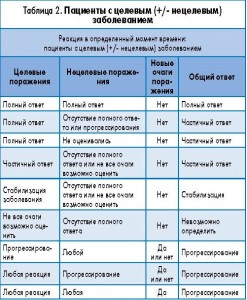
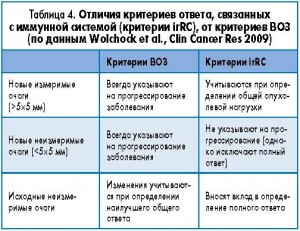
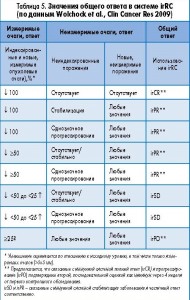
Различия в оценке ответа на разные типы противоопухолевой терапии между системами ВОЗ (RECIST) и irRC представлены в таблицах 3, 4 и 5.
Для системы irRC учитываются только индексированные (исходно выявленные) и новые измеримые очаги поражения (в отличие от критериев ВОЗ, которые не включают новых очагов и не требуют их измерения). Базовая оценка опухоли включает в себя сумму произведений двух самых больших перпендикулярных диаметров (SPD) всех индексов поражений (5 очагов на орган, до 10 висцеральных очагов и 5 кожных очагов). При каждой последующей оценке опухоли SPD индексированных очагов и новых измеримых очагов (≥5×5 мм, до 5 новых очагов на орган: 5 новых кожных очагов и 10 очагов внутренних органов) суммируются, чтобы рассчитать общую опухолевую нагрузку:
Опухолевая нагрузка =
SPDиндексированных очагов + SPDновых измеримых очагов
Итак, критерии irRC включают в себя следующие модифицированные представления об опухолевом ответе.
- Полный ответ, связанный с иммунной системой (irCR), – полное исчезновение всех пораженных участков (измеряемых или нет) и отсутствие новых очагов, что подтверждается при повторной последовательной оценке не менее чем через 4 недели после даты первого документированного ответа.
- Частичный ответ, связанный с иммунной системой (irРR), – снижение опухолевой нагрузки на >50% относительно исходной точки (надира), что подтверждается при повторной последовательной оценке не менее чем через 4 недели.
- Стабилизация заболевания, связанная с иммунной системой (irSD), – несоответствие критериям для irCR или irPR при отсутствии irPD.
- Прогрессирование заболевания, связанное с иммунной системой (irSD), – увеличение опухолевой нагрузки на >25% относительно минимальной величины (зарегистрированная минимальная опухолевая нагрузка), что подтверждается при повторной последовательной оценке не менее чем через 4 недели.
Таким образом, система irRC, предложенная Wolchok и соавт., является первым шагом в правильном направлении для оценки преимущества стратегии иммунотерапии опухолей. В настоящее время существуют некоторые сложности и неопределенности трактовки отдельных понятий, однако постоянное пополнение базы данных в направлении иммунотерапии позволяет оптимизировать критерии оценки ответа на лечение. Система успешно модифицируется с учетом вновь выявляемых фактов, и в будущем нас ожидают не только новые модификации системы irRC, но и новые лечебные стратегии, которые не только позволят с надеждой смотреть в будущее, но и потребуют иных подходов к формализации результатов лечения пациентов со злокачественными новообразованиями.
Подготовлено по заказу ТОВ «Рош Украина»
PID #264
* Не зарегистрирован в Украине.