8 червня, 2017
Патологія серцево-судинної системи при АНЦА-асоційованих системних васкулітах

Серцево-судинні захворювання (ССЗ) залишаються однією з основних причин захворюваності й смертності дорослого населення. Так, упродовж 2013 року в Європі зареєстровано понад 4 млн смертей від ССЗ, що становило 45% від усіх смертей. Однією з причин розвитку патології серцево-судинної системи (ССС), хоча й рідкісною, є системні васкуліти (СВ). Первинні СВ є гетерогенною групою захворювань, клінічні прояви яких упродовж тривалого часу часто неспецифічні, що ускладнює їх діагностику. Крім того, можливі випадки, коли перебіг СВ відбувається під «маскою» інших захворювань. Тому своєчасна діагностика й лікування СВ є важливими завданнями для лікарів.
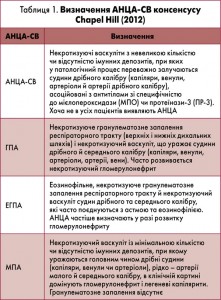
Одними з найпоширеніших СВ є ті, що асоціюються з наявністю антинейтрофільних цитоплазматичних антитіл (AНЦA) та належать до АНЦА-асоційованих СВ (АНЦА-СВ): гранулематоз із поліангіїтом (ГПА), еозинофільний ГПА (ЕГПА), мікроскопічний поліангіїт (МПА). АНЦА-СВ – потенційно небезпечні для життя аутоімунні захворювання, для яких характерні мультисистемні розлади внаслідок некротизуючого васкуліту судин малого й середнього калібру. Визначення АНЦА-СВ консенсусу Chapel Hill (2012) розглянуто в таблиці 1.
АНЦА-СВ є системними захворюваннями, що потенційно можуть уражати будь-які органи та характеризуються ураженням переважно судин дрібного калібру різних органів, включаючи легені, нирки, шкіру, периферичну нервову систему.
Некротизуючий васкуліт із відсутністю (чи незначною кількістю) імунних депозитів при імунолюмінесцентній мікроскопії – спільна морфологічна ознака всіх нозологічних форм АНЦА-СВ. Також для всіх АНЦА-СВ типовими є морфологічні зміни в нирках у вигляді фокального й сегментарного малоімунного некротизуючого гломерулонефриту з «півмісяцями», однак частота ураження нирок при цих СВ неоднакова: при МПА – 90%, при ЕГПА – 22-45%. Окрім того, АНЦА-СВ розрізняються за клінічними проявами та даними гістологічного дослідження. Так, для ГПА притаманне гранулематозне ураження респіраторного тракту, тоді як еозинофілія, бронхіальна астма, збільшення кількості еозинофілів у тканинах специфічні для ЕГПА. Гранулематозне запалення характерне для ГПА й ЕГПА, але не для МПА. Крім того, в разі запалення нейтрофіли переважають при ГПА, еозинофіли – при ЕГПА.
Епідеміологія
Щорічна захворюваність на ГПА, МПА й ЕГПА становить 2,1-14,4; 2,4-10,1 та 0,5-3,7 відповідно на 1 млн населення в Європі, а поширеність АНЦА-СВ становить 46-184 випадки на 1 млн осіб. Окрім того, європейські дослідження показали значні географічні відмінності: з вищою частотою захворюваності для ГПА на півночі, а МПА – на півдні. За даними багатоцентрового проспективного дослідження (Європейське товариство з вивчення васкулітів – European Vasculitis Study Group, EUVAS) за участю 535 пацієнтів, АНЦА-СВ (ГПА та МПА) асоціюються з розвитком небезпечних для життя ускладнень, таких як ниркова недостатність і легенева кровотеча. Упродовж 5 років спостереження смертність становила 25%, що у 2,6 раза вище за рівень загальної смертності в популяції. Основними причинами смерті протягом першого року були інфекції (48%) та активний васкуліт (19%), після першого року – ССЗ (26%), новоутворення (22%) й інфекції (20%).
Етіологія та патогенез
Етіологія АНЦА-СВ невідома. До основних тригерів розвитку АНЦА-СВ належать: генетична схильність, інфекційні збудники (віруси, бактерії, гриби, паразити), екологічні чинники, алергени, медикаменти.
Патогенез АНЦА-СВ є мультифакторіальним і до кінця не з’ясований. АНЦА-СВ є аутоімунними захворюваннями, в основі яких лежать порушення клітинного й гуморального імунітету. АНЦА зі специфічністю до ПР-3 або МПО є характерними для АНЦА-СВ і відіграють провідну роль у розвитку цих захворювань. Для ЕГПА та МПА характерна продукція АНЦА зі специфічністю до МПО, тоді як для ГПА – зі специфічністю до ПР-3. АНЦА зумовлюють активацію нейтрофілів, які відіграють роль у пошкодженні ендотелію, тканин і розвитку запалення з вивільненням прозапальних медіаторів, протеолітичних ферментів і активних форм кисню та ініціацією агрегації тромбоцитів і тромбоутворення. Особливістю патогенезу ЕГПА є аутоімунний процес із залученням еозинофілів.
АНЦА-СВ і серцево-судинні захворювання
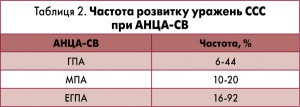
Пацієнти з АНЦА-СВ мають підвищений ризик розвитку уражень ССС, частота яких відображена в таблиці 2. Так, у ході дослідження, проведеного M.D. Morgan і співавт., було показано, що пацієнти з АНЦА-СВ мають більш ніж удвічі підвищений ризик серцево-судинних подій порівняно з групою контролю (відношення шансів, ВШ 2,23; 95% довірчий інтервал, ДІ 1,1-4,4; р=0,017), а хворі, що перебувають на гемодіалізі, та з анамнезом тютюнопаління мають додатковий підвищений ризик. За даними дослідження RHEU-M(A)R за участю 297 пацієнтів, поширеність ураження ССС була такою: у 54% хворих з АНЦА-СВ й у 22% хворих без АНЦА-СВ, у 14% пацієнтів із системними захворюваннями сполучної тканини, у 21% пацієнтів із запальними захворюваннями суглобів (ревматоїдний артрит, псоріатичний артрит) і в 24% хворих на саркоїдоз. Як видно з цих даних, найбільшу поширеність патології ССС спостерігали в пацієнтів з АНЦА-СВ, а найменшу – у хворих на системні захворювання сполучної тканини.
Згідно з результатами дослідження M.R. Hazebroek і співавт. ураження ССС за даними електрокардіографії (ЕКГ) та ехокардіографії (ЕхоКГ) виявлено в 62% пацієнтів з ЕГПА та в 46% пацієнтів із ГПА в період стійкої ремісії порівняно з 20% у контрольній групі (р<0,001 та р<0,014 відповідно), а за результатами магнітно-резонансної томографії (МРТ) серця – у 66% хворих на ЕГПА та в 61% хворих на ГПА. Крім того, виявлено збільшення загальної й серцево-судинної смертності в пацієнтів з ураженням ССС, що свідчить про високу частоту ураження серця у хворих на ЕГПА та ГПА навіть зі стійкою ремісією, а патологія ССС асоціювалася зі значним підвищенням смертності порівняно з пацієнтами без такої. Слід зазначити, що за відсутності симптомів і змін на ЕКГ у ході подальшого обстеження діагностували ураження серця. До того ж залучення ССС у патологічний процес при ГПА є предиктором серцево-судинної смертності, й тому стратифікацію ризику за допомогою методів обстеження з візуалізацією серця рекомендовано проводити в усіх пацієнтів з АНЦА-СВ, незалежно від наявності симптомів або змін на ЕКГ. Стандартизовані за віком річні показники смертності пацієнтів із ГПА та МПА внаслідок серцево-судинної патології становили 699 випадків на 100 тис. населення, що більше за очікувані в популяції. Ці дані підтверджують те, що пацієнти з ГПА та МПА мають значно підвищений ризик захворюваності та серцево-судинної смертності. За даними 5-річного дослідження EUVAS, у 13,8% пацієнтів із ГПА та МПА спостерігали серцево-судинні події (11,7 та 16,1% відповідно).
З 535 пацієнтів із ГПА та МПА 6% померли внаслідок розвитку серцево-судинної патології, 4,7% перенесли нефатальний інсульт, а 7,9% – нефатальний інфаркт міокарда (ІМ), аортокоронарне шунтування чи перкутанну коронарну ангіопластику.
Незалежними детермінантами серцево-судинних ускладнень були: старший вік (ВШ 1,45; 95% ДІ 1,11-1,90), діастолічна гіпертензія (ВШ 1,97; 95% ДІ 0,98-3,95), наявність АНЦА зі специфічністю до ПР-3 (ВШ 0,39; 95% ДІ 0,20-0,74). Різні потенційно небезпечні для життя серцево-судинні прояви описано в пацієнтів з АНЦА-СВ. Однак дані щодо МПА дуже обмежені, оскільки більшість спостережень проведено за участю пацієнтів із МПА, котрі були раніше класифіковані як хворі на вузликовий поліартеріїт. При АНЦА-СВ у патологічний процес можуть залучатися перикард, міокард, ендокард, коронарні артерії, провідна система серця. Існує багато потенційних причин, що підвищують серцево-судинний ризик у пацієнтів з АНЦА-СВ: ендотеліальна дисфункція, яка є визнаним фактором ризику (ФР) ССЗ і притаманна АНЦА-СВ, порушення функції нирок тощо. Крім того, запалення, характерне для первинного СВ, сприяє розвитку ендотеліальної дисфункції та атеросклерозу. Варто зазначити, що глюкокортикоїди (ГК), які є складовою частиною лікування СВ, збільшують ризик розвитку ССЗ за рахунок підвищення ризику розвитку цукрового діабету, дисліпідемії, артеріальної гіпертензії, але можуть відігравати й протекторну роль при СВ за рахунок зменшення системного запалення та внаслідок цього впливати на ендотеліальну дисфункцію. Дані щодо розвитку атеросклерозу при АНЦА-СВ дещо обмежені й суперечливі. Так, за результатами дослідження S. Mavrogeni і співавт., у пацієнтів із системними некротизуючими васкулітами, у яких виявлено безсимптомну патологію ССЗ, були відсутні ФР і клінічні прояви атеросклерозу за даними неінвазивного дослідження. Однак відомо, що при СВ спостерігають підвищену захворюваність і смертність унаслідок ССЗ через прискорений розвиток атеросклерозу. При АНЦА-СВ спостерігають 2-4-кратне підвищення відносного ризику ішемічної хвороби серця порівняно з контролем. Окрім того, аналогічний відносний ризик виявлено й для інсульту. Прискорений розвиток атеросклерозу є результатом системного запалення та імунних порушень – незалежних серцево-судинних ФР. Доведено, що пацієнти з АНЦА-СВ мають підвищений ризик розвитку венозних тромбоемболій (ВТЕ), особливо в активній фазі захворювання, що не може бути пояснено їхніми класичними ФР. Цей підвищений ризик, імовірно, пов’язаний зі змінами ендотелію та гіперкоагуляцією, індукованою АНЦА-СВ, та їх терапією. За даними дослідження P.M. Stassen і співавт., у 12% пацієнтів з АНЦА-СВ було діагностовано ВТЕ. У цілому захворюваність на ВТЕ становила 1,8 на 100 людино-років зі збільшенням до 6,7 на 100 людино-років у активній фазі захворювання. ВТЕ значно рідше діагностували в пацієнтів із ГПА, ніж із МПА. Ураження судин великого калібру не характерне для АНЦА-СВ, однак у літературі є поодинокі дані про залучення в патологічний процес аорти. Патологія артерій великого калібру при АНЦА-СВ може бути у вигляді стенозуючого артеріїту, аневризми, дисекції та розриву аорти, які часто є фатальними. Так, описано випадок аортиту й дисекції аорти в пацієнта з МПА. За результатами дослідження J.A. Chirinos і співавт., цю патологію частіше виявляють у пацієнтів із ГПА та МПА. Легенева гіпертензія є рідкісним явищем при АНЦА-СВ. Стратифікацію ризику проводять за допомогою п’ятифакторної шкали (the five-factor score, FFS). Наявність симптомів ураження серця визнано несприятливим прогностичним фактором, який може свідчити про вищий ризик 5-річної смертності в пацієнтів із системними некротизуючими васкулітами. У роботі R. Suppiah і співавт. запропоновано модель для кількісної оцінки ризику серцево-судинних подій залежно від віку, наявності діастолічної гіпертензії та ПР-3.
Гранулематоз із поліангіїтом
ГПА, відомий як гранулематоз Вегенера, є однією з найпоширеніших форм СВ, при якому в патологічний процес може залучатися будь-який орган. Типовими для ГПА є ураження верхніх, нижніх дихальних шляхів і нирок.
Ураження серця стостерігають у 6-44% випадків ГПА, однак є дані й про більшу частоту. Розвиваються серцево-судинні ураження внаслідок некротизуючого васкуліту й гранулематозного запалення. Під час проведення мультимодального скринінгу в 61% пацієнтів із ГПА було виявлено патологію ССС. Варто зазначити, що для ГПА характерний субклінічний перебіг ураження ССС.
У двох європейських когортних дослідженнях ураження ССС у хворих на ГПА було незалежним ФР розвитку рецидиву захворювання й резистентності до лікування. Проте в дослідженні, проведеному в Північній Америці, залучення в патологічний процес серця не було асоційовано з вищою смертністю чи розвитком рецидиву. Слід відзначити, що частота розвитку уражень серця була нижчою в цій когорті, ніж у європейській, і становила до 33,3% випадків. Водночас дослідження, проведені в Європі, діагностували в 46% пацієнтів залучення ССС у патологічний процес зі збільшенням загальної та серцево-судинної смертності. Так, смертність пацієнтів із ГПА й ураженням ССС становила 15-45%.
У ході дослідження, проведеного G. Cocco і співавт., було показано клінічне значення й потенційно фатальні наслідки різноманітних уражень серця. Перикардит, коронарит, міокардит, дилатаційна кардіоміопатія, неінфекційний ендокардит із розвитком вад серця, серцева недостатність (СН) є частими проявами патології серця при ГПА. Крім того, опубліковано численні повідомлення про розвиток при ГПА порушень ритму та провідності серця.
Перикардит є частим проявом ураження серця при ГПА, виявляється в 50% випадків ураження ССС і зазвичай має безсимптомний перебіг. Перикардит може бути фібринозним або ексудативним, навіть із розвитком тампонади серця. Перикардіальний випіт виявляють у пацієнтів із ГПА як за відсутності тяжкої дисфункції нирок, так і за наявності уремії.
У літературі трапляються поодинокі повідомлення про розвиток констриктивного перикардиту, що потребував перикардектомії.
Безсимптомний у більшості пацієнтів коронарит за даними аутопсій описано приблизно в 50% випадків ураження ССС. Однак за даними дослідження, проведеного S.D. Parry і співавт., ураження коронарних артерій є рідкісним і характеризується тромбозом/емболією коронарних артерій. Пацієнти з ГПА, за даними реєстру Датської національної лікарні, упродовж 5 років після встановлення діагнозу ГПА мали вищу частоту розвитку ІМ порівняно з популяцією. Ішемія міокарда розвивається внаслідок некротизуючого васкуліту, тромбозу, емболії коронарних артерій, однак стенокардія та ІМ не є частими. Для ІМ при ГПА характерною є відсутність типового загрудинного болю.
За даними дослідження P. Korantzopoulos і співавт., у пацієнтів із ГПА виявлено вогнища гранулематозного запалення в епікарді, міокарді, периваскулярне запалення й некротизуючий артеріоліт. Ендокард і клапани також були залучені в патологічний процес у деяких випадках із розвитком запалення, фібриноїдного некрозу й утворенням гранульом на мітральному та рідше трикуспідальному клапанах.
Частота виявлення ураження міокарда залежить від методів, які застосовують для діагностики патології ССС. Так, за результатами дослідження T. Miszalski-Jamka і співавт., у 54,5% пацієнтів із ГПА, що не досягли ремісії, незважаючи на 6 міс імуносупресивної терапії, та в яких при проведенні коронарографії (КГ) були відсутні істотні стенози коронарних артерій, виявлено міокардит за даними МРТ серця із застосуванням гадолінію. A. Weidhase і співавт. описали дифузний гранулематозний і некротизуючий гігантоклітинний міокардит за даними аутопсії. Слід відзначити розвиток міокардиту, атріовентрикулярної блокади в пацієнта з ГПА з підтвердженням діагнозу за допомогою контрастної МРТ і позитивним ефектом лікування ритуксимабом. Описано випадок міокардиту й небактеріального тромбоендокардиту в пацієнта з ГПА, у якого за даними трансторакальної та трансезофагеальної ЕхоКГ було виявлено систолічну дисфункцію лівого шлуночка (ЛШ) та «вегетацію» на стулках мітрального клапана. Потрібно зауважити, що посіви крові були негативними.
Ураження ендокарда з розвитком клапанних вад серця трапляється частіше при ГПА порівняно з іншими АНЦА-СВ. Так, найчастіше при ГПА розвивається недостатність клапанів аорти (в 60% випадків), рідше – мітральна недостатність (35%), поєднані вади серця (30%), комбіновані мітральні вади серця та описано поодинокі випадки аортального стенозу (5%). Декілька механізмів відповідальні за розвиток клапанних вад серця: формування унікальних «утворень» на стулках клапанів, що можуть імітувати вегетації, характерні для інфекційного ендокардиту, потовщення стулок, перфорація стулок, залучення в патологічний процес папілярних м’язів. У 50% випадків ураження клапанів діагностовано при первинному зверненні до лікаря й встановленні діагнозу СВ. Хірургічної корекції вади серця потребували більшість хворих. Результати гістологічного дослідження показали запалення і/або фіброз, гранульоми, які містять гігантські багатоядерні клітини, і/або мікроабсцеси. Описано випадок формування «запальних мас» на папілярних м’язах у 19-річної дівчини. Також у цієї пацієнтки спостерігали стійку шлуночкову тахікардію.
При ГПА можуть розвиватися порушення ритму й провідності серця. Частіше виявляють суправентрикулярні тахіаритмії, атріовентрикулярні блокади, блокади ніжок пучка Гіса. S.I. Ohkawa і співавт. описали випадок ГПА з розвитком ендокардиту, міокардиту, перикардиту, блокади правої ніжки пучка Гіса, блокади передньої гілки лівої ніжки пучка Гіса та рецидивуючої шлуночкової тахікардії. У ході аутопсії було виявлено некротизуючий васкуліт і гранулематозне запалення із залученням у патологічний процес провідної системи серця.
Описано випадок розвитку дилатаційної кардіоміопатії в молодого пацієнта з ГПА з розвитком ознак СН. За даними ЕхоКГ було виявлено кардіомегалію, дифузне зниження скоротливої здатності ЛШ із фракцією викиду ЛШ 21%. При проведенні КГ змін коронарних артерій не виявлено.
У літературі є дані про розвиток тромбоемболічних ускладнень при ГПА. Дані багатоцентрового рандомізованого подвійного сліпого плацебо-контрольованого дослідження (The Wegener’s Clinical Occurrence of Thrombosis (WeCLOT) Study) показали, що при ГПА спостерігають підвищений ризик розвитку ВТЕ порівняно з популяцією та хворими на системний червоний вовчак і ревматоїдний артрит. Частота розвитку ВТЕ становила 7,0 на 100 людино-років (95% ДІ 4,0-11,4).
Окрім того, при ГПА можливе ураження судин середнього та великого калібру з розвитком стенозуючого васкуліту, аневризм, дисекції й розриву аорти.
Артеріальна гіпертензія в цілому не характерна для ГПА й виявляється рідко.
Ураження серця часто розвивається в пацієнтів із тяжкою формою ГПА, і ретельний моніторинг ССС має вирішальне значення для діагностики патології серця. Стратифікацію ризику за допомогою візуалізації серця рекомендовано проводити всім хворим на ГПА, незалежно від наявності симптомів або змін на ЕКГ.
Мікроскопічний поліангіїт
При МПА в патологічний процес залучаються судини дрібного калібру (капіляри, венули, артеріоли), проте можуть уражатися й судини середнього калібру.
Поширеність МПА менша, ніж ГПА, і хворіють частіше чоловіки старше 50 років. Типовим є залучення в патологічний процес нирок і легень, однак при МПА можуть уражатися нервова система, шкіра, опорно-руховий апарат, очі, шлунково-кишковий тракт, а також серце. Ураження ССС менш вивчено при МПА, є не характерним і діагностується в 10-20% випадків. Утім, є дані про більшу частоту розвитку патології серця в таких хворих. Так, за даними дослідження за участю 85 пацієнтів із МПА, у 50,6% було виявлено патологію серця. Ознаки СН виявлено в 17,6% хворих, перикардит – у 10,6%, артеріальну гіпертензію – у 34%, ІМ – у 2,4%. Смертність пацієнтів, які перебували на лікуванні ГК і циклофосфамідом, становила 24,1%, при лікуванні тільки ГК – 48,4% (р<0,01), а 5-річна виживаність становила 74%. В іншому дослідженні, проведеному в Китаї за участю 132 пацієнтів з АНЦА-СВ, у більшості з яких (97%) діагностовано МПА, у 2,3% – ГПА й у 0,7% – ЕГПА, ураження серця було виявлено в 19,7% випадків. У 46% цих пацієнтів діагностовано перикардит, у 34,6% – СН/кардіоміопатію, у 3,8% – аортальну недостатність і в 3,8% – порушення серцевого ритму. Слід зазначити, що не було виявлено взаємозв’язку між ураженням нирок, серця, віком і перебігом захворювання. При МПА можливий розвиток тампонади серця, недостатності аортального клапана, гострої СН, зрідка спостерігають ураження серця внаслідок неконтрольованої вторинної артеріальної гіпертензії.
H. Tahir і співавт. описали в пацієнта з МПА з ураженням легень і гострим пошкодженням нирок розвиток суправентрикулярної тахікардії, нестійкої шлуночкової тахікардії з позитивним ефектом застосування ГК, циклофосфаміду й плазмаферезу. Описано випадок стрес-кардіоміопатії такоцубо в 70-річного пацієнта з активним МПА й повним регресом симптомів ураження серця після лікування ГК. За допомогою МРТ-ангіографії та МРТ із контрастом у пацієнтів із МПА, у яких були відсутні симптоми ураження серця, у 25% випадків виявлено фузіформні аневризми, у 87,5% – ектазії коронарних артерій і в 12,5% – некроз міокарда. Слід зауважити, що патологія серця істотно погіршує прогноз, особливо в пацієнтів із МПА. Основними причинами смерті були гостра СН, порушення ритму серця, ІМ.
Еозинофільний ГПА
ЕГПА характеризується наявністю бронхіальної астми, еозинофілії та інфільтрації еозинофілами тканин різних органів з утворенням гранульом. Для ЕГПА характерні еозинофільне запалення, екстраваскулярні гранульоми й некротизуючий васкуліт у пацієнтів із тяжкою бронхіальною астмою. ЕГПА – системне захворювання, при якому в патологічний процес може залучатися практично будь-який орган. Ураження органів дихання спостерігають майже в усіх пацієнтів з ЕГПА з розвитком астми та утворенням легеневих інфільтратів, які швидко минають після застосування ГК. Ураження нервової системи зазвичай маніфестує множинним мононевритом і периферичною полінейропатією. Іншими позалегеневими проявами ЕГПА є ураження шкіри, ішемія кишківника, периферична нейропатія, міокардит тощо.
При ЕГПА AНЦА позитивні в 40-60% випадків, переважно зі специфічністю до МПО. Розрізняють два фенотипи ЕГПА: АНЦА-позитивний і АНЦА-негативний. Згідно з даними дослідження R. Sable-Fourtassou і співавт. у АНЦА-позитивних пацієнтів частіше розвивається ураження нирок, периферична нейропатія, тоді як у АНЦА-негативних – ураження серця й лихоманка. Під час гістологічного дослідження васкуліт рідше виявляють у АНЦА-негативних пацієнтів порівняно з АНЦА-позитивними. У цих двох групах пацієнтів з ЕГПА, ймовірно, переважають різні патогенетичні механізми: АНЦА-опосередкований процес в AНЦА-позитивних хворих та інфільтрація тканин еозинофілами з подальшим вивільненням токсичних білків у АНЦА-негативних хворих.
ЕГПА є одним із СВ, при якому ураження ССС є найпоширенішим і яке погіршує прогноз та підвищує смертність. Частота ураження серця змінюється в широких межах і може залежати від активності захворювання, спостерігається в 16-92% пацієнтів й асоціюється з гіршим прогнозом і високою смертністю. Ці розбіжності здебільшого залежать від методів дослідження патології ССС і тяжкості й активності захворювання. Залучення в патологічний процес ССС є несприятливим прогностичним фактором у пацієнтів з ЕГПА, що підтверджують дані дослідження за участю 150 пацієнтів з ЕГПА, згідно з якими значущим предиктором смертності була наявність симптомної СН.
У патологічний процес при ЕГПА можуть бути залучені будь-які структури серця з розвитком міокардиту, перикардиту, коронариту, ІМ, кардіоміопатії, патології клапанів серця, порушень серцевого ритму й провідності, CН, раптової серцевої смерті, артеріальної гіпертензії, ендоміокардіального фіброзу з утворенням тромбів у порожнинах серця.
У ході дослідження J.P. Smedema і співавт. ураження ССС було виявлено в 60% пацієнтів з ЕГПА із залученням міокарда, перикарда, коронарних артерій, клапанів серця. Потрібно зазначити, що СН була причиною смерті в понад 25% пацієнтів з ЕГПА.
За даними дослідження з використанням ЕКГ, ЕхоКГ, МРТ серця й ендоміокардіальної біопсії (T. Neumann et al., 2009), ураження серця було діагностовано в 45% пацієнтів з ЕГПА, які були АНЦА-негативними (p<0,05), а рівень еозинофілів (р<0,001) був вищим порівняно з таким у пацієнтів без ураження серця. У 50% хворих було виявлено порушення функції ЛШ, недостатність клапанів – у 73%, перикардіальний випіт – у 41%. Найтяжчий перебіг спостерігали в групі пацієнтів з ендоміокардитом (у 59%) із формуванням тромбів. Після середнього періоду спостереження, що становив 47 міс, у більшості хворих відзначали регрес ознак ураження серця, за винятком хворих з ендоміокардитом. У цій групі пацієнтів спостерігали два летальні випадки внаслідок кардіоміопатії та СН. Ці дані підтверджують результати дослідження, проведеного S. Mavrogeni і співавт., згідно з якими АНЦА-негативні пацієнти з ЕГПА та ендоміокардіальним фіброзом мають значно гірший прогноз. Для ураження ССС при ЕГПА характерний субклінічний перебіг, симптоми відзначають у 26% пацієнтів, що підтверджують дані дослідження W. Szczeklik і співавт. Так, субклінічне ураження серця було виявлено в 90% хворих на ЕГПА в стадії клінічної ремісії за допомогою мультимодального скринінгу (ЕКГ, холтерівський моніторинг ЕКГ, тест із дозованим фізичним навантаженням, трансторакальна ЕхоКГ і МРТ серця).
Ці результати можуть свідчити про те, що ураження серця в період клінічної ремісії є поширеним явищем і характеризується не тільки фіброзом у міокарді, а й запаленням. Окрім того, в ході дослідження значну еозинофілію (до початку імуносупресивного лікування) спостерігали в пацієнтів із порушеннями серцевого ритму та систолічною СН (р<0,05) і було виявлено негативну кореляцію еозинофілії з фракцією викиду ЛШ (r=-0,65, р<0,05). У дослідженні L. Guillevin і співавт. перикардит був діагностований у 22% пацієнтів при встановленні діагнозу ЕГПА, СН – у 9% і транзиторні порушення провідності – у 3%. За результатами дослідження R. Sable Fourtassou і співавт., у 35% пацієнтів спостерігали ознаки ураження ССС. Так, перикардит діагностовано у 25% хворих із розвитком тампонади в 7 випадках, кардіоміопатія – у 24% хворих, з яких 18% мали клінічні прояви СН. Окрім того, показано, що в 49% пацієнтів із відсутністю АНЦА діагностували ураження серця, на відміну від 12% у АНЦА-позитивних пацієнтів, що підтверджують дані дослідження R.M. Dennert і співавт., згідно з якими в 74% АНЦА-негативних пацієнтів було виявлено ураження серця. Ураження міокарда розвивається внаслідок васкуліту коронарних артерій, їх оклюзії, еозинофільної інфільтрації міокарда, виділення токсичних медіаторів активованими еозинофілами (зокрема, еозинофільного катіонного білка й великого основного протеїна), що призводять до пошкодження міокарда, формування в міокарді гранульом і сполучної тканини. Описано розвиток еозинофільного міокардиту в 67-річної пацієнтки з бронхіальною астмою. Під час проведення ЕхоКГ було виявлено дифузний гіпокінез стінок ЛШ, зниження фракції викиду ЛШ (30%). Окрім того, у крові спостерігали значну еозинофілію, підвищення рівня тропоніну Т, еозинофільного катіонного білка та мозкового натрійуретичного пептиду. Діагноз ЕГПА був підтверджений за допомогою даних біопсії шкіри. Після проведення імуносупресивного лікування (преднізолон і циклофосфамід) та симптоматичного лікування СН стан хворої значно поліпшився. Є дані про розвиток аортальної недостатності, гострої лівошлуночкової недостатності та повної атріовентрикулярної блокади в 56-річної пацієнтки з ЕГПА, діагноз якого було встановлено 20 років тому. Було проведено хірургічну корекцію вади серця та імплантацію постійного штучного водія ритму.
За даними гістологічного дослідження виявлено некротизуюче гранулематозне запалення з інфільтрацією еозинофілами стулок клапана з їх потовщенням унаслідок запалення, частково – фіброзу. Стан хворої покращився після проведеного лікування преднізолоном та циклофосфамідом. За результатами дослідження S. Hellemans і співавт., майже в 50% випадків міокардит і коронарит є причиною смерті в пацієнтів із недіагностованими СВ. Залучення в патологічний процес коронарних артерій прижиттєво діагностують рідко, на відміну від даних аутопсій. При ЕГПА може розвиватися ішемія міокарда, асоційована з коронаритом та еозинофільною інфільтрацією. Проте стенокардія, ІМ є нечастими формами ураження ССС при цьому захворюванні. Атеросклероз коронарних артерій за результатами КГ виявлено в 15% пацієнтів. Однак є дані, що зміни епікардіальних артерій рідко виявляють за даними КГ. У пацієнтів з ЕГПА виявляли надшлуночкові й шлуночкові порушення серцевого ритму та порушення провідності серця, зокрема блокаду правої/лівої ніжки пучка Гіса, повну атріовентрикулярну блокаду. Описано випадок раптової серцевої смерті, ймовірно, внаслідок розвитку фатальних аритмій. Описано розвиток дилатаційної кардіоміопатії в пацієнтів з ЕГПА з утворенням внутрішньосерцевих тромбів. Еозинофільний ендоміокардит і ендоміокардіальний фіброз з утворенням тромбів при ЕГПА спостерігають украй рідко. Проте, за даними T. Neumann і співавт., ендоміокардит із формуванням тромбів виявлено в 59% пацієнтів з ЕГПА та ураженням серця. Описано випадок розвитку ЕГПА у 26-річної хворої з анамнезом бронхіальної астми, риніту, поліпів носа впродовж трьох років, у якої на тлі еозинофілії розвинулися легеневі інфільтрати й фульмінантний еозинофільний ендоміокардит, що ускладнився кардіогенним шоком після призначення антагоніста рецепторів цистеїнілових лейкотрієнів (пранлукаст) для лікування бронхіальної астми й відміни ГК. Гострий некротизуючий еозинофільний ендоміокардит підтверджено за допомогою ендоміокардіальної біопсії. Стан пацієнтки покращився після інтенсивного лікування, що включало застосування інтрааортальної балонної контрпульсації та пульс-терапії ГК із відміною пранлукасту. Легенева гіпертензія може розвиватися внаслідок ураження легень і спричиняти дисфункцію правого шлуночка.
Діагностика АНЦА-СВ та уражень
серцево-судинної системи
Діагностика АНЦА-СВ ґрунтується на міждисциплінарному підході й включає оцінювання клінічних даних, результатів лабораторних та інструментальних досліджень з метою встановлення стадії й ступеня тяжкості захворювання. Проте золотим стандартом діагностики залишається гістологічне дослідження біоптатів тканин (зокрема нирок, слизової оболонки носа, легень тощо) на наявність некротичного васкуліту судин дрібного калібру.
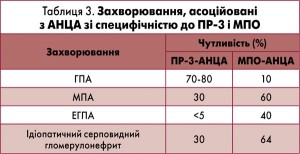
Визначення АНЦА є важливим, однак слід зазначити, що відсутність АНЦА не виключає СВ, так само й позитивні тести на їх наявність не обов’язково підтверджують діагноз АНЦА-СВ. Чутливість ПР-3-АНЦА та МПО-АНЦА наведено в таблиці 3. За результатами дослідження Z.W. Shuai і співавт., рівні ПР-3-АНЦА (середні титри дорівнювали 1:60) не корелювали з активністю захворювання й ступенем ураження органів, а рівні МПО-АНЦА позитивно корелювали з активністю захворювання.
Діагностику ураження ССС проводять за допомогою ЕКГ, 24-годинного холтерівського моніторингу, ЕхоКГ, багатозрізової комп’ютерної томографії, МРТ, ендоміокардіальної біопсії, КГ, позитронно-емісійної томографії тощо.
При проведенні ЕКГ діагностують порушення серцевого ритму й провідності, ішемію міокарда тощо. За даними дослідження T. Neumann і співавт., зміни на ЕКГ було виявлено в 77% пацієнтів з ЕГПА: частіше діагностували зміни сегмента ST і зубця Т (у 63,6% випадків), блокаду правої чи лівої ніжки пучка Гіса (22,7%), шлуночкові порушення серцевого ритму (9%).
За результатами 24-годинного холтерівського моніторингу виявлено більшу частоту суправентрикулярних і шлуночкових порушень ритму серця у хворих на ЕГПА порівняно з контрольною групою (р<0,05). Дані дослідження, проведеного W. Szczeklik і співавт., показали, що в пацієнтів з ЕГПА виявлено більшу дисперсію коригованого інтервалу QT (QTc) при встановленні діагнозу (p<0,0001) і в період ремісії (p=0,002) порівняно з групою контролю. ЕхоКГ є основним неінвазивним і доступним методом дослідження серця, за допомогою якого виявляють розширення порожнин серця, систолічну чи діастолічну дисфункцію ЛШ, клапанні вади серця, перикардит, тромби в порожнинах серця тощо. Так, при проведенні ЕхоКГ у 31,8% пацієнтів з ЕГПА в період ремісії фракція викиду ЛШ була нижче 50%, а рівень еозинофілів у периферичній крові – вищим. Ці дані підтверджують результати дослідження, проведеного W. Szczeklik і співавт., згідно з якими ураження серця при ЕГПА виявлено в 65% хворих, систолічна дисфункція ЛШ – у 30%. За даними роботи T. Neumann і співавт., у пацієнтів з ЕГПА зниження фракції викиду ЛШ виявлено в 50% випадків, недостатність мітрального клапана – у 27%, аортального – у 13,6%, трикуспідального – у 31,9%, перикардіальний випіт – у 41%, легеневу гіпертензію – у 27% і тромби в шлуночках серця – у 18%. Двовимірна спекл-трекінг ЕхоКГ дає змогу реєструвати порушення як глобальної, так і регіонарної скоротливості міокарда ЛШ, досліджуючи локальну деформацію будь-якого сегмента міокарда. За допомогою комп’ютерної томографії можна виявляти не тільки кальцифікацію коронарних артерій, а і їх стенозування, наявність атеросклеротичної бляшки, легеневої емболії. МРТ серця є чутливим методом для раннього виявлення патології ССС. За допомогою МРТ ураження серця діагностують у пацієнтів із ремісією захворювання й за відсутності симптомів. За даними дослідження J. Marmursztejn і співавт., при проведенні МРТ серця в 70% пацієнтів у період ремісії ЕГПА було виявлено субклінічні зміни в міокарді. У дослідженні, проведеному за участю невеликої кількості хворих на ЕГПА (n=8), через 6 міс імуносупресивного лікування в 75% пацієнтів відзначали регрес змін з боку ССС (за результатами МРТ серця). Крім того, виявлено кореляцію між даними МРТ і 3D-ЕхоКГ.
Дані дослідження S. Mavrogeni і співавт. узгоджуються з попередніми роботами, які показали наявність коронариту приблизно в 78% пацієнтів із СВ, що наразі класифікують як MПA. Слід зауважити, що за відсутності симптомів і змін на ЕКГ при проведенні ЕхоКГ та МРТ серця патологію ССС виявлено в 38% пацієнтів з ЕГПА. Широка, навіть рутинна практика проведення МРТ у пацієнтів з AНЦА-СВ є виправданою для отримання суттєвої діагностичної та прогностичної інформації й проведення стратифікації ризику. МРТ-ангіографію коронарних артерій можуть проводити для діагностики ураження коронарних артерій, зокрема їх ектазій та аневризм, ішемії міокарда (з використанням добутаміну, аденозину), оцінювання перфузії міокарда із застосуванням гадолінію. У пацієнтів, у яких відсутні симптоми ураження ССС, при проведенні МРТ коронарних судин виявлено фузіформні аневризми коронарних артерій у пацієнтів із MПА й вузликовим поліартеріїтом, тоді як ектазії коронарних артерій – у пацієнтів із MПА та ГПА. Для діагностики патології ССС за наявності показань можуть використовувати позитронно-емісійну томографію із застосуванням радіофармпрепартату фтордезоксиглюкози. Мультимодальний скринінг допомагає виявити субклінічне ураження серця, яке впливає на прогноз.
Лікування й прогноз
АНЦА-СВ є потенційно смертельними захворюваннями навіть в умовах проведення сучасної терапії. З часів перших описів ГПА вважали фатальним захворюванням зі смертністю 90% упродовж першого року після встановлення діагнозу. Однак проведення сучасної імуносупресивної терапії (застосування ГК і циклофосфаміду) в поєднанні з ад’ювантною терапією (антигіпертензивні препарати, нирково-замісна терапія) привело до покращення виживаності пацієнтів. Так, 5-річна виживаність пацієнтів з АНЦА-СВ становить приблизно 80%. Проте слід відзначити, що пацієнти з АНЦА-СВ мають вищу смертність порівняно з популяцією.
Результати дослідження з використанням бази даних первинної практики Великої Британії показали, що ризик смерті в 9 разів вищий у перший рік після діагностування ГПА порівняно з групою контролю. За результатами дослідження C. Mukhtyar і співавт., 5-річна виживаність пацієнтів із ГПА, МПА й ЕГПА дорівнює 74-91, 45-76 і 60-97% відповідно. Тяжкі ураження серця, нирок, легень і розвиток інфекцій є основними причинами смерті пацієнтів з АНЦА-СВ. Частота рецидивів становить близько 50% протягом 5 років і є вищою в ГПА, ніж у MПA. Дані дослідження показали, що похилий вік є предиктором резистентності до лікування, а наявність АНЦА зі специфічністю до ПР-3 й ураження легень є прогностичними факторами рецидиву в пацієнтів з АНЦА-СВ. За даними дослідження M. Catanoso і співавт., виживаність серед пацієнтів із ГПА значно нижча порівняно з контрольною групою (р<0,001). Так, при міждисциплінарному підході під час спостереження за 155 хворими на ГПА медіана виживаності становила >21 рік (95% ДІ 15,60-27,86).
Ураження серця вважають незалежним ФР смертності пацієнтів з АНЦА-СВ, і приблизно в 50% випадків ЕГПА й ГПА смертність асоційована з ураженням серця. Дані дослідження, проведеного M.R. Hazebroek і співавт., показали гіршу довгострокову виживаність пацієнтів з ЕГПА порівняно з контролем, тоді як прогноз при ГПА є сприятливішим. Окрім того, наявність ураження серця у хворих з АНЦА-СВ є значущим предиктором як загальної, так і серцево-судинної смертності. Ці дані підтверджують результати дослідження A. Brucato і співавт., згідно з якими залучення серця в патологічний процес має несприятливий прогноз і є головною причиною смерті у 50% пацієнтів з ЕГПА.
Ураження серця у хворих на ЕГПА може потребувати трансплантації серця. Так, описано 9 випадків трансплантації серця в пацієнтів з ЕГПА та кардіоміопатією. Незважаючи на імуносупресивне лікування, гістологічне дослідження показало наявність активного васкуліту в 78% випадків. Показник 5-річного виживання таких пацієнтів дорівнював 57%, 44% пацієнтів померли внаслідок раптової смерті в період від 3 до 60 міс (у середньому через 32 міс) після оперативного втручання.
Отже, ураження ССС при АНЦА-СВ часто має субклінічний перебіг і потенційно несприятливий прогноз. Тому міждисциплінарний підхід, рання діагностика та оптимальна терапія є важливими в пацієнтів з АНЦА-СВ і можуть запобігти розвитку й прогресуванню патології серця. Своєчасна діагностика ураження ССС сприяє ранньому призначенню імуносупресивного лікування, що може значно поліпшити прогноз захворювання.
Список літератури знаходиться в редакції.